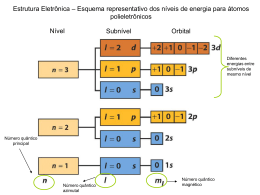
Unidade 1 Das Estrelas ao Átomo Química 10º ano Ano lectivo 2007/2008 Módulo 1 Das Estrelas ao Átomo Como se obtêm espectros atómicos? Módulo 1 Das Estrelas ao Átomo Os átomos no estado gasoso são excitados por : chamas a altas temperaturas descargas eléctricas. Módulo 1 Das Estrelas ao Átomo E E2 Energia E1 Excitação Átomo absorve energia Passa ao estado de maior energia Módulo 1 Das Estrelas ao Átomo E E2 Energia E1 Desexcitação Átomo liberta energia Passa ao estado de menor energia Os átomos são desexcitados quando: regressam ao estado fundamental libertam energia sob a forma de radiação. Módulo 1 Das Estrelas ao Átomo H2 rarefeito Algumas das riscas situam-se na zona do visível (baixa pressão) d.d.p. elevada Espectro atómico do H Módulo 1 Das Estrelas ao Átomo O espectro do átomo de H é um espectro de riscas. As riscas do espectro do H agrupam-se em séries ( cada uma compreende radiações de energia próxima) que correspondem a transições para um mesmo nível energético. Módulo 1 Das Estrelas ao Átomo Espectro do átomo de Hidrogénio Módulo 1 Das Estrelas ao Átomo Espectro do átomo de Hidrogénio Módulo 1 Das Estrelas ao Átomo Riscas visíveis do espectro do átomo de Hidrogénio As energias estão expressas por mole de átomos Módulo 1 Das Estrelas ao Átomo Modelos do átomo: Evolução do Modelo Atómico; O Modelo Quântico do Átomo. Módulo 1 Das Estrelas ao Átomo É na Grécia clássica que, pela primeira vez, se sugeriu que a matéria é constituída por partículas. Demócrito (400 a.C.) – refere o termo átomo que significa “indivisível”. Módulo 1 Das Estrelas ao Átomo Método Científico (observação e experimentação) Estrutura corpuscular da matéria Módulo 1 Das Estrelas ao Átomo Dalton(início do séc. XIX) – admitiu que a matéria era formada por átomos indivisíveis. O átomo era uma pequena esfera maciça. Modelo atómico de Dalton (“Bola de bilhar”) Módulo 1 Das Estrelas ao Átomo J.J. Thomson, 1897 - Descoberta do electrão Modelo de Thomson (1899) (“bolo de passas” ) Átomos neutros Cargas negativas (electrões) Carga positiva Módulo 1 Das Estrelas ao Átomo Rutherford (1911) fez passar um feixe de partículas α (He2+) através de uma finíssima folha de ouro. Módulo 1 Das Estrelas ao Átomo Interpretação da experiência de Rutherford: He2+ Carga positiva He2+ ??? Electrão (carga negativa) Electrão (carga negativa) Módulo 1 Das Estrelas ao Átomo Algumas partículas passavam (grandes espaços), mas outras eram desviadas por algo com carga positiva ??? que repelia as partículas α . Descoberta do Núcleo. Módulo 1 Das Estrelas ao Átomo Bohr (1913), considera o átomo com uma estrutura semelhante ao sistema solar (modelo planetário). Módulo 1 Das Estrelas ao Átomo O electrão (com carga negativa) movia-se em torno do núcleo (com carga positiva) atraído por forças electrostáticas que compensavam a força centrifuga, que tendia a afastá-lo. Módulo 1 Das Estrelas ao Átomo Bohr considerou as órbitas descritas pelo electrão como sendo circunferências. O electrão do átomo de H só poderia mover-se em certas órbitas a que correspondiam certas energias (energia quantificada). Quando o electrão mudava de órbita, absorvia ou libertava energia. Módulo 1 Das Estrelas ao Átomo Menor energia Ei Ef Núcleo Absorção de energia Energia Energia absorvida Ef - Ei absorvida Módulo 1 Das Estrelas ao Átomo Ei Ef Núcleo Libertação de energia Energia libertada Energia libertada Ef - Ei Maior energia Módulo 1 Das Estrelas ao Átomo ΔE ΔE Átomos excitados suficientemente afastados (estado gasoso) libertam a ΔE energia sob a forma de radiação. Energia da radiação emitida = Enf – Eni = ΔE Módulo 1 Das Estrelas ao Átomo Se só são emitidas radiações de algumas energias (riscas) é porque o electrão só pode ocupar estados de energia separados por quantidades finitas ΔE. A interpretação do espectro do átomo de hidrogénio levou a considerar que: a energia do electrão no átomo estava quantificada. Módulo 1 Das Estrelas ao Átomo ¾ Podemos comparar a quantificação a uma série de esferas iguais assentes sobre os degraus de uma escada. ¾ Só haverá esferas com energias de 1,2 J, 1,4 J e 1,6 J; não haverá esferas com energias intermédias. 1,6 J Quando as esferas mudam de degrau libertam / absorvem 0,2 J (1,6 – 1,4; 1,4 – 1,2; etc.). 1,5 J 1,2 J Módulo 1 Das Estrelas ao Átomo Se os níveis Ei fossem infinitamente próximos (ou seja, se não houvesse níveis...), seriam emitidas radiações de energias infinitamente próximas... ... e os espectros seriam contínuos e não de riscas Módulo 1 Das Estrelas ao Átomo Bohr deduziu uma expressão para cálculo da energia de cada um dos níveis de energia do átomo de hidrogénio: 2,179 ×10 −18 En = (− n2 ) J n = 1, 2, 3 ... Número quântico (principal) n – Define os diferentes estados estacionários em que o electrão do átomo de H se pode encontrar. Módulo 1 Das Estrelas ao Átomo Quando os átomos de hidrogénio são excitados, por regresso ao estado fundamental, emitem radiações (espectro de riscas), cujas energias e comprimentos de onda podem ser previstos. Módulo 1 Das Estrelas ao Átomo Notar que: Os níveis se vão aproximando à medida que n aumenta; Quando o electrão, em repouso, está fora da acção do núcleo, a sua energia considera-se nula, E∞= 0. Módulo 1 Das Estrelas ao Átomo Electrão fora do átomo (energia qualquer) Estados excitados Electrão no átomo Estado fundamental Energia quantificada Electrão livre H+(g) Energia de ionização Teremos então: E Electrão livre 0 H(g) Módulo 1 Das Estrelas ao Átomo A teoria de Bohr foi um êxito para o átomo de H (explicou o espectro de riscas e foram previstas as energias das várias riscas). Para átomos com mais electrões foi necessário recorrer a outras teorias e a outro modelo (modelo da nuvem electrónica). Módulo 1 Das Estrelas ao Átomo Heisenberg: não é possível conhecer simultaneamente a posição e energia de um electrão, isto é, não é possível conhecer simultaneamente a órbita e a energia de um electrão. Princípio da Incerteza de Heisenberg Módulo 1 Das Estrelas ao Átomo Só é possível conhecer a probabilidade de encontrar um electrão de dada energia numa dada zona do espaço, em torno do núcleo. A noção de Órbita teve de ser substituída pela Electrão Núcleo Nuvem electrónica noção de Orbital. Órbita (a linha) Orbital (a esfera) Módulo 1 Das Estrelas ao Átomo Se fosse possível fotografar as posições do electrão do átomo de H sobre a mesma película, obteríamos a imagem: Nuvem menos densa (menor probabilidade de encontrar o electrão) Nuvem mais densa (maior probabilidade de encontrar o electrão) Módulo 1 Das Estrelas ao Átomo O que são as orbitais? São zonas em torno do núcleo onde é elevada a probabilidade de encontrar determinada energia. um electrão com Módulo 1 Das Estrelas ao Átomo O electrão do átomo H, no estado de menor energia, tem uma probabilidade de cerca de 95% de ser encontrado dentro de R uma esfera centrada no núcleo, com raio (R) igual a 10-8 cm. Orbital do electrão do átomo de H (estado fundamental) Números quânticos. Camadas, subcamadas e orbitais. Princípio de Pauli. Módulo 1 Das Estrelas ao Átomo Átomo Vários electrões (distribuídos por diferentes zonas do espaço em torno do núcleo ) Energias que não são todas iguais. Módulo 1 Das Estrelas ao Átomo Para caracterizar diferentes “estados” dos electrões de um átomo… Números quânticos … do mesmo modo que as matrículas caracterizam os automóveis de um país. Módulo 1 Das Estrelas ao Átomo Número quântico principal, n. n = 1, 2, 3 ... ¾ energia da orbital ¾ tamanho da orbital n – indica um nível ou camada. Módulo 1 Das Estrelas ao Átomo Os valores possíveis de n são os números inteiros naturais n = 1, 2, 3 … O conjunto de orbitais com o mesmo valor de n designa-se por camada. Cada valor de n respectivamente. corresponde às camadas K,L,M, Módulo 1 Das Estrelas ao Átomo En E3 E2 E1 n =3 n =2 n =1 O tamanho aumenta com n A energia aumenta com n Número quântico principal - n Quanto maior for n maior é a energia do electrão e o tamanho da nuvem electrónica (orbital). Módulo 1 Das Estrelas ao Átomo Na análise das radiações emitidas por átomos excitados Utilização de espectroscópios de melhor resolução Mostra riscas obtidas constituídas por riscas muito próximas Níveis energéticos constituídos por subníveis (subcamadas) de energias próximas Módulo 1 Das Estrelas ao Átomo Número quântico secundário ou azimutal - l (l = 0 a n-1) ¾ forma da orbital ¾ energia da orbital l – indica um subnível ou subcamada. Módulo 1 Das Estrelas ao Átomo Camadas, subcamadas e orbitais: Para n = 1 (nível ou camada K) l = 0 (um único subnível ou subcamada) Para n = 2 (nível ou camada L) l = 0 ou l = 1 (dois subníveis ou subcamadas) Para cada nível ou camada n existem subcamadas. n subníveis ou Módulo 1 Das Estrelas ao Átomo As subcamadas de uma dada camada são normalmente designadas: l=0 subcamada s l=1 subcamada p l=2 subcamada d l=3 subcamada f l=4 subcamada g Módulo 1 Das Estrelas ao Átomo O que é uma subcamada? Uma ou mais orbitais com os mesmos valores de n e l. Exemplo: Para n=2 l=0 subcamada s subcamada 2s l=1 subcamada p subcamada 2p Módulo 1 Das Estrelas ao Átomo Forma das orbitais: Simetria esférica Módulo 1 Das Estrelas ao Átomo Número quântico magnético – ml (- l a +l) ¾ orientação da orbital no espaço, quando sujeito a um campo magnético. ml - indica o número de orbitais numa subcamada. Módulo 1 Das Estrelas ao Átomo Forma e orientação das orbitais p: Orbitais com a mesma forma e energia Diferem na orientação Módulo 1 Das Estrelas ao Átomo A existência de spins electrónicos diferentes foi observada com átomos de lítio no estado gasoso. A separação do feixe em dois resulta dos dois spins possíveis do electrão de valência em diferentes átomos de lítio. E E Módulo 1 Das Estrelas ao Átomo A Mecânica Clássica interpreta os dois estados de spin do electrão como correspondendo a movimentos de rotação do electrão em torno de si mesmo, como um pião, em dois sentidos possíveis. Número quântico de spin – ms +1/2 e -1/2 ¾ Sentido de rotação do electrão Módulo 1 Das Estrelas ao Átomo Faça corresponder os números quânticos da coluna da esquerda a uma (ou mais) alíneas da coluna da direita. A–n a) Subcamada B–l C – ml D – ms b) Sentido de rotação do electrão c) Camada d) Tamanho e) Orientação f) Energia Módulo 1 Das Estrelas ao Átomo Uma orbital é caracterizada pelo conjunto dos números n, l e ml. Ex. A orbital 2px n=2 l =1 m = -1 ou m = 0 ou m = 1 Módulo 1 Das Estrelas ao Átomo Os quatro números quânticos n, l, ml, ms permitem caracterizar completamente o electrão em qualquer orbital. Notação: (n, l, ml, ms) Módulo 1 Das Estrelas ao Átomo Princípio de exclusão de Pauli: y Num átomo não podem existir electrões com igual conjunto de números quânticos. Capacidades das diferentes camadas e subcamadas. Átomos polielectrónicos. Preenchimento das orbitais. Princípio da Energia Mínima. Regra de Hund. Módulo 1 Das Estrelas ao Átomo Dado um átomo neutro com número atómico Z, como se distribuem os Z electrões nas diferentes orbitais no estado fundamental? Os electrões distribuem-se pelas diferentes orbitais disponíveis que conduzam a um mínimo de energia para o átomo (Princípio da energia mínima). Módulo 1 Das Estrelas ao Átomo Quais são essas orbitais? Há regras para efectuar o preenchimento das orbitais (2 electrões em cada) de modo a obter a mínima energia possível: Utilização de um triângulo de subcamadas. Módulo 1 Das Estrelas ao Átomo Regra: 1 - Escrever as notações das subcamadas de cada camada em linhas horizontais; 2 – Seguir sucessivamente as linhas a 45º indicadas no triângulo. 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s ... Módulo 1 Das Estrelas ao Átomo Regra de Hund: - Num conjunto de orbitais da mesma energia (por exemplo as 3 orbitais p, as 5 orbitais d, as 7 orbitais f) ocupam-se primeiro (parcialmente) as orbitais vazias e só depois se passa ao emparelhamento de electrões (se os houver). e não Módulo 1 Das Estrelas ao Átomo - Os electrões das orbitais semipreenchidas têm o mesmo spin. e não Spins opostos Módulo 1 Das Estrelas ao Átomo Configurações electrónicas dos elementos: A distribuição dos electrões pelas várias orbitais constitui a configuração electrónica do átomo (ou do ião). Notação: x electrões na orbital nl Número quântico principal x Número quântico secundário Módulo 1 Das Estrelas ao Átomo Notar que: o nº de electrões num átomo neutro é igual ao nº atómico Z. Exemplo: Notação utilizada para representar o átomo de Azoto (Z=7): 2 electrões na orbital 1s (n = 1; l = 0) 1s2 2 electrões na orbital 2s (n = 2; l = 0) 2s2 3 electrões na orbital 2p (n = 2; l = 1) 2p3 Configuração electrónica do Boro: 7N - 1s2 2s2 2p3 Módulo 1 Das Estrelas ao Átomo Energia Representação em diagrama de energia: 2p 2s 1s 1s2 2s2 2p3 Módulo 1 Das Estrelas ao Átomo As propriedades químicas dos elementos dependem da sua configuração electrónica de valência, isto é, da última camada. Exemplo: gases nobres (raros ou inertes) – He, Ne,… Elevada estabilidade Última camada preenchida
Download