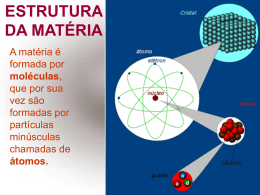
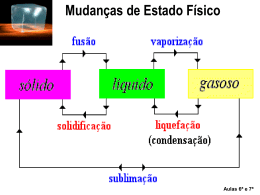
Mudanças de Fases Uma substância pura pode se apresentar de três maneiras, de acordo com o seu estado de agregação: sólido, liquido ou gasoso. A mudança de um estado para o outro é denominada conforme indica a figura abaixo. Evaporação É o tipo de vaporização lenta, que ocorre apenas junto à superfície livre do líquido. Esse fenômeno não requer condições físicas determinadas para ocorrer. Em outras palavras, não há uma temperatura determinada para um líquido evaporar. A água do tanque, por exemplo, evapora a 5o C, a 20o C, a 60o C , etc. Ebulição ou Vaporização É a vaporização intensa e turbulenta que ocorre ao longo de toda a massa líquida, com formação de bolhas de vapor junto às superfícies aquecidas. Essa bolhas aumentam de volume à medida que se elevam no líquido, em virtude da redução da pressão. Ao contrário da evaporação, a ebulição só acontece quando é atingida uma certa temperatura, que depende da pressão exercida sobre o líquido pelo ambiente. Conceitos Básicos Ponto de fusão é a temperatura na qual a substância muda da fase sólida para a fase líquida. Ponto de vaporização é a temperatura na qual a substância muda da fase líquida para a fase gasosa. Substância Mercúrio Ponto de fusão ( ° C ) -39 Ponto de vaporização ( ° C ) 357 Nitrogênio -210 -196 Álcool -115 78 Enxofre 119 420 Gelo 0 ----- Prata 961 ----- Água ----- 100 Ponto de condensação é a temperatura na qual a substância muda da fase gasosa para a fase líquida. Ponto de solidificação é a temperatura na qual a substância muda da fase líquida para a fase sólida. Ponto de vaporização em alguns lugares Em alguns lugares, o ponto de vaporização pode variar dependendo da altitude local. Maceió, Recife e Rio de Janeiro 100º C São Paulo 98º C Brasília 96º C Quito 90º C La Paz 87º C Alto do Monte Everest 75º C Calor Latente É a quantidade de calor que uma substância recebe para mudar de fase quando a mesma se encontra no ponto de fusão, ou no ponto de vaporização, ou no ponto de solidificação, etc. Substância Mercúrio Nitrogênio Álcool Enxofre Gelo Oxigênio Água Calor latente de fusão (cal / g) 2,8 6,09 2,5 13,2 80 3,3 ----- Calor latente de vaporização ( cal /g ) 65 48 204 62 ----51 540 Fórmula do Calor Latente Q = m . L Q - Quantidade de calor necessária à mudança de fase quando a substância está no ponto de mudança. m - massa da substância. L - calor latente de mudança de fase da substância. Fórmula do Calor Sensível Q = m . c . Dt Q - Quantidade de calor necessária a uma variação de temperatura. m - massa da substância. Estado Sólido É o estado em que os átomos que formam as substâncias se encontram fortemente ligados através de forças muito intensas. Os átomos não sofrem movimento de translação, mas estão em constante estado de vibração ao redor da sua posição de equilíbrio. Todas as substâncias que se encontram nessa fase apresentam as seguintes características: • Forma geométrica definida e volume constante; • São pouco compressíveis. Estado Líquido Neste estado, as forças existentes entre os átomos são mais fracas, assim eles ficam mais afastados uns dos outros, possuem maior liberdade de vibração de modo que podem sofrer pequenos movimentos de translações no interior do líquido. As substâncias que se encontram nesse estado possuem como característica principal o fato de não apresentarem forma própria, mas o seu volume se mantém sempre constante. Estado Gasoso Nesta fase, os átomos das substâncias se movimentam livremente em todas as direções, fato este que não acontece com os átomos das substâncias que se encontram nos estados sólido e líquido. A movimentação desordenada dessas partículas acontece porque a força de ligação entre os átomos é tão pequena que se torna praticamente nula, sendo assim, as substâncias que se encontram nesse estado não apresentam forma e volume definido. Grupos Aldair Fabrício Jarlen Thaylon Weverton Professor: Rogério nº 01 nº 08 nº 13 nº 30 nº 33
Download