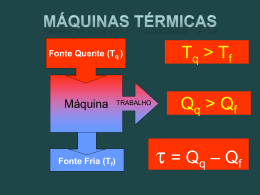
Termodinâmica TERMODINÂMICA Fernando Luiz Pellegrini Pessoa ESCOLA DE QUÍMICA UNIVERSIDADE FEDERAL DO RIO DE JANEIRO ESCOLA DE QUIMICA / UFRJ Termodinâmica TERMODINÂMICA GRAD TERÇA - QUINTA 15 - 17 h AULA DIA ATIVIDADE 1 23/mar FP 2 25/mar FP 3 30/mar FP 4 1/abr PF 5 6/abr PF 6 8/abr Cauê 7 13/abr Cauê 8 15/abr Cauê 9 20/abr PF 10 22/abr recesso 11 27/abr PF 12 29/abr PROVA 1 13 4/mai FP 14 6/mai FP 15 11/mai FP 16 13/mai FP 17 18/mai PF 18 20/mai PF 19 25/mai PF 20 27/mai PROVA2 21 1/jun FP 22 3/jun FERIADO 23 8/jun FP 24 10/jun FP 25 15/jun PF - SUIÇA 26 17/jun PF - SUIÇA 27 22/jun FP 28 24/jun FP 29 29/jun PF 30 1/jul PROVA 3 6/jul 8/jul 13/jul 15/jul 20/jul 22/jul ESCOLAPROVA DEFINALQUIMICA / UFRJ Termodinâmica Dias: Terça/Quinta-Feira Horário: 15:00 – 17:00 Professores: Fernando Luiz Pellegrini Pessoa/Pedro Wagner Dúvidas: Terça/Quinta-Feira 14-15 h ;17-18 h (agendar) [email protected] Critérios de Avaliação. MP = (P1 + P2 + P3)/3 MP 7 Aprovado 3 MP < 7 Prova final. MP < 3 Reprovado. MF = (MP + PF)/2 MF 5 Aprovado MF < 5 Reprovado ESCOLA DE QUIMICA / UFRJ eqe359 Termodinâmica RELAÇÃO PROFESSOR – ALUNOS Segundo as mais recentes tendências sobre ensino de engenharia, a absorção do conhecimento deixou de depender primordialmente do empenho em ensinar para depender primordialmente do empenho em aprender. ESCOLA DE QUIMICA / UFRJ Termodinâmica Participação dos Alunos nas Aulas A aula é uma atividade interpessoal, não impessoal. Ela é ministrada a cada um dos alunos presentes e não à turma. Os alunos devem assistir às aulas com atenção, evitando saídas para tratar de outros assuntos, muito menos para atender telefones celulares. É de boa educação o aluno sinalizar ao professor quando precisar sair da sala de aula. Os alunos não devem assumir compromissos outros, como estágios, para o horário das aulas. ESCOLA DE QUIMICA / UFRJ Termodinâmica A ciência da TERMODINÂMICA nasceu no século 19, com a necessidade de descrever a operação das máquinas a vapor e de avaliar o limite do seu desempenho. os princípios observados válidos para as máquinas são facilmente generalizados, e são conhecidos como a primeira e a segunda leis da termodinâmica ESCOLA DE QUIMICA / UFRJ Termodinâmica Estas leis levam através de deduções matemáticas a um conjunto de equações que encontram aplicações em todos os campos da ciência e da engenharia Engenharia (voltada para a) Química Processos Químicos ESCOLA DE QUIMICA / UFRJ Termodinâmica Existem vários casos da aplicação simples da TD OPORTUNIDADES ESCOLA DE QUIMICA / UFRJ Termodinâmica ► cálculo das necessidades de calor e de trabalho para processos físicos e químicos BM e BE ► determinação das condições de equilíbrio para as reações químicas e para a transferência de espécies químicas entre fases diferentes condição de estabilidade TD ESCOLA DE QUIMICA / UFRJ Termodinâmica ESCOLA DE QUIMICA / UFRJ Termodinâmica primeira lei da TD: ► energia transformada e transferida ► corrente de processo com calor disponível pode cedê-lo ► corrente de processo que necessita de calor recebê-lo segunda lei da TD: ► calor só pode ser transferido de um corpo com Th para um corpo com temperatura Tc, se Th > Tc ESCOLA DE QUIMICA / UFRJ Termodinâmica OPÇÃO UTIL UTIL FRIA QUENTE (kW) (kW) Sem integração 470 510 Com integração, sem cascata 97,5 137,5 Com integração e cascata 20 60 ESCOLA DE QUIMICA / UFRJ Termodinâmica TD CLÁSSICA uma rede de equações, desenvolvidas através de uma lógica formal da matemática a partir de alguns postulados fundamentais levando a uma grande variedade de deduções úteis Os postulados e conceitos serão apresentados sem traçar um histórico dos mesmos ESCOLA DE QUIMICA / UFRJ Termodinâmica A aplicação da TD começa com a identificação de um corpo particular da matéria que chamamos de sistema O estado TD do sistema é definido por propriedades macroscópicas ESCOLA DE QUIMICA / UFRJ Termodinâmica Um sistema é definido como uma quantidade de matéria ou região no espaço escolhido para estudo. A massa ou região no lado de fora do sistema é chamado de vizinhança. A superfície real ou imaginária que separa o sistema da vizinhança é chamada de envoltória ou contorno. Define o volume de controle. vizinhança SISTEMA Contorno ESCOLA DE QUIMICA / UFRJ Termodinâmica Gas 2 kg 3 m3 Contorno móvel Gas 2 kg 1 m3 Contorno fixo Um sistema fechado com contorno móvel. ESCOLA DE QUIMICA / UFRJ Termodinâmica Um sistema aberto (volume de controle) é uma região propriamente selecionada no espaço contendo um equipamento no qual existe fluxo de massa entrando e saindo. Massa e energia podem atravessar a envoltória. Massa Volume de controle H2O quent sai H2O fria entra Um sistema aberto (volume de controle) com uma saída/uma entrada Energia Massa e energia atravessando o volume de controle ESCOLA DE QUIMICA / UFRJ Termodinâmica Processos Espontâneos Processos espontâneos são aqueles que podem ocorrer sem qualquer intervenção externa. O gás no vaso B irá fluir espontaneamente para o vaso A, mas uma vez que o gás está nos dois vasos, ele não fluirá espontaneamente ESCOLA DE QUIMICA / UFRJ Termodinâmica Processos Espontâneos Processos que são espontâneos em uma direção não são espontâneos na direção contrária. ESCOLA DE QUIMICA / UFRJ Termodinâmica Processos Reversíveis Em um processo reversível, o sistema muda de uma forma que o sistema e a vizinhança podem ser retornados ao seu estado original pelo processo exatamente reverso. Mudanças são infinitesimalmente pequenas em um processo reversível. ESCOLA DE QUIMICA / UFRJ Termodinâmica Processos Irreversíveis Processos irreversíveis não podem voltar ao estado original pelo processo inverso. Todo processo Espontâneo é irreversível. Todo processo Real é irreversível. ESCOLA DE QUIMICA / UFRJ Termodinâmica Estado de equilíbrio: o estado sem tendência de sair espontaneamente Processo: mudança equilíbrio de estado de Processo reversível: aquele que o sistema é mantido no estado de equilíbrio ao longo do processo Sistema de uma fase em um estado de equilíbrio interno: significa que é homogêneo, propriedades macroscópicas uniformes ESCOLA DE QUIMICA / UFRJ Termodinâmica Um sistema em dois estados diferentes. m = 2 kg T2 = 20 oC V2 = 3 m3 m = 2 kg T1 = 20 oC V1 = 1.5 m3 ESCOLA DE QUIMICA / UFRJ Termodinâmica P Estado Final Caminho do Processo Estado Inicial V Sistema Diagrama P-V de um processo de compressão. ESCOLA DE QUIMICA / UFRJ Termodinâmica Função de Estado ESCOLA DE QUIMICA / UFRJ Termodinâmica Propriedades Intensivas são independentes da quantidade de material , kg/m3 , m3/kg e, kJ/kg u, kJ/kg Propriedades intensivas são independentes do tamanho do sistema. ESCOLA DE QUIMICA / UFRJ Termodinâmica Propriedades extensivas dependem da quantidadde do material do sistema tal como U & V. U & V tornam-se propriedades intensivas se for consideradad uma massa unitária (U & V específica), ou um mol (U & V molar) m ½m ½m Propriedade Extensiva V ½V ½V T T T P P P Diferença entre propriedades extensiva e intensiva ESCOLA DE QUIMICA / UFRJ Propriedade Intensiva Termodinâmica A Natureza de um função F Uma variável F é dita para ser uma função de x e y, isto é, F=f(x,y), se para todos os pares de valores (x,y) existe um valor de F (F pode depender de várias variáveis) Uma equação que ligue F a x e y pode ser ou não conhecida F pode ser fornecida graficamente, onde um valor de F está associado a um par (x,y) ESCOLA DE QUIMICA / UFRJ Termodinâmica Propriedades dos Fluidos As aplicações da TD Clássica estão ligadas com as propriedades macroscópicas dos fluidos e suas relações com as condições mensuráveis de T,P,z Não é levado em conta campo magnético ou eletrostático, ou campo gravitacional, a amostra é estacionária, não é sujeita a força cisalhante e os efeitos de superfície são desprezados ESCOLA DE QUIMICA / UFRJ Termodinâmica As equações geradas podem ser aplicadas a estes sistemas, que os efeitos foram desprezados ESCOLA DE QUIMICA / UFRJ Termodinâmica POSTULADO 1 As propriedades macroscópicas de fluidos homogêneos no estado de equilíbrio são funções de T,P,z somente. V é uma função de T,P,z e caracterizamos o fluido como um sistema PVT ESCOLA DE QUIMICA / UFRJ Termodinâmica Tomamos T, P, z como variáveis básicas da TD para fluidos homogêneos Elas não são propriedades dos fluidos, mas condições impostas ou manifestadas Elas servem como coordenadas TD ESCOLA DE QUIMICA / UFRJ Termodinâmica Quais são as propriedades que são funções de T, P e z? Volume molar ou específico é uma delas Para um fluido homogêneo com z constante em equilíbrio, em um sistema PVT pode-se escrever; V=V(P,T) ESCOLA DE QUIMICA / UFRJ Termodinâmica V=V(P,T) A relação fundamental existe, mas sua expressão para um fluido por meio de tabela, gráfico ou uma equação deve ser baseada em medidas experimentais cuidadosas As eqs são chamadas Equações de Estado PVT ESCOLA DE QUIMICA / UFRJ Termodinâmica Pode-se propor várias funções de T e P, a z constante, mas tem que ser medida diretamente ou é uma função essencial na qual é possível fazer generalização que permitam a predição do comportamento do sistema Fazendo-se funções arbitrárias é difícil conseguir uma propriedade que represente os fluidos ESCOLA DE QUIMICA / UFRJ Termodinâmica A única forma de evitar definições arbitrárias de propriedades é tomar como base o reconhecimento destas propriedades no comportamento de fluidos reais O conceito mais fundamental energia (mais antigo) Generalização de energia é lei da conservação ESCOLA DE QUIMICA / UFRJ Termodinâmica Energia Não tem peso nem cor... ...tampouco cheiro! Mas pagamos por ela! Não podemos vê-la diretamente... ... Mas podemos percebê-la nas mudanças e transformações por ela produzidas. ESCOLA DE QUIMICA / UFRJ Termodinâmica Lei da Conservação da Energia 1o Princípio da Termodinâmica O uso da energia implica em transformá-la de uma forma para outra... porém ela, a energia, não é criada nem destruida. Energia total antes da explosão = Energia total após a explosão Sejam quantas forem as transformações, a quantidade total de energia no Universo permanece constante. ESCOLA DE QUIMICA / UFRJ Termodinâmica Calor (Q) = energia em gradiente de temperatura trânsito; Não é uma propriedade do sistema Representa uma quantidade de energia transferida entre um sistema e sua vizinhança ESCOLA DE QUIMICA / UFRJ Termodinâmica Trabalho: energia em trânsito entre o sistema e sua vizinhança; não é propriedade do sistema 1. Realizado quando uma força atua em uma distância W F .dl 2. Expansão/compressão cilindro com pistão V dW F .dl P . A .d ( ) P .dV A V2 W P .dV V1 ESCOLA DE QUIMICA / UFRJ Termodinâmica Energia dW Fdl madl m du dl dt Cinética: Se em um corpo de massa m é aplicada uma força F durante um intervalo de tempo diferencial dt, o deslocamento do corpo igual a dl: dW m dl mdu dt W 1 2 Ek Potencial: Se um corpo de massa m vai de uma elevação inicial z1 para uma elevação final z2, com uma força exercida de no mínimo o peso do corpo, aplicada na distância de (z2-z1): du 1 mudu dt 2 mu 2 mu dl 1 2 2 mu 1 E k 2 2 F m .a m . g W F .( z 2 z 1 ) m . g . z Ep ESCOLA DE QUIMICA / UFRJ Termodinâmica EXPERIMENTO DE JOULE (James P. Joule; 1818-1889; 1840;Manchester, England 1.Quantidades conhecidas de H2O ou óleo ou Hg em uma vaso isolado e agitado 2.Medir trabalho realizado pelo agitador e variação de T do fluido. 3.Quantidade fixa de W por unidade de massa para aumentar T. 4. T pode ser restaurado adicionando calor. 5.Relação quantitativa entre W e Q. ESCOLA DE QUIMICA / UFRJ Termodinâmica Energia Interna Energia que se refere às moléculas internas à substância; Energia de rotação, tanslação, vibração e potencial das forças intermoleculares; Chamada interna para diferenciar da cinética e potencial, que são externas; Adição de Q ou realização de W pode aumentar sua energia interna; Não tem uma definição concisa na TD Clássica; Não pode ser medida diretamente; Não são conhecidos valores absolutos; Só utilizamos variações da energia interna. ESCOLA DE QUIMICA / UFRJ Termodinâmica POSTULADO 2 Existe uma forma de energia, conhecida como energia interna (U), que para fluidos homogêneos existindo em equilíbrio no sistema PVT é uma propriedade do material e uma função de T,P,z. ESCOLA DE QUIMICA / UFRJ Termodinâmica POSTULADO 3 A energia total de um sistema e sua vizinhança é conservada; energia pode ser transferida de um sistema para sua vizinhança de uma forma para outra, mas a quantidade total permanece constante Primeira Lei da TD ESCOLA DE QUIMICA / UFRJ Termodinâmica 2o Princípio da Termodinâmica As transformações não alteram a quantidade de energia do Universo. Embora permaneça inalterada, ... ... em cada transformação, a parcela da energia disponível torna-se cada vez menor. Na maioria das transformações parte da energia converte em calor... ... que ao se dissipar caoticamente pela vizinhança torna-se , cada vez menos disponível, para realização de trabalho. A energia total do Universo não muda, mas a parcela disponível para realização de trabalho, torna-se cada vez menor. ESCOLA DE QUIMICA / UFRJ Termodinâmica Termodinâmica trata da transformação de todo tipo de energia, de uma forma para outra. As restrições em que tais transformações são observadas para ocorrer são conhecidas como a primeira e a segunda leis da termodinâmica. ESCOLA DE QUIMICA / UFRJ Termodinâmica Energia pode existir em diferentes formas. A energia total do sistema (E) é constituída de formas macroscópica e microscópica. As formas macroscópicas são aquelas que o sistema possui em relação a sua vizinhança, tal como energias cinética (KE) [movimento] e potencial (PE) [posição]. Macroscópica E = KE + PE ESCOLA DE QUIMICA / UFRJ Termodinâmica A soma de todas as formas de energias microscópicas é chamada de energia interna (U) do sistema. Ela leva em conta os movimentos internos das moléculas que movem com alguma velocidade (translação), vibram em relação a outra (vibracional, interação) e movem em torno de um eixo durante o movimento randômico (rotação). Total E = U + KE + PE ESCOLA DE QUIMICA / UFRJ Termodinâmica Calor (Q) é uma palavra que denota energia em trânsito como o resultado de um gradiente de temperatura (Experimento de Joule) Não é uma propriedade do sistema Representa uma quantidade de energia transferida entre um sistema e sua vizinhança ESCOLA DE QUIMICA / UFRJ Termodinâmica Conservação de energia: Apesar da energia assumir diferentes formas, a quantidade total de energia é constante, e quando uma energia desaparece em uma forma, ela aparece simultaneamente em outras formas. Em outras palavras: Energia não pode ser criada ou destruída, apenas transformada. Esta lei se aplica para o sistema e sua vizinhança: (energia do sistema) + (energia da vizinhança) = 0 ESCOLA DE QUIMICA / UFRJ Termodinâmica (energia do sistema) + (energia da vizinhança) = 0 Esta eq. assume formas práticas. Para um sistema fechado (energia da vizinhança) = - Q – W Q e W referem-se para o sistema. Para vizinhança tem sinal oposto. (energia do sistema) = Q + W ESCOLA DE QUIMICA / UFRJ Termodinâmica (energia do sistema) = Q + W Para sistema fechado, geralmente, só tem variação da energia interna do sistema, então: (nU) = Q + W Esta eq pode ser tomada como uma definição explícita de U; a definição exata não é conhecida; o postulado da existência de U pode ser testado com esta eq através de experimentos com fluidos homogêneos ESCOLA DE QUIMICA / UFRJ Termodinâmica Experimento Com 1 mol (ou 1 unidade de massa) de um fluido homogêneo com composição constante em um equipamento do tipo pistão-cilindro; T e P são variáveis independentes; variação em T e/ou P leva à adição/remoção de Q, realização de W (deslocamento do pistão); experimento lento, equilíbrio interno, variações infinitesimais, equilíbrio sistema-vizinhança, processo reversível ESCOLA DE QUIMICA / UFRJ Termodinâmica Observa-se ( constante Qrev + Wrev ) é A observação confirma parcialmente os postulados Qrev + Wrev é visto como uma variação de uma propriedade, a U A restrição de reversível é devido ao experimento e não aos postulados ESCOLA DE QUIMICA / UFRJ Termodinâmica Um exame adicional experimentais leva experimento: dos para 2 V 1 dados cada dWrev P Eq. bem conhecida para W dWrev = - PdV A variação de V tem uma medida direta ESCOLA DE QUIMICA / UFRJ Termodinâmica Outra integral avaliada é 2 dQrev T 1 Obtém-se um único valor para todas as etapas Evidência de uma propriedade, ainda não conhecida Dá-se o nome de entropia, S, onde 2 S 1 ESCOLA DE QUIMICA / UFRJ dQrev T Termodinâmica POSTULADO 4 Existe uma propriedade chamada entropia, S, que para fluidos homogêneos em sistemas PVT em equilíbrio é uma função de P, T, z. ESCOLA DE QUIMICA / UFRJ Termodinâmica (nU) = Q + W não explicita a definição da propriedade U; as eqs. 2 V 1 dWrev P 2 S 1 dQrev T não fornecem definições explícitas de volume e entropia Está implicito nestas eqs. a existência de 3 propriedades extensivas. No caso de V é óbvio uma definição explícita através de medida direta. Em relação a U e S é diferente, pois a TD Clássica não fornece definições explícitas destas propriedades ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropia Entropia (S) é um termo batizado por Rudolph Clausius no século 19. Clausius estava convencido do significado da razão entre o calor fornecido e a temperatura na qual ele é q fornecido. T ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropia Entropia pode ser pensada como uma medida da não randomicidade de uma sistema. Ela está relacionada com várias formas de movimento em moléculas. ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropia Como energia total, E, e entalpia, H, entropia é uma função de estado. Então, S = Sfinal Sinitial ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropia Para um processo ocorrendo a temperatura constante (um processo isotérmico): qrev = o calor que é transferido quando o processo ocorre reversivelmente a temperatura constante. T = temperatura em Kelvin. ESCOLA DE QUIMICA / UFRJ Termodinâmica Segunda Lei da TD CAFÉ QUENTE Calor Uma xícara de café não torna-se mais quente em uma sala mais fria ESCOLA DE QUIMICA / UFRJ Termodinâmica A variação de entropia de um reservatório de calor é sempre Q/T para uma fonte ou sumidouro de calor se a transferência é reversível or irreversível. Para um processo adiabático e reversível dQrev = 0 e dSt = 0 a entropia é constante durante um processo isentrópico. Resumo: (1) A variação de entropia de qualquer sistema em um processo reversível é S t dQ rev T dQ rev T (2) Para um processo irreversível (real) aplicada para um processo reversível arbitrário que alcança a mesma mudança de estado igual ao processo real. Entropia é a função de estado a variação de entropia para processos reversível e irreversível são idênticas. (3) Entropia é uma propriedade derivada da segunda lei assim como U foi derivada da primeira lei. S t ESCOLA DE QUIMICA / UFRJ Termodinâmica Segunda Lei da TD A segunda lei da TD: A entropia do universo não muda para um processo reversível e aumenta para um processo espontâneo. Reversível (ideal): Irreversível (real, espontâneos): ESCOLA DE QUIMICA / UFRJ Termodinâmica Segunda Lei da TD “Não se pode violar” Reversível (ideal): Irreversível (real, espontaneo): ESCOLA DE QUIMICA / UFRJ Termodinâmica Segunda Lei da TD A entropia do universo aumenta (real, processo espontaneo). Mas, entropia pode diminuir para sistemas individuais. Reverível (ideal): Irreversível (real, espontaneo): ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropia na Escala Molecular Ludwig Boltzmann descreveu o conceito de entropia no nível molecular. Temperatura é uma medida da energia cinética média das moléculas em uma amostra. ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropia na Escala Molecular Moléculas exibem vários tipos de movimentos: – Translacional: Movimento da molécula inteira de um lugar para outro. – Vibracional: Movimento periódico dos atómos da molécula. – Rotacional: Rotação da molécula em relação seu próprio eixo ou em relação a ligações . ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropia na Escala Molecular Boltzmann partiu dos movimentos de uma amostra de moléculas em um instante particular no tempo. Ele chamou esta amostra como um microestado do sistema termodinâmico. ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropia na Escala Molecular Cada estado TD tem um número específico de microestados, W, associado com ele. Entropia é S = k lnW onde k é a constante de Boltzmann, 1.38 1023 J/K. ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropia na Escala Molecular Implicações: • mais partículas -> + estados -> + entropia • maior T -> + estados de energia -> + entropia • menos estruturado (gas vs solido) -> + estados -> + entropia ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropia na Escala Molecular O número de microestados e, por isso, a entropia tende a aumentar com o aumento na – Temperatura. – Volume (gases). – O número de movimentos independentes das moléculas. ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropia e Estado Físico Entropia aumenta com a liberdade de movimento das moléculas. Então, S(g) > S(l) > S(s) ESCOLA DE QUIMICA / UFRJ Termodinâmica Soluções Dissolução de um sólido: Ions tem maior entropia (+ estados) Mas, Algumas moléculas têm uma entropia menor (elas estão agrupadas em torno dos ions). Normalmente, existe um aumento global em S. (A exceção são ions com carga muito alta que atraem um número grande de moléculas de água em torno dela) ESCOLA DE QUIMICA / UFRJ Termodinâmica Variação de Entropia Em geral, entropia aumenta quando – Gases são formados de líquidos e sólidos. – Líquidos ou soluções são formados a partir de líquidos. – O número de moléculas de gás aumenta. – O número de moles aumenta. ESCOLA DE QUIMICA / UFRJ Termodinâmica Terceira Lei da TD A entropia de uma substância cristalina pura no zero absoluto é 0. ESCOLA DE QUIMICA / UFRJ Termodinâmica Terceira Lei da TD A entropia de uma substância cristalina pura no zero absoluto é 0. ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropias Padrão Entropia molar em seu estado padrão. Entropias padrão tendem a aumentar com o aumento da massa molar. ESCOLA DE QUIMICA / UFRJ Termodinâmica Entropias Padrão Quanto maior e mais complexa a molécula maior o valor da entropia. ESCOLA DE QUIMICA / UFRJ Termodinâmica Volume é uma propriedade importante porque pode ser medida diretamente e fornecer informação experimental sobre o sistema; Entropia e energia interna só podem ser determinadas indiretamente; U e S são essenciais para a ciência da TD; Sem o reconhecimento de S e U a Primeira e Segunda Leis da TD seriam impossíveis; A 1st Lei da TD não seria formulada sem o postulado afirmando a existência de U como propriedade do material e U é tomada como propriedade porque permite generalização ESCOLA DE QUIMICA / UFRJ Termodinâmica Uma vez que a existência de S é postulada, é necessário determinar se qualquer generalização com base nesta propriedade é possível; Após calcular a variação de S associada a vários processos e examinar os resultados: – Proc. Reversível=> S total é zero – Proc Irreversível => é positivo Postulado Final: Todos os processos caminham em uma direção que a variação de S total é positivo; o valor limite, quando o processo tende a reversibilidade é zero, isto é, Stotal ≥ 0 ESCOLA DE QUIMICA / UFRJ Termodinâmica POSTULADO 5 A variação de S total resultante para qualquer processo real é positivo; o valor limite, quando o processo tende a reversibilidade é zero, isto é, Stotal ≥ 0 ESCOLA DE QUIMICA / UFRJ Termodinâmica A primeira lei da TD é sobre a conservação de energia e diz que: Energia não pode ser criada ou destruída, apenas transformada A segunda lei da TD diz que: Energia tem qualidade e quantidade e um processo real ocorre na direção da diminuição da qualidade de energia. A eficiência de um processo real não é 100%. ESCOLA DE QUIMICA / UFRJ Termodinâmica No caso de sistemas heterogêneos, com várias fases e cada fase sendo um sistema PVT existindo em equilíbrio com as outras fases, o estado do sistema depende de P, T, composição e quantidade relativa das fases; a propriedade total do sistema é a soma das partes Pode-se estabelecer um conjunto completo de propriedades totais para qualquer estado de equilíbrio do sistema = generalizar as eqs. para fluidos homogêneos ESCOLA DE QUIMICA / UFRJ
Download