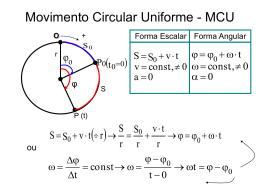
Diagramas de Fase:
2)Substâncias que contraem na Fusão:
(Água- Bismuto-Ferro-Antinômio)
P (Água)
d sólido < d líquido
1)Substâncias que dilatam na Fusão:
(maioria)
C O2
P(atm)
217,5 atm
d sólido > d líquido
C
73
C
Líquido
1 atm
5
Gás
T
Gás
4,58 mmHg
Sólido
T
1
Vapor
Vapor
0
- 78
- 56,6
31
Ɵ (ºC)
T = Ponto Tríplice ou Triplo (S+L+V)
C = Ponto Crítico(Vapor/Gás)
Gás é uma substância na fase gasosa numa
temperatura Superior a Temperatura Crítica. Não
se condensa por compressão isotérmica
Su b limação
: G eloseco (CO2 Só lid o )
Io d o(1 8 5 ,3
C)
- Água :
- Fusão:
0,01
100 374
θ F = 0⁰C
p = 135 atm → θ F = - 1⁰C
p =340atm → θ F = - 2,5⁰C
p = 1 atm →
Ɵ (ºC)
Regelo (Tyndall)
Água : Líquido – Vapor:
Ebulição: 100ºC → 1 atm (Recife)
98⁰C → S.Paulo
90ºC→ Quito
96ºC → Brasília
87⁰C → La Paz
-Panela de Pressão → p maior →Ɵ> 100⁰C
-Autoclave
Estudo dos Gases
• compressibilidade e expansibilidade
• moléculas não tem volume próprio → “volume dos vazios”
(volume do recipiente que o contém).
• forças coesivas desprezíveis entre as moléculas
• Não mudam de fase : (gasoso)
• partículas puntiformes
• Ep 0 Ec das moléculas Mov.desordenado CAOS
• Colisões perf eitamente elásticas: Emec const.e Q const.
Gás ideal ou perfeito
Gás real → ideal:
pressão baixa e
temperatura alta
•Estado de um gás → 3 variáveis de estado {p - V - T}
Teoria Cinética dos gases:
1m 2
v m v 2 3pV
3V
1
3
3
energia cinética : Ec mv 2 pV nRT
2
2
2
pressão do gás : p
3RT
Temperatur a grau de agitação das partículas
M
E
3 n
3 R
energia cinética média por molécula : E c R T
T Ec 3 K T
c
N 2 N
2 NA
2
J
velocidade média das moléculas : v
onde K R
1,38 10 23 K const.Boltzmann Ec 0 T 0 zeroabsoluto
NA
energia Interna gás monoatômico : U Σ Ec
• ΔT>0→AU >0
ΔT<0→AU<0
3
3
nRT U nRT
2
2
ΔT=0→AU=0
Lei de Joule : U é funçãoexclusivada Temperatur a
(Gás Diatômico : U
5
nRT)
2
Mol → Quantidade de matéria que contém um número invariável de partícilas
Esse número invariável de partículas é o número ou constante de Avogadro
NA=6,02x10²³
átomos
moléculas
ions
elétrons
O mol de um gás é o conjunto de 6,02x10²³ moléculas do mesmo
ex :1 mol de O 2 6,02x 10²³ moléculas de O 2 .
Número de mols n
Ex: O₂
m
M
→ massa de amostra de gás
→ molécula grama = massa de 1 mol (massa molar)
m 96
m=96 g
n
3 mols
M 32
M= 32g /mol
Equação de Clapeyron :
pV
R n R const.universal dos gases ideais
R 0,082
T
p V nRT
ou
pV
m
RT
M
Lei geral dos gases perfeitos:
Estado A
Pa
Va → Pa Va = nRTa
Ta
Estado B
Pb
Vb → Pb Vb = nRTb
Tb
(T Kelvin)
Pa Va nR Ta
Pa Va Pb Vb
Pb Vb nR Tb
Ta
Tb
(÷)
CNTP
T 0º C 273K
p 1atm 105 Pa
R 8,31
atm l
mol k
J
mol k
Transformações:
P
T2
T 1 Isótermas
v
Isotérmica (Boyle Mariotte): T= const.→ pV = const (Pa Va pbVb ) :
v
P
Va Vb
V
Isobárica (Gay Lussac): p const. T const. Ta Tb :
v
Isocória ou Isométrica (Charles) : V const. P const. Pa Pb :
Ta
Tb
T
P
P
T
T2 > T 1
v
T
Download