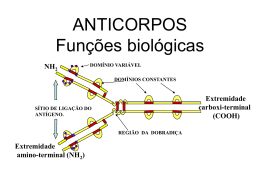
Estrutura e funções de Anticorpos 14 e 21/08/07 Imunoglobulinas – Proteínas de conformação globular que participam da Resposta Imune Podem ser encontradas secretadas ou ancoradas na membrana das células do sistema imunológico Anticorpos – Glicoproteínas de formato globular secretadas por Linfócitos B que conferem a característica de especificidade da Resposta Imune Adquirida Humoral Todo anticorpo é uma imunoglobulina, mas nem toda imunoglobulina é um Anticorpo!!! Eletroforese de Proteínas do Soro Imunoglobulinas e Anticorpos Estrutura básica de uma molécula de Anticorpo Formados por 4 cadeias polipetídicas: 2 cadeias idênticas entre si denominadas Cadeias Pesadas (H) E duas cadeias idênticas entre si Denominadas Cadeias Leves (L) As cadeias leves se ligam às cadeias aesadas através de ligações dissulfeto. As cadeias pesadas se ligam entre si Também por ligações dissulfeto 2 tipos principais de cadeias leves: Kappa (k) e Lambda (l) 4 tipos principais de cadeias pesadas: Gamma (γ), mu (μ ), epsilon (ε), delta (δ ) e alpha (α) A cadeia pesada possui uma região rica em determinados Aminoácidos, a qual confere maleabilidade à estrutura do Anticorpo, denominada Região da Dobradiça Além disso, podemos encontrar distribuídos pelas Cadeias Leves e Pesadas, estruturas denominadas domínios, que são seqüências repetitivas de Aminoácidos que assumem conformação particular Os anticorpos são classificados de acordo com o tipo de cadeia pesada que apresentam (Isotipos): γ – IgG (subclasses IgG1, IgG2, IgG3 e IgG4) δ – IgD ε – IgE α – IgA (Subclasses IgA1 e IgA2) μ - IgM Frações Fab e Fc Frações Fab e Fc As cadeias leves e pesadas possuem duas regiões distintas, classificadas de acordo com sua seqüência de aminoácidos: A Região Constante e a Região Variável Nas regiões variáveis, podemos identificar partes denominadas Regiões Hipervariáveis, ou mesmo CDRs (Regiões Determinantes De Complementariedade), que são estruturas que entram em contato Íntimo com o antígeno para o qual o anticorpo é específico Esquema das Regiões CDRs Ligação do Antígeno ao Anticorpo As regiões variáveis das cadeias pesadas e leves são mostradas em azul e amarelo. As cadeias em vermelho compõem o sítio de ligação, evidenciando os resíduos de aminoácidos, nas regiões determinantes de complementariedade (CDR), que fazem contato com o antígeno. o Fc tem funções importantes. Veja então as funções do Fab e algumas do Fc: MICRÓBIO 1 - SE LIGA AO ANTICORPO MICRÓBIO 2 - NÃO SE LIGA AO ANTICORPO Ligação com o antígeno específico Fab LIGAÇÃO DO Fc AO FAGÓCITO Outras atividades funcionais Fc RECEPTOR DE Fc LIGAÇÃO DO Fc AO COMPLEMENTO Neutralização, Opsonização e Ativação do Complemento Isotipos, Alotipos e Idiotipos Características dos Isotipos de Anticorpos: Estrutura dos Isotipos de Anticorpos: Os diferentes isotipos de Acs apresentam estruturas variadas IgM - Neutralizam toxinas - Fixam o complemento -Receptor de antígenos na superfície dos Linf. B -Marcador de fase aguda de doenças infecciosas IgG - Quatro subclasses: IgG1, IgG2, IgG3 e IgG4 - neutralizam toxinas (todos) - fazem opsonização (IgG1 e IgG3) - fixam complemento (IgG1, IgG2 e IgG3) - são os únicos que podem atravessar a placenta (IgG2) IgA - neutralizam toxinas - bloqueiam a ligação de antígenos nas mucosas -Apresentam-se na forma dimérica ou trimérica IgE -Levam a degranulação de mastócitos e basófilos. -Participam da imunidade contra helmintos IgD -Receptor de antígenos na superfície dos linf. B Antígeno -Toda molécula reconhecida como estranha pelo organismo – interage com Ac e TCR -Epitopo – menor fração de um antígeno capaz de ser reconhecida por anticorpos ou se ligar a TCRs. -Antigenicidade: capacidade de um antígeno de ser reconhecido pelo sistema imunológico -Imunogenicidade: capacidade do antígeno de ativar uma resposta imunológica Antígeno Qualquer molécula biológica é potencialmente um antígeno! Self e Non-Self! Anticorpos podem se ligar a virtualmente toda e qualquer espécie de molécula biológica! TCRs se ligam somente a peptídeos processados e apresentados por APCs! Determinantes Antigênicos A estrutura íntegra do antígeno é primordial para seu reconhecimento ideal FORÇAS DE INTERAÇÃO AG-AC Diversos tipos de ligações químicas podem estar envolvidas Ao mesmo tempo na ligação Ag-Ac Ligação do Antígeno ao Anticorpo A ligação entre Ag e Ac é resultado da conformação do Ag e do Fab do Ac e das interações químicas entre eles INTERAÇÃO AG-AC Ag + Ac Ag-Ac A interação Antígeno-Anticorpo segue a lei das massas Complexo Ag-AC A quantidade de um antígeno e de um anticorpo em uma Solução é fundamental para a formação de complexos Ag-Ac Valência, Avidez e Afinidade Afinidade – representa a força da ligação entre o Ag e o Ac Avidez – representa o somatório de todas essas forças Bibliografia: Immunobiology – Janeway and Travers, 6th ed., Elsevier, 2004. Immunology - Roitt, Brostoff and Male, 6th ed., Mosby, 2002. Cellular and Molecular Immunology – Abbas and Lichtmann, 5th ed. Saunders. 2003. Immunity's Early-Warning System - O'Neill, Scientific American, 292:32, 2005.
Download