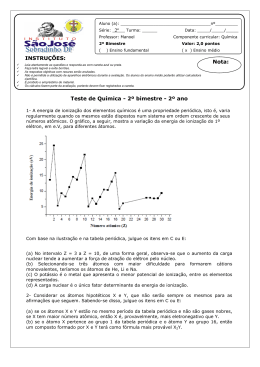
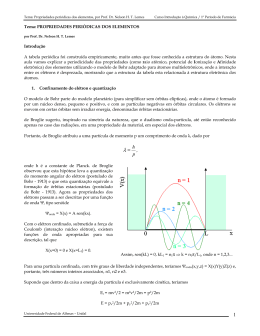
Curso: Bacharelado em Química Tecnológica Disciplina: Química Geral Prof .Veiga Lista de Exercícios – Assunto: Tabela Periódica 1. Defina o que é um período e o que é um grupo da Tabela Periódica dos Elementos Químicos. 2. O que apresentam em comum átomos de elementos de um mesmo grupo? 3. O que apresentam em comum átomos de elementos de um mesmo período? 4. Quais são as principais características dos elementos metálicos? 5. Classifique cada um dos elementos em metal, não metal ou metalóide a) antimônio b) enxôfre c) manganês d) magnésio e) fósforo f) silício 6. Considere os metais: potássio, estrôncio, vanádio, platina, lítio, urânio, sódio, bário, ouro e tungstênio. Quais são considerados de transição? 7. Complete o quadro (sem usar a Tabela Periódica) Elemento E1 E2 E3 E4 E5 Número atômico 40 Configuração externa Grupo Período Família 5º Gás nobre 4s24p5 6s24f4 II A 6º 8. Consulte a TP e indique os nomes e símbolos dos elementos E1, E2, E3, E4 e E5 do exercício anterior. Curso: Bacharelado em Química Tecnológica Disciplina: Química Geral Prof. Veiga 5ª Lista de Exercícios – Assunto: Tabela Periódica Gabarito Prof. Pedro & Veiga 1. São as linhas horizontais da Tabela Periódica, que têm um tamanho tal, que elementos com as mesmas características fiquem uns sob os outros. 2. Subníveis externos iguais em níveis energéticos diferentes. 3. Mesmo nível energético. 4. É a metade da distância entre dois átomos vizinhos de um mesmo elemento 5. Aumenta de cima para baixo, pois os elétrons entram em diferentes e crescentes níveis energéticos. 6. Diminui da esquerda para a direita, pois os elétrons vão entrando em mesmo nível energético, aumentando a atração elétron/ núcleo, sendo que os núcleos vão apresentando um número crescente de prótons. 7. É a energia necessária para retirar um elétron do átomo no estado gasoso. 8. Diminui de cima para baixo, a medida em que os elétrons mais externos vão ficando mais longe do núcleo e como conseqüência menos atraídos. 9. Aumenta da esquerda para a direita, a medida em que os elétrons mais externos vão ficando mais atraídos pelo núcleo, pois aumenta a atração elétron/núcleo. 10. Ca tem o menor raio atômico, portanto a maior energia de ionização. Rb tem o maior raio atômico, portanto a menor energia de ionização 11. a) Maior: Al; Menor: C b) Maior Ei: C; Menor Ei: Al 12. Brilho, maleabilidade, ductibilidade, condução de eletricidade e calor. 13. Diminui da esquerda para a direita; aumenta da esquerda para direita -1 0 14. Raio atômico: 0,230 nm / densidade: 1,38 gmL / PF: 14,5 C. 15. metal: Mn e Mg não metal: S e P metalóides: Sb e Si 16. V, Pt, U, Au e W 2 2 17. E1: 5s 4d / IV B / 5º / metal de transição E2: 35 / VII A / 4º / halogênios 2 6 E3: 54 / 5s 5p / VIII A E4: 60 / III B / 6º / série dos lantanídeos 2 E5: 56 / 6s / metal alcalino terroso 18. Zircônio (Zr) / bromo (Br) / xenônio (Xe) / neodímio (Nd) / bário (Ba)
Download