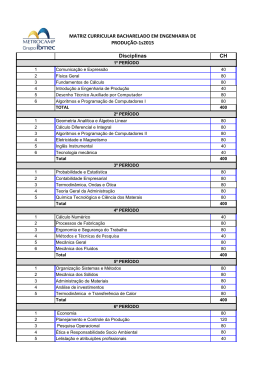
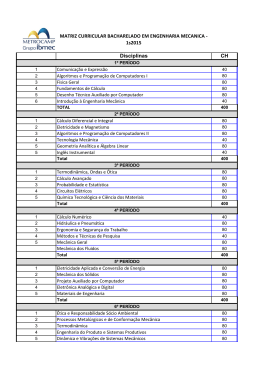
Formulário de Identificação da Disciplina UNIDADE: Instituto de Química DEPARTAMENTO: Departamento de Química Geral e Inorgânica DISCIPLINA: Elementos Químicos VI CH TOTAL 120 CRÉDITOS Característica: X 06 CÓDIGO QUI01-03981 Cursos: Obrigatória Física – Bacharelado e Licenciatura Plena Eletiva restrita Eletiva definida Eletiva universal Carga Horária: Distribuição de carga horária da disciplina: do Aluno do Professor 120 H 60H Tipo de aula: Semanal Semestral Teórica 4 60 Prática 4 60 Laboratório - - Estágio - - 08 120 Total Objetivos: Estudar a evolução das teorias e dos modelos de átomos e de ligações químicas. Aplicar conceitos e equações fundamentais da química na resolução de problemas. Conceitos de outras disciplinas necessários para a aprendizagem desta disciplina: Pré-requisito(s) sugerido(s): Código: Pré-requisito: Código: Ementa: UNIDADE 1: A EVOLUÇÃO DO CONCEITO DE ÁTOMO 1.1 Os primeiros modelos atômicos: Dalton, Thompson e Rutherford. 1.2 O átomo de Bohr 1.3 O comportamento dual do elétron 1.4 Números quânticos 1.5 Princípio da exclusão de Pauli. 1.6 Regra de hund. 1.7 As energias eletrônicas. UNIDADE 2: LIGAÇÕES QUÍMICAS 2.1 – Ligações iônicas 2.2 – ligações covalentes 2.3 – Polaridade das moléculas. 2.4 – Ligação metálica UNIDADE 3: SOLUÇÕES AQUOSAS 3.1 – Unidades de Concentração 3.2 – Princípios de solubilidade. 3.3 – Propriedades Coligativas 3.4 - Eletrólitos UNIDADE 4: RELAÇÕES ÁCIDO-BASE 4.1 – Definição de Arrhenius. 4.2 – Definição pelo sistema solvente 4.3 – Definição de Bronsted-Lowry 4.4 – Reações de neutralização: titulações ácido-base UNIDADE 5: EQUILÍBRIO ÁCIDO-BASE 5.1 – a dissociação de ácidos fracos e bases fracas: constantes de dissociação. 5.2 – A dissociação da água: produto iônico da água; Ph 5.3 – Hidrólise: Hidrólise do ânion; hidrólise do cátion; constantes de hidrólise; ph de soluções de sais 5.4 – Soluções tampão UNIDADE 6: ASPECTOS TERMODINÂMICOS DAS TRANSFORMAÇÕES QUÍMICAS 6.1 – A Primeira Lei da Termodinâmica 6.2 – Entalpia e capacidade calorífica 6.3 – Termoquímica 6.4 – A segunda Lei da Termodinâmica 6.5 – Variações da entropia e de energia livre de Gibbs 6.6 – Termodinâmica e Equilíbrio. UNIDADE 7: ELETROQUÍMICA 7.1 – Células galvânicas 7.2 – Células eletrolíticas 7.3 – Potenciais de padrão de eletrodo 7.4 – Energia livre, tensão de célula e equilíbrio 7.5 – Medida eletroquímica do ph. 7.6 – Pilhas Comerciais UNIDADE 8: ASPECTOS CINÉTICOS DAS TRANSFORMAÇÕES QUÍMICAS 8.1 – introdução ao significado de velocidade e de mecanismo de reações 8.2 – Equação de velocidade. 8.3 – Teoria das colisões. 8.4 – Complexo ativado 8.5 – Catálise. UNIDADE 9: PROCESSOS NUCLEARES 9.1 – Radiatividade natural e séries de desintegrações radioativas 9.2 – A cinética da desintegração nuclear: desintegração radioativa de primeira ordem; datação radioquímica 9.3 – Reações nucleares: transmutação. Bibliografia (Clássica / Básica da área): BRADY, J.E., HUMISTON, G. E. Quimíca Geral. 2ª edição. Rio de Janeiro: Livros Técnicos e Científicos, 1981. Vol. 1 e 2. MASTERTON, W.L., SLOWINSKI, E. J. SLANITSKI, C.L. Princípios de Química. 6ª edição. Rio de Janeiro. Livros Técnicos Científicos, 1990. RUSSEL, J. B. Química Geral. 2ª edição. São Paulo: Makron Books, 1994. Vol. 1 e 2. Professor proponente Rosana Bulos Santiago Data Assinatura/matr. Chefe do Departamento Maria Lúcia Grillo P. Baptista Data Rubrica Diretor Luis A. C. P. da Mota Data Rubrica
Download