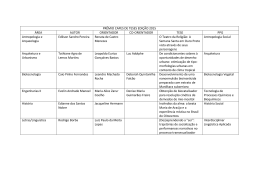
05/04/2012 Ligações Intermoleculares Prof. Msc. Frederico Costa 03/04/2012 Relembrando… Átomos Moléculas Química Aplicada a Engenharias Matéria 2 1 05/04/2012 Ligação Intermolecular • As Ligações Intermoleculares são as responsáveis pelas propriedades físicas apresentadas por fases condensadas da matéria. – – – Propriedades Físicas – Propriedades tais como estado físico, ponto de fusão, ponto de ebulição, viscosidade… Fase – é uma porção da matéria que apresenta composição química e propriedades físicas uniformes ao longo de sua extensão. Fase Condensada – classifica toda a matéria no Estado Sólido ou Líquido. Química Aplicada a Engenharias 3 Ligação Intermolecular • Imagine a seguinte situação: Do ponto de vista molecular, qual é a diferença entre estes estados da água? Química Aplicada a Engenharias 4 2 05/04/2012 Ligação Intermolecular • • Os tipos de Ligação Intermolecular são: Tipo de Interação Energia Média (kJ/mol) íon-íon 250 íon-dipolo 15 dipolo-dipolo 2,0 dipolo-dipolo induzido 2,0 forças de London 2,0 ligação de hidrogênio 20 OBS: Todos os tipos de ligação intermolecular envolvem forças de atração coulômbicas (forças eletrostáticas) Química Aplicada a Engenharias 5 Ligação Íon-Dipolo • Acontece entre um íon e moléculas polares. Distribuição da carga parcial ao redor da molécula polar de água (H2O). Representação de cargas elétricas de um ânion (verde) e cátion (vermelho). Química Aplicada a Engenharias 6 3 05/04/2012 Ligação Íon-Dipolo • Uma das interações íon-dipolo mais comuns acontece durante a hidratação, ou solvatação, de um íon em água : Em (a) um cátion é cercado por moléculas de água, já em (b) um ânion é rodeado por moléculas de água. Química Aplicada a Engenharias 7 Ligação Íon-Dipolo • Para exemplificar este tipo de interação, consideremos a dissolução de NaCl em água: a) Primeiro contato entre moléculas de água e um dos íons (Na+ ou Cl-), formação da primeira ligação entre íon e molécula de água. b) As moléculas de água formam mais ligações com o íon, enquanto este vai desfazendo algumas de suas ligações com os outros íons do corpo sólido. Química Aplicada a Engenharias 8 4 05/04/2012 Ligação Íon-Dipolo c) Finalmente o número de interações entre as moléculas de água e o íon aumenta a ponto de vencer as interações intermoleculares do sólido; desta maneira o íon é inteiramente envolvido por moléculas de água, finalizando assim o processo de solvatação. Química Aplicada a Engenharias 9 Ligação Íon-Dipolo • Por se tratar de uma atração coulômbica, a Energia Potencial, Ep, da interação íon-dipolo pode ser examinada com o auxílio da seguinte equação: onde: μ – momento de dipolo elétrico da molécula z – carga do íon r – distância entre os núcleos (íons e moléculas) Química Aplicada a Engenharias 10 5 05/04/2012 Ligação Íon-Dipolo • • Portanto, a distância entre os núcleos afetará o valor de Ep mais fortemente quando comparado com os valores de carga. Assim ligações íon-dipolo serão mais fortes quando cargas altas e raios iônicos baixos se combinarem. – – Sais de Li ou de Na são mais higroscópicos que os de K, Rb ou de Cs. Sais de Ba são ainda mais higroscópicos que os de K. Química Aplicada a Engenharias 11 Ligações Dipolo-Dipolo • Ocorre entre moléculas polares. Molécula de CHCl3 e suas cargas parciais, note bem a localização da carga ao longo da molécula. Química Aplicada a Engenharias 12 6 05/04/2012 Ligações Dipolo-Dipolo • A Ep deste tipo de ligação pode ser examinada da seguinte maneira: onde: μ – momento de dipolo elétrico da molécula r – distância entre os núcleos (moléculas) Química Aplicada a Engenharias 13 Ligações de Hidrogênio • Característica de moléculas polares. • Ocorre quando um átomo de H ligado a um átomo pequeno e eletronegativo (tal qual N, O ou F) é atraído pelos elétrons não ligantes de outro átomo de N, O ou F. Química Aplicada a Engenharias 14 7 05/04/2012 Ligações de Hidrogênio • Este tipo de interação tem aproximadamente 10% da força de uma ligação covalente, e é a mais forte dentre as interações intermoleculares: Química Aplicada a Engenharias 15 Ligações de London • Ocorre entre moléculas apolares. • Formação do Dipolo-flutuante: Química Aplicada a Engenharias 16 8 05/04/2012 Ligações de London • Ligação entre dipolos flutuantes: Química Aplicada a Engenharias 17 Ligações de London • Polarizabilidade (α) – é alta quando o átomo possui pouco controle sobre os elétrons que o cercam. (altos raios iônicos ou altos pesos moleculares) Ao lado, a comparação entre três hidrocarbonetos: à esquerda o pentano C5H12, no meio o pentadecano C15H32 e à direita o octadecano, C18H38. Química Aplicada a Engenharias 18 9 05/04/2012 Ligações de London • A Ep destas ligações é examinada pela seguinte relação: onde: α – polarizabilidade da molécula r – distância entre os núcleos (íons e moléculas) Química Aplicada a Engenharias 19 Ligações de London • A forma das moléculas no espaço também influencia a intensidade das ligações de London, vide o exemplo abaixo: Química Aplicada a Engenharias 20 10 05/04/2012 Ligações de London • Comparando a forma molecular dos halogênios é possível verificar o efeito das Ligações de London: Halogênio Estado Físico a 25oC Halogênio F2 Br2 Cl2 I2 Estado Físico a 25oC Química Aplicada a Engenharias 21 Ligação Dipolo-Dipolo induzido • Ocorre entre uma molécula polar e outra apolar. • A Ep deste tipo de ligação pode ser investigada por: onde: μ – momento de dipolo elétrico da molécula α – polarizabilidade da molécula r – distância entre os núcleos (íons e moléculas) Química Aplicada a Engenharias 22 11
Download