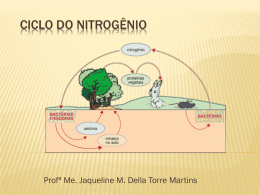
Aula: 13 Temática: Sais minerais e Nitrogênio Iniciaremos a unidade III com o estudo dos sais minerais presentes nas águas naturais. Sais minerais Sais minerais são os sais essenciais aos organismos vegetais, como algas, vegetais superiores entre outros organismos que vivem nos corpos d’água. Existem inúmeros sais minerais dissolvidos nas águas naturais, entre eles estão o nitrogênio, fósforo, enxofre, magnésio, potássio, cálcio, ferro. O teor de sais dissolvidos nas águas é que diferenciam a água doce da água do mar. Os principais sais dissolvidos na água do mar são: Cl- (cloreto) 56%, Na+ (sódio) 28%, SO42- (sulfato) 8%, Mg 2+ (magnésio) 4%, Ca2+ (cálcio) 1.5%, K+ (potássio) 1%, HCO3- (bicarbonato) 0.5%. Vários fatores influenciam na concentração dos sais minerais nas águas naturais. O solo por onde as águas percorrem e percolam, a temperatura da água, a quantidade de matéria orgânica nela dissolvida, a concentração de dióxido de carbono e oxigênio, o comportamento geoquímico dos compostos químicos entre outros fatores são os responsáveis pelos sais dissolvidos nas águas naturais. Desta forma, as concentrações dos sais encontradas nas águas naturais não são homogêneas, podendo ser encontrado diferentes concentrações de carbonatos, nitratos, sulfatos, cloretos, silicatos, fosfatos, potássio e ferro dependendo dos corpos d’água. Os compostos de nitrogênio e fósforo são indispensáveis para a vida aquática, entretanto dependendo da quantidade, eles provocam danos ao meio aquático, causando proliferação das algas. Esse fenômeno é conhecido como eutrofização. Nitrogênio O nitrogênio é um elemento muito importante para os organismos, pois fazem parte das moléculas de proteína, sendo encontrado em todas as células dos organismos vivos. 56 QUÍMICA AMBIENTAL O gás nitrogênio nas águas naturais pode ser encontrado nas formas orgânicas e inorgânicas. Dependendo de seu estado de oxidação ele pode se apresentar sob as formas de nitrogênio orgânico, molecular, amônio, nitrito e nitrato. As algas e plantas aquáticas assimilam mais facilmente o nitrogênio na forma de amônio e nitrato. Segundo Libânio o nitrogênio pode ser: • Nitrogênio orgânico na forma dissolvida – compostos orgânicos nitrogenados – e particulada, integrando a biomassa dos organismos de meio aquático; dissolvido ou particulado; • Nitrogênio molecular (N2), sujeito a constantes perdas na atmosfera; • Amônia (NH4+), forma reduzida presente em condições aeróbicas; • Nitrito (NO2-), forma intermediária e instável da oxidação do amônio; • Nitrato (NO3-), forma oxidada presente em condições anaeróbicas e indicador de poluição remota por esgotos domésticos. Em águas naturais ocorrem os processos de nitrificação e desnitrificação. No processo de nitrificação, o nitrogênio, principalmente na forma de amônia, sobre oxidação pela ação das bactérias, se transformando primeiro em nitritos e depois em nitratos. Na desnitrificação os nitratos e nitritos são reduzidos a nitrogênio gasoso. Em ambientes aeróbicos o nitrogênio o é encontrado na forma de nitrato, e em ambientes anaeróbicos nas formas de amônia e íons amônia. Os padrões de qualidade das águas, segundo a resolução CONAMA nº 357/2005, para compostos de nitrogênio são: QUÍMICA AMBIENTAL 57 Classes das águas nitrato nitrito nitrogênio amoniacal total Águas doces – classes 1 e 2 10,0 1,0 Águas doces – classe 3 10,0 1,0 Águas salinas – classe 1 Águas salinas – classe 2 Águas salobras – classe 1 Águas salobras – classe 2 Padrões de lançamento de efluentes 0,40 0,70 0,40 0,70 - 0,07 0,20 0,07 0,20 - 3,7, para pH £ 7,5 2,0, para 7,5 < pH £ 8,0 2,0, para 7,5 < pH £ 8,0 1,0, para 8,0 < pH £ 8,5 0,5, para pH > 8,5 13,3, para pH £ 7,5 5,6, para 7,5 < pH £ 8,0 2,2, para 8,0 < pH £ 8,5 1,0, para pH > 8,5 0,40 0,70 0,40 0,70 20,0 Nesta resolução é utilizado o Nitrogênio amoniacal (NH4+), e mg/L N como unidade. A portaria nº 518, de 25 de março de 2004, estabelece como padrão de potabilidade para substâncias químicas que representam riscos à saúde, 10mg/L de nitrato (como N) e 1mg/L de nitrito (como N), e padrões de aceitação para consumo humano 1,5mg/L de amônia (como NH3). Nos oceanos o nitrogênio provém do vulcanismo, da atmosfera, dos rios, despejos domésticos e industriais. O nitrogênio molecular é a forma mais abundante, a concentração dos nitratos na camada superficial é baixa e aumenta com a profundidade. A amônia na água do mar aparece predominantemente como íon amônio (NH41+), como conseqüência do pH que é de aproximadamente 8,1. A concentração de amônia pode ser danosa ao ecossistema, pois grandes quantidades podem causar sufocamento de peixes. Daremos continuidade, na próxima aula, ao estudo sobre os sais minerais, focando o fósforo. Espero você. 58 QUÍMICA AMBIENTAL
Download