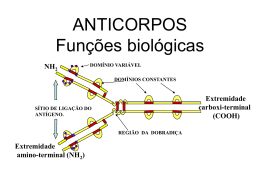
UNIVERSIDADE FEDERAL DE PERNAMBUCO-CCB UNIVERSIDADE FEDERAL PERNAMBUCO-CCB DEPARTAMENTO DEDE GENÉTICA DEPARTAMENTO DE GENÉTICA PROGRAMA DE PÓS-GRADUAÇÃO EM GENÉTICA PROGRAMA DE PÓS-GRADUAÇÃO EM GENÉTICA Disciplina de Genética Molecular Disciplina dePaulo Genética Molecular Professor Andrade Professor Paulo Andrade Anticorpos Monoclonais Nanocorpos Proteína Vif e Imunização intracelular HIV-I • Tem capacidade de infectar células com receptor específico CD4 e co-receptores CCR5 e CXCR4 que se encontram na superfície das células T (linfócitos) CD4 (Klatsmann et al..1984) além de outras células que apresentam estes receptores como monócitos, macrófagos, lifócitos B e células dendríticas Proteína Vif • Fator de Infecção Viral (Vif) – Proteína acessória do do HIV para bloquear a ação do Apobec3g (citidina deaminase) que torna o HIV-I não infeccioso promovendo hipermutações GA durante a síntese do DNA viral – Proteína fosfolrilada multimérica que se encontra maioritariamente no citoplasma das células infectadas (Golçalves et al.1994) – Peso molecular 23 Kdaltons (192 aminiácidos) – Atua nos últimos estágios da replicação viral aumentando de 50 a 1000 vezes a infecção (Fisher et al., 1987; Strebel et al., 1987) – Na ausência de Vif os vírus têm a capacidade de iniciar a transcrição reversa, no entanto, não conseguem completar a síntese do DNA Apobec3g • O Apobec3G é uma proteína da família das citidina deaminases que tem a capacidade de converter citosinas em uracilos por perda de um grupo amina, provocando uma alteração de C-G; A-T (Sheehy et al.,2002; Mariani et al., 2003) • Hipermutações na cadeia negativa do DNA viral. • Desencadeia um processo de reparação do DNA por excisão de bases comprometendo a integridade da estrutura da cadeia simples de DNA viral resultando na interrupção da transcrição. • Na presença de Vif, esta proteína viral interage com o Apobec3G, prevenindo a seu encapsulamento, protegendo o genoma viral de eventuais mutações. Solução terapêutica Gênica • Desenvolvimento de anticorpos recombinantes de cadeia única (scFv) específicos contra o Vif Obstáculos • Expressão intracelular dos anticorpos é confrontado por: – Diminuição da solubilidade – Níveis de expressão – Tempo de meia-vida – Instabilidade da ligação entre VH e VL • Impedem a capacidade de neutralização da proteína alvo • Anticorpos de cadeia única VH ou VL Alternativa • Construção de anticorpos de domínio único baseados nas características dos anticorpos de cadeia pesada dos camelos (VHH) – solubilidade e estabilidade elevadas devido a substituições específicas dos aminoácidos (Phe-37, Glu-44, Arg-45, Gly-47 e Arg-103) na região correspondente a interação com VL – Aminoácidos hidrofóbicos hidrofílicos Anticorpos de cadeia pesada de camelo • Anticorpos com apenas um par de cadeias pesadas nos gêneros Tylopoda (dromedários, camelos e lhamas) • Não apresentam cadeia leve, e a cadeia pesada apresenta apenas três domínios, pois o equivalente ao primeiro domínio constante (CH1) está ausente • Apresenta um domínio variável também na região Nterminal, denominado VHH, seguindo-se os dois domínios CH2 e CH3 (Muyldermans, 2001a,b). • A ausência do domínio VL nos anticorpos IgG VHH retira teoricamente aproximadamente metade do potencial de ligação ao antígenio. Esta perda foi no entanto compensada com uma CDR3 mais longa (loop com 17 resíduos) do que a dos humanos (12 resíduos). Anticorpos de cadeia pesada de camelo • Substituições específicas de aminoácidos, na região correspondente à interação com o domínio VL (Vu, et al, 1997) localizadas na FR2 e FR4 (Phe-37, Glu-44, Arg45, Gly-47 e Arg103) • Aumento da hidrofilicidade dos VHH nesta região, melhorando a solubilidade dos anticorpos dos dromedários, camelos e lhamas (Muyldermans, 2001a,b). • Os domínios VHH representam a mais pequena unidade de ligação ao antígeno com um tamanho molecular perto de 15 kDa em comparação com os fragmentos scFv (30 kDa), fragmentos Fab (60 kDa ) e o anticorpo inteiro (150kDa). Região determinante de complementaridade CDR Fr (Frameworks) OBJETIVOS • Desenvolvimento de anticorpos de domínio único VH anti-Vif de coelho menores e robustos que mantenham as suas propriedade de ligação e neutralização do antígeno (Vif) no ambiente redutor do citoplasma Domínio VH anti-Vif • Domínio VH anti-Vif de um dos anticorpos isolados que apresentou uma das afinidades mais elevadas e que inibiu a replicação do HIV1 (Goncalves et al., 2002). O fragmento VH foi clonado no vetor pComb3X (Barbas et al., 2001). • Plasmídeo pComb3X-VH foi introduzido em células de E. coli TOP 10F’ Ampr. Domínio VH anti-Vif • A indução da expressão do domínio VH – IPTG. Após 18 horas – purificação por cromatografia de afinidade. – Aproximadamente 80% do domínio VH expresso está localizado na fração insolúvel.. Camelização do domínio VH anti-Vif • Mutações na região de interface. • Em anticorpos de camelo,estes aminoácidos são substituídos pelo resíduos Phe-37, Glu-44, Arg-45 e Gly47 (Muyldermans, 2001). • Trp-103 situado na FR4 • Três mutantes denominados, VH-W, VH-CAM e VH-D, Camelização do domínio VH anti-Vif • Método de Kundel, utilizando oligonucleótideos que introduzem a mutação desejada e sequência alvo para uma enzima de restrição. • VH-W mutação W103R na FR4 do domínio VH antiVif. • VH-CAM, mutações V37F, G44E, L44R e W47G dentro da FR2. • VH-D todas as mutações descritas foram introduzidas no domínio VH anti-Vif (V37F, G44E, L44R, W47G e W103R). • Os resultados de expressão e purificação demonstram que a solubilidade do domínio VH vai aumentando à medida que o processo de camelização aumenta (W_CAM_ D) (Aires da Silva et al., 2004). Camelização do domínio VH anti-Vif Avaliação da especificidade e afinidade dos domínios VH anti-Vif • Para avaliar se o domínio VH selvagem e o mutantes construídos mantinham a mesma especificidade e afinidade na ausência do domínio VL, realizaram-se ensaios de ELISA • VH e VHs camelizados apresentaram uma diminuição de ~50% na capacidade de ligação ao Vif. • O decréscimo na afinidade dos VHs anti-Vif não aparenta ser dramático na avaliação do domínios únicos de coelho como anticorpos intracelulares, permitindo mesmo assim um reconhecimento específico da proteína Vif do VIH-1 (Aires da Silva et al., 2004). Expressão dos domínios VH em células eucariontes • VH, VH-W, VH-CAM e VH-D foi clonado no vetor pcDNA3.1. • Os plasmídeos resultantes destas clonagens, designados por pcDNA3.1-VH,pcDNA3.1-VH-W, pcDNA3.1-VH-CAM, e pcDNA3.1-VH-D, foram utilizados para transfectar células 293T. • Após 48 horas de transfecção, as células foram lisadas e os domínios VH expressos foram imunoprecipitados com a matriz anti-HA. Expressão dos domínios VH em células eucariontes • VH-CAM e o VH-D foram os dois domínios que apresentaram os níveis de expressão mais elevados e significativos. • Células eucariontes há correlação entre o aumento da solubilidade e níveis de expressão dos domínios VH, com o aumento da camelização (W_ CAM_ D) (Aires da Silva et al., 2004). Expressão dos domínios VH em células eucariontes • Tempo de meia vida - níveis de expressão dos VHs no ambiente redutor de células eucariontes pulse-chase. • pcDNA3.1-VH-W, pcDNA3.1-VH-CAM e pcDNA3.1-D, as células (293T) incubadas meio sem metionina/cisteína durante 2 horas e de seguida marcadas metabolicamente com [35S] metionina/cisteína. • Incubação com meio suplementado com excesso de metionina (40x) e cisteína (20x) durante vários períodos. A expressão da proteína foi analisada após imunoprecipitação com a matriz anti-HA e electroforese em gel de SDS-PAGE. Expressão dos domínios VH em células eucariontes Domínios VH anti-Vif impedem a síntese de ADN viral e inibem a degradação do Apobec3G • O PCR em tempo real, oligonucleótideos específicos – vírus VIH-1 foram produzidos em células 293T na presença de Apobec3G – plasmídeos pcDNA3.1-VH, pcDNA3.1-VH-W, pcDNA3.1VHCAM, pcDNA3.1-VH-D ou pcDNA3.1-4BL. Infectar células Hela CD4. • Pico na fase inicial da transcrição reversa entre as 9 horas e 12 horas. • O domínio VH selvagem e domínio VH-W SEM EFEITO • VH-CAM, VH-D e scFv-4BL EFEITO NEGATIVO na eficiência da síntese tardia da transcrição reversa. Domínios VH anti-Vif impedem a síntese de ADN viral e inibem a degradação do Apobec3G • Diminuição na integração do provírus mais acentuada na presença do domínio VH-D e scFv-4BL. • Confirmam que os domínios mais solúveis e estáveis são os que apresentam a maior capacidade de inibição da replicação viral (Aires da Silva et al., 2004). CONCLUSÃO • A terapia gênica é uma nova estratégia de medicina molecular com enormes potencialidades na terapêutica de doenças infecciosas e cancerígenas (Cattaneo & Biocca, 1997). • A imunização intracelular através da expressão de zonas variáveis de anticorpos dentro do citoplasma da célula, é uma estratégia cujo objetivo é neutralizar proteínas essenciais a processos biológicos. CONCLUSÃO • Têm sido propostos uma variedade de métodos para obter estes pequenos fragmentos de anticorpos, ou anticorpos de cadeia única (scFv). • Estes anticorpos apresentam normalmente uma especificidade e afinidade idêntica à molécula inteira do anticorpo. No entanto, as regiões de ligação aos antígenos (CDR) dos anticorpos clássicos apresentam desvantagens. CONCLUSÃO cont. • Os resultados de expressão mostraram que existe uma excelente correlação entre o aumento da solubilidade dos domínios VH, com o aumento da camelização (W_ CAM_ D). CONCLUSÃO cont. • Os resultados obtidos com o ensaio de pulse-chase indicaram também que o processo de camelização do domínio VH anti-Vif tem um papel importante não só no aumento da solubilidade e expressão como também melhora a estabilidade e tempo de vida intracelular dos domínios CONCLUSÃO cont. • Os resultados obtidos neste estudo abrem novas perspectivas na área da manipulação de anticorpos intracelulares. A camelização de domínios VH de coelho poderá ser assim uma nova abordagem para desenvolver anticorpos mais pequenos, robustos e eficientes na neutralização da proteína alvo. • Muito Obrigado!!!
Baixar