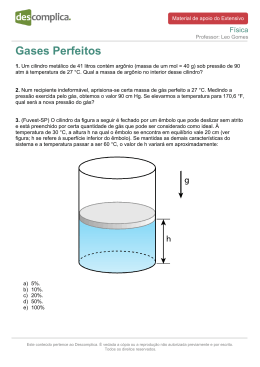
Ciclo 2- FÍSICA - Frente 1Gases Perfeitos - 3°trimestre Aula Aula Aula Aula Sampaio puxa, rapidamente, o êmbolo dessa seringa, como mostrado nesta figura: 17 – Estudo dos gases perfeitos 18- Equação de Clapeyron 19- Lei geral dos gases e misturas 20- Gases perfeitos 1- Dudu é apaixonado por jogar futebol. Certo dia, ele combinou com seus amigos jogar uma partida na quadra de seu prédio, à noite. Durante a tarde ele procurou sua bola e encontrou-a ao Sol, verificando que estava bem cheia. No entanto, à noite, seus amigos reclamaram que ele poderia ter enchido melhor a bola. Sabendo que na noite do jogo estava bem frio, como você explicaria o fato da bola ter ficado um pouco murcha? 2-Um gás perfeito está sob pressão de 20atm, na temperatura de 200K e apresenta um volume de 40 litros. Se o referido gás tiver sua pressão alterada para 40atm, na mesma temperatura, qual será o novo volume? 3-(PUC) Quando usamos um desodorante na forma de spray temos a sensação de frio. Isto se deve ao fato que o spray: a) Está dentro da lata em estado líquido e na temperatura ambiente. Ao sair da lata, passa para o estado de vapor roubando calor do ambiente. b) Já estava frio quando fechado na lata, pois todo vapor para se condensar deve ter sua pressão aumentada, provocando redução de sua temperatura. c) Já estava frio quando acondicionado na lata, pois todo vapor só se condensa quando a temperatura diminui. d) Já estava frio quando fechado na lata, pois todo vapor para se condensar, deve ter sua pressão diminuída, provocando, como conseqüência, redução de sua temperatura. e) Já estava frio quando colocado na lata, pois esta é feita de metal, o qual tem a propriedade de roubar calor do interior da lata rapidamente. 4-(PUC) A pressão do ar no interior dos pneus é recomendada pelo fabricante para a situação em que a borracha está fria. Quando o carro é posto em movimento, os pneus se aquecem, seus volumes têm alterações desprezíveis e ocorrem variações nas pressões internas dos mesmos. Considere que os pneus de um veículo tenham sido calibrados a 17°C com uma pressão de 1,7x10¦N/m2. Após rodar por uma hora, a temperatura dos pneus chega a 37°C. A pressão no interior dos pneus atinge um valor aproximado de: a) 1,8 x 105N/m2 b) 3,7 x 105 N/m2 4 2 c) 7,8 x 10 N/m d) 8,7 x 105 N/m2 5-(Ufmg) Uma seringa, com a extremidade fechada, contém uma certa quantidade de ar em seu interior. Considere o ar como um gás ideal. Sabe-se que, para um gás ideal, a energia interna é proporcional à sua temperatura. Com base nessas informações, é CORRETO afirmar que, no interior da seringa, a) a pressão do ar aumenta e sua temperatura diminui. b) a pressão do ar diminui e sua temperatura aumenta. c) a pressão e a temperatura do ar aumentam. d) a pressão e a temperatura do ar diminuem. 6-(Ufmg) Um cilindro tem como tampa um êmbolo, que pode se mover livremente. Um gás, contido nesse cilindro, está sendo aquecido, como representado na figura. Assinale a alternativa cujo diagrama MELHOR representa a pressão em função da temperatura nessa situação. 7-(Uerj) Um equilibrista se apresenta sobre uma bola, calibrada para ter uma pressão de 2,0atm a uma temperatura de 300K. Após a apresentação, essa temperatura elevou-se para 306K. Considere desprezível a variação no volume da bola. Calcule a pressão interna final da bola. 8-(PUC) A panela de pressão utilizada em nossas casas cozinha mais rapidamente os alimentos. Por quê? Marque a resposta correta. a) A panela de pressão não altera o tempo de cozimento. b) nenhuma é correta. c) Os alimentos são cozidos a uma temperatura mais elevada que nas panelas comuns. d) Aumentando a pressão, a água penetra melhor nos alimentos; em conseqüência, cozinha melhor. e) Aumentando a pressão, diminui o volume dos alimentos; em conseqüência, cozinha melhor. 9-(Uefs) Dois recipientes A e B de mesmo volume V são conectados através de um tubo curto, de volume desprezível, e dotado de um a torneira inicialmente fechada. O recipiente A contém N mols de um gás ideal a uma temperatura T e no recipiente B é feito vácuo. Considere que todo o sistema seja isolado adiabaticamente. Após a torneira ser aberta e o sistema atingir o equilíbrio, a temperatura do gás será: a) T/ 4 b) T/2 c) T d) 2T e) 4T 10-(Mackenzie) 13-(Ufg) Um gás ideal está encerrado em um cilindro provido de um êmbolo, que pode se deslocar livremente. Se o gás sofrer uma expansão rápida, ( ) a pressão p e o volume V irão variar de tal modo que o produto pV permanece constante. ( ) sua energia interna diminuirá. ( ) a quantidade de calor, trocada entre ele e a vizinhança, será desprezível. ( ) a velocidade média das moléculas aumentará. 14-(Fuvest) Um equipamento possui um sistema formado por um pistão, com massa de 10kg, que se movimenta, sem atrito, em um cilindro de secção transversal S = 0,01m2. Operando em uma região onde a pressão atmosférica é de 10,0×104 Pa (1 Pa = 1 N/m2), o ar aprisionado no interior do cilindro mantém o pistão a uma altura H = 18 cm. No estado D, a massa de gás ocupa um volume de: a) 2,40 litros b) 2,80 litros c) 3,00 litros d) 3,60 litros e) 4,00 litros 11-(Puc) No esporte de mergulho submarino, há risco de doenças graves pelo chamado mal descompressivo, que ocorre quando o mergulhador sobe muito rápido à superfície, formando-se bolhas de nitrogênio nos tecidos e no sangue. Isto ocorre porque: a) sendo constante a pressão interna dos pulmões enquanto o mergulhador sobe, os gases ficam presos nos tecidos e no sangue, não sendo possível eliminá-los. b) a alta pressão externa da água a grandes profundidades impede a expiração do ar pelos pulmões. c) volume dos pulmões se contrai rapidamente na subida, impedindo a eliminação do ar; d) a densidade do nitrogênio dissolvido nos tecidos e no sangue é cada vez maior à medida que o mergulhador sobe; e) os gases diluídos no sangue expandem-se rapidamente, não sendo possível eliminá-los a tempo através da respiração. 12-(Uel) Um "freezer" é programado para manter a temperatura em seu interior a -19°C. Ao ser instalado, suponha que a temperatura ambiente seja de 27°C. Considerando que o sistema de fechamento da porta a mantém hermeticamente fechada, qual será a pressão no interior do "freezer" quando ele tiver atingido a temperatura para a qual foi programado? a) 0,72 atm b) 0,78 atm c) 0,85 atmd) 0,89 atme) 0,94 atm Quando esse sistema é levado a operar em uma região onde a pressão atmosférica é de 8,0×104 Pa, mantendo-se a mesma temperatura, a nova altura H no interior do cilindro passa a ser aproximadamente de a) 5,5 cm b) 14,7 cm c) 20 cm d) 22 cm e) 36 cm 15-(Uece) Numa transformação isobárica, a temperatura absoluta de uma amostra de gás ideal é diretamente proporcional à(ao): a) sua massa b) sua densidade c) volume ocupado pelo gás d) seu número de moles 16-(Mackenzie) Na figura a seguir, o diagrama de Clapeyron mostra as transformações sofridas por uma certa massa de gás perfeito. A temperatura desse gás no estado C é: a) 327 °C b) 300 °C c) 273 °C d) 212 °C e) 180 °C 17-( Ufrs) Um gás ideal sofre uma compressão adiabática durante a qual sua temperatura absoluta passa de T para 4T. Sendo P a pressão inicial, podemos afirmar que a pressão final será a) menor do que P. d) igual a 4 P. b) igual a P. c) igual a 2 P. e) maior do que 4 P. 18-(Unicamp) Um cilindro de 2,0 litros é dividido em duas partes por uma parede móvel fina, conforme o esquema a seguir. O lado esquerdo do cilindro contém 1,0mol de um gás ideal. O outro lado contém 2,0 mols do mesmo gás. O conjunto está à temperatura de 300 K. Adote R = 0,080 atm.l/mol.K a) Qual será o volume do lado esquerdo quando a parede móvel estiver equilibrada? b) Qual é a pressão nos dois lados, na situação de equilíbrio? 19-(Fuvest) Uma certa quantidade de gás perfeito passa por uma transformação isotérmica. Os pares de pontos pressão (P) e volume (V), que podem representar esta transformação, são: a) P= 4; V= 2 e P= 8; V= 1 b) P= 3; V= 9 e P= 4; V= 16 c) P= 2; V= 2 e P= 6; V= 6 d) P= 3; V= 1 e P= 6; V= 2 e) P= 1; V= 2 e P= 2; V= 8 20-(Ufpe) Qual dos gráficos a seguir melhor representa o que acontece com a pressão no interior de um recipiente contendo um gás ideal, a volume constante, quando a temperatura aumenta? c) não sofre variação alguma. d) torna-se 5 vezes maior. e) torna-se 5 vezes menor. 23-(Mackenzie) Certa massa de gás ideal sofre uma transformação Isobárica, com sua temperatura absoluta T variando proporcionalmente ao seu volume V. Sendo P a pressão desse gás, a melhor representação gráfica dessa transformação é: 24-(Puc) Um recipiente rígido contém gás perfeito sob pressão de 3 atm. Sem deixar variar a temperatura, são retirados 4 mols do gás, fazendo com que a pressão se reduza a 1 atm. O número de mols existente inicialmente no recipiente era a) 6 b) 8 c) 10 d) 12 e) 16 25-(Unicamp) Uma sala tem 6 m de largura, 10 m de comprimento e 4 m de altura. Deseja-se refrigerar o ar dentro da sala. Considere o calor específico do ar como sendo 30 J/ (mol K) e use R= 8 J/ (mol K). a) Considerando o ar dentro da sala como um gás ideal à pressão ambiente (P = 105 N/m2 ), quantos moles de gás existem dentro da sala a 27 °C? b) Qual é a quantidade de calor que o refrigerador deve retirar da massa de ar do item (a) para resfriá-la até 17 °C? 26-Se você colocar uma bola de futebol, bem cheia, dentro do congelador por algumas horas, o que deverá acontecer com o volume da bola? Por que? 27-Se você encher uma bexiga ao nível do mar e depois levá-la ao alto de uma montanha, o que ocorrerá com o volume da bexiga? 21-(Unesp) Dois gases ideais, denominados G1 e G2 ocupam volumes idênticos, porém p1 =2p2 e T2 =3/5T1 (p e T são, respectivamente, pressão e temperatura absoluta). Se o número de mols de G1 é 12, qual será o número de mols de G2 ? a) 10 b) 6 c) 14,4 d) 7,2 e) 12 22-(Ufmg) Um gás encerrado num recipiente, cujo volume pode variar, tem sua temperatura aumentada de 20°C para 100°C em uma transformação isobárica. Nesse processo, a densidade do gás a) aumenta, mas não chega a ser duplicada. b) diminui, mas não chega a reduzir-se à metade. 28-(Fuvest) O cilindro da figura a seguir é fechado por um êmbolo que pode deslizar sem atrito e está preenchido por uma certa quantidade de gás que pode ser considerado como ideal. À temperatura de 30°C, a altura h na qual o êmbolo se encontra em equilíbrio vale 20cm( ver figura; h se refere à superfície inferior do êmbolo). Se, mantidas as demais características do sistema, a temperatura passar a ser 60°C, o valor de h variará de, aproximadamente: a) 5%. b) 10%. c) 20%. d) 50%. e) 100%. 29-(Unesp) Ar do ambiente, a 27°C, entra em um secador de cabelos (aquecedor de ar), e dele sai a 57°C, voltando para o ambiente. Qual a razão entre o volume de uma certa massa de ar quando sai do secador e o volume dessa mesma massa quando entrou no secador? 30-(Unesp) A que temperatura se deveria elevar certa quantidade de um gás ideal, inicialmente a 300K, para que tanto a pressão como o volume se dupliquem? 31-(Unesp) Um recipiente de paredes rígidas contém certa massa de um gás perfeito (gás ideal), à pressão P1 e temperatura T1. Retira-se do gás determinada quantidade de calor, e a temperatura cai à metade do valor inicial. a) Qual o novo valor da pressão do gás? b) Localize nos eixos a seguir dos novos valores da temperatura e da pressão. Esboce um gráfico mostrando como a pressão varia com a temperatura (este resultado é conhecido como lei de Charles). 32-(Cesgranrio) Um gás ideal evolui de um estado A para um estado B, de acordo com o gráfico representado a seguir. A temperatura no estado A vale 80K. Logo, sua temperatura no estado B vale: a) 120K. b) 180K . c) 240K. d) 300K. e) 360K. 33-(Unicamp) Calibra-se a pressão dos pneus de um carro em 30psi (libras-força/polegada2) usando nitrogênio na temperatura ambiente (27°C). Para simplificar os cálculos adote: 1 polegada=2,5cm; 1 libras-força=5,0N e a constante universal dos gases R=8,0J/mol.K. a) Quanto vale essa pressão em N/m2? b) Faça uma estimativa do volume do pneu e com a mesma estime o número de moles de nitrogênio contidos no pneu. c) Em um dia quente a temperatura do pneu em movimento atinge 57°C. Qual a variação percentual da pressão no pneu.
Download