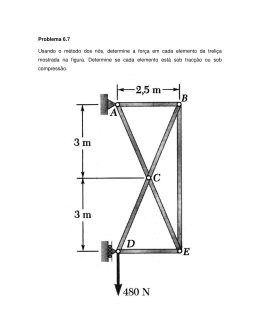
PRIMEIRA LISTA DE CALORIMETRIA ENSINO MÉDIO Aluno: ______________________________________________________________________ Série: Disciplina: Professor: Data: 1) O gráfico a seguir é a curva de aquecimento de 10g de uma substância, à pressão de 1 atm. a) Determine o calor específico da substância na fase sólida, líquida e gasosa. b) Determine o calor latente de fusão e vaporização da substância. 2) Qual a quantidade de calor necessária para transformar 10 g de gelo à temperatura de 0 °C em vapor à temperatura de 100 °C? (Considere que o calor específico da água é Ca = 4,2 J/g.°C, o calor de fusão do gelo é Lg = 336 J/g e o calor de vaporização da água é Lv = 2 268 J/g.) 3) Um recipiente de vidro de 500 g e calor específico 0,20 cal/g°C contém 500 g de água cujo calor específico é 1,0 cal/g°C. O sistema encontra-se isolado e em equilíbrio térmico. Quando recebe uma certa quantidade de calor, o sistema tem sua temperatura elevada. Determine: a) a razão entre a quantidade de calor absorvida pela água e a recebida pelo vidro. b) a quantidade de calor absorvida pelo sistema para uma elevação de 1,0 °C em sua temperatura. 4) Um frasco contém 20 g de água a 0 °C. Em seu interior é colocado um objeto de 50 g de alumínio a 80 °C. Os calores específicos da água e do alumínio são respectivamente 1,0 cal/g°C e 0,10 cal/g°C. Supondo não haver trocas de calor com o frasco e com o meio ambiente, determine a temperatura de equilíbrio desta mistura. 5) Para se determinar o calor específico do ferro, um aluno misturou em um calorímetro ideal 200 g de água a 20 °C com 50 g de ferro a 100 °C e obteve a temperatura final da mistura š = 22 °C. Qual é o calor específico do ferro? 6) A temperatura de dois corpos M e N, de massas iguais a 100 g cada, varia com o calor recebido como indica o gráfico a seguir. Colocando N a 10 °C em contato com M a 80 °C e admitindo que a troca de calor ocorra somente entre eles, qual será a temperatura final de equilíbrio?
Baixar