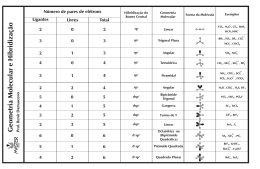
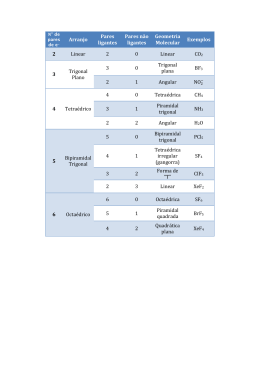
ENSINO MÉDIO PRÉ-VESTIBULAR Química ___/___/______. Aluno: Nº: Turma: GEOMETRIAS MOLECULARES PELA TEORIA RPECV Pares estereotipados Pares isolados 1 2 3 4 5 2 Exemplos CO2, BaCl2, N2O Linear Triangular: BF3, NO3–, CO32 –, SO3 3 Tipo “V”: NO2 –, SO2 Triangular Tipo “V” Tetraédrica: CH4, SO42 –, PO43 –, NH4+ 4 Piramidal: NH3, H3O+, SO32 – Angular: H2O, ClO2– Tetraédrica Piramidal triangular Angular Bipiramidal: PCl5, SbCl5 Gangorra: SF4, TeCl4 5 Tipo “T”: BrF3, ClF3 Bipiramidal trigonal Tipo “Gangorra” Tipo “T” Linear: I3– , XeF2 Linear Octaédrica: SF6, SiF62–, IOF5 6 Piramidal: BrF5 Piramidal de base Octaédrica quadrada MOLÉCULA COM 5 PARES DE ÉLETRONS • • • • Sem elétrons livres – bipiramidal Com 1 par de elétrons livres – gangorra Com 2 pares de elétrons livres – tipo t Com 3 pares de elétrons livres – linear A escolha de quem pensa. Quadrática: BrF4– , XeF4 Quadrática Tipo “T” Linear MOLÉCULA COM 6 PARES DE ÉLETRONS • Sem elétrons livres – octaédrica • • • Com 1 par de elétrons livres – piramidal de base quadrática Com 2 pares de elétrons livres – quadrática Com 3 pares de elétrons livres – TIPO T 1 ENSINO MÉDIO Total de domínios de elétrons Arranjo 5 Domínios ligantes Domínios nãoligantes 5 0 Geometria molecular Exemplos PCl5 Bipiramidal trigonal Bipiramidal trigonal 4 1 SF4 Gangorra 3 2 ClF3 Em “T” 2 3 XeF2 Linear 6 0 SF6 Octaédrica Octaédrico 5 1 BrF3 Piramidal quadrada 4 2 XeF4 Quadrática plana 2 A escolha de quem pensa.
Baixar