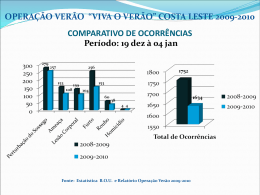
UNIVERSIDADE DO VALE DO ITAJAÍ MESTRADO EM CIÊNCIA E TECNOLOGIA AMBIENTAL ANÁLISE QUALI-QUANTITATIVA DA CARCINOFAUNA DA ENSEADA DO SACO DOS LIMÕES, BAÍA-SUL, FLORIANÓPOLIS, SC E OS IMPACTOS DECORRENTES DA CONSTRUÇÃO DA VIA EXPRESSA SC-SUL FELIPE FREITAS JÚNIOR ITAJAÍ 2008 UNIVERSIDADE DO VALE DO ITAJAÍ MESTRADO EM CIÊNCIA E TECNOLOGIA AMBIENTAL ANÁLISE QUALI-QUANTITATIVA DA CARCINOFAUNA DA ENSEADA DO SACO DOS LIMÕES, BAÍA-SUL, FLORIANÓPOLIS, SC E OS IMPACTOS DECORRENTES DA CONSTRUÇÃO DA VIA EXPRESSA SC-SUL FELIPE FREITAS JÚNIOR Dissertação apresentada à Universidade do Vale do Itajaí, como parte dos requisitos para obtenção do grau de Mestre em Ciência e Tecnologia Ambiental. Orientador: Branco. ITAJAÍ 2008 Prof. Dr2. Joaquim Olinto Aos meus pais Felipe Freitas e Verônica Maria Zens Freitas e “in memorian” de Felinsk Freitas, Maria Gilda e Marilda Zen. iii “Ainda que eu andasse pelo vale da sombra da morte, não temeria mal algum, porque tu estás comigo; a tua vara e o teu cajado me consolam.” (Salmo 23) iv AGRADECIMENTOS Agradeço a Deus por ter sempre iluminado meu caminho, dando-me forças para encarar os obstáculos, com muita honestidade e determinação. Ao Prof. Dr2. Joaquim Olinto Branco pelas orientações nas pesquisas e trabalhos desenvolvidos, e pela amizade construída em mais de seis anos de trabalhos juntos, sempre com sábios conselhos sobre as mais variadas situações da vida. Ao Prof. Msc. Marcelo Rodrigues Ribeiro, coordenador do Projeto BaíaSul, que em conjunto com o Prof. Dr2. Joaquim Olinto Branco, me ajudaram a conseguir uma vaga como Técnico responsável pela carcinofauna, e por disponibilizarem os dados que deram origem a este trabalho. A UNIVALI, através do curso de Oceanografia e do Programa de Mestrado em Ciência e Tecnologia Ambiental, bem como dos professores e funcionários, que auxiliaram para o desenvolvimento deste trabalho e para o meu crescimento profissional e pessoal. Aos companheiros do Laboratório de Biologia do CTTMar/UNIVALI, Andressa, Bruno, Cristiano, Cristopher, Fernando Koerich, Fernando Dix, Francine, Gislei, Irece, Jurandir, Juliano, Leonardo, Marcos e Tuane, pelo auxílio nas atividades de campo e laboratoriais e é claro pela amizade conquistada. A minha namorada Tuane Cristine Pinheiro, pela atenção, paciência, zelo, carinho e amor. Aos meus pais Felipe Freitas e Verônica Maria Zen Freitas, pelo exemplo de garra, coragem e amor. Sou eternamente grato a eles por esta grande conquista. Ao técnico do laboratório, Sr. Anilton Bispo dos Santos, pelas broncas e principalmente pelo carinho e amizade, durante seis anos de laboratório juntos. Aos meus avós Felinsk Freitas e Maria Gilda Freitas, e a tia Marilda que de um algum lugar no céu, estão vibrando com esta conquista. Aos amigos do peito, Augusto, Diogo, Eduardo, Fernando, Gustavo, Hélio, Heloisa, Juliano, Luiz Fernando, Marcos, Paola, Paulo Henrique, v Paulinho, Presalino, Rodrigo, e Thiago, que sempre estiveram comigo dividindo momentos de alegria e de tristeza. Aos colegas do curso de Oceanografia, do Mestrado, e do Projeto BaíaSul, pela amizade, trabalhos e festas. vi SUMÁRIO AGRADECIMENTOS..............................................................................................................v LISTA DE TABELAS ........................................................................................................... viii LISTA DE FIGURAS ..............................................................................................................ix RESUMO ............................................................................................................................... xii ABSTRACT .......................................................................................................................... xiii 1. INTRODUÇÃO ................................................................................................................... 1 2. OBJETIVOS ....................................................................................................................... 4 2.1 - OBJETIVO GERAL ......................................................................................................... 4 2.2 - OBJETIVOS ESPECÍFICOS .............................................................................................. 5 3. ÁREA DE ESTUDO ........................................................................................................... 5 4. MATERIAIS E MÉTODOS ................................................................................................. 6 4.1 - TRABALHO DE CAMPO................................................................................................... 6 4.2 - TRABALHO DE LABORATÓRIO ........................................................................................ 7 4.3- ANÁLISE DOS DADOS ..................................................................................................... 8 5. RESULTADOS................................................................................................................. 10 5.1 - PARÂMETROS AMBIENTAIS .......................................................................................... 10 5.2 - COMPOSIÇÃO DA CARCINOFAUNA ................................................................................ 11 5.3 - ABUNDÂNCIA DA CARCINOFAUNA ................................................................................. 16 5.3.1 – Abundância de exemplares por ano de amostragem...................................... 16 5.3.2 – Abundância de exemplares nas áreas de coleta ............................................ 16 5.3.3 – Variação sazonal da abundância..................................................................... 18 5.4 - DIVERSIDADE ............................................................................................................. 20 5.4.1 – Diversidade por ano de amostragem .............................................................. 20 5.4.2 – Diversidade por área de coleta........................................................................ 20 5.4.3 – Variação sazonal da diversidade..................................................................... 22 5.5 - EQUITABILIDADE ......................................................................................................... 24 5.5.1 – Equitabilidade por ano de amostragem........................................................... 24 5.5.2 – Equitabilidade por área de coleta .................................................................... 24 5.5.3 – Variação sazonal da equitabilidade................................................................. 26 5.6 - ESTRUTURA POPULACIONAL DAS ESPÉCIES DOMINANTES ............................................. 28 5.6.1 - Farfantepenaeus brasiliensis............................................................................ 28 5.6.2 - Litopenaeus schimitti ........................................................................................ 32 5.6.3 - Farfantepenaeus paulensis .............................................................................. 36 5.6.4 - Callinectes danae ............................................................................................. 40 5.7 - SIMILARIDADE DA CARCINOFAUNA ENTRE OS ANOS DE COLETA ..................................... 44 5.8 - ASSOCIAÇÃO FAUNÍSTICA............................................................................................ 44 5.9 - POSSÍVEIS IMPACTOS DA DRAGAGEM...................................................................................... 46 6. DISCUSSÃO .................................................................................................................... 47 6.1 - CARACTERIZAÇÃO QUALI-QUANTITATIVA DA CARCINOFAUNA......................................... 47 6.2 - IMPACTOS DAS OPERAÇÕES DE DRAGAGEM ................................................................. 55 7. CONSIDERAÇÕES FINAIS............................................................................................. 58 8. CONCLUSÕES .............................................................................................................. 589 9. REFERÊNCIAS BIBLIOGRÁFICAS. .............................................................................. 60 vii LISTA DE TABELAS Tabela I Tabela I. Caracterização dos sedimentos de fundo nas áreas de coleta, no Saco dos Limões, nas campanhas de janeiro de 1997 (a) e outubro de 2006 (b)........................................................................................ Tabela II 11 Tabela II – Relação das espécies de crustáceos e suas respectivas freqüências em número e peso, durante o período de 1997 a 2006. (A ocorrência das espécies é representada por C = constante; A = acessória; O = ocasional)............................................................................ Tabela III Tabela III - Similaridade da carcinofauna nos oito anos de coleta.................................................................................. Tabela IV 12 44 Tabela IV. Síntese dos possíveis impactos das atividades de dragagem sobre a carcinofauna do Saco dos Limões... 46 viii LISTA DE FIGURAS Figura 1 Mapa da Enseada do Saco dos Limões, Baía-sul, Florianópolis, SC, indicando as áreas de coleta............................................................................................. Figura 2 6 Variação temporal média dos parâmetros físico-químicos da água de superfície no Saco dos limões (Baía-Sul), durante o período de 1997 a 2006 (Barra vertical= erro da média)........................................................................................... 10 Figura 3 Contribuição percentual em número de indivíduos das principais espécies de crustáceos capturadas no Saco dos Limões, entre 1997 e 2006.................................................................................. 15 Figura 4 Variação sazonal do número de crustáceos capturados no Saco dos Limões, nos oito anos de amostragem................................................................................... 17 Figura 5 Variação sazonal do número de crustáceos capturados nas áreas I (a), II (b), III (c), IV (d), V (e), VI (f), na região do Saco dos Limões, durante os anos de 2001 a 2006............................... 18 Figura 6 Variação sazonal média do número de crustáceos capturados no Saco dos Limões, durante os anos de 1997 a 2006 (Barra vertical = erro da média)............................................................... 19 Figura 7 Variação sazonal média do número de crustáceos capturados no Saco dos Limões, durante os períodos diurno e noturno (Barra vertical = erro da média)..................................................... 19 ix Figura 8 Variação sazonal do índice de diversidade da carcinofauna (H´) no Saco dos Limões, entre 1997 e 2006....................................... 21 Figura 9 Variação sazonal do índice de diversidade (H’) nas áreas I (a), II (b), III (c), IV (d), V (e), VI (f), na região do Saco dos Limões, durante os anos de 2001 a 2006................................................... 22 Figura 10 Variação sazonal média do índice de diversidade (H´) no Saco dos Limões, durante os anos de 1997 a 2006. (Barra vertical = erro da média)............................................................................... 23 Figura 11 Variação sazonal média do índice de diversidade (H´) no Saco dos Limões, durante os períodos diurno e noturno (Barra vertical = erro da média)............................................................... 23 Figura 12 Variação sazonal do índice de equitabilidade da carcinofauna (J´) no Saco dos Limões, entre 1997 a 2006................................. 25 Figura 13 Variação sazonal do índice de equitabilidade (J´) nas áreas I (a), II (b), III (c), IV (d), V (e), VI (f), na região do Saco dos Limões, durante os anos de 2001 a 2006................................................... 26 Figura 14 Variação sazonal média do índice de equitabilidade (J´) no Saco dos Limões, durante os anos de 1997 a 2006. (Barra vertical = erro da média)............................................................................... 27 Figura 15 Variação sazonal média do índice de equitabilidade (J´) no Saco dos Limões, durante os períodos diurno e noturno (Barra vertical = erro da média)................................................................ 27 Figura 16 Distribuição de freqüência por classe de comprimento de F. brasiliensis , durante os anos de 2001 a 2006. Linha tracejada= L50 (BRANCO & VERANI, 1998a)................................................ 29 x Figura 17 Variação sazonal da abundância e biomassa de F. brasiliensis capturados no Saco dos Limões, durante 1997 a 2006................ 31 Figura 18 Distribuição de freqüência por classe de comprimento de L. schimitti, durante os anos de 1997 a 2006. Linha tracejada= L50................................................................................................. 33 Figura 19 Variação sazonal da abundância e biomassa de L schimitti capturados no Saco dos Limões, durante 1997 a 2006............... 35 Figura 20 Distribuição de freqüência por classe de comprimento de F. paulensis, durante os anos de 1997 a 2006. Linha tracejada= L50 (BRANCO & VERANI, 1998b)................................................ 38 Figura 21 Variação sazonal da abundância e biomassa de F. paulensis capturados no Saco dos Limões, durante 1997 a 2006................ 39 Figura 22 Distribuição de freqüência por classe de largura de C. danae, durante os anos de 1997 a 2006. Linha tracejada= L50............... 42 Figura 23 Variação sazonal da abundância e biomassa de C. danae capturados no Saco dos Limões, durante 1997 a 2006................ 43 Figura 24 Dendrograma baseado nos dados de abundância das espécies de crustáceos nos oito anos de amostragens............................... 45 Figura 25 Dendrograma do agrupamento das 20 espécies de crustáceos capturadas na região do Saco dos Limões, entre 1997 a 2006............................................................................................... 45 xi RESUMO Áreas costeiras como lagoas, baías e estuários, normalmente caracterizam-se por apresentar uma elevada produtividade, funcionando como importantes locais de reprodução e crescimento para uma variedade de organismos. Os crustáceos representam um importante grupo dentro destes ecossistemas, transferindo a energia para níveis superiores, além de contribuírem nas pescarias artesanais e industriais. Objetivando avaliar as relações quali-quantitativas da carcinofauna do Saco dos Limões e os impactos das atividades de dragagem, foram realizadas coletas trimestrais, em seis áreas de amostragem, durante o período diurno e noturno, compreendendo os anos de 1997 a 2006; com auxilio de um barco de arrasto, empregado na pesca do camarão sete-barbas. As famílias Penaeidae e Portunidae foram as mais diversas, além de contribuírem com as maiores abundâncias, onde os camarões Farfantepenaeus brasiliensis, Litopenaeus schimitti, Farfantepenaeus paulensis, juntamente com o siri Callinectes danae, destacaram-se como espécies dominantes. As maiores abundâncias ocorreram nas áreas VI e V, durante os meses de verão no período da noite. Os índices de diversidade e equitabilidade apresentaram padrões semelhantes de flutuação, com os maiores valores ocorrendo nos meses de outono e inverno. O índice de Jaccard indicou maior similaridade na composição dos crustáceos entre os anos de 2005 e 2006, enquanto que a menor ocorreu entre 1997 e 2005. Foram observadas mudanças na estrutura da carcinofauna ao longo dos anos, com elevadas mortalidades durante as operações de dragagem, no verão de 1997, e posterior recuperação nos anos subseqüentes. Entretanto a avaliação da real magnitude do impacto tornou-se dificultada em função da ausência de dados pretéritos, bem como a própria variabilidade intrínseca do ambiente em estudo. Os resultados obtidos neste trabalho realçam a importância da Enseada do Saco dos Limões como área de berçário e crescimento para espécies de camarão de relevante interesse econômico, além de contribuir como ambiente de reprodução para os siris do gênero Callinectes, onde provavelmente a eclosão das larvas ocorre na região costeira adjacente, com subseqüente migração destas para área de crescimento, na baía, onde reiniciam o ciclo. Palavras-chave: Abundância, crustáceos, dragagem. xii ABSTRACT Coastal areas as ponds, bays and estuaries, are usually characterized by presenting a high productivity, working as important reproduction and growth areas for a variety of organisms. The crustaceans represent an important group, transferring the energy for superior levels, besides they contribute in the artisanal and industrial fisheries. Aiming to evaluate the quail-quantitative relationships of the carcinofauna of Saco dos Limões and the impacts of the dredging activities, collections were made every three months, in six sampling areas, during the period of the day and night, from 1997 to 2006; with aid of a boat employed in the fishing of the shrimp “sete-barbas”. The families Penaeidae and Portunidae were the most diversity, besides they contribute with the largest abundances, where the shrimps Farfantepenaeus brasiliensis, Litopenaeus schimitti, Farfantepenaeus paulensis, together with the crab Callinectes danae, were the dominant species. The largest abundances occurred in the areas VI and V, during summer, in the period of the night. The diversity and equitabilidade presented similar flotation, with the largest values on autumn and winter. The index of Jaccard indicated larger similarity in the composition of the crustaceans between the years of 2005 and 2006, while the smallest occurred between 1997 and 2005. Changes were observed in the structure of the carcinofauna along the years, with high mortalities during the summer 1997 dredging operations, and subsequent recovery in the last years. However the evaluation of the real magnitude of the impact was difficult, in function of the absence of previous data, as well as the own intrinsic variability of the study. The results obtained in this work enhance the importance of Enseada do Saco dos Limões as nursery and growth for species of shrimp of relevant economical interest, besides contributing as reproduction place for the crabs of the genus Callinectes, where probably the initial larval phase takes place in the adjacent coastal area, with subsequent migration of these for growth areas, in the bay, where they restart the cycle. Key words: abundance, crustaceans, dredging activities xiii Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 1. INTRODUÇÃO Ambientes costeiros como lagoas, baías e estuários, apesar de serem ecossistemas sujeitos a perturbações humanas, normalmente caracterizam-se por apresentar uma elevada produtividade, funcionando como importantes locais de reprodução, berçário e crescimento para uma variedade de organismos, que nestes realizam parte de seu ciclo vital (SIGNORET, 1974; BRANCO & VERANI, 1998a; ALBERTONI et al. 1999; HOSTIM-SILVA et al. 2002; ALBERTONI et al. 2003). Os Crustáceos decápodas são organismos característicos destes ambientes, dentre os quais destacam-se as famílias Penaeidae, Solenoceridae, Calappidae, Leucosidade, e Portunidae, representantes estes, de considerada abundância, freqüência e biomassa, sendo utilizados como alvo de pescarias, com grande representação na economia e na alimentação humana, além de participarem nos processos de aeração e sedimentação do solo (PETTI, 1997; BRANCO, 1998a). Os camarões peneídeos constituem-se em um dos recursos pesqueiros mais freqüentes e explorados nas regiões costeiras em todo o mundo, assim como em toda a costa brasileira (D’INCAO, 1991; VALENTINI et al. 1991; ALBERTONI et al. 2003; CASTRO et al. 2005; GUSMÃO et al. 2005; LEITE & PETRERE, 2006a; LEITE & PETRERE, 2006b; ROBERT et al. 2007). Na Venezuela a pesca dirigida ao camarão branco (Litopenaeus schimitti) atinge alto valor comercial, sendo realizada com grande intensidade em frente às lagoas de Piritu, Unae e Tacarigua, no mar do Caribe (LAREZ & KHANDKER, 1972). Enquanto que no Brasil, os municípios de Bertioga e Cananéia, no litoral paulista são considerados os principais criadouros naturais para a espécie, suportando importantes pescarias para a região (CHAGAS-SOARES et al. 1995). A exploração comercial de siris e caranguejos é um fator importante na economia de alguns países americanos, europeus e Japoneses (ROMAMCONTERAS, 1986; BRANCO & MASUNARI, 1992; SEVERINO-RODRIGUES et al. 2001; BRANCO & FRACASSO, 2004a). Além disso, representam alto valor na cadeia trófica, transferindo a energia para níveis superiores, ao servir 1 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 de presas para a maioria dos organismos carnívoros, seja no estágio larval ou na forma adulta (BRANCO & VERANI, 1997; TEIXEIRA & SÁ, 1998). As espécies mais capturadas pertencem ao gênero Callinectes (TEIXEIRA & SÁ, 1998), podendo habitar estuários com fundo de lama, rios de manguezais, fundo de cascalho recoberto por algas, praias e oceanos com profundidades de até 70 metros (WILLIANS, 1984). Na literatura internacional, são raros os trabalhos envolvendo a composição da carcinofauna de regiões estuarinas, estando restritos a abordagens ecológicas (TANKERSLEY et al. 1998; PÉREZ-CASTAÑEDA & DEFEO, 2005; SEED & HUGHES, 1997; SEITZ et al. 2003), dinâmica das larvas (JOHNSON, 1985; DITTEL & EPIFANIO, 1990; FORBES & CYRUS, 1991), bem como a distribuição espaço-temporal das espécies com valor econômico (PÉREZ-CASTAÑEDA & DEFEO, 2001; SHAROV et al. 2003). No Brasil, estes levantamentos estão concentrados nas regiões Nordeste, Sudeste e Sul, com destaque para os trabalhos de COELHO et al. (2004a), com os siris do rio Una, em Pernambuco e de SOUZA et al. (2000), COELHO et al. (2004b) e ALMEIDA et al. (2006, 2007), com os decapoda dos estados de Alagoas, Sergipe e Bahia. No manguezal da Baia de Sepetiba (RJ), OSHIRO et al. (1998), estudaram a composição da fauna de braquiúros, ao passo que no Complexo Baía-estuário de Santos, destacam-se os estudos de PITA et al. (1985a), com portunídeos e de MOREIRA et al. (1988), com a biologia dos braquiúros. ABREU (1980) estudou a distribuição e ecologia dos decapoda numa área estuarina de Ubatuba, enquanto que NAKAGAKI et al. (1995) e COSTA et al. (2000) analisaram a composição, ocorrência e abundância de camarões Penaeidea e Caridea, nesta mesma enseada. Recentemente BRAGA et al. (2005), realizaram uma caracterização abrangente sobre a composição e abundância de siris em Ubatuba e Caraguatatuba. Para o litoral do Rio Grande do Sul, PEREIRA et al. (1998) apresentaram uma lista dos crustáceos decápodas do estuário Arroio Chuí, ao passo que SANTOS et al. (2000) abordaram aspectos da composição e distribuição dos Crustacea na Lagoa do Peixe. Em Santa Catarina, destacamse os trabalhos de BRANCO (1998a), o qual realizou um levantamento dos crustáceos decápodas no manguezal de Itacorubí, estudando também os 2 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 aspectos ecológicos dos Brachyura deste mesmo ambiente (BRANCO, 1998b); de RODRIGUES et al. (1994), que caracterizaram a carcinofauna do Manguezal do Rio Camboriú; de BRANCO et al. (1998a), que analisaram as espécies de crustáceos do Manguezal da Baía da Babitonga e de BRANCO & FRACASSO (2004b), os quais abordaram aspectos da ocorrência e abundância da carcinofauna acompanhante na pescaria do camarão sete barbas na Armação do Itapocoroy. Objetivando solucionar os problemas de tráfego na cidade de Florianópolis, o governo do Estado de Santa Catarina iniciou em 1995, a construção da Via Expressa SC-Sul, às margens da Enseada do Saco dos Limões, localizada no lado interno da Ilha de Santa Catarina, na margem leste da Baía Sul. Para execução da obra, foi realizado um aterro de 15,9 Km de extensão, a partir do deslocamento de 8,5x106 m3 de areia dragada de uma jazida localizada no centro do próprio ambiente (FACIMAR, 1998). Segundo BEMVENUTI et al. (2005), atividades de dragagem têm se constituído em um impacto antrópico muito comum em áreas costeiras, seja para facilitar a entrada de navios em portos ou para execução de obras costeiras. Dragagens promovem a remoção de uma grande quantidade de sedimento, causando mudanças na estrutura e dinâmica das comunidades de fundo, podendo também disponibilizar para coluna d’água, aqueles contaminantes que estavam acumulados no sedimento (VON DOLAH et al. 1984; MARQUES et al. 1993; TORRES, 2000; NEWELL et al. 2003; NEWELL et al. 2004; ANGONESI et al. 2006). Entretanto, podem contribuir na dinâmica e circulação de estuários de baías, possibilitando a rápida recolonização e favorecer o ingresso de novas espécies (TORRES, 2000). A Baía-Sul constitui uma importante feição costeira no litoral do Estado de Santa Catarina, abrangendo uma área de 181 Km2, onde se encontram manguezais, uma reserva extrativista marinha, enseadas e um grande número de ilhas e praias, sendo utilizada em atividades de lazer, turismo, pesca, criação e comercialização de moluscos, como fonte de alimento e geração de renda para uma parcela significativa da população local (MOLLERI & BONETTI, 2005). Neste ecossistema foram realizados alguns estudos, como SOUZACONCEIÇÃO (2001, 2004) e SOUZA-CONCEIÇÃO et al. (2005), os quais 3 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 estudaram a dinâmica populacional, biologia reprodutiva e ictioplâncton de Cetengraulis edentulus. BRANCO et al. (2004) realizaram um levantamento da avifauna associado a este ambiente, e BRANCO & FRACASSO (2005) abordaram aspectos da ocorrência e abundância de Rynchops niger nesta baía. PEZZUTO & ECHTERNACHT (1999), avaliaram o impacto da construção da Via Expressa SC-Sul sobre o berbigão Anomalocardia brasiliana, enquanto que RESGALLA JR (2001) estudou os impactos ambientais da obra sobre a comunidade zooplanctônica deste ecossistema. SCHETTINI et al. (2000), realizaram uma caracterização oceanográfica e biogeoquímica da área e MOLLERI & BONETTI (2005), analisaram as características morfo- sedimentares da Baía-Sul com base em sistemas de informação geográfica. A carcinofauna vem sendo monitorada desde 1997 (final das atividades de dragagen) pelo Laboratório de Biologia do CTTMar/UNIVALI, no entanto os dados encontram-se restritos a relatórios de pesquisa, sendo que nenhuma informação foi publicada até o momento. Considerando o impacto causado pelas obras de aterro para construção de vias públicas no ecossistema da Baía-Sul, importância ecológica e econômica do grupo Crustacea, faz-se necessário quantificar e qualificar as espécies de crustáceos que ainda habitam este ambiente, assim como determinar a variação espaço-temporal da carcinofauna e caracterizar a estrutura populacional das espécies dominantes, determinando suas flutuações ao longo dos anos de amostragem. Os resultados obtidos poderão ser utilizados como instrumento de auxílio ao manejo desse ecossistema, servindo como importante ferramenta na tomada de decisões, assim como referência para trabalhos futuros. 2. OBJETIVOS 2.1 - Objetivo Geral - Estudar as relações quali-quantitativas da carcinofauna da Enseada do Saco dos Limões, Baía-Sul, Florianópolis, SC, assim como, avaliar os impactos decorrentes da Via Expressa SC-Sul, sobre as principais espécies de crustáceos da região. 4 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 2.2 - Objetivos Específicos - Identificar as espécies de crustáceos que ocorrem na área de estudo; - Determinar a variação espaço-temporal da abundância da carcinofauna na Enseada do Saco dos Limões, Baía-Sul, Florianópolis, SC; - Comparar as áreas de amostragem em termos de diversidade e equitabilidade da carcinofauna; - Determinar a estrutura de comprimento e as flutuações da abundância e biomassa das principais espécies de crustáceos que ocorrem na região; - Analisar as variações quali-quantitativas da carcinofauna em relação aos anos de coleta; - Avaliar os impactos das dragagens para construção da Via Expressa SC-Sul, sobre a Carcinofauna do Saco dos Limões. 3. ÁREA DE ESTUDO O presente estudo foi realizado na Enseada do Saco dos Limões, localizada no interior da Baía-Sul, entre o continente e a Ilha de Santa Catarina, no município de Florianópolis, entre as coordenadas (27º 36’ - 27º 39’ S e 48º 33’- 48º 31’ W) (Fig. 1). A área apresenta fundo areno-lamoso com grande quantidade de material biodetrítico e fragmentos de conchas, profundidades reduzidas, salinidades elevadas devido à baixa contribuição de água doce continental, amplitude de maré inferior a 2m e hidrodinâmica controlada pelo regime de marés e pelos ventos de quadrante Sul e Nordeste (FACIMAR, 1998; MOLLERI & BONETTI, 2005). O ambiente caracteriza-se por apresentar uma diversidade de habitats, onde na porção Norte, encontra-se a Ilha das Vinhas; na porção Sul, o Manguezal do Rio Tavares; a leste tem-se o Morro do Tavares, com intensa e crescente urbanização, e a oeste se localiza o canal da Baía-Sul; além de uma 5 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 reserva extrativista marinha e um grande número de praias, as quais são utilizadas em atividades de lazer, turismo, pesca, criação e comercialização de moluscos, gerando alimento e renda para uma parcela significativa da população local (FACIMAR, 1998; SOUZA-CONCEIÇÃO, 2004; MOLLERI & BONETTI, 2005). Figura 1. Mapa da Enseada do Saco dos Limões, Baía-sul, Florianópolis, SC, indicando as áreas de coleta.(Fonte: Laboratório de Geoprocessamento/ UNIVALI). 4. MATERIAIS E MÉTODOS 4.1 - Trabalho de Campo Para realização deste trabalho, foram utilizados os dados referentes a carcinofauna, obtidos durante o período de 1997 (final das operações de dragagem) a 2006, a partir de um monitoramento ambiental que vem sendo desenvolvido na Enseada do Saco dos Limões, Baía-Sul, Florianópolis, SC, pelo Centro de Ciências Tecnológicas da Terra e do Mar da Universidade do 6 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Vale do Itajaí (CTTMar/ UNIVALI), com financiamento do Departamento de Estradas e Rodagem de Santa Catarina (DER-SC). As amostragens foram realizadas trimestralmente, em seis áreas predefinidas em função das características hidrológicas e fisiográficas do ambiente (Fig. 1), durante os períodos diurno e noturno. Para coleta, foi utilizado um barco empregado na pesca artesanal do camarão sete barbas, equipado com duas redes-de-arrasto com portas, sendo que cada uma delas possuia 7,5 metros de comprimento total, tralha superior de 7m e inferior de 8m, com malha de 12 milímetros entre nós opostos. O esforço de pesca foi de 10 minutos em cada uma das seis áreas. Após as operações de captura, a carcinofauna de cada rede foi separada da fauna acompanhante, armazenada em sacos plásticos etiquetados e transportada em caixas de isopor com gelo até o laboratório de Biologia do CTTMar/UNIVALI para triagem. Paralelamente as coletas, foram ainda registradas as temperaturas e salinidades da água de superfície, sendo que em 1997 e 2006, foi obtida uma amostra de sedimento por área para caracterização granulométrica e determinação do teor de carbonato e conteúdo de matéria orgânica. É importante ressaltar, que ao longo dos oito anos de coleta, cinco estagiários fizeram parte da obtenção dos dados da carcinofauna, o que resultou na perda de informações referentes aos anos de 1998 e 1999. Ainda em 1997 e 2000, não foi realizada a biometria e a aferição da biomassa de algumas espécies, dificultando a interpretação dos resultados. Fato semelhante ocorreu na aferição dos parâmetros abióticos, sendo utilizados os dados de cinco anos para a temperatura e de sete para a salinidade. 4.2 - Trabalho de Laboratório Em laboratório, os crustáceos capturados foram identificados e separados por espécies, segundo (PÉREZ-FARFANTE, 1978; MELO 1996); em seguida foi determinado o sexo e estágio de maturação, sendo classificado em juvenil e adulto (freqüência onde 50% dos exemplares apresentaram o petasma unido nos machos e o télico completamente desenvolvido nas fêmeas) para os camarões (PÉREZ-FARFANTE, 1970) e maturo e imaturo 7 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 para os siris e caranguejos, definido pela forma do abdome nas fêmeas e pela sua condição de “selado” (ou não) nos machos, conforme TAISSOUN (1969) e WILLIAMS (1974). De cada exemplar foi registrado o comprimento total (Lt) em centímetros (medido a partir da margem anterior do rostro até a ponta do telso para camarões e entre as extremidades dos espinhos laterais para siris e caranguejos) e o peso total (Wt) em gramas. Para os camarões, foi registrado também o comprimento do cefalotórax, seguindo a metodologia adotada por BRANCO & VERANI (1997, 1998a). 4.3- Análise dos Dados A biomassa foi determinada a partir do peso total capturado em gramas, por estação do ano, nas principais espécies de crustáceos, ao longo do período de estudo; enquanto que a abundância foi definida como o número total de exemplares por ano de amostragem, área e período de coleta, bem como, trimestramente para as espécies dominantes. No cálculo da diversidade, foram considerados os índices de diversidade de Shannon (H’) e de equitabilidade de Pielou (J’), calculados trimestralmente para cada área e ano de amostragem (LUDWIG & REYNOLDS, 1988). O grau de similaridade da carcinofauna entre os anos de amostragem foi estimado através do índice de Jaccard (SOUTHWODD, 1968), adotado por BRANCO (1999). As estações do ano foram estabelecidas da seguinte maneira: Inverno (julho, agosto e setembro), Primavera (outubro, novembro e dezembro), Verão (janeiro, fevereiro e março) e Outono (abril, maio e junho) (BRANCO, 1999). A análise de variância paramétrica (ANOVA) (ZAR, 1999) foi utilizada para verificar a existência de diferenças significativas nos parâmetros ambientais, no número de indivíduos, biomassa (CPUE), diversidade e equitabilidade entre as áreas de coleta, estações do ano e entre os diferentes anos de amostragem, sendo testados quanto à homogeneidade da variância (teste de Bartlett) e de normalidade da distribuição (prova de KolmorovSmirnov). Na existência de diferenças significativas, o contraste das médias (teste de Tukey-Kramer) foi aplicado para indicar quais médias foram 8 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 significativamente distintas. O teste T foi utilizado para verificar as diferenças nas médias destes mesmos parâmetros entre o dia e a noite, para cada estação do ano, conforme o adotado por BRANCO & VERANI (2006). De acordo com a ocorrência nas coletas, as espécies foram classificadas em três categorias: constantes, quando presentes em mais de 50% das amostras; acessórias, entre 25 e 50% e ocasionais, em menos de 25% (SEVERINO-RODRIGUES et al. 2002). Para caracterizar a estrutura populacional das espécies dominantes, foi considerada a distribuição de freqüência por classe de comprimento por estação do ano, nos diferentes anos de amostragem. O tamanho de primeira maturação foi estimado de acordo com VAZZOLER (1981), para Litopenaeus schimitti e Callinectes danae, enquanto que para Farfantepenaeus brasiliensis e Farfantepenaeus paulensis, foi adotado o comprimento encontrado nos trabalhos de BRANCO & VERANI (1998a, b). Através da análise de agrupamento foram estabelecidas as associações entre as espécies nos oito anos de coleta, assim como entre os anos, utilizando-se o número de indivíduos por espécie em cada estação e a abundância das espécies em cada ano, considerando-se o fato de não existir um critério definitivo que permita estabelecer o melhor número de agrupamentos e o nível de similaridade adotado na sua definição (CURI, 1985). Foi realizada a padronização dos dados com a transformação logarítmica [ln (x+1)], devido à ocorrência de distribuição contagiosa típica em crustáceos e peixes (COLVOCORESSES & MUSICK, 1984), conforme o adotado por BRANCO & VERANI (2006). Na seqüência, foi estabelecida pela distância Euclidiana, a medida de semelhança entre os pares de espécies e agrupados pelo método de Ward, os quais serão implementados no software Statistica 6. 9 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 5. RESULTADOS 5.1 - Parâmetros ambientais A temperatura média da água de superfície apresentou um padrão de flutuação sazonal uniforme, não diferindo significativamente entre os anos de coleta (F4-18= 0,227; p≥0,05), bem como entre as áreas (F5-18= 0,058; p≥0,05). Os valores médios mais elevados foram registrados nos meses de verão (26,87ºC), enquanto que as menores temperaturas ocorreram no inverno (22,83ºC) (Fig. 2). A salinidade média da água de superfície manteve a tendência sazonal apresentada pela temperatura, sem diferenças significativas entre os anos (F618= 0,657; p≥0,05) e áreas de amostragem (F5-18= 0,241; p≥0,05), onde os maiores teores médios ocorreram no verão (32,43‰) e os menores no outono (27,00‰) (Fig. 2) Tº C Tº C S‰ Sal 29 35 27 30 25 25 23 20 21 15 19 10 17 5 15 Verão Outono Inverno Primavera Estações Figura 2. Variação temporal média dos parâmetros físico-químicos da água de superfície no Saco dos limões (Baía-Sul,) durante o período de 1997 a 2006. (Barra vertical= erro da média). Os sedimentos encontrados ao longo do Saco dos Limões, durante a campanha de 1997 (logo após as realizações das obras de dragagem), variaram de lama terrígena (áreas I, II, III e IV) à areia litoclástica fina a muito fina, sendo esta última, encontrada na área VI denominada como “buraco da draga”, onde ocorreram as extrações de material para o aterro (Tab. Ia). As 10 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 maiores porcentagens de matéria orgânica neste ano foram encontradas nas áreas IV (12,82%) e I (12,20%), enquanto que a menor ocorreu na área VI com apenas 0,19%. Os maiores teores de carbonatos foram registrados na área II (18,42%) (Tab. Ia). Após oito anos das atividades de dragagem, verificou-se que os sedimentos apresentaram uma distribuição uniforme ao longo da região amostral, sendo caracterizados como lama terrígena em todos locais, com maiores teores de matéria orgânica (12,81%) e carbonatos (10,66%) na área VI (Tab. Ib). Tabela I. Caracterização dos sedimentos de fundo nas áreas de coleta, no Saco dos Limões, nas campanhas de janeiro de 1997 e outubro de 2006. (M.O = matéria orgânica) (a) Campanha de janeiro de 1997 Áreas Latitude Longitude I II III IV V VI 27º36'48'' 27º37'18'' 27º37'00'' 27º37'30'' 27º38'05'' 27º38'13'' 48º33'48'' 48º32'44'' 48º32'07'' 48º32'04'' 48º32'06'' 48º32'40'' Teor de Classificação Textural Dias, 1996 (Mod. De Larsonneur, 1977) Carbonato Lama terrígena 6,19 Lama terrígena 18,42 Lama terrígena Lama terrígena Lama terrígena arenosa 6,1 Areia Litoclástica fina a muito fina 5,07 Teor de M. O 12,20 12,10 12,00 12,82 5,19 0,19 (b) Campanha de outubro de 2006 Áreas I II Latitude Longitude Classificação Textural Teor de Dias, 1996 (Mod. De Larsonneur, 1977) Carbonato Teor de M. O 27º36'48'' 48º33'48'' 27º37'18'' 48º32'44'' Lama terrígena Lama terrígena 9,09 9,55 11,82 11,88 III 27º37'00'' 48º32'07'' Lama terrígena 8,44 11,92 IV 27º37'30'' 48º32'04'' Lama terrígena 9,56 10,56 V 27º38'05'' 48º32'06'' Lama terrígena 9,34 11,58 VI 27º38'13'' 48º32'40'' Lama terrígena 10,66 12,81 5.2 - Composição da carcinofauna Durante os oito anos de amostragem, foi coletado um total de 14249 crustáceos, pertencentes a 21 espécies, 16 gêneros e 10 famílias (Tab. II), sendo que cinco espécies foram comuns ao longo do período de coleta. As maiores capturas em número de indivíduos foram registradas em 2006 (2896), enquanto que as menores ocorreram no ano de 1997, com apenas 978 crustáceos coletados (Tab. II) 11 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Tabela II – Relação das espécies de crustáceos e suas respectivas freqüências em número e peso, durante o período de 1997 a 2006. (A ocorrência das espécies é representada por C = constante; A = acessória; O = ocasional). 1997 Família/Espécie N Peso (g) 2000 Oc N Peso (g) 2001 Oc N Peso (g) 2002 Oc 2003 2004 2005 Peso (g) 2006 N Peso (g) Oc N Peso (g) Oc N Peso (g) Oc N Oc 1 0,23 O 10 22,96 O 6 20,54 O 6 20,54 O 2 1,77 O N Peso (g) Oc Crustacea/Malacostraca Penaeidae Artemesia longinaris Xiphopenaeus kroyeri Litopenaeus schmitti 465 C 747 C 90 965,21 C 619 4125,02 C 521 3467,98 C 181 942,18 C 233 1364,80 C 492 3101,47 C Farfantepenaeus paulensis 283 C 384 C 221 1184,37 C 373 2021,25 C 479 2368,83 C 273 1269,26 C 281 1581,58 C 237 1353,54 C Farfantepenaeus brasiliensis 70 A 434 C 388 1846,42 C 695 3121,12 C 664 3444,89 C 540 2372,33 C 1001 5182,55 A 1826 9520,77 C 16 35,12 O 47 71,35 C 4 5,52 O 4 6,77 O 3 5,58 O 3 2,31 O 10,34 A Rimapenaeus constrictus Solenoceridae 5 Pleoticus muelleri O 7 8,01 O 5 8,94 O Sicyoniidae Sycione dorsalis 1 0,90 O 3 7,48 A 1 0,90 O 4 1,79 A 3 2,66 O 78 42,55 A Diogenidae Alpheus spp. 79 48,82 C 1 15,17 O 1 25,58 O Stomatopoda Squilla grenadensis 2 O 5 1 O 1 Calappidae Hepatus pudibundus 2 94,96 O Paguridae Loxopagurus loxochelis O Leucosiidae 1 Persephona punctata 14,85 O 1 1,33 O Persephona lichtensteinii 2 26,53 O 1 15,79 O 2 9,12 O 2 9,12 O 276 10050,48 C 250 9187,12 C Majidae 2 Libinia spinosa O 2 18,05 O 270 C 371 13265,16 C 270 8976,69 C 241 9406,27 1 O 1 135,52 O 1 151,17 O 2 118,85 1 17,78 O C 302 10657,21 C O 3 254,37 O Portunidae Callinectes danae Callinectes sapidus 150 A 12 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Continuação Tab. I 1997 Família/Espécie N Peso (g) 2000 Oc N Peso (g) 2001 Oc N Peso (g) 2002 Oc Callinectes bocourti Callinectes ornatus 10 O 33 C 22 422,40 Portunus spinimanus C 2003 N Peso (g) Oc 1 74,88 O 7 62,89 A 1 161,70 O 1982 18720,37 N 39 Peso (g) 565,40 2004 Oc C 2005 N Peso (g) Oc 1 74,88 O 67 781,44 C N Peso (g) Total espécies 978 1876 1182 17934,70 1965 19521,64 1454 16434,77 Oc N Peso (g) 793,08 C 27 179,97 C 3 100,67 O 1 48,19 O 1 25,12 O 1916 19158,21 2896 23530,67 5 8 11 11 12 12 15 14 0,58 0,93 1,41 1,31 1,45 1,51 1,85 1,50 Índice de diversidade H' 1,23 1,41 1,55 1,39 1,46 1,62 1,41 1,16 Índice de equitabilidade J' 0,77 0,68 0,65 0,58 0,60 0,65 0,52 0,45 Número de sp. Constantes 2 5 6 4 5 5 4 6 Número de sp. Acessórias 2 0 0 2 1 1 1 1 Número de sp. Ocasionais 1 3 5 5 6 6 10 7 Índice de riqueza D Oc 88 Charybdis hellerii Total 2006 13 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 O número de espécies apresentou oscilações ao longo do período de amostragem (Tab. II), com os menores valores ocorrendo em 1997 (cinco) e as maiores contribuições em 2005 (15) e 2006 (14), sendo que neste último ano, foi registrada a presença de Charybdis hellerii (A. Milne-Edwards 1867), espécie exótica na baia (Tab. II). As famílias Penaeidae e Portunidae, ambas com seis espécies, foram as mais diversificadas, contribuindo com 98,39% do total capturado, enquanto que as outras oito famílias, em conjunto, representaram 1,61% da carcinofauna (Tab. II) Os camarões Farfantepenaeus brasiliensis Latreille, 1817, Litopenaeus schimitti (Burkenroad, 1936) e Farfantepenaeus paulensis (Pérez Farfante, 1967), em conjunto com o siri Callinectes danae (Smith, 1869) foram as espécies numericamente dominantes (Tab. II) L. schimitti contribuiu com as maiores capturas em número de exemplares para os anos de 1997 (47,55%) e 2000 (39,82%), enquanto que F. brasiliensis dominou nos demais anos, com participações de 33,17% a 63,07% dos crustáceos capturados (Tab. II e Fig. 3). F. paulensis foi a segunda espécie mais abundante nos anos de 1997 (28,94%) e 2005 (14,67%), assim como C. danae em 2001 (32,27%) e 2004 (20,80%) (Tab. II e Fig. 3). Nos demais anos F. paulensis e C.danae ocuparam respectivamente as 3ª e 4ª colocações (exceto em 2000) nas capturas (Tab. II e Fig. 3). C. ornatus foi a quinta espécie mais representativa nos anos de 1997, 2000 e de 2003 a 2006, sendo substituído por Alpheus spp. em 2001 e Xiphopenaeus kroyeri (Heller, 1862) em 2002 (Tab. II e Fig. 3). Quanto às categorias de ocorrência, as espécies consideradas constantes predominaram nas capturas dos primeiros anos (1997, 2000 e 2001), enquanto que as ocasionais dominaram nas demais amostragens (Tab. II). Para as espécies constantes, as maiores freqüências ocorreram em 2000 (62,50%) e as menores em 2005 (26,67%), enquanto que nas acessórias, os maiores valores foram registrados em 1997 (40,00%) e os menores em 2005 (6,67%), sendo que em 2000 e 2001, não se obteve registro das mesmas na Baía-Sul. Nas espécies de ocorrência ocasional, as maiores porcentagens ocorreram em 2005 (66,67%) e as menores em 1997 (20,00%) (Tab. II). 14 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 1997 2003 Lito penaeus schmitti 47,55 % Farfantepenaeus paulensis Callinectes ornatus 26,51% Farfantepenaeus paulensis 15,34 % Farfantepenaeus brasiliensis 33,77 % Lito penaeus schmitti 28,94 % Callinectes danae Farfantepenaeus brasiliensis 24,35 % Callinectes danae 7,16 % Callinectes o rnatus 1,02 % 12,26 % 1,98 % 2000 2004 Lito penaeus schmitti 39,82 % Farfantepenaeus brasiliensis 23,13 % Farfantepenaeus paulensis Callinectes ornatus 33,17 % 20,80 % Callinectes danae Farfantepenaeus paulensis 20,47 % 18,76 % Lito penaeus schmitti 14,39% Callinectes danae Farfantepenaeus brasiliensis 1,76% 12,44 % 5,37 % A lpheus spp. 2001 2005 Farfantepenaeus brasiliensis 33,80 % 32,27 % Callinectes danae Farfantepenaeus paulensis 19,21% Lito penaeus schmitti 52,26% Farfantepenaeus paulensis 14,67 % 14,41% Callinectes danae Lito penaeus schmitti 7,84% 6,88 % A lpheus spp. Farfantepenaeus brasiliensis Callinectes ornatus 12,16 % 4,59 % 2002 2006 Farfantepenaeus brasiliensis 35,07 % Lito penaeus schmitti 31,24 % Farfantepenaeus paulensis 18,82 % Callinectes danae Xiphopenaeus kro yeri 13,60 % 0,50 % Farfantepenaeus brasiliensis 63,07% Lito penaeus schmitti 16,99 % Callinectes danae 8,64% Farfantepenaeus paulensis 8,19 % Callinectes ornatus 0,93 % Figura 3. Contribuição percentual em número de indivíduos das principais espécies de crustáceos capturadas no Saco dos Limões, entre 1997 e 2006. 15 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 5.3 - Abundância da carcinofauna 5.3.1 – Abundância de exemplares por ano de amostragem O número de crustáceos capturados apresentou flutuações distintas ao longo dos anos, com os menores valores em 1997 (978) e os maiores em 2006 (2896) (Fig.4). Apesar destas oscilações, a ANOVA (F7-24= 0,760; p≥0,05) aplicadas às abundâncias entre os anos de coleta, revelou que não existem diferenças significativas entre os mesmos. Para o ano de 1997, os maiores registros ocorreram durante o outono (383) e os menores na primavera (89), enquanto que em 2000 e 2001, o verão contribuiu com as maiores ocorrências e o inverno com as menores (Fig. 4). Em 2002, o outono (779) foi o responsável pelas maiores abundâncias numéricas, sendo que nos anos seguintes, o verão voltou a apresentar as maiores taxas de captura, com os menores valores ocorrendo durante o inverno em 2003 (275) e 2006 (165), e no outono para o período de 2004 (145) e 2005 (192) (Fig. 4). 5.3.2 – Abundância de exemplares nas áreas de coleta Para área I, o verão foi o responsável pelas maiores abundâncias durante o período diurno (17,64±3,77) e noturno (108,92±50,12), sendo o inverno a estação com as menores taxas de crustáceos capturados (Fig. 5a). Na área II, as maiores taxas de captura diurnas foram encontradas na primavera (15,75±5,84), enquanto que para a noite, as maiores contribuições ocorreram no outono (35,30±10,37) (Fig. 5b). Na área III, as maiores capturas ocorreram no verão para o dia (132,97±74,76) e na primavera para a noite (41,79±11,31) (Fig. 5c), ao passo que para as áreas IV e V, a primavera contribuiu com os maiores registros diurnos (31,13±5,62) e (35,38±5,86), e o verão com os noturnos (81,44±27,79) e (141,61±44,23) (Fig. 5d e 5e). Para área VI, o verão apresentou as maiores capturas diurnas (86,78±23,02) e noturnas (96,75±17,87), enquanto que o inverno contribuiu com as menores (23,33±11,14) e (25,40±4,82) (Fig. 5f). 16 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 A ANOVA aplicada ao número de indivíduos da carcinofauna, nas seis áreas de coleta, durante o período diurno (F5-18= 2,436; p≥0,05) e noturno (F518= 1,896; p≥0,05), indicou que não ocorrem diferenças significativas entre estes locais, embora as áreas VI e V tenham apresentado as maiores abundâncias médias (Fig. 5f e 5e). 1997 N 2003 N N= 978 1650 N= 1965 1650 1375 1375 1100 1100 825 825 550 550 275 275 0 0 Verão Outono Inverno Primavera Estações 2000 N Verão Outono N= 1876 Primavera 1650 1375 1375 1100 1100 825 825 550 550 275 275 0 Estações 2004 N 1650 Inverno N= 1454 0 Verão Outono N Inverno Primavera Estações Verão Outono 1650 Primavera Estações 2005 N 2001 Inverno 1650 1375 N= 1182 1375 1100 1100 825 825 550 550 275 275 0 N= 1916 0 Verão Outono Inverno Primavera Estações 2002 N Verão Outono N= 1982 1375 1650 Estações N= 2895 1375 1100 1100 825 825 550 550 275 275 0 Primavera 2006 N 1650 Inverno 0 Verão Outono Inverno Primavera Estações Verão Outono Inverno Primavera Estações Figura 4. Variação sazonal do número de crustáceos capturados no Saco dos Limões, nos oito anos de amostragem. 17 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Dia N Noite 250 200 Dia N Noite 250 200 (a) 150 150 100 100 50 50 0 (d) 0 Verão Outono Inverno Primavera Estações Dia N Noite 250 200 Verão Outono Inverno Primavera Estações Dia N Noite 250 200 (b) 150 100 100 50 50 0 (e) 150 0 Verão Outono Inverno Primavera Estações Dia N Noite 250 Verão Outono Inverno Primavera Estações Dia N Noite 250 200 200 (c) 150 100 100 50 50 0 (f) 150 0 Verão Outono Inverno Primavera Estações Verão Outono Inverno Primavera Estações Figura 5. Variação sazonal do número de crustáceos capturados nas áreas I (a), II (b), III (c), IV (d), V (e), VI (f), na região do Saco dos Limões, durante os anos de 2001 a 2006. 5.3.3 – Variação sazonal da abundância Na Figura 6, os dados de captura em número de indivíduos da carcinofauna, ao longo dos oito anos foram fundidos para apresentar a variação sazonal média da abundância por estação do ano, onde as maiores capturas foram registradas durante o verão (770±169), enquanto que as menores ocorreram no inverno (219±24) (Fig. 6). A aplicação da ANOVA aos 18 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 dados de abundância (F3-28= 5,690; p≤0,05) revelou a existência de diferenças significativas entre as estações do ano, atribuídas pelo teste de Tukey-Kramer, às maiores taxas obtidas durante os meses de verão. N 1000 750 500 250 0 Verão Outono Inverno Primavera Estações Figura 6. Variação sazonal média do número de crustáceos capturados no Saco dos Limões, durante os anos de 1997 a 2006 (Barra vertical = erro da média). Quando analisadas as capturas por período de coleta, verificou-se que as maiores taxas foram encontradas durante a noite nas quatro estações do ano, com os maiores registros no verão (493±106,42 e 307±118,01) e menores no inverno (145±28,01 e 84,00±19,18) respectivamente para o dia e a noite. (Fig. 7). Apesar da variação nas capturas entre os períodos, o teste t aplicado aos dados de abundância no verão (t=1,17; p≥0,05), outono (t=1,19; p≥0,05), inverno (t=1,76; p≥0,05) e primavera (t=1,57; p≥0,05), indicou que não ocorrem diferenças significativas entre as capturas diurnas e noturnas. N Noite Dia 600 500 400 300 200 100 0 Verão Outono Inverno Primavera Estações Figura 7. Variação sazonal média do número de crustáceos capturados no Saco dos Limões, durante os períodos diurno e noturno (Barra vertical = erro da média). 19 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 5.4 - Diversidade 5.4.1 – Diversidade por ano de amostragem O índice de diversidade de Shannom (H’) apresentou moderadas flutuações ao longo dos anos, com valores reduzidos em 1997 (1,23), incrementos em 2000 e 2001, atingindo um pico em 2004 (1,62). A partir de 2005 houve uma redução nos índices registrados, apresentando os menores valores em 2006 (1,16) (Tab. II e Fig. 8). No entanto, quando aplicada a ANOVA (F7-24= 2,158; p≥0,05), aos valores de diversidade entre os anos de coleta, não ocorreram diferenças significativas entre os mesmos. Em 1997, as maiores diversidades foram registradas durante o verão (1,14) e as menores no inverno (1,02), enquanto que em 2000 e 2001, o outono contribuiu com os maiores valores (Fig. 8). Para o ano de 2002, os maiores registros ocorreram no inverno (1,39) e os menores no outono (1,21), sendo que em 2003, os meses de verão (1,45) e inverno (1,45) apresentaram os maiores índices. No ano de 2004, o verão foi o responsável pelas maiores diversidades (1,70), enquanto que outono (1,25) e inverno (1,25) contribuíram com as menores (Fig. 8). No ano de 2005 o inverno (1,48) passou a apresentar novamente os maiores índices, com o verão contribuindo com a menor diversidade (1,14), ao passo que em 2006 o outono (1,39) caracterizou-se como a estação com as maiores diversidades (Fig. 8). 5.4.2 – Diversidade por área de coleta Analisando os índices de diversidade ao longo das áreas de coleta, verificou-se que na área I, os meses de verão foram os que apresentaram as maiores contribuições para os períodos diurno (1,21±0,10) e noturno (1,20±0,11), ao passo que para a área II, o inverno foi o responsável pelos maiores registros (Fig. 9a e 9b). Na área III, o outono contribuiu com os maiores índices durante o dia (1,14±0,10) e a noite (1,25±0,03), sendo que o inverno apresentou os menores índices diurnos (0,72±0,13) e a primavera os noturnos (0,84±0,10) (Fig. 9c). 20 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 H' 1,8 1,7 1,6 1,5 1,4 1,3 1,2 1,1 1 0,9 0,8 0,7 0,6 V O I P V 1997 O I 2000 P V O I 2001 P V O I P 2002 V O 2003 I P V O 2004 I P V O I 2005 P V O I P Estações 2006 Figura 8. Variação sazonal do índice de diversidade da carcinofauna (H´) no Saco dos Limões, entre 1997 e 2006. Na área IV o verão foi a estação que apresentou os maiores índices para o dia (1,21±0,10), com o outono mantendo-se com as maiores contribuições para a noite (1,26±0,10) (Fig. 9d), ao passo que para área V a primavera contribuiu com os maiores registros diurnos (1,16±0,11), e o outono com os noturnos (1,17±0,16) (Fig. 9e). Para área VI, de modo semelhante ao encontrado na III, os maiores valores ocorreram no outono (1,04±0,11) durante o dia, enquanto que para a noite, as maiores diversidades foram registradas no inverno (1,30±0,08) (Fig. 9f). Não foram encontradas diferenças significativas nos índices de diversidade do dia (F5-18= 0,449; p≥0,05) e noite (F5-18= 2,134; p≥0,05) entre os locais de coleta, embora as áreas VI e V tenham apresentado os menores índices (Fig. 9f e 9e). 21 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Dia H´ Noite 1,5 1 (a) 0,5 Dia H´ Noite 1,5 1 (d) 0,5 0 0 Verão Outono Inverno Primavera Estações Dia H´ Noite 1,5 1 (b) 0,5 Verão Outono Inverno Primavera Estações Dia H´ Noite 1,5 1 (e) 0,5 0 0 Verão Outono Inverno Primavera Estações Dia H´ Noite 1,5 Verão Outono Inverno Primavera Estações Dia H´ Noite 1,5 1 1 (f) (c) 0,5 0,5 0 0 Verão Outono Inverno Primavera Estações Verão Outono Inverno Primavera Estações Figura 9. Variação sazonal do índice de diversidade (H’) nas áreas I (a), II (b), III (c), IV (d), V (e), VI (f), na região do Saco dos Limões, durante os anos de 2001 a 2006. 5.4.3 – Variação sazonal da diversidade A Figura 10 sintetiza a variação sazonal média do índice de diversidade ao longo do período de estudo, demonstrando valores muito próximos entre as estações do ano, onde o outono contribuiu com os maiores índices (1,33±0,07), ao passo que os menores valores foram registrados nos meses de primavera (1,22±0,77). Apesar destas variações, a aplicação da ANOVA (F3- 22 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 28= 0,374; p≥0,05) aos dados de diversidade, indicou que não ocorrem diferenças entre as estações do ano. H´ 1,5 1,25 1 0,75 0,5 0,25 0 Verão Outono Inverno Primavera Estações Figura 10. Variação sazonal média do índice de diversidade (H´) no Saco dos Limões, durante os anos de 1997 a 2006. (Barra vertical = erro da média). Com relação aos períodos de coleta, as amostragens diurnas apresentaram as maiores diversidades (exceto no inverno), com os maiores registros ocorrendo no outono, tanto para o dia (1,44±0,08) quanto para a noite (1,44±0,08) (Fig. 11). No entanto, quando aplicado o teste t entre os índices registrados no verão (t= 0,84; p≥0,05), outono (t=0,04; p≥0,05), inverno (t=0,97; p≥0,05) e primavera (t= 1,78; p≥0,05), verificou-se que não ocorrem diferenças significativas entre as coletas diurnas e noturnas. Noite H' Dia 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 Verão Outono Inverno Primavera Estações Figura 11. Variação sazonal média do índice de diversidade (H´) no Saco dos Limões, durante os períodos diurno e noturno (Barra vertical = erro da média). 23 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 5.5 - Equitabilidade 5.5.1 – Equitabilidade por ano de amostragem O índice de equitabilidade de Pielou (J’) apresentou oscilações distintas para os oito anos de amostragem, com os maiores valores em 1997 (0,77) e os menores em 2006 (0,45) (Tab. II e Fig. 12). Apesar destas flutuações, a ANOVA (F7-24= 2,540; p≥0,05) aplicada às equitabilidades entre os anos de coleta, revelou que não existem diferenças significativas entre os mesmos. Para o ano de 1997, os maiores registros ocorreram durante o inverno (0,93), com os menores índices no outono (0,74), enquanto que em 2000, a primavera contribuiu com os maiores valores (0,75) e o inverno com os menores (0,49) (Fig. 12). Em 2001, as maiores equitabilidades foram registradas no outono (0,86), ao passo que em 2002, o inverno foi o responsável pelos maiores índices (0,87), com os menores valores ocorrendo no verão (0,58) (Fig. 12). Para o ano de 2003, a distribuição dos crustáceos na Baía-Sul foi mais uniforme, com pequenas flutuações entre as estações do ano (Fig. 12). Em 2004, o verão foi o responsável pelos maiores índices (0,77), enquanto que em 2005, o inverno contribuiu com as maiores equitabilidades (0,71) (Fig. 12). De modo semelhante ao encontrado no início das amostragens, em 2006 o outono voltou a participar com os maiores registros (0,67) e a primavera com os menores (0,36) (Fig. 12). 5.5.2 – Equitabilidade por área de coleta Na área I, os maiores valores foram registrados no outono para as amostragens do dia (0,85±0,05) e no inverno (0,77±0,07) para a noite, com os menores índices ocorrendo no verão (Fig. 13a). Para área II, o inverno contribuiu com os maiores registros, sendo que as menores equitabilidades diurnas ocorreram na primavera (0,81±0,09) e as noturnas no verão (0,61±0,06) (Fig. 13b). 24 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Na área III, os maiores índices ocorreram no outono e menores no verão (Fig. 13c), enquanto que nas áreas IV e V, o inverno foi a estação responsável pelas maiores equitabilidades diurnas e o outono pelas noturnas (Fig. 13d e 13e). Para área VI, as maiores contribuições foram registradas durante o outono para o dia (0,80±0,07) e no inverno para a noite (0,73±0,09), com os menores valores diurnos ocorrendo no verão (0,65±0,04) e os noturnos na primavera (0,60±0,07) (Fig. 13f). A ANOVA aplicada às equitabilidades nas seis áreas de coleta durante o dia (F5-18= 2,152; p≥0,05) e a noite (F5-18= 0,466; p≥0,05), indicou que não ocorrem diferenças significativas entre estes locais, embora as áreas VI e V tenham apresentado os menores índices (Fig. 13f e 13e). J' 1 0,9 0,8 0,7 0,6 0,5 0,4 0,3 V O 1997 I P V O I 2000 P V O I 2001 P V O I 2002 P V O 2003 I P V O I 2004 P V O I 2005 P V O I P Estações 2006 Figura 12. Variação sazonal do índice de equitabilidade da carcinofauna (J´) no Saco dos Limões, entre 1997 e 2006. 25 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Dia J´ Noite 1 0,8 Dia J´ Noite 1 0,8 (a) 0,6 0,4 0,4 0,2 0,2 0 (d) 0,6 0 Verão Outono Inverno Primavera Estações Dia J´ Noite 1 0,8 Verão Outono Inverno Primavera Estações Dia J´ Noite 1 0,8 (b) 0,6 (e) 0,6 0,4 0,4 0,2 0,2 0 0 Verão Outono Inverno Primavera Estações J´ 1 Verão Dia J´ Noite 1 Outono Inverno Primavera Estações Dia Noite 0,8 0,8 (c) 0,6 (f) 0,6 0,4 0,4 0,2 0,2 0 0 Verão Outono Inverno Primavera Estações Verão Outono Inverno Primavera Estações Figura 13. Variação sazonal do índice de equitabilidade (J´) nas áreas I (a), II (b), III (c), IV (d), V (e), VI (f), na região do Saco dos Limões, durante os anos de 2001 a 2006. 5.5.3 – Variação sazonal da equitabilidade A Figura 14 mostra a variação sazonal média da equitabilidade no Saco dos Limões, ao longo do período de estudo, onde os maiores índices ocorreram nos meses de outono (0,71±0,03) e inverno (0,70±0,05), enquanto que o verão (0,63±0,04) apresentou os menores valores. Não foram observadas existências de diferenças significativas nas equitabilidades entre as estações (F3-28= 0,842; p≥0,05). 26 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 J´ 1 0,8 0,6 0,4 0,2 0 Verão Outono Inverno Primavera Estações Figura 14. Variação sazonal média do índice de equitabilidade (J´) no Saco dos Limões, durante os anos de 1997 a 2006. (Barra vertical = erro da média). Analisando os períodos de coleta, verificou-se que as maiores equitabilidades ocorreram durante as amostragens diurnas, com o outono contribuindo com os maiores índices (0,82±0,04 e 0,74±0,03) e o verão com os menores (0,71±0,05 e 0,61±0,03), respectivamente para dia e noite (Fig.15). Apesar destas variações, a aplicação do teste t entre os valores registrados no verão (t=1,843; p≥0,05), outono (t=1,493; p≥0,05), inverno (t=1,537; p≥0,05) e na primavera (t=1,939; p≥0,05), indicou que não ocorrem diferenças significativas entre as equitabilidades diurnas e noturnas. Noite J' Dia 1 0,75 0,5 0,25 0 Verão Outono Inverno Primavera Estações Figura 15. Variação sazonal média do índice de equitabilidade (J´) no Saco dos Limões, durante os períodos diurno e noturno (Barra vertical = erro da média). 27 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 5.6 - Estrutura populacional das espécies dominantes 5.6.1 - Farfantepenaeus brasiliensis – Estrutura de comprimento A Figura 16 mostra as distribuições da freqüência anual das classes de comprimento dos machos e das fêmeas de F. brasiliensis, durante o período de 2001 a 2006, revelando um padrão de distribuição semelhante ao longo dos anos, com incrementos e oscilações nos machos a partir de 4,0 a 8,0cm, com queda gradativa até os 15,0cm, enquanto que nas fêmeas foram registrados acréscimos na abundância a partir dos 3,0cm até os 8,0cm, seguido de redução abrupta até os 16,0cm. Em geral, estas apresentaram comprimentos totais superiores aos encontrados para os machos durante todo o período amostral (Fig. 16). Durante o ano de 2001, a amplitude de comprimento total nos machos variou de 4,5 a 13,7cm, enquanto que nas fêmeas a oscilação foi de 4,0 até 15,9cm, com as maiores capturas na classe de 7,0cm em ambos os sexos (Fig. 16). No ano de 2002, os machos alcançaram tamanhos superiores aos registrados em 2001, com uma amplitude de 5,3 a 15,2cm, enquanto que as fêmeas mantiveram o seu padrão de distribuição (Fig. 16). Em 2003, o comprimento total apresentado pelos machos variou de 5,0 até 13,8cm, com picos nas classes de 7,0 e 8,0cm, sendo que as fêmeas mantiveram a flutuação de 4,5 a 15,8cm (Fig. 16). Para o ano de 2004, verificou-se uma redução no tamanho dos machos, que atingiram um comprimento máximo de 12,6cm, ao passo que as fêmeas apresentaram um pequeno incremento, com amplitude de 4,7 a 16,2cm (Fig. 16) Nos anos de 2005 e 2006, a variação do comprimento total no machos voltou a seguir o padrão dos anos iniciais, com oscilações de 5,0 a 13,7cm e 5,6 a 13,9cm, com picos na classe de 8,0cm, enquanto que nas fêmeas, a amplitude de variação em 2005 foi de 3,5 a 15,7cm, com os maiores comprimentos em 2006, onde a flutuação foi de 5,0 a 16,6cm (Fig. 16). Analisando as distribuições de freqüência por classe de comprimento de machos e fêmeas, em conjunto com o tamanho de primeira maturação encontrado na literatura, verificou-se que a população desta espécie esteve 28 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 representada principalmente por juvenis, com participações que variaram de 89,44% (2001) a 95,51% (2005) nos machos e de 78,08 (2006) a 92,22% (2001) nas fêmeas (Fig. 16). Machos Fêmeas % N=155 2001 40 % N=233 2001 40 35 35 Juvenis 30 30 Adultos 25 25 20 20 15 15 10 10 5 5 Juvenis Adultos 0 0 3 4 5 6 7 8 9 % 2002 40 3 10 11 12 13 14 15 16 Lt (cm) N=334 4 5 6 7 8 9 10 11 12 13 14 15 16 Lt (cm) % 35 30 30 25 25 20 20 15 15 10 10 N=361 2002 40 35 5 5 0 0 3 4 5 6 7 8 9 % 2003 40 3 10 11 12 13 14 15 16 Lt (cm) N=257 4 5 6 7 8 9 10 11 12 13 14 15 16 Lt (cm) % 35 30 30 25 25 20 20 15 15 10 10 5 5 N=407 2003 40 35 0 0 3 4 5 6 7 8 9 % N=234 40 3 10 11 12 13 14 15 16 Lt (cm) 4 5 6 7 8 35 35 30 30 25 25 20 20 15 15 10 10 5 10 11 12 13 14 15 16 Lt (cm) % N=306 40 2004 9 2004 5 0 0 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Lt (cm) % N=558 4 5 6 7 8 9 35 35 30 30 25 25 20 20 15 15 10 10 5 5 0 10 11 12 13 14 15 16 Lt (cm) N=443 2005 40 2005 40 3 % 0 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Lt (cm) % 2006 40 N=785 3 5 6 7 8 9 10 11 12 13 14 15 16 Lt (cm) 35 30 30 25 25 20 20 15 15 N=1041 2006 40 35 10 4 % 10 5 9,2 0 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Lt (cm) 5 8,8 0 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Lt (cm) Figura 16. Distribuição de freqüência por classe de comprimento de F. brasiliensis , durante os anos de 2001 a 2006. Linha tracejada= L50 (BRANCO & VERANI, 1998a). 29 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 – Abundância e Biomassa entre os anos de coleta A série temporal de coleta (Fig. 17) indicou que ocorreram flutuações sazonais nas capturas de F. brasiliensis, com as maiores abundâncias durante os meses de verão, exceto em 2002, onde o outono contribuiu com as maiores capturas, e as menores no inverno. Foram observadas diferenças significativas (F3-26= 3,714; p≤0,05) no número de exemplares ao longo dos anos, com os maiores registros em 2006 (1826) e os menores em 1997 (70) (Fig. 17). As maiores biomassas ocorreram durante o verão nos anos de 2001, 2005 e 2006, na primavera em 2003 e 2004 e no outono em 2002, com o inverno contribuindo com as menores capturas (Fig. 17). Em geral, o ano de 2006 apresentou os maiores rendimentos em peso e 2001 os menores (Fig. 17), entretanto, a aplicação da ANOVA não revelou a existência de diferenças significativas (F5-17= 2,090; p≥0,05) entre os oito anos de coleta. 30 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 2003 N Biomassa 1997 N 1000 N=70 900 Biomassa 800 6000 700 5000 600 N N=664 4000 500 400 3000 300 2000 200 1000 100 0 0 Verão Outono Inverno Primavera Verão Estações Outono Inverno Primavera 2004 N Biomassa 2000 N 1000 N=434 900 Biomassa 800 6000 700 5000 600 N N=540 4000 500 400 3000 300 2000 200 1000 100 0 0 Verão Outono Inverno Primavera 2001 Verão Estações Outono Inverno Primavera 2005 Biomassa N Biomassa N N=388 5000 4000 3000 2000 1000 0 Verão Outono Inverno Primavera 2002 1000 900 800 700 600 500 400 300 200 100 0 Estações Biomassa N 6000 N=1001 5000 4000 3000 2000 1000 0 Verão Outono Inverno Primavera 2006 Biomassa N N 6000 N=695 5000 4000 3000 2000 1000 0 Verão Outono Inverno Primavera 1000 900 800 700 600 500 400 300 200 100 0 Estações Biomassa N Biomassa 1000 900 800 700 600 500 400 300 200 100 0 Estações Biomassa N 6000 1000 900 800 700 600 500 400 300 200 100 0 Estações 1000 900 800 700 600 500 400 300 200 100 0 Estações Biomassa N 6000 N=1826 5000 4000 3000 2000 1000 0 Verão Outono Inverno Primavera 1000 900 800 700 600 500 400 300 200 100 0 Estações Figura 17. Variação sazonal da abundância e biomassa de F. brasiliensis capturados no Saco dos Limões, durante 1997 a 2006. 31 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 5.6.2 - Litopenaeus schimitti – Estrutura de comprimento No camarão-branco L. schimitti, as distribuições de freqüência por classe de comprimento total de machos e fêmeas apresentaram flutuações distintas entre os anos de coleta, onde em 1997, as maiores contribuições ocorreram entre as classes de 9,0 a 12,0cm (Fig. 18), enquanto que nos demais anos, a participação das classes de menor tamanho foi mais evidente, ocorrendo entre 6,0 a 11,0cm, com as maiores taxas de captura variando de 7,0 a 8,0cm na população (Fig. 18). As fêmeas apresentaram comprimentos totais superiores ao longo do período amostral (Fig. 18). No ano de 1997, o comprimento total dos machos variou de 5,0 a 15,1cm, enquanto que nas fêmeas, a flutuação foi de 6,0 a 15,2cm, com as maiores capturas na classe de 10,0cm para ambos os sexos (Fig.18). Em 2001 ocorreu uma redução no tamanho dos exemplares capturados, onde a amplitude de comprimento total nos machos foi de 3,7 a 15,7cm, com moda nas classes de 7,0 e 8,0cm, e nas fêmeas de 4,2 a 16,1cm, com pico nos 7,0cm (Fig. 18). Para 2002, o comprimento total dos machos esteve entre 5,0 a 16,1cm, com pico em 8,0cm, enquanto que nas fêmeas variou entre 4,3 a 17,5cm (Fig. 18). Já em 2003 e 2004, o tamanho dos machos foi em torno dos 3,3 a 15,4cm, e das fêmeas de 3,5 a 15,7cm (2003) e de 3,5 a 18,5cm em 2004 (Fig. 18). Em 2005, variou nos machos de 6,6 a 13,0cm, com picos em 7,0 e 9,0cm, e nas fêmeas de 4,3 a 18,5cm, com moda na classe de 8,0cm (Fig. 18), enquanto que em 2006, o comprimento nos machos variou de 5,6 a 15,0cm e nas fêmeas de 4,3 a 16,5cm (Fig. 18). As distribuições de freqüência por classe de comprimento de L. schimitti, quando confrontadas com o tamanho de primeira maturação calculado para a população da Baía-Sul, indicam que esta espécie esteve representada principalmente por juvenis, com as maiores porcentagens no ano de 2001 (Fig. 18). Em geral os adultos apresentaram as maiores contribuições em 1997, com participações de 24,07% para os machos e 17,40% para as fêmeas, sendo que nos anos posteriores, as contribuições não chegaram a 15,00% (Fig. 18) 32 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Fêmeas Machos % N=237 1997 35 30 Juvenis 25 % 30 Adultos Juvenis 25 20 20 15 15 10 10 5 5 N=228 1997 35 Adultos 0 0 3 4 5 6 7 8 Lt (cm) 9 10 11 12 13 14 15 16 17 18 % 2001 35 N=37 3 4 5 6 7 8 2001 35 30 30 25 25 20 20 15 15 10 10 5 5 Lt (cm) 9 10 11 12 13 14 15 16 17 18 % N=53 0 0 3 4 5 6 7 8 Lt (cm) 9 10 11 12 13 14 15 16 17 18 % N=258 35 2002 3 4 5 6 7 8 2002 35 30 30 25 25 20 20 15 15 10 10 5 5 Lt (cm) 9 10 11 12 13 14 15 16 17 18 % N=361 0 0 3 4 5 6 7 8 Lt (cm) 9 10 11 12 13 14 15 16 17 18 % 2003 35 N=228 3 4 5 6 7 8 9 2003 35 30 30 25 25 20 20 15 15 10 10 5 5 Lt (cm) 10 11 12 13 14 15 16 17 18 % N=293 0 0 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 % 2004 35 Lt (cm) N=68 3 30 25 25 20 20 15 15 10 10 5 5 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 % 2005 35 Lt (cm) N=90 25 20 15 15 10 10 5 5 6 7 8 9 10 11 12 13 14 15 16 17 18 % 2006 35 Lt (cm) N=204 N=113 4 5 6 7 8 9 Lt (cm) 10 11 12 13 14 15 16 17 18 N=143 2005 0 3 4 5 6 7 8 9 Lt (cm) 10 11 12 13 14 15 16 17 18 % 30 25 25 20 20 15 15 N=288 2006 35 30 10 Lt (cm) 9 10 11 12 13 14 15 16 17 18 35 20 5 8 2004 3 25 4 7 % 30 3 6 0 30 0 5 35 30 0 4 % 10 5 5 10,7 0 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Lt (cm) 10,7 0 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Lt (cm) Figura 18. Distribuição de freqüência por classe de comprimento de L. schimitti, durante os anos de 1997 a 2006. Linha tracejada= L50. 33 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 – Abundância e biomassa entre os anos de coleta De acordo com a figura 19, ocorreram flutuações na abundância de L. schimitti na Baía-Sul, com a maiores contribuições no verão (2000 e 2004 a 2006) e no outono (1997 e 2001 a 2003) e as menores no inverno (Fig. 19). Em geral o ano de 2000 foi o responsável pelas maiores capturas (747), enquanto que 2001 (90) apresentou os menores registros (Fig. 19). Apesar destas variações, não foram encontradas diferenças significativas (F7-24= 1,242; p≥0,05) no número de indivíduos entre os anos de coleta. A biomassa apresentou uma tendência de variação semelhante à abundância, com as maiores capturas em peso ocorrendo no outono (2001 a 2003) e no verão (2004 a 2006), ao passo que os menores rendimentos ocorreram durante o inverno (Fig. 19). Não foram observadas diferenças significativas (F5-18= 2,275; p≥0,05) nas biomassas entre os oito anos de amostragem, embora os maiores valores tenham ocorrido em 2002 e os menores em 2004, sendo que em 1997 e 2000, não foi registrada a biomassa da espécie nas coletas (Fig. 19). 34 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 2003 1997 N Biomassa N 750 N=465 Biomassa 600 2600 450 1950 300 1300 150 650 N N=521 750 600 450 300 150 0 0 Verão Outono Inverno Primavera Verão Estações Outono 2000 N Inverno Primavera 2004 0 Estações Biomassa N 750 N=747 600 Biomassa N 2600 450 1950 300 1300 150 650 N=181 750 600 450 300 0 150 0 Verão Outono Inverno Primavera 2001 Verão Estações Outono Inverno Primavera 2005 Biomassa Biomassa N N Biomassa N 2600 N=90 1950 0 Estações Biomassa 750 2600 600 1950 N N=233 750 600 450 450 1300 1300 300 300 650 150 0 Verão Outono Inverno Primavera 2002 0 Estações 650 150 0 Verão Outono Inverno Primavera 2006 Biomassa Biomassa N N Biomassa N 2600 N=619 750 600 1950 0 Estações Biomassa N 2600 N= 492 750 600 1950 450 450 1300 1300 300 300 650 150 0 Verão Outono Inverno Primavera 0 Estações 650 150 0 Verão Outono Inverno Primavera 0 Estações Figura 19. Variação sazonal da abundância e biomassa de L. schimitti capturados no Saco dos Limões, durante 1997 a 2006. 35 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 5.6.3 - Farfantepenaeus paulensis – Estrutura de comprimento A análise da distribuição de freqüência por classe de comprimento revelou alterações na estrutura de tamanho da população de F. paulensis ao longo dos anos de coleta (Fig. 20). Em geral, durante o ano de 1997, as classes de 9,0 a 12,0cm contribuíram com as maiores freqüências para ambos os sexos, enquanto que de 2001 a 2004 (exceto em 2003), os exemplares menores, com tamanho entre 6,0 a 9,0cm predominaram nas amostragens (Fig. 20). Em 2005 e 2006, as maiores porcentagens de captura voltaram a ocorrer nas classes de 8,0 a 12,0cm (Fig. 20), entretanto o tamanho máximo atingido pelos exemplares foi menor. Em 1997 a amplitude de comprimento de machos e fêmeas foi semelhante, onde os primeiros apresentaram uma flutuação de 5,0 a 14,0cm, enquanto que as fêmeas atingiram de 5,0 a 14,2cm, com picos de captura em 9,0cm para ambos os sexos (Fig. 20). Em 2001, os exemplares de menor tamanho passaram a contribuir com as maiores capturas, sendo que nos machos, o comprimento variou de 4,7 a 14,6cm, com moda na classe de 8,0cm, e nas fêmeas de 4,3 a 15,4cm, com as maiores freqüências nos 7,0cm (Fig. 20). Para 2002, os machos mantiveram a tendência de flutuação de 2001, ao passo que as fêmeas alcançaram comprimentos superiores, sendo registrados exemplares de até 17,0cm (Fig. 20). No ano de 2003, machos e fêmeas apresentaram distribuições de tamanho semelhantes, variando de 4,7 a 15,0cm, onde as maiores capturas nos machos ocorreram nas classes de 7,0, 8,0 e 10,0cm, enquanto que nas fêmeas o pico ocorreu em 7,0cm (Fig. 20). Em 2004 o comprimento total dos machos variou entre 4,7 a 14,6cm e entre 4,6 a 17,0cm nas fêmeas (Fig. 20), sendo que nos anos de 2005 a 2006, os primeiros alcançaram tamanhos de no máximo 12,0cm, enquanto que 14,0cm foi o maior comprimento registrado entre as fêmeas (Fig. 20) Analisando as distribuições de comprimento de machos e fêmeas de F. paulensis, em conjunto com o tamanho de primeira maturação encontrado na literatura, verificou-se que assim como para as demais espécies de camarão 36 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 registradas na baía, a população esteve representada principalmente por juvenis, com as maiores porcentagens no ano de 2004 (80,14%) e (89,33%), respectivamente para machos e fêmeas (Fig. 20). Em relação aos adultos, as maiores capturas ocorreram no ano de 1997 para as fêmeas (37,34%) e em 2006 (31,37%) para os machos (Fig. 20). – Abundância e biomassa entre os anos de coleta Na Figura 21, encontram-se reunidos os dados de captura em número de indivíduos e biomassa, para os oito anos de coleta, onde as maiores abundâncias foram registradas durante os meses de verão (1997 ,2001, 2003 e 2005 a 2006) e primavera (2000, 2002 e 2004), enquanto que as menores contribuições ocorreram no inverno. A biomassa apresentou um padrão de flutuação similar ao encontrado na abundância, com a primavera contribuindo com as maiores capturas em peso para a maioria dos anos, enquanto que o inverno foi o responsável pelas menores taxas de captura (Fig. 21). Não foram observadas diferenças significativas no número de indivíduos coletados (F7-24= 0,474; p≥0,05) e nas biomassas (F5-18= 0,709; p≥0,05) entre os anos de coleta, embora os maiores valores tenham ocorrido em 2003 e os menores em 2001. 37 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Machos N=144 1997 40 Fêmeas % % N=139 1997 40 35 35 Juvenis 30 Adultos Juvenis 30 Adultos 25 25 20 20 15 15 10 10 5 5 0 0 4 5 6 7 8 9 % 2001 40 4 10 11 12 13 14 15 16 17 Lt (cm) N=98 5 6 7 8 9 % 35 30 30 25 25 20 20 15 15 10 10 5 5 N=123 2001 40 35 10 11 12 13 14 15 16 17 Lt (cm) 0 0 4 5 6 7 8 9 % 2002 40 4 10 11 12 13 14 15 16 17 Lt (cm) N=168 5 6 7 8 9 10 11 12 13 14 15 16 17 Lt (cm) % 35 35 30 30 25 25 20 20 15 15 10 10 5 5 N=205 2002 40 0 0 4 5 6 7 8 9 % 2003 40 4 10 11 12 13 14 15 16 17 Lt (cm) N=203 5 6 7 8 9 % 35 30 30 25 25 20 20 15 15 10 10 5 5 0 N=276 2003 40 35 10 11 12 13 14 15 16 17 Lt (cm) 0 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Lt (cm) % 2004 40 N=117 4 5 6 7 8 9 35 30 30 25 25 20 20 15 15 10 10 5 5 N=156 2004 40 35 0 10 11 12 13 14 15 16 17 Lt (cm) % 0 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Lt (cm) % 2005 40 N=111 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Lt (cm) % 35 35 30 30 25 25 20 20 15 15 10 10 5 5 N=170 2005 40 0 0 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Lt (cm) % 2006 40 N=102 4 5 6 7 8 9 % 40 35 35 30 30 25 25 20 20 15 15 10 11 12 13 14 15 16 17 Lt (cm) N=135 2006 10 10 5 9,3 5 8,8 0 0 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Lt (cm) 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Lt (cm) Figura 20. Distribuição de freqüência por classe de comprimento de F. paulensis, durante os anos de 1997 a 2006. Linha tracejada= L50 (BRANCO & VERANI, 1998b). 38 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 2003 1997 N Biomassa N 220 200 180 N=283 Biomassa N N=479 1100 1000 900 800 700 600 500 400 300 200 100 0 160 140 120 100 80 60 40 20 0 Verão Outono Inverno Primavera Verão Estações Outono Primavera 2004 2000 N Inverno 220 200 180 160 140 120 100 80 60 40 20 0 Estações Biomassa N 220 200 N=384 180 160 Biomassa N N=273 1100 1000 900 800 700 600 500 400 300 200 100 0 140 120 100 80 60 40 20 0 Verão Outono Inverno Primavera 2001 Verão Estações Outono Inverno Primavera 2005 Biomassa Biomassa N N Biomassa N 1100 1000 900 800 700 600 500 400 300 200 100 0 N=221 Verão Outono Inverno Primavera 2002 220 200 180 160 140 120 100 80 60 40 20 0 Estações Biomassa N N=281 1100 1000 900 800 700 600 500 400 300 200 100 0 Verão Outono Inverno Primavera 2006 Biomassa N=373 1100 1000 900 800 700 600 500 400 300 200 100 0 Verão Outono Inverno Primavera 220 200 180 160 140 120 100 80 60 40 20 0 Estações Biomassa N N Biomassa 220 200 180 160 140 120 100 80 60 40 20 0 Estações N 220 200 180 160 140 120 100 80 60 40 20 0 Estações Biomassa N N=237 1100 1000 900 800 700 600 500 400 300 200 100 0 Verão Outono Inverno Primavera 220 200 180 160 140 120 100 80 60 40 20 0 Estações Figura 21. Variação sazonal da abundância e biomassa de F. paulensis capturados no Saco dos Limões, durante 1997 a 2006. 39 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 5.6.4 - Callinectes danae – Estrutura de comprimento As distribuições de largura total da carapaça de C. danae revelaram um padrão de flutuação semelhante ao longo do período de estudo, com distribuição polimodal nos machos, onde as maiores capturas dentre os juvenis ocorreram de 4,0 a 7,0cm e nos adultos, nas classes de 10,0 e 11,0cm (Fig. 22). Nas fêmeas, a tendência foi predominantemente unimodal, com as maiores porcentagens de captura incidindo sobre os juvenis, nas classes de 6,0 a 7,0cm (Fig. 22). Em geral as fêmeas apresentaram larguras totais de carapaça inferiores às encontradas nos machos (Fig. 22). Para os anos de 1997 e 2001, a amplitude de variação da largura da carapaça foi semelhante dentre os machos, oscilando de 2,0 a 13,0cm, com picos em 5,0, 7,0 e 11,0cm, enquanto que nas fêmeas, variou de 4,0 a 11,0cm em 1997 e de 2,2 a 13,1cm em 2001, com as maiores capturas nas classes de 7,0 e 8,0cm (Fig. 22). Em 2002, a variação foi de 3,2 a 13,1cm nos machos, com moda nas classes de 6,0, 7,0 e 10,0cm, enquanto que as fêmeas não atingiram larguras superiores a 10,1cm (Fig. 22). No ano de 2003, apesar da amplitude de largura total ter-se mantido constante em relação ao ano anterior para os machos, os picos de captura ocorreram em classes diferentes, com modas em 4,0, 6,0, 8,0 e 10,0cm, ao passo que nas fêmeas, a oscilação foi de 3,4 a 11,1cm, com as classes de 6,0 e 8,0cm contribuindo com as maiores capturas (Fig. 22). Para 2004, a largura variou de 2,8 a 13,1cm, com modas em 7,0, 10,0 e 11,0cm nos machos e de 2,3 a 10,5cm nas fêmeas, enquanto que em 2005, a variação nos primeiros foi de 3,1 a 13,5cm e nas fêmeas de 2,6 a 10,6cm (Fig. 22). Em 2006, os machos mantiveram a tendência observada em 2005, com largura variando de 2,0 a 13,5cm, com picos em 4,0, 6,0 e 10,0cm, ao passo que as fêmeas apresentaram uma variação de 2,6 a 10,3cm, onde as classes de 4,0, 6,0 e 10,0cm apresentaram as maiores contribuições (Fig. 22). As distribuições de largura total da carapaça de C. danae, quando confrontadas com o tamanho de primeira maturação calculado para a população da Baía-Sul, revelaram que para os machos, existe uma equilíbrio 40 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 entre as capturas de indivíduos juvenis e adultos, enquanto que para as fêmeas, a porção juvenil predominou nas amostragens, com contribuições que variaram de 77,63% a 92,22%, sendo que os adultos não ultrapassaram 22,37% (Fig. 22). – Abundância e biomassa entre os anos de coleta Analisando a série temporal de coleta, verificou-se a existência de flutuações sazonais na abundância de C. danae, onde as maiores capturas ocorreram durante a primavera (2000, 2002 a 2004) e o verão (1997, 2005 e 2006) e as menores no inverno. (Fig. 23). Em 1997, foram registradas as menores capturas em número de indivíduos (150), enquanto que 2001 foi o ano responsável pelas maiores contribuições (371) (Fig. 23). Apesar destas variações, não foram observadas diferenças significativas (F7-23= 0,935; p≥0,05) na abundância da espécie entre os anos de coleta. O outono (2001 e 2003) e o verão (2005 e 2006) foram os responsáveis pelas maiores biomassas, enquanto que a primavera (2001 e 2005) e o inverno (2005 e 2006) apresentaram as menores capturas em peso (Fig. 23). Em geral, os maiores rendimentos foram registradas em 2001 e os menores em 2002, entretanto, assim como para a abundância, não foram observadas diferenças significativas (F5-18= 0,678; p≥0,05) entre os oito anos de coleta. 41 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Machos Fêmeas % N=109 40 35 Juvenis 30 % 35 Adultos Juvenis 30 25 25 20 20 15 15 10 10 5 N=41 1997 40 1997 Adultos 5 0 0 2 3 4 5 6 7 8 9 10 11 12 13 % N=234 2001 40 Wid (c m) 2 3 4 5 6 7 8 9 % 35 30 30 25 25 20 20 15 15 10 10 5 5 11 12 13 Wid (cm) N=137 2001 40 35 10 0 0 2 3 4 5 6 7 8 9 10 11 12 13 % N=164 40 2 Wid (cm) 3 4 5 6 7 8 9 35 35 30 30 25 25 20 20 15 15 10 10 5 5 0 11 12 13 % Wid (c m) N=106 40 2002 10 2002 0 2 3 4 5 6 7 8 9 10 11 12 13 % Wid (c m) N=159 40 2 3 4 5 6 7 8 9 35 35 30 30 25 25 20 20 15 15 10 10 5 11 12 13 % Wid (cm) N=82 40 2003 10 2003 5 0 0 2 3 4 5 6 7 8 9 10 11 12 13 % Wid (cm) N=192 40 2 3 4 5 6 7 8 9 11 12 13 % 35 35 30 30 25 25 20 20 15 15 10 10 Wid (cm) N=110 40 2004 10 2004 5 5 0 0 2 3 4 5 6 7 8 9 10 11 12 13 % Wid (cm) N=160 40 2 3 4 5 6 7 8 9 35 35 30 30 25 25 20 20 15 15 10 10 5 5 0 11 12 13 % Wid (cm) N=116 40 2005 10 2005 0 2 3 4 5 6 7 8 9 10 11 12 13 % N168 2006 40 Wid (cm) 2 3 4 5 6 7 8 9 11 12 13 35 30 30 25 25 20 20 15 15 Wid (cm) N=82 2006 40 35 10 10 % 10 5 5 8,3 0 2 3 4 5 6 7 8 9 7,5 0 10 11 12 13 Wid (cm) 2 3 4 5 6 7 8 9 10 11 12 13 Wid (cm) Figura 22. Distribuição de freqüência por classe de largura de C. danae, durante os anos de 1997 a 2006. Linha tracejada= L50. 42 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 2003 N Biomassa 1997 N 120 N Biomassa N=150 100 5000 80 4000 60 3000 40 2000 20 1000 0 0 N=241 120 100 80 60 Verão Outono Inverno N Primavera 40 20 Verão Estações Outono Inverno Primavera 2004 2000 0 Estações Biomassa N 120 Biomassa N=270 100 N 5000 80 4000 60 3000 40 2000 20 1000 N=302 120 100 80 60 0 40 20 0 Verão Outono Inverno Primavera 2001 Verão Estações Outono Inverno Primavera Biomassa 2005 Biomassa N N Biomassa N=371 4000 120 5000 100 4000 80 3000 N Biomassa N 5000 N=276 40 1000 20 0 Verão Outono Inverno Primavera 0 Estações 80 3000 60 2000 40 1000 20 0 Verão Outono Inverno Primavera N N N Biomassa 5000 N=270 4000 Biomassa 120 5000 100 4000 80 3000 N N=276 40 1000 20 0 Verão Outono Inverno Primavera 0 Estações 120 100 80 3000 60 60 2000 0 Estações Biomassa 2006 Biomassa 2002 120 100 60 2000 0 Estações 2000 40 1000 20 0 Verão Outono Inverno Primavera 0 Estações Figura 23. Variação sazonal da abundância e biomassa de C. danae capturados no Saco dos Limões, durante 1997 a 2006. 43 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 5.7 - Similaridade da carcinofauna entre os anos de coleta De acordo com o índice de Jaccard, a similaridade entre os anos de amostragem variou de 31,25 a 76,92% (Tab. III), sendo que os maiores valores ocorreram entre os períodos de 2002-2004 (76,92%) e 2005-2006 (75,00%), enquanto que os menores índices foram registrados entre 2000-2006 (31,25%) e 1997-2005 (33,33%). Tabela III - Similaridade da carcinofauna nos oito anos de coleta. 1997 2000 62,50 2000 2001 45,45 72,73 2001 2002 45,45 46,15 46,67 2002 2003 41,67 53,85 64,29 64,29 2003 2004 41,67 42,86 53,33 76,92 71,43 2004 2005 33,33 35,29 36,84 36,84 50,00 42,11 2005 2006 38,46 31,25 41,18 50,00 47,06 47,06 75,00 2006 5.8 - Associação faunística Considerando-se a abundância anual dos 21 táxons capturados e utilizando a análise de Cluster, foi possível separar os anos de coleta em três grupos a um nível de distância de junção “4” (Fig. 24). O grupo I, formado pelos anos de 1997, 2000, 2003 e 2002, onde 1997 apresentou as menores capturas em número de indivíduos, distanciando-se um pouco do intervalo de 2000, 2003 e 2004, o qual representou um período de sucessão ecológica, com abundâncias intermediárias (Tab. II e Fig. 24). O grupo II, composto pelos anos de 2001 e 2004, que contribuíram com as maiores diversidades e o grupo III, representado pelos últimos anos de amostragem, onde foram registradas as maiores capturas em número de indivíduos e espécies, assim como as menores equitabilidades, indicando que o ambiente voltou a apresentar características comuns à áreas de baia (Tab. II e Fig. 24). 44 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Método de Ward Distância Euclidiana 1997 2000 I 2003 2002 II 2001 2004 2005 III 2006 2 3 4 5 6 7 8 9 Distância de junção Figura 24. Dendrograma baseado nos dados de abundância das espécies de crustáceos nos oito anos de amostragens. A análise de Cluster, aplicada aos 21 táxons encontrados na região da Baía-Sul, gerou a presença de três agrupamentos a um nível de distância de junção “10” (Fig. 25). No grupo I, composto por 12 espécies, registraram-se as de ocorrência ocasional, as quais apresentaram baixas abundâncias ao longo do período de estudo (Tab. II e Fig. 25). O grupo II foi composto por cinco espécies, que alternaram entre as ocorrências ocasional e acessória, com abundâncias intermediárias, enquanto o grupo III, foi formado pelas espécies constantes, responsáveis pelas maiores capturas ao longo dos oito anos de coleta (Tab. II e Fig. 25). Método de Ward Distância Euclidiana I II III Artemesia longinaris Lopagurus loxochelis Callinectes bocourti Charybdis hellerii Hepatus pudibundus Callinectes sapidus Libinia spinosa Sycione dorsalis Squilla sp Persephona punctata Portunus spinimanus Persephona lichtensteinii Xiphopenaeus kroyeri Pleoticus muelleri Rimapenaeus constrictus Alpheus spp. Callinectes ornatus Litopenaeus schmitti Farfantepenaeus paulensis Callinectes danae Farfantepenaeus brasiliensis 0 10 20 30 40 50 60 70 80 90 Distância de junção Figura 25. Dendrograma do agrupamento das 20 espécies de crustáceos capturadas na região do Saco dos Limões, entre 1997 a 2006. 45 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 5. 9 - Possíveis impactos da dragagem A tabela IV apresenta uma síntese dos efeitos das atividades de dragagem sobre a comunidade de crustáceos do Saco dos Limões. No período de 1997 (logo após o término da obras), foram observadas as menores abundâncias na baía, com apenas 978 exemplares capturados, refletindo um momento de grande stress para a carcinofauna (Tab. IV e Fig. 4). Tais instabilidades possivelmente contribuíram para que poucas espécies (cinco) fossem capazes de habitar a região, sendo registradas as menores diversidades (Tab. IV e fig. 8). Por outro lado, foi durante este momento, onde ocorreram as maiores equitabilidades, pois apesar da existência de poucas espécies, não foi verificada uma dominância entre elas (Tab. IV e Fig. 12). O período entre os anos de 2000 a 2004 foi caracterizado como um período de sucessão ecológica, onde foram observadas as maiores oscilações nos índices de diversidade e equitabilidade, associadas às mudanças na composição da comunidade carcinofaunística (Tab II e IV), bem como na dominância das espécies, sendo observado um incremento nas capturas de F. brasiliensis, enquanto que L. schimitti deixou de ser a espécie dominante (Fig. 3). Dez anos às atividades de dragagem, foi observado um incremento no número de espécies (14) e abundância de exemplares (2896), indicando um provável equilíbrio da carcinofauna, com alta riqueza específica e dominância de um pequeno grupo, resultando nas mais baixas equitabilidades registradas (Tab. IV). Além destes efeitos, foram observadas mudanças significativas na abundância de F. brasiliensis ao longo do período de estudo, e uma redução no tamanho dos exemplares das espécies F. paulensis e L. schimitti. (Fig. 17, 18 e 20). Apesar destas modificações observadas na composição e estrutura da carcinofauna, não se pode afirmar que foram resultantes das atividades de dragagem, em virtude da natureza dinâmica do ambiente em estudo, da ausência de informações pretéritas, bem como, do desenho amostral ineficiente, onde a área I caracterizada como um controle, não possuía as mesmas características das demais, dificultando a interpretação correta dos dados. 46 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Tabela IV. Síntese dos possíveis impactos das atividades de dragagem sobre a carcinofauna do Saco dos Limões. 1997 Sobre efeito da dragagen Número de espécies 5 Abundância 978 Diversidade 0,58 Equitabilidade 0,77 2000-2004 Intermediário 8 - 12 1182 - 1982 1,39 - 1,62 0,58 - 0,68 2006 Sem efeito da dragagen 14 2896 1,5 0,45 6. DISCUSSÃO 6.1 - Caracterização quali-quantitativa da carcinofauna Levantamentos faunísticos regionais, voltados à composição qualiquantitativa de invertebrados marinhos são de fundamental importância para uma melhor compreensão da estrutura, funcionamento e variabilidade natural das comunidades bentônicas, constituindo um requisito fundamental no estabelecimento de programas de monitoramento ambiental, além de servirem como base para a conservação da biodiversidade (SANTOS et al. 2000; MANTELATTO et al. 2004; BRAGA et al. 2005). No presente trabalho foi registrada a ocorrência de 21 espécies de crustáceos, pertencentes a 16 gêneros e 10 famílias, enquanto que BRANCO (1998a, b) em estudos no Manguezal do Itacorubí, situado na Baía-Norte da ilha de Santa Catarina, citou a presença de 19 espécies, distribuídas em seis famílias. Nos manguezais do Rio Camboriú e da Baía da Babitonga, a carcinofauna esteve representada por 17 e 26 espécies respectivamente (RODRIGUES et al. 1994; BRANCO et al. 1998a). TEIXEIRA & SÁ (1998) analisando a abundância de macrocrustáceos decápodas nas áreas rasas do complexo lagunar Mundaú/Manguaba, Alagoas, constataram a presença de 15 espécies em quatro famílias, enquanto que para a Baía de Ubatuba, no litoral Norte de São Paulo, MANTELATTO & FRANSOZO (2000) levantaram 50 espécies de Brachyura, distribuídas em 10 famílias. Para o Estado do Rio Grande do Sul, SANTOS et al. (2000), com auxílio de rede de coca, observaram 11 espécies de crustáceos, distribuídos em cinco famílias ao longo da Lagoa do Peixe, ao passo que no estuário do Arroio Chuí, PEREIRA et al. (1998) registraram nove espécies pertencentes a cinco famílias. 47 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 As diferenças encontradas na composição da carcinofauna entre os locais comparados, provavelmente estão relacionados com as características hidrológicas (NAKAGAKI et al. 1995), a heterogeneidade de habitats (SANTOS et al. 2000; MANTELATTO et al. 2004), a extensão e o estado de conservação destes ambientes (RODRIGUES et al. 1994; BRANCO et al. 1998a), bem como, aos esforços e metodologias de captura diferenciados (SANTOS et al. 2000; MANTELATTO et al. 2004). As famílias Penaeidae e Portunidae foram as que apresentaram as maiores riquezas específicas, além de contribuírem com as maiores porcentagens em número de crustáceos capturados, o que tem sido observado em levantamentos realizados por SOUZA-SAMPAIO & FAUSTO-FILHO (1984), MOREIRA et al. (1988), NEGREIROS-FRANSOZO et al. (1992), RODRIGUES et al. (1994), NAKAGAKI et al. (1995), BRANCO et al. (1998a), SEVERINORODRIGUES et al. (2002), BRANCO & FRACASSO (2004b), BRAGA et al. (2005). Os camarões peneídeos constituem-se em um dos recursos pesqueiros mais freqüentes e explorados nas regiões costeiras subtropicais e tropicais em todo o mundo, assim como na costa brasileira (D’INCAO, 1991, VALENTINI et al. 1991; ALBERTONI et al. 2003; CASTRO et al. 2005; GUSMÃO et al. 2005; LEITE & PETRERE, 2006 a; LEITE & PETRERE, 2006 b; ROBERT et al. 2007). Nas regiões Sudeste e Sul do Brasil, as frotas artesanais e industriais atuam principalmente sobre os estoques das espécies mais lucrativas, tais como os camarões-rosa (Farfantepenaeus brasiliensis e Farfantepenaeus paulensis), o branco (Litopenaeus schimitti) e o sete barbas (Xiphopenaeus kroyeri), sendo que recentemente, o camarão barba-ruça (Artemesia longinaris Bate, 1888) e o Solenoceridae (Pleoticus muelleri Bate, 1888) vêem ganhando importância comercial (VALENTINI et al. 1991; DUMOND & D’INCAO, 2004; FRANSOZO et al. 2004; GRAÇA-LOPES et al. 2007). Tais espécies foram encontradas na BaíaSul, ao longo dos oito anos de amostragem, onde F. brasiliensis, L. shimitti e F. paulensis, destacaram-se entre as mais abundantes, o que tem sido observado nos estudos de SOUZA-SAMPAIO & FAUSTO-FILHO (1984), CHAGASSOARES et al. (1995), BRANCO & VERANI (1998a,b), SANTOS & COELHO (1998), ROBERT et al. (2007). 48 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Segundo SEVERINO-RODRIGUES et al. (2001), grande parte da fauna bentônica associada às águas estuarinas está constituída por crustáceos braquiúros, especialmente os Portunidae. Essa dominância pode ter contribuído na popularização da pesca dos siris (Callinectes), tornando-a uma das atividades mais antigas no litoral brasileiro e suportando atualmente, diversas comunidades que sobrevivem de sua comercialização (BARRETO et al. 2006). Atualmente são descritas 14 espécies de Callinectes, das quais oito ocorrem no Atlântico ocidental, três no oriental e três no Pacífico oriental (WILLIANS, 1974). A região Sul do Brasil é caracterizada pela presença marcante de três espécies, Callinectes sapidus Rathbun, 1896, C. danae e C. ornatus Ordway, 1863 (MELO, 1996) e de duas de menor importância C. bocourti A. Milne Edwards 1879 e C. exasperatus Gertaecker, 1856 (WEBER et al. 2003). LOEBMANN & VIEIRA (2006), analisando o impacto da pesca do camarão-rosa F. paulensis nas assembléias de peixes e siris do Parque Nacional da Lagoa do Peixe (RS), destacaram o siri azul C. danae como abundante, sendo considerado uma “praga” por danificar as redes de camarão e por não possuir aproveitamento de sua carne pelos pescadores da região. Para RODRIGUES et al. (1994), C. danae ocorreu em maior freqüência dentre as espécies de Callinectes no manguezal do Rio Camboriú, sendo aproveitado como recurso alimentar pelas populações ribeirinhas, o que foi igualmente verificado para Lagoa da Conceição (BRANCO 1998a), manguezal do Itacorubí (BRANCO & MASUNARI 2000) e manguezal da Baía da Babitonga (BRANCO et al. 1998a). No ecossistema Saco da Fazenda, Itajaí, (SC), esta espécie em conjunto com o siri Callinectes sapidus contribuíram com as maiores capturas para a carcinofauna (BRANCO & FREITAS-JÚNIOR, no prelo). Para a região do Saco dos Limões, C. danae foi a espécie de Callinectes dominante nas capturas, sendo que C. sapidus ocorreu apenas de forma acidental. Tal fato provavelmente está associado à estratificação espacial diferenciada entre as duas espécies, onde C. sapidus habitaria as áreas mais internas dos manguezais, ficando fora do alcance do petrecho de pesca, ao passo que C. danae estaria distribuído ao longo da baía, o que é corroborado por PITA et al. (1985b), MELO (1996) e SEVERINO-RODRIGUES et al. (2001), 49 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 bem como, por relatos de pescadores locais, os quais estariam capturando exemplares de C. sapidus ao longo do manguezal do Rio Tavares. No presente trabalho foi registrada a ocorrência do portunídeo IndoPacífico Charybdis hellerii. Esta espécie exótica foi documentada pela primeira vez para a costa brasileira por CARQUEIJA & GOUVÊA (1996) no Estado do Alagoas, tendo sido encontrado na costa do Estado de São Paulo (NEGREIROS-FRANSOZO, 1996), no Rio de Janeiro (TAVARES & MENDONÇA JR, 1996), em Santa Catarina (MANTELATTO & DIAS, 1999), no Rio Grande do Norte (FERREIRA et al. 2001) e no litoral de Pernambuco (COELHO & SANTOS, 2003). Acredita-se que C. hellerii tenha sido introduzido no Hemisfério ocidental, a partir do transporte de larvas, pela água de lastro de navios (MANTELATTO & DIAS , 1999; NUCCI et al. 2001; COELHO & SANTOS , 2003), sendo que em algumas localidades, como no litoral da Bahia, a espécie já possui uma população estabelecida (MANTELATTO & GARCIA, 2001; ALMEIDA et al. 2006), provavelmente em função da competição por alimento e habitat com os outros portunídeos nativos, da inexistência de predadores naturais e do não aproveitamento deste pela pesca artesanal (ALMEIDA et al. 2006). Desta maneira, a presença de C. hellerii na Baía-Sul é preocupante, havendo a necessidade de uma adequação do esforço e metodologia de captura, na tentativa de verificar se a espécie possui uma população estabilizada na baía, o que poderia causar uma grave modificação na composição da fauna bentônica. Segundo DAY et al. (1989), estuários e baías são ambientes dinâmicos, onde as rápidas mudanças físico-químicas exigem muita energia dos organismos, dificultando a sobrevivência de alguns grupos. Desta forma, poucas são as espécies residentes que completam seus ciclos de vida nestes ecossistemas, a grande maioria são visitantes ocasionais de origem marinha (SANTOS et al. 2002). Essa tendência foi observada na Baía-Sul, sendo corroborado por BRANCO et al. (1998b), MANTELATTO & FRANSOZO (2000), SEVERINO-RODRIGUES et al. (2002) e ROBERT et al. (2007). Para MANTELATTO et al. (2004) e BRAGA et al. (2005), a ocorrência de espécies ocasionais sugere que estes crustáceos estariam em trânsito pela área de estudo, ou possivelmente, distribuídas em áreas restritas destes ambientes. 50 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 A temperatura da água de superfície no Saco dos Limões apresentou-se dentro dos padrões de sazonalidade esperado para a região, com os maiores valores nos meses de verão e os menores no inverno (MATSURA, 1986). Padrão semelhante foi encontrado para a salinidade da água de superfície, com valores típicos de zonas costeiras (MATSURA, 1986), onde o verão contribuiu com os maiores valores, enquanto o outono apresentou os menores teores. A cobertura sedimentar predominante ao longo do ambiente foi composta por lama terrígena com elevadas concentrações de matéria orgânica, com presença localizada de areia litoclástica fina, na área caracterizada como “buraco da draga”, durante o início das atividades de monitoramento. De acordo com BOSHI (1969) e GUERRA-CASTRO et al. (2007), diversos fatores vem sendo atribuídos como responsáveis pelas variações nas abundâncias de espécies de crustáceos ao longo de seus ambientes. Para BRANFORD (1981) a textura do sedimento, bem como o conteúdo de matéria orgânica, desempenham um importante papel na ecologia dos penaeidae, uma vez que o primeiro estaria relacionado com a capacidade da espécie se enterrar para fugir dos predadores, enquanto que o material orgânico refletiria a disponibilidade de alimento. Para PEREZ-CASTAÑEDA & DEFEO (2001), estas oscilações estão mais relacionadas às influências abióticas de temperatura e salinidade, o que tem sido demonstrado nos trabalhos de SIGNORET (1974), SPIVAK (1997), TEIXEIRA & SÁ (1998), CHACUR & NEGREIROS-FRANSOZO (2001) e LOEBMAM &VIEIRA (2006). Além destes fatores, o período reprodutivo, as taxas de mortalidade, assim como, o padrão de migração das espécies, podem contribuir para as variações encontradas no número de indivíduos capturados (JOHNSON, 1985; DITTEL & EPIFANIO, 1990; FORBES & CYRUS, 1991; SHANKS, 1998; TANKERSLEY et al. 1998; FERNANDES et al. 2002; PEREZ-CASTAÑEDA & DEFEO, 2005), sendo de fundamental importância a compreensão desses parâmetros para interpretação das oscilações nas abundâncias da carcinofauna. Na região do Saco dos Limões, a ocorrência de elevadas quantidades de zoea durante os meses mais quentes do ano, provenientes de desovas ocorrentes no ambiente costeiro adjacente (RESGALLA JR, 2001), associada com as altas temperaturas registradas durante o verão e a disponibilidade de alimento, principalmente matéria orgânica, que tem sido referida como 51 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 importante item na dieta de siris (BRANCO & VERANI, 1997; BRANCO et al. 2002) e camarões (BRANCO & JUNIOR, 2001), podem ter contribuído para as maiores abundâncias registradas. BRANCO et al. (1998b), em estudos com os macroinvertebrados da Armação do Itapocoroy, encontraram as maiores abundâncias, durante o período da tarde e a noite, corroborando com os dados do presente estudo. Segundo NEIVA (1966) e SANTOS et al. (2006), é comum o hábito dos crustáceos permanecerem enterrados durante o dia para evitar a predação, sendo mais ativos a noite, onde normalmente são capturados pelas redes de pesca. No entanto, SANTOS & SOUZA-FREITAS (2004) destacam que em áreas onde ocorrem altas concentrações de partículas sólidas em suspensão, que tornam a água mais turva, podem-se observar elevadas capturas diurnas. De acordo com SANTOS (2000), o índice de diversidade de Shannom (H’) indica o grau de complexidade da comunidade que se estuda, sendo influenciado pelo número de espécies, assim como, pelo número de indivíduos dentro de cada espécie. No presente trabalho, esse índice variou de 0,79 a 1,70, sendo inferior ao encontrado por MANTELATTO & FRANSOZO (2000) (1,10 a 2,06) na baia de Ubatuba e por MANTELATTO et al. (2004) (1,86 a 3,54) no infralitoral arenoso e rochoso da ilha de Anchieta, SP. Além das diferenças na extensão e nas características hidrológicas destas regiões, a heterogeneidade de habitats em Ubatuba e na ilha de Anchieta, provavelmente contribuiu para uma maior coexistência de diferentes espécies nestes locais, resultando nas maiores diversidades observadas (NUCCI et al. 2001; SANTOS et al. 2000; BRAGA et al. 2005). Em geral as maiores diversidades no Saco dos Limões ocorreram durante os meses de outono e inverno, o que segundo MANTELATTO & FRANSOZO (2000), está possivelmente relacionado às variações sazonais na abundância das espécies dominantes, em conjunto com as mudanças nas condições ambientais. Já para BRANCO et al. (1998b), estas oscilações estariam vinculadas ao grande número de espécies com ocorrência ocasional e sazonal que transitam no ambiente de estudo. O índice de equitabilidade de Pielou (J’) obtido no presente estudo variou de 0,36 a 0,93, enquanto que MANTELATTO et al. (2004) registraram uma variação de aproximadamente 0,65 a 1,00. Assim como para a diversidade, o 52 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 outono e o inverno contribuíram com os maiores índices, indicando uma distribuição mais uniforme dos indivíduos na área de estudo durante os meses mais frios. Segundo BRANCO & VERANI (2006), informações sobre a análise de Cluster aplicada às comunidades de crustáceos e peixes são raros na literatura nacional. Neste estudo, as associações obtidas apresentaram-se estruturadas em função da abundância e ocorrência das espécies. As dominantes numericamente, como L. schimitti, F. brasiliensis, F. paulensis e C. danae, de ocorrência constante nas coletas, formaram um grupo independente dos demais taxa, enquanto que os dois maiores agrupamentos reuniram as espécies das categorias ocasional e acessória. O conhecimento do tamanho de primeira maturação gonadal é fundamental para a administração racional de um estoque sujeito a exploração, pois fornece a informação básica para determinação do tamanho mínimo de captura e dimensionamento das malhas das redes (BRANCO, 2005). Além disso, a sobreposição desse tamanho com as curvas de distribuição de freqüência de comprimento permitem determinar o estrato da população que a pesca vem atuando. Partindo deste pressuposto, foi possível verificar que as populações dos camarões-rosa F. brasiliensis e F. paulensis, bem como a do camarão-branco L. schimitti foram constituídas predominantemente por indivíduos juvenis na região do Saco dos Limões, com uma pequena participação dos adultos, o que está de acordo com o encontrado por CHAGASSOARES et al. (1995), BRANCO & VERANI (1998a) e SANTOS & SOUZAFREITAS (2004). Segundo D’INCAO (1991), a reprodução do gênero Farfantepenaeus ocorre na plataforma continental em profundidades entre 40 e 100 metros, com a liberação de ovos bentônicos, que após permanecerem por vários estágios larvais planctônicos, penetram em águas mais calmas e ricas da região estuarina, onde ocorre o crescimento, com migração (após aproximadamente 5 meses) para as zonas de reprodução no mar. Entretanto, este mesmo autor destaca que alguns indivíduos podem permanecer no estuário até a idade de 10 meses, onde estes camarões retardatários formariam pequenos cardumes para emigração, até o desaparecimento total da população para fechar o ciclo de vida em mar aberto. Deste modo, a presença de indivíduos adultos no Saco dos 53 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Limões, provavelmente está relacionada aos retardatários que ainda não completaram o seu ciclo de vida. Para o siri azul C. danae, a análise das distribuições de comprimento em conjunto com o tamanho de primeira maturação revelou uma maior paridade entre as porções juvenil e adulta que habitam a baía. No entanto, dentre os indivíduos adultos, foi observado uma estratificação diferenciada entre os sexos, com uma pequena contribuição das fêmeas de maior tamanho. Segundo BRANCO & MASUNARI (2000), a ausência de fêmeas adultas nestes ambientes está relacionada ao próprio ciclo reprodutivo da espécie, onde o comportamento de corte e cópula ocorreria dentro do sistema estuarino, sendo que os machos adultos permaneceriam no ambiente, enquanto que as fêmeas ovígeras migrariam para águas mais salinas para o desenvolvimento e dispersão das larvas. De acordo com TANKERSLEY et al. (1998), para C. sapidus da Baía de Beaufort, estas migrações ocorrem durante as marés de vazante noturnas e estão vinculadas à deslocamentos ativos ao longo da coluna d’água, a partir da percepção de mudanças nas características físico-químicas das massas d’água. A ocorrência de casais em cópula durante o período de estudo reforça a hipótese de que a espécie apresenta atividade reprodutiva dentro do Saco dos Limões, entretanto a baixa incidência de fêmeas ovígeras indica que C. danae provavelmente completa seu ciclo de vida fora do ecossistema Baía-Sul, o que tem sido observado nos trabalhos de PITA et al. (1985b) no complexo baía estuário de Santos e São Vicente (SP), CHACUR & NEGREIROS-FRANSOZO (2001) na Baía de Ubatuba (SP), BAPTISTA-METRI et al. (2005) no Balneário Shangri-lá, Pontal do Paraná (PR) e BRANCO & MASUNARI (2000) na Lagoa da Conceição (SC). Os dados obtidos no presente estudo indicam a região do Saco dos Limões como uma área de grande importância para o estabelecimento de diversas espécies de crustáceos, onde as famílias Penaeidae e Portunidae destacaram-se entre as mais abundantes, além de possuírem relevante interesse comercial. Considerando a grande abundância de indivíduos juvenis nas coletas, verificou-se que a baía atua como um local de berçário e crescimento para os peneídeos, além de contribuir como ambiente de reprodução para os portunídeos, onde provavelmente a eclosão das larvas 54 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 ocorre na região costeira adjacente, com subseqüente migração destas para áreas de crescimento dentro da baía onde reiniciam o ciclo. 6.2 - Impactos das operações de dragagem A atividade de dragagem em áreas estuarinas constitui um impacto comum, seja para facilitar a entrada de navios em portos ou para execução de obras costeiras (BEMVENUTI et al. 2005). Em países como os Estados Unidos, bem como em diversos locais da Europa, esta prática vem sendo considerada como um dos maiores problemas no gerenciamento da zona costeira (VON DOLAH et al. 1984; WIDDOWS et al. 2006). Dragagens promovem a remoção da camada superficial do sedimento, causando mudanças na estrutura e dinâmica das comunidades bentônicas, assim como, dispersão na coluna d’água de poluentes eventualmente retidos no fundo (VON DOLAH et al. 1984; MARQUES et al. 1993; TORRES, 2000; NEWELL et al. 2003; NEWELL et al. 2004; ANGONESI et al. 2006). No entanto, podem contribuir na dinâmica e circulação dos estuários, possibilitando a recolonização e o ingresso de novas espécies (BRANCO, 2000). Durante os oito anos de amostragem, foram registradas alterações na estrutura de crustáceos do Saco dos Limões, o que foi evidenciado pelos baixos valores de similaridade obtidos entre os primeiros e os últimos anos de coleta, bem como, pela presença de três agrupamentos distintos envolvendo os períodos de 1997-2000-2003-2002, 2001-2004 e 2005-2006. Em geral, a abundância mostrou-se reduzida durante o início do monitoramento ambiental, o que possivelmente esteve associado à grande instabilidade promovida pela intensificação das obras de dragagem no verão de 1997, resultando em altas taxas de mortalidade (FACIMAR, 1998; RESGALLA JR, 2001). Estas perdas provavelmente foram ocasionadas devido à ação mecânica da draga, na medida em que os organismos poderiam ter sido sugados por esta; pelo entupimento das brânquias gerado pelo excesso de material em suspensão (FACIMAR, 1998); ou por uma redução da disponibilidade de alimento, uma vez que suas presas constituem-se de organismos sésseis ou com pequeno poder de locomoção, estando assim, mais vulneráveis aos equipamentos da draga. Tal fato, também foi verificado nos 55 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 trabalhos de VON DOLAH et al. (1984) e de NEWELL et al. (2003 e 2004), os quais destacam que em áreas sujeitas às atividades de dragagem, os macrocrustáceos em geral, são parcialmente afetados, pois sua mobilidade permite a fuga da região de impacto, sendo a infauna, composta por poliquetas, oligoquetas, moluscos e pequenos crustáceos, a mais prejudicada. Outro fator que possivelmente contribuiu para o reduzido número de crustáceos observados em 1997 foi a baixa ocorrência de zoea neste período, o que segundo RESGALLA JR (2001) esteve associado às elevadas concentrações de material em suspensão, com baixo conteúdo orgânico limitando a produção primária no ambiente. Quando analisado a variação do número de exemplares de F. brasiliensis, F. paulensis, L. schimitti e C. danae ao longo do período de estudo, de modo isolado, verificou-se que apenas para F. brasiliensis foram detectadas diferenças significativas nas abundâncias entre os anos de coleta, com os menores valores no início das amostragens, indicando que as espécies responderam de forma diferenciada ao impacto. Apesar das grandes mortalidades observadas durante o início da amostragem, foi verificada também uma recuperação da carcinofauna nos anos subseqüentes, corroborada pelo incremento na abundância e no número de espécies, bem como pelas variações nos índices de diversidade e equitabilidade. As menores diversidades registradas em 1997, provavelmente foram um reflexo da baixa riqueza específica, vinculada ao estado de stress ao qual a baía se encontrava. Entretanto, quando analisado o índice de equitabilidade, verificou-se que este foi o período que contribuiu com os maiores valores, pois apesar de poucas espécies estarem presentes, estas ocuparam de forma uniforme o ambiente. Com a diminuição dos fatores impactantes nos anos seguintes, houve o desenvolvimento de uma sucessão ecológica, a partir do ingresso de novas espécies, o que refletiu em grandes oscilações nos índices de diversidade e equitabilidade, bem como na composição da carcinofauna. Ao final deste período de sucessão, o ecossistema possivelmente voltou ao equilíbrio, apresentando alta riqueza de espécies e dominância de um pequeno grupo, o 56 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 que de acordo com STONER (1986) e DAY et al. (1989) constitui-se em uma característica comum de ambientes estuarinos e de baía. Com relação às áreas de coleta, o desenho amostral proposto pelo Monitoramento Ambiental abrangeu cinco locais dentro da região do Saco dos Limões e um mais externo (área I), por estar fora da região de impacto das atividades de dragagem. Desta forma, era de se esperar que as maiores abundâncias fossem registradas neste local. A ausência de dados pretéritos e durante a realização da dragagem, bem como o uso de valores médios para caracterizar as áreas, dificultou a interpretação exata dos resultados. Sendo assim, as áreas VI e V foram as que apresentaram o maior número de organismos capturados, o que provavelmente esteve mais relacionado com o padrão de distribuição dos crustáceos dentro da baía, do que com as operações de dragagem. A proximidade dessas áreas com o manguezal do Rio Tavares, bem como com a Foz do Rio Defuntos, pode ter contribuído para o aporte de alimento para estes locais, o que somado às condições mais abrigadas, propiciou um ambiente favorável ao crescimento dos juvenis, refletindo nas maiores abundâncias registradas. Por outro lado, as maiores velocidades de corrente na área I (MOLLERI & BONETTI, 2005), possivelmente estiveram relacionadas à entrada e saída de indivíduos na Baía-Sul. Padrão semelhante foi encontrado por BRANCO & VERANI (1998a) e BRANCO & MASUNARI (2000) para as populações de siris e camarões da Lagoa da Conceição. De acordo com ALBERTONI et al. (2003), mudanças nas condições ambientais na áreas de crescimento de peixes e crustáceos juvenis podem afetar o tamanho dos adultos de uma população. Desta forma, o acompanhamento da variação dos parâmetros biométricos das comunidades de crustáceos de uma determinada região é de fundamental importância (MOURA et al. 2003 ) quando se pretende verificar a existência de alterações na estrutura de populações submetidas à um impacto. No presente estudo, o monitoramento das distribuições de comprimento das espécies mais abundantes revelou alterações na estrutura de tamanho de L. schimitti e F. paulensis, enquanto que para C. danae e F. brasiliensis, foi observado um padrão de distribuição semelhante ao longo dos anos. 57 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Em geral, foi observada uma redução no comprimento dos exemplares, evidenciada pelas maiores contribuições das classes de menor tamanho em L. schimitti a partir de 2001 até o final do período de estudo, enquanto que para F. paulensis, embora tenha ocorrido uma semelhança nas contribuições das classes ao longo dos anos, em 2005 e 2006, o tamanho máximo atingido pelos exemplares foi menor. Em virtude da elevada variabilidade ambiental em regiões de estuários e baías, a avaliação da real magnitude dos impactos ambientais promovidos pelas dragagens torna-se dificultada (BEMVENUTI et al. 2005). Deste modo, as flutuações nos índices de abundância, diversidade, e equitabilidade e na estrutura de tamanho das populações encontradas neste estudo, podem também estar relacionadas ao próprio ciclo de vida das espécies. 7. CONSIDERAÇÕES FINAIS Este trabalho contribuiu para a compreensão da estrutura da carcinofauna do Saco dos Limões (Baía-Sul), identificando as espécies, caracterizando as flutuações sazonais e a distribuição espacial, além de avaliar os possíveis impactos resultantes das atividades de dragagem. A presença do Portunidae exótico Charybdis hellerii (A. Milne-Edwards 1867), é um fato importante a ser destacado, visto que em algumas regiões do país, essa espécie já possui populações estabelecidas. O método de captura empregado parece não ter sido muito eficiente na amostragem deste organismo, fazendo-se necessário a utilização de estratégias amostrais complementares para o entendimento de sua distribuição e abundância. O emprego de jererés ao longo do Saco dos Limões, abrangendo também as áreas internas dos manguezais, além de auxiliar nas capturas, contribuiria para testar a hipótese de que os siris Callinectes sapidus estariam restritos ao manguezal, e por isto, foram subestimados no presente estudo. Além disto, trabalhos abordando a bioecologia dos camarões Farfantepenaeus brasiliensis, F. paulensis, Litopenaeus schimitti e siris Callinectes danae, com amostragem mensal, seriam importantes para determinar o espectro alimentar, as possíveis rotas migratórias, locais de desova, bem como a dinâmica de entrada e dispersão das larvas na baía, 58 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 contribuindo para uma melhor compreensão do funcionamento do ecossistema Baía-Sul, além de servirem como uma ferramenta na gestão e conservação desse ambiente. 8. CONCLUSÕES - A carcinofauna do Saco dos Limões esteve representada por 21 espécies, distribuídas em 16 gêneros e 10 famílias, onde os Penaeidae e Portunidae contribuíram com o maior número de espécies, com o domínio de Farfantepenaeus brasiliensis, Litopenaeus schimitti, Farfantepenaeus paulensis e Callinectes danae. Em geral, as maiores abundâncias foram observadas nas áreas V e VI, durante os meses de verão, no período da noite. - A distribuição de comprimento das espécies dominantes, com os tamanhos de primeira maturação, demonstraram que carcinofauna do Saco dos limões esteve representada, principalmente por camarões juvenis e uma proporção equivalente de siris juvenis e adultos. - A análise das similaridades obtidas entre os anos de coleta revelou a existência de mudanças na composição da carcinofauna ao longo do período de estudo, com os menores valores ocorrendo entre 1997 e 2005, provavelmente em função das baixas abundâncias registradas no inicio das amostragens, devido à intensificação das atividades de dragagem. - As espécies F. brasiliensis, L. schimitti, F. paulensis e C. danae responderam de forma diferenciada aos impactos da dragagem, com redução do tamanho dos exemplares de L. shimitti e F. paulensis e alterações significativas na abundância de F. brasiliensis nos anos iniciais de dragagem, enquanto que para C. danae, não foram observadas mudanças na estrutura da população. 59 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 - Constatou-se uma recuperação da carcinofauna ao longo dos anos, a partir do incremento do número de indivíduos e espécies, bem como pelas variações observadas nos índices de equitabilidade e diversidade. - A avaliação da magnitude dos impactos ambientais foi dificultada em virtude da ausência de dados pretéritos, bem como pela natureza dinâmica do ambiente em estudo. Desta forma, os padrões observados, podem estar também relacionados ao próprio ciclo de vida das espécies. - Os dados obtidos demonstraram que o Saco dos Limões caracteriza-se como uma área berçário e de crescimento para camarões Penaeidae, servindo, também como ambiente de reprodução para os Portunidae, onde provavelmente a eclosão das larvas ocorra na região costeira adjacente, com subseqüente migração destas para o interior da baía, mantendo o ciclo de vida das espécies integrantes da carcinofauna. 9. REFERÊNCIAS BIBLIOGRÁFICAS. ABREU, J. Distribuição e Ecologia dos Decapoda numa Área Estuarina de Ubatuba. Bolm. Inst. Oceanogr., v.29, n.2, p. 1-3, 1980. ALBERTONI, E. F.; PALMA-SILVA, C. & ESTEVES, F.A. Larvae and Postlarvae of Penaeidae and Palaemonidae in Coastal lagoons of the North of Rio de Janeiro (Macaé, Rj). Rev. Brasil. Biol., v.59, n.1, p. 109-117, 1999. ALBERTONI, E. F.; PALMA-SILVA, C. & ESTEVES, F.A. Crescimento e fator de condição de Farfantepenaeus brasiliensis (Latreille) e F. Paulensis (PérezFarfante) (Crustacea, Decapoda, Penaeidae) em uma lagoa costeira tropical do Rio de Janeiro, Brasil. Revta. Bras. Zool., v.20, n.3, p. 409-418, 2003. ALMEIDA, A. O.; COELHO, P. A.; SANTOS, J. T. A. & FERRAZ, N. R. Crustáceos decápodos estuarinos de Ilhéus, Bahia, Brasil. Biota Neotropica, v.6, n.2, p. 1-20, 2006. ALMEIDA, A. O. ; COELHO, P. A. ; SANTOS, J. T. A. ; FERRAZ, N. R. . Crustáceos estomatópodos e decápodos da costa de Ilhéus, Bahia, Brasil. Atlântica, v. 20, p. 5-20, 2007. 60 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 ANGONESI, L. G.; BEMVENUTI, C. E. & GANDRA, M. S. Effects of dredged sediment disposal on the coastal marine macrobenthic assemblage in Southern Brazil. Braz. J. Biol., v.66, n.2A, p. 413-420, 2006. BAPTISTA-METRI, C.; PINHEIRO, M. A. A.; BLANKENSTEYN, A. & BORZONE. C. A. Biologia populacional de Callinectes danae Smith (Crustacea, Portunidae) no Balneário Shangri-Lá, Pontal do Paraná, Paraná, Brasil. Revta. Bras. Zool., v.22, n.2, p. 446-453, 2005. BARRETO, A. V.; LEITE, L. M. A. B.; AGUIAR, M. C. A. Maturidade sexual das fêmeas de Callinectes danae (Crustacea, Decapoda, Portunidae) nos estuários dos rios Botafogo e Carrapicho, Itamaracá-PE Brasil. Iheringia, v.96, n.2, p.141-146, 2006. BEMVENUTI, C. E.; ANGONESI, L. G. & GANDRA, M. S. Effects of dredging operations on soft bottom macrofauna in a harbor in the Patos Lagoon estuarine region of the Southern Brazil. Braz. J. Biol., v.65, n.4, p. 573-581, 2005. BRAGA, A. A.; FRANSOZO, A.; BERTINI, G. & FUMIS, P. B. Composition and abundance of the crabs (Decapoda Brachyura) off Ubatuba and Caraguatatuba, Northern Coast of São Paulo, Brasil. Biota Neotropica, v.5, n.2, p. 1-34, 2005 BRANCO, J. O. & MASUNARI, S. Crescimento de Callinectes danae Smith (Decapoda, Portunidae) da Lagoa da Conceição, Florianópolis, Santa Catarina, Brasil. Revta. Bras. Zool., v.9, n.1/2, p. 53-66, 1992. BRANCO, J. O. & VERANI, J. R. Dinâmica da alimentação Natural de Callinectes danae Smith (Decapoda, Portunidae) na Lagoa da Conceição, Florianópolis, Santa Catarina, Brasil. Revta. Bras. Zool., v.14, n.4, p. 10031018, 1997. BRANCO, J. O. Crustáceos decápodos do Manguezal de Itacorubí na Ilha de Santa Catarina, Brasil. In: SORIANO-SIERRA, E.F. & SIERRA, L. Ecologia e Gerenciamento do Manguezal de Itacorubí, 1998a. p. 139-144. BRANCO, J. O. Aspectos Ecológicos dos Brachyura (Crustacea: Decapoda) no Manguezal de Itacorubí, SC, Brasil. In: SORIANO-SIERRA, E.F. & SIERRA, L. Ecologia e Gerenciamento do Manguezal de Itacorubí, 1998b. p. 145-161. 61 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 BRANCO, J. O; HOSTIM-SILVA, M.; RODRIGUES, A. M. T.; CLEZAR, L.; RIBEIRO, G. C. & SOUZA, M. S. C. Proteção e Controle de Ecossistemas Costeiros: Manguezal da Baía da Babitonga. Brasília, Coleção Meio Ambiente IBAMA Série Estudos Pesca, 1998a. p. 49-58. BRANCO, J. O.; LUNARDON-BRANCO, M. J.; PERET, A. C.; SOUTO, F. X.; SCHVEITZER, R. & VALE, W. G. Associações entre macroinvertebrados e peixes demersais na Armação do Itapocoroy, Penha, SC, Brazil. Braz. Arch. Biol. Tech., v. 41,n.2, p. 268-277, 1998b. BRANCO, J. O. & VERANI, J. R. Aspectos Bioecológicos do Camarão- Rosa Penaeus brasiliensis LATREILLE (Natantia, Penaeidae) da Lagoa da Conceição, Florianópolis, Santa Catarina, Brasil. Revta. Bras. Zool., v.15, n.2, p. 345-351, 1998a. BRANCO, J. O. & VERANI, J. R. Estrutura populacional do Camarão- Rosa Penaeus paulensis LATREILLE (Natantia, Penaeidae) na Lagoa da Conceição, Santa Catarina, Brasil. Revta. Bras. Zool., v.15, n.2, p. 353-364, 1998b. BRANCO, J. O. Biologia do Xiphopenaeus kroyeri (Heller, 1862) (Decapoda: Penaeidae), análise da fauna acompanhante e das aves marinhas relacionadas a sua pesca, na região de Penha, SC, Brasil. 1999. 147f. Tese de Doutorado. Universidade de São Carlos, São Paulo, 1999. BRANCO, J. O. Avifauna associada ao estuário do Saco da Fazenda, Itajaí, SC, Brasil. Revta. Bras. Zool., v.17, p. 384 -394, 2000. BRANCO, J. O. & MASUNARI, S. Reproductive ecology of the blue crab, Callinectes danae Smith, 1869 in the Conceição Lagoon system, Santa Catarina isle, Brazil. Rev. Brasil. Biol., v.60, n.1, p. 17-27, 2000. BRANCO, J. O. & JUNIOR, H. C. M. Alimentação natural do camarão setebarbas (Xiphopenaeus kroyeri), na Armação do Itapocoroy, Penha, SC. Revta. Bras. Zool., v.18, n.1, p. 53-61, 2001. BRANCO, J. O.; LUNARDON-BRANCO, M. J.; VERANI, J. R.; SCHVEITZER, R.; SOUTO, F. X. & VALE, W. G. Natural diet of Callinectes ornatus Ordway, 1863 (Decapoda, Portunidae) in the Itapocoroy inlet, Penha, SC, Brazil. Braz. Arch. Biol. Tech., v.45, n.1, p. 35-40, 2002. 62 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 BRANCO, J. O. & FRACASSO, H. A. Biologia populacional de Callinectes ornatus (Ordway) na Armação do Itapocoroy, Penha, Santa Catarina, Brasil. Revta. Bras. Zool., v.21, n.1, p. 91-96, 2004a. BRANCO, J. O. & FRACASSO, H. A. Ocorrência e abundância da carcinofauna acompanhante na pesca do camarão sete-barbas, Xiphopenaeus kroyeri Heller (Crustacea, Decapoda), na Armação do Itapocoroy, Penha, Santa Catarina, Brasil. Revta. Bras. Zool., v.21, n.2, p. 295-301, 2004b. BRANCO, J. O.; MACHADO, I. F. & BOVENDORP, M. S. Avifauna associada à ambientes de influência marítima no litoral de Santa Catarina, Brasil. Revta. Bras. Zool., v.21, n.3, p. 459-466, 2004. BRANCO, J. O. Biologia e pesca do camarão sete-barbas Xiphopenaeus kroyeri (Heller) (Crustacea, Penaeidae), na Armação do Itapocoroy, Penha, Santa Catarina, Brasil. Revta. Bras. Zool., v.22, n.2, p. 1050-1062, 2005. BRANCO, J. O. & FRACASSO, H. A. A. Ocorrência e abundância de Rynchops niger Linnaeus, no litoral de Santa Catarina, Brasil. Revta. Bras. Zool., v.22, n.2, p. 430-432, 2005. BRANCO, J. O. & VERANI, J.R. Análise quali-quantitativa da ictiofauna acompanhante na pesca do camarão sete-barbas, na Armação do Itapocoroy, Penha, Santa Catarina. Revta. Bras. Zool., v.23, n.2, p. 381-391, 2006. BRANCO, J. O. & JÚNIOR, F. F. 2008. Análise quali-quantitativa dos crustáceos no ecossistema Saco da Fazenda, Itajaí, SC., ......p. In: Joaquim Olinto Branco; Maria José Lunardon-Branco & Valéria Regina Bellotto (Org.). Estuário do Rio Itajaí-Açú, Santa Catarina: caracterização ambiental e alterações antrópicas. Editora INSULAR, Florianópolis, SC., .....p. BRANFORD, J. R. Sediment and the distribution of Penaeid shrimp in the Sudanese Red Sea. Estuar. Coast. Shelf. Sci., v.13, p. 349-354, 1981. BOSCHI, E. E. Estudio biológico pesquero del camarón Artemesia longinaris Bate, de Mar del Plata. Boln. Biol. Mar., v.18, p. 1-47, 1969. CARQUEIJA, C. R. G. 7 GOUVÊA, E. P. A. A ocorrência, na costa brasileira, de um Portunidae (Crustacea, Decapoda), originário do Indo-Pacífico e Mediterrâneo. Nauplius, v.4, p. 105,112, 1996. 63 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 CASTRO, R. H.; COSTA, R. C.; FRANSOZO, A. & MANTELATTO, F. L. M. Population structure of the seabob shrimp Xiphopenaeus kroyeri (Heller, 1862) (Crustacea: Penaeoidea) in the littoral of São Paulo, Brazil. Scientia Marina, v.69, n.1, p. 105-112, 2005. CHACUR, M. M. & NEGREIROS-FRANSOZO. Spatial and seasonal distributions of Callinectes danae (Decapoda, Portunidae) in Ubatuba bay, São Paulo, Brazil. Journal of crustacean biology, v.21, n.2, p. 414-425, 2001. CHAGAS-SOARES, F.; PEREIRA, O. M. & SANTOS, E. D. Contribuição ao ciclo biológico de Penaeus schmitti BURKENROAD, 1936, Penaeus brasiliensis, LATREILLE, 1817 e Penaeus paulensis PÈREZ-FARFANTE, 1967, na região lagunar-estuarina de Cananéia, São Paulo, Brasil. B. Inst. Pesca, v.22, n.1, p. 49-59, 1995. COELHO, P. A. & SANTOS, M. C. F. Ocorrência de Charybdis hellerii (Milne Edwards, 1867) ( Custacea, Decapoda, Portunidae) no litoral de Pernanbuco. Bol. Técn. Cient. CEPENE, v. 11, n.1, p. 167-173, 2003. COELHO, P. A.; SANTOS, M. C. F. Siris do estuário do rio Una, São José da Coroa Grande, Pernambuco - Brasil (Crustacea, Decapoda, Portunidae).Bol. Técn. Cient. CEPENE, v. 12, n. 1, p. 187-194, 2004a. COELHO, P. A.; SANTOS, M. C. F.; FREITAS, A. E. T. S.; SILVA, A. C. C. D.; SANTOS, S. M. Crustáceos Decápodos coletados no estado de Sergipe Brasil. Bol. Técn. Cient. CEPENE, v. 12, n. 1, p. 81-90, 2004b. COLVOCORESSES, J. A. & MUSICK, J. A. Species associations and community composition of Middle Atlantic Bight continental shelf demersal fishes. Fish Bulletin, v.82, p. 295-313, 1984. COSTA, R. C.; FRANSOZO, A.; MANTELATTO, F. L. M. & CASTRO, R. H. Occurrence of shrimp species (Crustacea: Decapoda: Natantia: Penaeidea and Caridea) in Ubatuba bay, Ubatuba, SP, Brazil. Proceedings of the biological society of Washington, v.113, n.3, p. 776-781, 2000 CURI, P. R. Análise de agrupamento complementada com ordenação pelos componentes principais e análise de variância multivariada. Um exemplo biológico. Ciências e Cultura, São Paulo, v.37, n.6, p. 879-888, 1985. 64 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 DAY, J. W.; HALL, C. A.; KEMP, W. M.; YÁÑEZ-ARANCIBIA, A. Estuarine Ecology, New York: John Wiley & Sons, 1989. D’ INCAO. Pesca e biologia de Penaeus paulensis na Lagoa dos Patos, RS, Brasil. Atlântica, v.13, n.1, p. 159-169, 1991. DITTEL, A. I. & EPIFANIO, C. E. Seasonal and tidal abundance of crab larvae in a Tropical mangrove system, Gulf of Nicoya, Costa Rica. Mar. Ecol. Prog. Ser., v.65, p. 25-34, 1990. DUMONT, L. F. C. & D´INCAO. Estágios de desenvolvimento gonadal de fêmeas do camarão-barba-ruça (Artemesia longinaris – Decapoda: Penaeidae). Iheringia, v.94, n.4, p. 389-393, 2004. FACIMAR. Monitoramento ambiental na área de abrangência da Via Expresso, Florianópolis, SC. Segundo relatório semestral. Referente ao período entre Janeiro de 1997 e Janeiro de 1998. FACIMAR/UNIVALI, Setembro de 1998, Itajaí, SC, 1998. 80p. FERNANDES, L. D.; BONECKER, S. L. C. & VALENTIN, J. L. Dynamic of decapod crustacean larvae on the entrance of Ganabara bay. Braz. Arch. Biol. Tech., v.45, n.4, p.491-498, 2002. FERREIRA, A. C.; SANKARANKUTY, C.; CUNHA, I. M. C. & DUARTE, F. T. Yet another record of Charybdis hellerii (Milne Edwards, 1867) (Decapoda, Portunidae) from the Northeast of Brazil. Revta. Bras. Zool., v.18, n.1, p. 357358, 2001. FORBES, A. T. & CYRUS, D. P. Recruitment and origin of Penaeid prawn postlarvae in two south-east African estuaries. Estuar. Coast. Shelf. Sci., v.33, p. 281-289, 1991. FRANSOZO, A.; COSTA, R. C; CASTILHO, A. L. & MANTELATTO, F. L. Ecological distribution of the shrimp “camarão serrinha” Artemesia longinaris (Decapoda, Penaeidae) in Fortaleza bay, Ubatuba, Brazil, in relation to abiotic factors. Rev. Invest. Desarr. Pesq., v.16, p. 45-53, 2004. GRAÇA-LOPES, R.; SANTOS, E. P.; SEVERINO-RODRIGUES, E.; BRAGA, F. M. S. & PUZZI, A. Aportes ao conhecimento da biologia e da pesca do camarão-sete-barbas (Xiphopenaeus kroyeri Heller, 1862) no Litoral do Estado de São Paulo, Brasil. B. Inst. Pesca., v.33, n.1, p.63-84, 2007. 65 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 GUERRA-CASTRO, E.; CARMONA-SUÁREZ, C. A. JESÚS, E. C. Activity patterns and zonation of the swimming crabs Arenaeus cribarius and Callinectes ornatus. Journal of crustacean biology, v.27, n.1, p. 49-58, 2007. GUSMÃO, JAQUELINE.; LAZOSKI, C. & SOLÉ-CAVA, A. M. Population genetic structure of brazilian shrimp species (Farfantepenaeus sp., F. Brasiliensis, F. Paulensis and Litopenaeus schmitti: Decapoda: Penaeidae). Genetics and Molecular Biology, v.28, n.1, p. 165-171, 2005. HOSTIM-SILVA, M.; VICENTE, M. J. D.; FIGNA,V. & J. P. ANDRADE. Ictiofauna do Rio Itajaí Açu, Santa Catarina, Brasil. Notas Técnicas Facimar, v.6, p. 127-135, 2002. JOHNSON, D. F. The distribution of Brachyuran Crustacean Megalopae in the waters of the York River, Lower Chesapeake bay and adjacent shelf: Implications for recruitment. Estuar. Coast. Shelf. Sci., v.20, p. 693-705, 1985. LAREZ, L. B. & KHANDKER, N. A. Pesca de arrastre en las zonas de las Lagunas de Tacarigua, Unare y Piritu, con referencia especial a camarones. Bol. Inst. Oceanogr. Univ. Oriente, v.11, n.1, p. 51-56, 1972. LEITE JR, N. O. & PETRERE JR, M. Stock assessment and fishery management of the the pink-shrimp Farfantepenaeus brasiliensis Latreille, 1970 and F. Paulensis Pérez-Farfante 1967 in Southeast Brazil (23º to 28ºS). Braz. J. Biol., v.66, n.1B, p. 263-277, 2006a. LEITE JR, N. O. & PETRERE JR, M. Growth and mortalities of the pink-shrimp Farfantepenaeus brasiliensis Latreille, 1970 and F. Paulensis Pérez-Farfante 1967 in Southeast Brazil. Braz. J. Biol., v.66, n.2A, p.523-536, 2006b. LOEBMANN, D. & VIEIRA, J. P. O impacto da pesca do camarão-rosa Farfantepenaeus paulensis (Pérez-Farfante) (Decapoda, Penaeidae) nas assembléias de peixes e siris do Parque Nacional da Lagoa do Peixe, Rio Grande do Sul, Brasil. Revta. Bras. Zool., v.23, n.4, p. 1016-1028, 2006. LUDWIG, J. A. & REYNOLDS, J. F. Statistical ecology: a primer on methods and computing. John Wiley e Sons, INC, 1988. 338p. MANTELATTO, F. L. M. & DIAS, L. L. Extension of the Known distribution of Charybdis hellerii (Milne Edwards, 1867) (Decapoda, Portunidae) along the 66 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 Western Tropical South Atlantic. Crustaceana, Leiden, v. 72, n.6, p. 212-217, 1999. MANTELATTO, F. L. M. & FRANSOZO, A. Brachyuran community in Ubatuba bay, Northern coast of São Paulo State, Brazil. Journal of shellfish Research, V.19, n.2, p. 701-709, 2000. MANTELATTO, F. L. M & GARCIA, BIAGI, R.G. Biological aspects of the crab Charybdis hellerii in the Western Tropical South Atlantic. Bulletin of Marine Science, v.68, n.3, p. 469-477, 2001. MANTELATTO, F. L M.; BIAGI, R.; FARIA, F. C. R.; MEIRELES, A. L. & MELO, G. A. S. Checklist on brachyuran fauna (Decapoda) from infralitoral rocky/sandy bottom of Anchieta Island, São Paulo State, Brazil. Nauplius, v.12, n.2, p. 135142, 2004. MARQUES, J. C.; MARANHÃO, P. & PARDAL, M. A. Human impact on the subtidal macrobenthic community structure in the Mondego estuary (Western Portugal). Estuar. Coast. Shelf. Sci., v.37, p. 403-419, 1993. MATSUURA, Y. Contribuição ao estudo da estrutura oceanográfica da Região Sudeste entre Cabo Frio (RJ) e Cabo de Santa Marta Grande (SC). Ciência e Cultura, Rio de Janeiro, v.38, n.8, p. 1439-1450, 1986. MELO, G.A.S. Manual de identificação dos Brachyura (caranguejos e siris) do litoral brasileiro. São Paulo: Plêiade/FAPESP, 1996. 604p. MOLLERI, G.S.F. & BONETTI, J. Disponível em: http:// www.abequa2005.geologia.ufrj.br/nukleo/pdfs/0096_abequa_gust.pdf. Acesso em: 12 de março de 2006. MOREIRA, P. S.; PAIVA FILHO, A. M.; OKIDA, C. M.; SCHMIEGELOW, J. M. M. & GIANNINI, R. Biologia de Crustáceos Decápodos, Braquiúros, no Sistema Baía-Estuário de Santos e São Vicente, SP. Ocorrência e Composição. Bolm. Inst. Oceanogr., v.36, n.1/2, p. 55-62, 1988. MOURA, G. F.; MELO, G. N. & SAMPAIO, J. A. A. Estudos biométricos das espécies de camarões peneídeos de importância econômica no litoral de Lucena, Paraíba. Bol. Técn. Cient. CEPENE, Tamandaré, v.11, n.1, p. 189210, 2003. 67 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 NAKAGAKI, J. M.; NEGREIROS-FRANSOZO, M. L. & FRANSOZO A. Composição e Abundância de Camarões Marinhos (Crustacea, Decapoda, Penaeidae) na Enseada de Ubatuba (SP), Brasil. Arq. Biol. Tecnol., v.38, n. 2, p. 583-591, 1995. NEGREIROS-FRANSOZO, M. L.; REIGADA, A. L. D. & FRANSOZO, A. Braquiúros (Crustacea, Decapoda) dos sedimentos sublitorais da praia da enseada, Ubatuba (SP). B. Inst. Pesca., v.19, p. 17-22, 1992. NEGREIROS-FRANSOZO, M. L. The zoea I of Charybdis hellerii (Milne Edwards, 1867) (Decapoda, Portunidae) obtained in laboratory. Nauplius, v.4, p. 165-168, 1996. NEIVA, G. S. Aspectos sobre a biologia e a pesca do camarão rosa da região Centro-Sul do Brasil. Revista Nacional da pesca, p. 9-12, 1966. NEWELL, R. C.; SEIDERER, L. J. & HITCHCOCK, D. R. The impact of dredging works in coastal waters: A review of the sensitivity to disturbance and subsequent recovery of biological resources on the sea bed. Oceanography and Marine biology, v.36, p. 127-178, 2003. NEWELL, R. C.; SEIDERER, L. J.; SIMPSON, N. M. & ROBINSON, J. E. Impacts of marine aggregate dredging on benthic macrofauna off the South Coast of the United Kingdom. Journal of Coastal Research, v.20, n.1, p. 115125, 2004. NUCCI, P. R.; TURRA, A. & MORGADO, E. H. Diversity and distribution of crustaceans from 13 sheltered sandy beaches along São Sebastião channel, South-eastern Brazil. J. Mar. Biol. Ass. U.k., v.81, p. 475-484, 2001. OSHIRO, L. M. Y. ; SILVA, R.; SILVA, Z. S. Composição da fauna de braquiúros (Crustacea, Decapoda) dos manguezais da Baía de Sepetiba-RJ. Nauplius, Rio Grande, RS, v. 6, p. 31-40, 1998. PEREIRA, L. E.; RAMOS, L. A. & PONTES, S. X. Lista comentada de peixes e crustáceos decápodos do Estuário do Arroio Chuí e região costeira adjacente, RS. Atlântica, v.20, p. 165-172, 1998. 68 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 PÉREZ-CASTAÑEDA, R. & DEFEO, O. Population variability of four sympatric Penaeid shrimps (Farfantepenaeus spp.) in a Tropical Coastal Lagoon of Mexico. Estuar. Coast. Shelf. Sci., v.52, p. 631-641, 2001. PÉREZ-CASTAÑEDA, R. & DEFEO, O. Growth and mortality of transient shrimp populations (Farfantepenaeus spp.) in a coastal lagoon of Mexico: role of the environment and density-dependence. Journal of Marine Science, v.62, p. 1424, 2005. PÉREZ-FARFANTE, I. Diagnostic characters of juveniles of the shrimps Penaeus aztecus aztecus, P. duorarum duorarum, and P. brasiliensis (Crustacea, Decapoda, Penaeidae). Spec. Sci. Rep. Fih., v. 599, p. 1-26, 1970. PÉREZ-FARFANTE, I. Shrimps and prawns. In: Fisher, W. (Ed.). FAO species identifications sheets for fishery proposes. Western Central Atlantic (Fishery Area 31), Rome: FAO, v.6, 1978. PETTI, M. A. V. Papel dos Crustáceos Braquiúros na rede trófica da plataforma interna de Ubatuba, São Paulo (Brasil). Nerítica, v.11, p. 123-137, 1997. PEZZUTO, P. R. & ECHTERNACHT, A. M. Avaliação de impactos da construção da Via Expressa SC-Sul, sobre o berbigão Anomalocardia brasiliana (Gmelin, 1791) (Molusca: Pelecypoda) na Reserva Extrativista Marinha do Pirajubaé (Florianópolis, SC, Brasil). Atlântica., v.21, p. 105-119, 1999. PITA, J. B.; RODRIGUES, E. S.; GRAÇA LOPES, R. & COELHO, J. A. P. Levantamento da família Portunidae (Crustacea, Decapoda, Brachyura) no complexo Baía-Estuário de Santos, São Paulo, Brasil. B. Inst. Pesca., v.12, n. 3, p. 153-162, 1985a. PITA, J. B.; RODRIGUES, E. S.; LOPES, R. G. & COELHO, J. A. P. Observações bioecológicas sobre o siri Callinectes danae Smith, 1869 (Crustácea, Portunidae), no complexo Baía-Estuário de Santos. Estado de São Paulo, Brasil. B. Inst. Pesca, v.12, n.4, p. 35-43, 1985b. RESGALLA JR, C. Estudo de impacto ambiental sobre a comunidade do zooplâncton na enseada do Saco dos Limões, Baía-Sul da Ilha de Santa Catarina, Brasil. Atlântica., v.23, p. 5-16, 2001. 69 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 ROBERT, R.; BORZONE, C. A. & NATIVIDADE, C. D. Os camarões da fauna acompanhante na pesca dirigida ao camarão sete-barbas (Xiphopenaeus kroyeri) no Litoral do Paraná. B. Inst. Pesca., v.33, n.2, p. 237-246, 2007. RODRIGUES, A. M. T.; PEREIRA, M. T.; WEGNER, P. Z.; BRANCO, J. O.; CLEZAR, L.; HOSTIM-SILVA, M. & SORIANO-SIERRA, E. J. Manguezal do Rio Camboriú: Preservação e controle da qualidade ambiental. IBAMACEPSUL, 1994. 65 p. ROMAN-CONTERAS, R. Análisis de la población de Callinectes spp. (Decapoda: Portunidae) en el sector occidental de la Laguna de Terminos, Campeche, México. Anais Instituto Ciencia del Mar y Limnologia, México, v.13, n.1, p. 315-322, 1986. SANTOS, M. A. C.; COELHO, P. A. Camarões (Crustacea Decapoda) do Litoral de Jabotão dos Guararapes, Pernambuco – Brasil. Trab. Oceanog. Fed., v.26, n.1, p. 63-83, 1998. SANTOS, M. C. F. Diversidade ecológica da ictiofauna acompanhante nas pescarias de camarões em Tamandaré, PE, Brasil. Bol. Téc. Cient. CEPENE, v.8, p. 165-183, 2000. SANTOS, S.; RIEGER, P. J.; VIEIRA, R. R. R. &BARUTOT, R. A. Composição dos Crustacea (Decapoda) na Lagoa do Peixe, Rio Grande do Sul, Brasil. Revta. Bras. Zool., v.17, n.1, p. 213-223, 2000. SANTOS, C.; SCHWARZ-JUNIOR, R.; OLIVEIRA-NETO, J. F. de.; SPACH, H. L. A ictiofauna em duas planícies de maré do setor euhalino da Baía de Paranaguá, Pr, Brasil. Bol. Inst. Pesca, v.28, p. 49-60, 2002. SANTOS, M. D. F. & SOUZA-FREITAS, A. E. T. Estrutura populacional e pesca do camarão-branco, Litopenaeus schmitti (Burkenroad, 1936) (Crustacea, Decapoda, Penaeidae) na Lagoa do Papari, Município de Nísia Floresta (Rio Grande do Norte – Brazil). Bol. Técn. Cient. CEPENE, v.12, n.1, p. 23-42, 2004. SANTOS, M. C. F.; PEREIRA, J. A. & IVO, C. T. C. A pesca do camarãobranco Litopenaeus schimitti (Burkenroad, 1936) (Crustacea, Decapoda, Penaeidae), no Nordeste do Brasil. Bol. Téc. Cient. CEPENE., v.14, n.1, p. 3358, 2006. 70 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 SCHETTINI, C. A. F.; PEREIRA FILHO, J. & SPILLERE. L. Caracterização Oceanográfica e Biogeoquímica dos estuários dos Rios Tavares e Defuntos, Reserva Extrativista de Pirajubaé, Florianópolis, SC. Notas técnicas da Facimar., v.4, p. 11-28, 2000. SEED, R. & HUGHES, R. N. Chelal Characteristics and foraging behaviour of the blue crab Callinectes sapidus Rathbun. Estuar. Coast. Shelf. Sci., v.44, p. 221-229, 1997. SEITZ, R. D.; LIPCIUS, R. N.; STOCKHAUSEN, W.T.; DELANO, K. A.; SEEBO, M. S. & GERDES, P. D. Potential bottom-up control of blue crab (Callinectes sapidus), distribution at various spatial scales. Bulletin of Marine Science, v. 72, n.2, p. 471-490, 2003. SEVERINO-RODRIGUES, E.; PITA, J. B. & GRAÇA-LOPES, R. Pesca artesanal de siris (Crustácea, Decapoda, Portunidae) na região estuarina de Santos e São Vicente (SP), Brasil. B. Inst. Pesca., v. 27, n.1, p. 7-19, 2001. SEVERINO-RODRIGUES, E.; GUERRA, D. S. F & GRAÇA-LOPES, R. Carcinofauna acompanhante da pesca dirigida ao camarão sete-barbas (Xiphopenaeus kroyeri) desembarcado na praia do perequê, Estado de São Paulo, Brasil. B. Inst. Pesca., v.28, n.1, p. 33-48, 2002. SHANKS, A. L. Abundance of post-larval Callinectes sapidus, Penaeus spp., Uca spp., and Libinia spp. Collected at an outer coastal site and their cross-shelf transport. Mar. Ecol. Prog. Ser., v.168, p. 57-69, 1998. SHAROV, A. F.; VOLSTAD, J. H.; DAVIS, G. R.; DAVIS, B. K,; LIPCIUS, R. N. & MONTANE, M. M. Abundance and exploitation rate of the blue crab (Callinectes Sapidus) in Chesapeake Bay. Bulletin of Marine Science, v.72, n.2, p. 543,565, 2003. SIGNORET, M. Abundancia, tamaño y distribución de camarones (Crustacea, Penaeidae) de la Laguna de Términos, Campeche y su relación con algunos factores hidrológicos. An. Inst. Biol. Univ. Nal. Autón., México v.45, n.1, p. 119-140, 1974. SOUSA, E. C.; COELHO, P. A. ; CALADO, T. C. DOS S. Crustacea Decapoda dos canais da lagoa Manguaba no complexo estuarino-lagunar Mundaú/Manguaba - Alagoas, Brasil. Boletim de Estudos de Ciências do Mar., Maceió, v. 11, p. 165-192, 2000. 71 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 SOUTHWOOD, T. R. E. Ecological methods. Chapman and Holl, London, 1968. 368p. SOUZA-CONCEIÇÃO, J. M. Aspectos populacionais e reprodutivos da manjuba boca-torta Cetengraulis edentulus, Cuvier no Saco dos Limões – Baía-Sul – Florianópolis/SC. 2001. 45f. Monografia (Curso de Oceanografia CTTMar/Univali). Universidade do Vale do Itajaí, Itajaí, 2001. SOUZA-CONCEIÇÃO, J. M. Estrutura populacional e distribuição espaçotemporal da Manjuba boca-torta (Cetengraulis edentulus) no Saco dos Limões, Baía-Sul, Florianópolis/SC. 2004. 70f. Dissertação de Mestrado. Universidade do Vale do Itajaí, Itajaí, 2004. SOUZA-CONCEIÇÃO, J. M.; RODRIGUES-RIBEIRO, M. & CASTRO-SILVA, M. A. Dinâmica populacional, biologia reprodutiva e ictioplâncton de Cetengraulis edentulus Cuvier (Pisces, Clupeiformes, Engraulidae) na Enseda do Saco do Saco dos Limões, Florianópolis, Santa Catarina, Brasil. Revta. Bras. Zool., v.22, n.4, p. 953-961, 2005. SOUZA-SAMPAIO, C. M. & FAUSTO-FILHO, J. Considerações sobre a bioecologia dos crustáceos decápodos da enseada do Mucuripe (Fortaleza, Ceará, Brazil). Arq. Ciên. Mar., v.23, p. 11-24, 1984. SPIVAK, E. D. Cangrejos estuariales del Atlántico Sudoccidental (25º-41ºS) (Crustacea: Decapoda: Brachyura). Invest. Mar. Valparaíso, v.25, p. 105-120, 1997. STONER, A. W. Community structure of thee demersai fish species of Laguna Joyuda. Puerto Rico. Estuaries, v.9, p. 142-152, 1986. TAISSOUN, N. E. Las espécies de cangrejos Del gênero Callinectes (Brachyura) en el Golfo de Venezuela y Lago de Maracaibo. Boln. Cient. Invest. Biol., v.2, p. 1-102, 1969. TANKERSLEY, R. A; WIEBER, M. G.; SIGALA, M. A. & KACHURAK, K. A. Migratory behavior of ovigerous blue crabs Callinectes sapidus: Evidence for selective tidal-stream transport. Biol. Bull., v.195, p. 168-173, 1998. 72 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 TAVARES, M. & MENDONÇA JR, J. B. Charybdis hellerii (Milne Edwards, 1867) (Decapoda, Portunidae), eighth nonindigenous marine decapod recorded from Brazil. Crust. Res., v. 25, p. 151-157, 1996. TEIXEIRA, R. L. & SÁ, H. S. Abundância de macrocrustáceos decápodas nas áreas rasas do complexo lagunar Mundaú/Manguaba, AL. Rev. Bras. Biol., v.58, n.3, p. 393-404, 1998. TORRES, J. R. Uma análise preliminar dos processos de dragagem do porto de Rio Grande, RS. 2000. 173f. Dissertação (Mestrado em engenharia oceânica) – Fundação Universidade do Rio Grande, Universidade Federal do Rio Grande, Rio Grande, 2000. VALENTINI, H.; D’ INCAO.; RODRIGUES L. F.; REBELO NETO J. E. & RAHN. E. Análise da pesca do camarão rosa (Penaeus brasiliensis e Penaeus paulensis) nas regiões Sudeste e Sul do Brasil. Atlântica., v.13, n.1, p. 143157, 1991. VAZZOLER, A. E. A. M. Manual de métodos para estudos biológicos de populações de peixes: reprodução e crescimento. Brasília, CNPq, Programa Nacional de Zoologia, 1981. 106p. VON DOLAH, R. F.; CALDER, D. R. & KNOTT, D. M. Effects of dredging and Open-Water disposal on benthic macroinvertebrates in a South Carolina estuary. Estuaries, v.7, n.1, p. 28-37, 1984. WEBER, L. L.; A. PUCHNICK, J. P. LAMEGO. & LEVY, J. A. Genetic relationships among the most common swimming crabs of southern Brazil. Journal of Crustacean biology, v.23, n.1, p. 201-211, 2003. WIDDOWS, J. BRINSLEY, M. D.; POPE, N. D.; STAFF, F. J.; BOLAM, S. G. & SOMERFIELD, P. J. Changes in biota and sediment erodability following the placement of fine dredged material on upper intertidal shores of estuaries. Mar. Ecol. Prog. Ser., v.319, p. 27-41, 2006. WILLIAMS, A. B. The swimming crabs of the genus Callinectes (Decapoda: Portunidae). Fishery Bulletin, Seattle, v.72, n.3, p. 685-798, 1974. WILLIANS, A. B. Shrimp, Lobsters and Crabs of the Atlantic Coast of the Eastern United States, Maine to Florida. Washington, DC: Smithisonion Institution Press, 1984. 550p. 73 Análise quali-quantitativa da carcinofauna .... FREITAS, 2008 ZAR, J. H. Bioestatistical Analysis. New Jersey: Prentice-Hall, 4ª ed., 1999. 663p. 74
Download