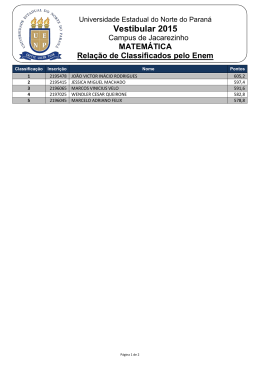
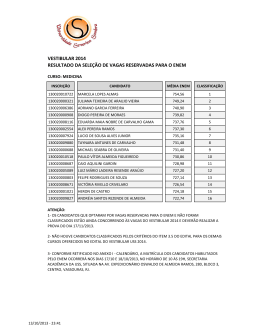
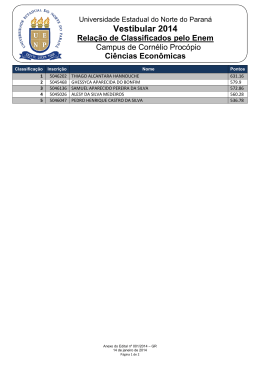
Sumário 14 Capítulo 3 Diluição e mistura de soluções...... 48 Capítulo 1 Dispersões: coloides, suspensões e soluções . ................................................... 16 1. Diluição . .................................................................................................... 49 Como preparar uma solução diluída ..................................................................................... 50 Atividades ............................................................................................ 52 2. As dispersões ................................................................................ 53 Mistura de soluções de mesmo soluto ............................................. 53 Mistura de soluções de solutos diferentes que não reagem entre si ................................................................................... 55 Atividades ............................................................................................ 56 Atividade experimental: Diluição de solução de sulfato de cobre (II) .................................................................. 57 Questões globais ................................................................. 58 Ciência, tecnologia e sociedade: Rio é contaminado por ácido ..................... 59 Esquema do capítulo ................................................. 60 Vestibular e Enem .............................................................. 61 Unidade I Soluções 1. As dispersões ................................................................................ 17 Dispersões coloidais ............................................ 18 Suspensões ............................................................................ 19 Soluções .......................................................................................... 19 Atividades ............................................................................................ 20 2. As soluções ......................................................................................... 21 Classificação das soluções ...................... 21 Atividades ............................................................................................ 24 Atividade experimental: Efeito Tyndall – identificação das suspensões .......................................................................... 25 Questões globais ................................................................. 26 Ciência, tecnologia e sociedade: Soluções usadas como contraste em radiografias .......................................................................... 27 Esquema do capítulo ................................................. 28 Vestibular e Enem .............................................................. 29 Para explorar .................................................................................................................................................. 63 Capítulo 2 Concentração das soluções .......... 30 1. Introdução: como preparar soluções ..................................................................................................... 31 Relações entre a quantidade de soluto, a de solvente e a de solução .................................................................................... 31 Atividades ............................................................................................ 36 2. Solubilidade ...................................................................................... 37 Influência da pressão ......................................... 37 Influência da temperatura ...................... 37 Influência da reatividade ........................... 38 Regra de solubilidade ....................................... 38 Saturação de uma solução ..................... 38 Curvas de solubilidade ................................. 39 ............................................................................................ 40 Atividades Atividade experimental: Determinação da concentração de sólidos em uma amostra de água ........................................................................................................ 41 Questões globais ................................................................. 42 Ciência, tecnologia e sociedade: Dureza da água .......................................................................... 43 Esquema do capítulo ................................................. 44 Vestibular e Enem .............................................................. 45 4P_EMQ2_LA_INICIAIS_001A0013.indd 6 2/25/10 8:20:54 PM Capítulo 4 Propriedades coligativas das soluções ............................................... 64 1. Introdução: propriedades físicas das substâncias .......................................................................... 65 2. Pressão de vapor de um líquido ......... 66 A pressão de vapor depende da natureza do líquido e da temperatura . .......................................... 67 Atividades ............................................................................................ 68 3. Temperatura de ebulição de um líquido ....................................................................................... 69 Diagrama de fases de uma substância pura ................................................... 70 Atividades ............................................................................................ 72 4. Tonoscopia ou tonometria ............................... 73 Atividades ............................................................................................ 74 5. Ebulioscopia e crioscopia .................................... 75 Atividades ............................................................................................ 76 6. Osmose ...................................................................................................... 79 Membrana semipermeável .................. 79 Pressão osmótica ...................................................... 80 Osmose reversa .............................................................. 81 Atividades ............................................................................................ 82 Atividade experimental: Osmose ...... 83 Questões globais ................................................................. 84 Ciência, tecnologia e sociedade: Por que se usa sal para derreter o gelo nas estradas ............................................................ 85 Esquema do capítulo ................................................. 86 Vestibular e Enem .............................................................. 87 Unidade II Termoquímica 88 Capítulo 5 A energia e as transformações químicas da matéria ............................ 90 1. Estados físicos e entalpia ...................................... 91 Termoquímica: processos endotérmicos e exotérmicos ........................................................... 92 Medidas de quantidade de calor ................................................................................... 93 Atividades ............................................................................................ 94 2. Entalpia e variação de entalpia ............... 95 ∆H nas mudanças de estado físico .............................................................................................. 96 Variação de entalpia em reações endotérmicas e exotérmicas ........................................................... 97 Atividades ............................................................................................ 98 3. Entalpia-padrão e equações químicas .................................................................................................... 99 Entalpia de formação ......................................... 99 Equação termoquímica e entalpia de reação .............................. 100 Entalpia de combustão .............................. 101 Energia de ligação ................................................ 101 Atividades ........................................................................................ 102 4. A Lei de Hess ................................................................................ 103 Atividades ........................................................................................ 104 Atividade experimental: Decomposição da água oxigenada .......................................................................................... 105 Questões globais ............................................................. 106 Ciência, tecnologia e sociedade: No inverno, alimentação aquecida ............................................................................................... 107 Esquema do capítulo ............................................. 108 Vestibular e Enem .......................................................... 109 Para explorar .............................................................................................................................................. 111 Projeto 1: Águas naturais – soluções aquosas para a vida .......................................................................................................................................................... 112 4P_EMQ2_LA_INICIAIS_001A0013.indd 7 2/25/10 8:20:57 PM Sumário Unidade III Cinética química 114 Capítulo 6 A rapidez das reações químicas ..................................................... 116 1. Como as reações ocorrem? ......................... 117 Condições fundamentais ...................... 117 Teoria das colisões ................................................ 118 Energia de ativação ............................................ 119 Teoria do estado de transição ............................................................................. 119 Atividades ........................................................................................ 120 2. Rapidez das reações .................................................... 121 Medida da rapidez média de uma reação .................................................... 122 Quantidades de substâncias × tempo de reação ........................................... 123 Medida da rapidez instantânea de uma reação .................................................... 125 Atividades ........................................................................................ 126 Atividade experimental: Rapidez de uma reação química ..... 127 Questões globais ............................................................. 128 Ciência, tecnologia e sociedade: Bactérias fabricam plástico biodegradável / Decomposição rápida ............................................. 129 Esquema do capítulo ............................................. 130 Vestibular e Enem .......................................................... 131 Capítulo 7 Fatores que afetam a rapidez das transformações químicas ..... 136 1. Influência da concentração, da temperatura, da superfície de contato e dos catalisadores ........................ 137 A concentração e a rapidez da reação ........................................................................ 137 A temperatura e a rapidez das reações ................................................................ 138 Superfície de contato .................................... 139 Catalisadores .................................................................... 140 Atividades ........................................................................................ 142 Atividade experimental: Cinética na reação ........................................................... 145 Questões globais ............................................................. 146 Ciência, tecnologia e sociedade: Conversores catalíticos ......................................... 147 Esquema do capítulo ............................................. 148 Vestibular e Enem .......................................................... 149 4P_EMQ2_LA_INICIAIS_001A0013.indd 8 Capítulo 8 Determinação da ordem de reação ................................................... 152 1. Ordem de uma reação ........................................... 153 Ordem e equação da rapidez de uma reação global ........................ 155 Mecanismo de uma reação .............. 156 Atividades ........................................................................................ 158 Atividade experimental: Como a concentração dos reagentes pode alterar a rapidez da reação? ................................................... 159 Questões globais ............................................................. 160 Ciência, tecnologia e sociedade: Buraco da camada de ozônio sobre a Antártida já é maior do que em 2007 ................................................................... 161 Esquema do capítulo ............................................. 162 Vestibular e Enem .......................................................... 163 Para explorar .............................................................................................................................................. 165 2/26/10 9:09:02 AM Unidade IV Equilíbrio químico 166 Capítulo 9 Reações reversíveis e o estado de equilíbrio.................... 168 1. Conceito de reações reversíveis e de equilíbrio químico ........................................ 169 Reações reversíveis ............................................. 169 Equilíbrio químico ................................................ 170 Equilíbrios homogêneos e equilíbrios heterogêneos ........... 171 Atividades ........................................................................................ 172 2. Constantes de equilíbrio ................................... 173 Constantes de equilíbrio (KC) ........ 174 Constantes de equilíbrio e pressões parciais (KP) ............................ 174 Relação entre KC e Kp ......................................... 175 Atividades ........................................................................................ 176 3. Expressões matemáticas ................................... 177 Cálculo das constantes de equilíbrio ........................................................................ 177 Interpretação do valor de KC e extensão da reação ........................... 178 Grau de equilíbrio (α) ..................................... 179 Quociente de equilíbrio (QC) .......... 180 Atividades ........................................................................................ 182 Atividade experimental: Determinação da constante de dissociação do ácido acético ................... 183 Questões globais ............................................................. 184 Ciência, tecnologia e sociedade: Manejo do solo: princípios do equilíbrio químico ........................................................... 185 Esquema do capítulo ............................................. 186 Vestibular e Enem .......................................................... 187 4P_EMQ2_LA_INICIAIS_001A0013.indd 9 Capítulo 10 Fatores que afetam o estado de equilíbrio ..................... 190 1. Princípio de Le Châtelier .................................... 191 Concentração .................................................................. 192 Pressão ........................................................................................... 192 Temperatura ...................................................................... 193 Atividades ........................................................................................ 194 2. Catalisadores ............................................................................... 195 Atividades ........................................................................................ 196 Atividade experimental: Fatores que afetam o estado de equilíbrio ............................................. 197 Questões globais ............................................................. 198 Ciência, tecnologia e sociedade: Academias investem em alternativas ao cloro nas piscinas ..................................................................................... 199 Esquema do capítulo ............................................. 200 Vestibular e Enem .......................................................... 201 Para explorar .............................................................................................................................................. 203 Unidade V Equilíbrios em sistemas aquosos 204 Capítulo 11 A força dos ácidos e das bases..... 206 1. Constante de dissociação (Ka) ................ 207 Dissociação de ácidos e constante de equilíbrio ........... 207 Constante de dissociação dos ácidos .................................................................... 208 Constante de dissociação das bases ........................................................................ 209 Cálculo da concentração de um solvente ................................................. 209 Lei da Diluição de Ostwald ................ 210 Atividades ........................................................................................ 212 2. Definição de ácido e base de acordo com a Teoria de Brönsted-Lowry . ....................................................... 213 Atividades ........................................................................................ 214 Atividade experimental: A força dos ácidos e das bases ............. 215 Questões globais ............................................................. 216 Ciência, tecnologia e sociedade: Importância da vitamina C ........................... 217 Esquema do capítulo ............................................. 218 Vestibular e Enem .......................................................... 219 2/25/10 8:21:00 PM Sumário Capítulo 12 O produto iônico da água e o pH de soluções aquosas............... 220 1. Equilíbrio iônico e produto iônico da água ....................................... 221 Equilíbrio iônico da água ...................... 221 Produto iônico da água: Kw ............... 222 Meios neutro, ácido e básico ........ 223 Atividades ........................................................................................ 224 2. Determinação do pH ................................................. 225 O pH e o caráter ácido ou básico ........................................................................ 225 A escala de pH ............................................................... 226 Indicadores ácido-base ............................. 227 Cálculo de pH de soluções de ácidos e bases ......................................... 228 Soluções de ácidos fracos e bases fracas ........................................................ 229 Atividades ........................................................................................ 230 3. Titulação ácido-base .................................................. 231 Titulação de solução de ácido acético com solução de hidróxido de sódio .................................... 232 Determinação da concentração de ácido acético no vinagre ....................................... 233 Atividades ........................................................................................ 234 Atividade experimental: Determinação da acidez de uma amostra de suco de limão ou de suco de laranja ................................................ 235 Questões globais ............................................................. 236 Ciência, tecnologia e sociedade: A chuva ácida ............................................................................. 237 Esquema do capítulo ............................................. 238 Vestibular e Enem .......................................................... 239 4P_EMQ2_LA_INICIAIS_001A0013.indd 10 Capítulo 13 Hidrólise de sais ................................... 242 1. Hidrólise de sais .................................................................... 243 Dissolução de sal derivado de ácido forte e base forte: solução neutra ................................................... 243 Hidrólise de sal derivado de ácido forte e base fraca ou hidrólise de um cátion: solução ácida ........................................................ 244 Hidrólise de sal derivado de base forte e ácido fraco ou hidrólise de um ânion: solução básica ..................................................... 244 Hidrólise de sal derivado de ácido fraco e base fraca ou hidrólise do cátion e do ânion .................................................................... 245 Constante de hidrólise (Kh) ................ 246 Atividades ........................................................................................ 248 2. Sistema-tampão ou solução-tampão ................................................................... 249 Efeito do íon comum ...................................... 249 Determinação do pH das soluções-tampão .......................... 251 Atividades ........................................................................................ 252 Atividade experimental: Hidrólise de sais .................................................................... 253 Questões globais ............................................................. 254 Ciência, tecnologia e sociedade: 40% dos adolescentes já perderam ao menos um dente no Brasil .......................................................... 255 Esquema do capítulo ............................................. 256 Vestibular e Enem .......................................................... 257 2/25/10 8:21:01 PM Capítulo 14 Equilíbrios em sistemas heterogêneos . ....................................... 258 1. Equilíbrios heterogêneos ................................ 259 Kc para equilíbrios heterogêneos ...................................................... 259 Kp para equilíbrios heterogêneos ....................................................... 260 Perturbação de equilíbrios heterogêneos ....................................................... 261 Produto de solubilidade .......................... 262 Expressão geral do produto de solubilidade ................................................. 263 Efeito do íon comum na solubilidade ............................................................. 263 Atividades ........................................................................................ 264 Atividade experimental: Estudando a influência da temperatura na solubilidade dos sais ..................................................................................................... 265 Questões globais ............................................................. 266 Ciência, tecnologia e sociedade: Chuva ácida e ovos de pássaros com casca fina e porosa ...................................... 267 Esquema do capítulo ............................................. 268 Vestibular e Enem .......................................................... 269 Para explorar .............................................................................................................................................. 271 Unidade VI Transformações químicas que produzem energia 272 Capítulo 15 Número de oxidação e balanceamento de reações ......... 274 1. Reações envolvendo transferência de elétrons .................................. 275 Número de oxidação (Nox) ............... 276 Eletronegatividade e número de oxidação .............................................................. 277 Nox e as reações de transferência de elétrons ............ 278 Regras para determinação do Nox .................................................................................. 279 ........................................................................................ 280 Atividades 2. Agente redutor e agente oxidante ............................................................................................... 281 Exemplo de método para balancear equações de oxirredução ............................................................... 282 Atividades ........................................................................................ 284 Atividade experimental: Estudo comparativo da corrosão do ferro .................................................................................................... 285 4P_EMQ2_LA_INICIAIS_001A0013.indd 11 Questões globais ............................................................. 286 Ciência, tecnologia e sociedade: Hálito culpado: o princípio químico do bafômetro .......................................... 287 Esquema do capítulo ............................................. 288 Vestibular e Enem .......................................................... 289 Capítulo 16 Pilhas ou células eletroquímicas ...................................... 292 1. Reações de oxirredução e a produção de corrente elétrica .............. 293 A pilha de Daniell ................................................... 294 O eletrodo padrão (E°) de hidrogênio ...................................................... 295 Potencial-padrão de redução ...... 296 Espontaneidade das reações ........ 297 ........................................................................................ 298 Atividades 2. Pilhas comerciais ................................................................ 299 Pilha seca (pilha de Leclanché) e pilha alcalina ................................................... 299 Bateria de chumbo/óxido de chumbo (IV) ................................................. 300 Bateria de níquel/cádmio ..................... 300 Bateria hidreto metálico/óxido níquel (NiMH) ....................................................... 301 Baterias de íon lítio ............................................. 301 Atividades ........................................................................................ 302 Atividade experimental: Pilha de limão ............................................................................ 303 Questões globais ............................................................. 304 Ciência, tecnologia e sociedade: Aplicações das células a combustível ................................................................................... 305 Esquema do capítulo ............................................. 306 Vestibular e Enem .......................................................... 307 Para explorar .............................................................................................................................................. 309 2/25/10 8:21:02 PM Sumário Capítulo 17 Corrosão de metais . .......................... 310 1. Corrosão de metais: um exemplo de pilha .................................................................................................... 311 Massa ................................................................................................. 311 A formação da ferrugem ........................ 312 Condições favoráveis para a formação da ferrugem ............... 313 Atividades ........................................................................................ 314 2. Proteção contra a corrosão .......................... 315 Proteção anódica .................................................... 315 Galvanização .................................................................... 316 Outros exemplos de proteção catódica ............................................................................. 316 Folha de flandres ou lata ........................ 317 Metais pouco reativos também oxidam . ........................................... 317 ........................................................................................ 318 Atividades Atividade experimental: Corrosão do ferro – um estudo comparativo .................................................................................. 319 Questões globais ............................................................. 320 Ciência, tecnologia e sociedade: Corrosão nas regiões litorâneas ........ 321 Esquema do capítulo ............................................. 322 Vestibular e Enem .......................................................... 323 Unidade VII Eletrólise: energia elétrica gerando transformações químicas 324 Capítulo 18 Eletrólise .................................................... 326 1. Eletrólise ígnea e eletrólise em solução aquosa ........................................................ 327 Eletrólise ígnea ............................................................. 328 Eletrólise em solução aquosa ...... 329 Prioridade de descarga dos íons em solução aquosa ............... 330 Atividades ........................................................................................ 332 2.Comparação entre eletrólise e funcionamento das pilhas ....................... 335 Atividades ........................................................................................ 336 Atividade experimental: Cobreação de um objeto metálico . ................................................................................................ 337 Questões globais ............................................................. 338 Ciência, tecnologia e sociedade: Reaproveitamento de resíduos .......... 339 Esquema do capítulo ............................................. 340 Vestibular e Enem .......................................................... 341 4P_EMQ2_LA_INICIAIS_001A0013.indd 12 Capítulo 19 Aplicações da eletrólise ................. 344 1. Principais aplicações da eletrólise ................................................................................................ 345 Obtenção de metais por eletrólise ígnea .................................................. 345 Eletrólise da salmoura .................................. 349 Atividades ........................................................................................ 350 Atividade experimental: Eletrólise da salmoura ............................................. 351 Questões globais ............................................................. 352 Ciência, tecnologia e sociedade: Do pó ao cobre – Reciclagem de sucata eletrônica permite obtenção de matéria-prima nobre ..................................... 353 Esquema do capítulo ............................................. 354 Vestibular e Enem .......................................................... 355 Capítulo 20 Aspectos quantitativos da eletrólise ............................................. 356 1. Aspectos quantitativos ......................................... 357 Corrente elétrica ....................................................... 358 Cálculos envolvendo pilhas e eletrólise ................................................................... 359 Atividades ........................................................................................ 360 Atividade experimental: Determinação da constante de Avogadro por eletrólise de NaOH(aq) ................................................................................. 361 Questões globais ............................................................. 362 Ciência, tecnologia e sociedade: Cloro, hipoclorito de sódio ou água sanitária? ............................................................ 363 Esquema do capítulo ............................................. 364 Vestibular e Enem .......................................................... 365 Para explorar .............................................................................................................................................. 367 2/25/10 8:21:04 PM Unidade VIII Reações nucleares 368 Capítulo 21 Reações nucleares .............................. 370 1. A descoberta da radioatividade e as suas leis .................................................................................. 371 Radiações da pechblenda ................... 371 Radiação alfa (α) ........................................................ 372 Radiação beta (β) ............................................... 372 Radiação gama () . .............................................. 373 Emissão de pósitrons ..................................... 373 Emissão de nêutrons ....................................... 373 Raios X ............................................................................................. 373 Atividades ........................................................................................ 374 2. Séries radioativas ............................................................... 375 Transmutação artificial ............................... 375 Meia-vida ou período de semidesintegração ................................... 376 Datação com o carbono-14 ............. 376 Datação com o urânio e o potássio ............................................................... 377 Medicina ..................................................................................... 377 Agricultura, indústria e alimentação ............................................................. 377 Atividades ........................................................................................ 378 Atividade: A radioatividade e a função exponencial ........................................ 379 Questões globais ............................................................. 380 Ciência, tecnologia e sociedade: Irradiação de alimentos ....................................... 381 Esquema do capítulo ............................................. 382 Vestibular e Enem .......................................................... 383 4P_EMQ2_LA_INICIAIS_001A0013.indd 13 Capítulo 22 Transmutações artificiais, fissão e fusão nucleares ................................ 384 1. O acelerador de partículas .............................. 385 Os elementos transurânicos ........... 385 Atividades ........................................................................................ 386 2. Fissão nuclear .............................................................................. 387 Reator nuclear ............................................................... 388 Lixo nuclear ......................................................................... 389 Atividades ........................................................................................ 390 3. Fusão nuclear ............................................................................. 391 Atividades ........................................................................................ 392 Atividade: Reações nucleares ............... 393 Questões globais ............................................................. 394 Ciência, tecnologia e sociedade: O maior acelerador de partículas do mundo .......................................................................................... 395 Esquema do capítulo ............................................. 396 Vestibular e Enem .......................................................... 397 Para explorar .............................................................................................................................................. 401 Projeto 2: Equipando o laboratório da escola ................... 402 Respostas dos exercícios ................................................................................................ 405 Siglas de universidades ..................................................................................................... 429 Referências bibliográficas ........................................................................................... 430 Créditos das fotografias ................................................................................................... 431 Créditos das ilustrações .................................................................................................... 432 2/25/10 8:21:05 PM
Download