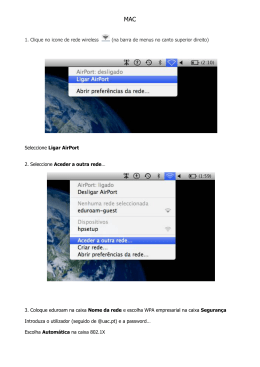
EXAME NACIONAL DO ENSINO SECUNDÁRIO Decreto-Lei n.º 74/2004, de 26 de Março Prova Escrita de Física e Química A 11.º/12.º anos de Escolaridade Prova 715/Época Especial 16 Páginas Duração da Prova: 120 minutos. Tolerância: 30 minutos 2008 Prova 715 • Página 1/ 16 Utilize apenas caneta ou esferográfica de tinta indelével azul ou preta. Pode utilizar a régua e a máquina de calcular gráfica. Não é permitido o uso de corrector. Em caso de engano, deve riscar, de forma inequívoca, aquilo que pretende que não seja classificado. Escreva de forma legível a numeração dos grupos e/ou dos itens, bem como as respectivas respostas. Para cada item, apresente apenas uma resposta. Se escrever mais do que uma resposta a um mesmo item, apenas é classificada a resposta apresentada em primeiro lugar. Para responder aos itens de escolha múltipla, escreva, na folha de respostas, • o número do item; • a letra identificativa da alternativa correcta. Para responder aos itens de verdadeiro/falso, escreva, na folha de respostas, • o número do item; • a letra identificativa de cada afirmação e, a seguir, uma das letras, «V» para as afirmações verdadeiras ou «F» para as afirmações falsas. No item 1.4., o domínio da comunicação escrita em língua portuguesa representa cerca de 10% da cotação. Nos itens em que é solicitado o cálculo de uma grandeza, apresente todas as etapas de resolução, explicitando todos os cálculos efectuados e apresentando todas as justificações e/ou conclusões solicitadas. As cotações dos itens encontram-se na página 16. A prova inclui um formulário, uma tabela de constantes e uma Tabela Periódica. Prova 715 • Página 2/ 16 TABELA DE CONSTANTES c = 3,00 × 108 m s–1 Velocidade de propagação da luz no vácuo Módulo da aceleração gravítica de um corpo junto g = 10 m s–2 à superfície da Terra Massa da Terra M T = 5,98 × 1024 kg Constante de Gravitação Universal G = 6,67 × 10–11 N m2 kg–2 Constante de Avogadro NA = 6,02 × 1023 mol–1 Constante de Stefan-Boltzmann σ = 5,67 × 10–8 W m–2 K – 4 Produto iónico da água (a 25 °C) Kw = 1,00 × 10–14 Volume molar de um gás (PTN) Vm = 22,4 dm3 mol–1 FORMULÁRIO • Conversão de temperatura (de grau Celsius para kelvin) ........................ T = θ + 273,15 T – temperatura absoluta (temperatura em kelvin) θ – temperatura em grau Celsius • Densidade (massa volúmica) ............................................................................ m ρ = –— V m – massa V – volume • Efeito fotoeléctrico ............................................................................................. Erad = Erem + Ec Erad – energia de um fotão da radiação incidente no metal Erem – energia de remoção de um electrão do metal Ec – energia cinética do electrão removido • Concentração de solução .................................................................................. n – quantidade de soluto n c = –— V V – volume de solução • Concentração mássica de solução .................................................................. m c m = –— V m – massa de soluto V – volume de solução • Relação entre pH e concentração de H3O+ ............................. Ö pH = –log [H3O+] / mol dm–3 • 1.ª Lei da Termodinâmica ................................................................................. × ∆U = W +Q +R ∆U – variação da energia interna do sistema (também representada por ∆ Ei) W – energia transferida entre o sistema e o exterior sob a forma de trabalho Q – energia transferida entre o sistema e o exterior sob a forma de calor R – energia transferida entre o sistema e o exterior sob a forma de radiação Prova 715 • Página 3/ 16 • Lei de Stefan-Boltzmann ..................................................................................... P = e σ AT 4 P – potência total irradiada por um corpo e – emissividade σ – constante de Stefan-Boltzmann A – área da superfície do corpo T – temperatura absoluta do corpo • Energia ganha ou perdida por um corpo devido à variação da sua temperatura ............................................................................................ E = m c ∆T m – massa do corpo c – capacidade térmica mássica do material de que é constituído o corpo ∆T – variação da temperatura do corpo • Taxa temporal de transmissão de energia como calor............................. Q – energia transferida através de uma barra como calor, no intervalo de tempo ∆t A Q –— = k –— ∆T ∆t k – condutividade térmica do material de que é constituída a barra A – área da secção recta da barra – comprimento da barra ∆T – diferença de temperatura entre as extremidades da barra → • Trabalho realizado por uma força constante, F , que actua sobre um corpo em movimento rectilíneo..................................................... W = F d cos α d – módulo do deslocamento do ponto de aplicação da força α – ângulo definido pela força e pelo deslocamento • Energia cinética de translação .......................................................................... 1 Ec = –— m v 2 2 m – massa v – módulo da velocidade • Energia potencial gravítica em relação a um nível de referência .......... Ep = m g h m – massa g – módulo da aceleração gravítica junto à superfície da Terra h – altura em relação ao nível de referência considerado • Teorema da energia cinética.............................................................................. W = ∆Ec W – soma dos trabalhos realizados pelas forças que actuam num corpo, num determinado intervalo de tempo ∆Ec – variação da energia cinética do centro de massa do corpo, no mesmo intervalo de tempo m1 m2 • Lei da Gravitação Universal ............................................................................... Fg = G –—–— r2 Fg – módulo da força gravítica exercida pela massa pontual m1 (m2) na massa pontual m2 (m1) G – constante de gravitação universal r – distância entre as duas massas Prova 715 • Página 4/ 16 → → • 2.ª Lei de Newton .................................................................................................. F = m a → F – resultante das forças que actuam num corpo de massa m → a – aceleração do centro de massa do corpo 1 • Equações do movimento unidimensional com aceleração constante ....... x = x0 + v 0 t + – at 2 2 x – valor (componente escalar) da posição v = v0 + a t v – valor (componente escalar) da velocidade a – valor (componente escalar) da aceleração t – tempo v2 • Equações do movimento circular com aceleração de módulo constante a c = –— r ac – módulo da aceleração centrípeta 2π r v = ––— T v – módulo da velocidade linear r – raio da trajectória 2π ω = ––— T T – período do movimento ω – módulo da velocidade angular • Comprimento de onda ........................................................................................ v – módulo da velocidade de propagação da onda v λ = –— f f – frequência do movimento ondulatório • Função que descreve um sinal harmónico ou sinusoidal ......................... y =A sin (ω t) A – amplitude do sinal ω – frequência angular t – tempo • Fluxo magnético que atravessa uma superfície de área A em que existe um → campo magnético uniforme B ........................................................................ Φm = B A cos α α – ângulo entre a direcção do campo e a direcção perpendicular à superfície • Força electromotriz induzida numa espira metálica ................................ ∆Φm – variação do fluxo magnético que atravessa a superfície delimitada pela espira, no intervalo de tempo ∆t • Lei de Snell-Descartes para a refracção ........................................................ |∆Φm| |ε i| = –––—— ∆t n1 sin α1 = n2 sin α2 n1, n2 – índices de refracção dos meios 1 e 2, respectivamente α1, α2 – ângulos entre as direcções de propagação da onda e da normal à superfície separadora no ponto de incidência, nos meios 1 e 2, respectivamente Prova 715 • Página 5/ 16 Prova 715 • Página 6/ 16 K [223] [226] 88 Ra 87 137,33 Fr 132,91 56 Ba 55 87,62 Cs 85,47 [227] 232,04 231,04 91 90 Th 89 Ac Pa 140,91 140,12 138,91 59 Pr 58 Ce 57 La Db 105 180,95 Ta 73 92,91 Nb 41 50,94 V 23 5 [262] Rf 104 178,49 Hf 72 91,22 Zr 40 47,87 Ti 22 4 238,03 U 92 144,24 Nd 60 [266] Sg 106 183,84 W 74 95,94 Mo 42 52,00 Cr 24 6 [237] Np 93 [145] Pm 61 [264] Bh 107 186,21 Re 75 97,91 Tc 43 54,94 Mn 25 7 [244] Pu 94 150,36 Sm 62 [277] Hs 108 190,23 Os 76 101,07 Ru 44 55,85 Fe 26 8 [243] Am 95 151,96 Eu 63 [268] Mt 109 192,22 Ir 77 102,91 Rh 45 58,93 Co 27 9 [247] Cm 96 157,25 Gd 64 [271] Ds 110 195,08 Pt 78 106,42 Pd 46 58,69 Ni 28 10 [247] Bk 97 158,92 Tb 65 [272] Rg 111 196,97 Au 79 107,87 Ag 47 63,55 Cu 29 11 [251] Cf 98 162,50 Dy 66 200,59 Hg 80 112,41 Cd 48 65,41 Zn 30 12 [252] Es 99 164,93 Ho 67 204,38 T 81 114,82 49 In 69,72 Ga 31 26,98 A 13 10,81 B 5 13 TABELA PERIÓDICA DOS ELEMENTOS QUÍMICOS Massa atómica relativa Elemento Número atómico [261] Actinídeos 89-103 Lantanídeos 57-71 88,91 39 38 Sr 37 Rb Y 44,96 40,08 39,10 21 20 Ca 19 Sc 3 24,31 22,99 12 Mg 11 9,01 Na 6,94 4 Be 3 2 Li 1,01 H 1 1 [257] Fm 100 167,26 Er 68 207,21 Pb 82 118,71 Sn 50 72,64 Ge 32 28,09 Si 14 12,01 C 6 14 [258] Md 101 168,93 Tm 69 208,98 Bi 83 121,76 Sb 51 74,92 As 33 30,97 P 15 14,01 N 7 15 [259] No 102 173,04 Yb 70 [208,98] Po 84 127,60 Te 52 78,96 Se 34 32,07 S 16 16,00 O 8 16 Lr [262] 103 174,98 Lu 71 [209,99] At 85 126,90 I 53 79,90 Br 35 35,45 C 17 19,00 F 9 17 [222,02] Rn 86 131,29 Xe 54 83,80 Kr 36 39,95 Ar 18 20,18 Ne 10 4,00 He 2 18 1. Leia atentamente o seguinte texto. Mais de 2/3 da superfície do nosso planeta está coberta de água líquida e mais de 5% da superfície está coberta de gelo. A atmosfera da Terra contém água nos três estados físicos – sólido, líquido e gasoso. O ciclo hidrológico – a constante circulação da água entre os reservatórios na terra, no mar e no céu – é determinante para a vida na Terra. Sugerir que a água é um líquido muito invulgar poderia, assim, parecer absurdo. No entanto, ela apresenta diversas peculiaridades e comportamentos anómalos. Uma das peculiaridades da água é o facto de ela dissolver quase tudo. Por esse motivo, as águas naturais contendo CO2 dissolvido, ao infiltrarem-se no solo, atravessam diversas camadas rochosas, tornando-se geralmente ricas em sais provenientes da dissolução dos minerais existentes nessas rochas. Quando as águas naturais, ligeiramente ácidas, entram em contacto com rochas calcárias – compostas principalmente por carbonato de cálcio em combinação com algum carbonato de magnésio –, os iões H3O+(aq) reagem com os carbonatos, daí resultando bicarbonatos relativamente solúveis: a água transforma-se numa solução bicarbonatada, que é, com frequência, fracamente alcalina. Esta é a «água dura» que causa o entupimento das canalizações e a formação de incrustações calcárias nas caldeiras. Um dos comportamentos anómalos da água, que é traduzido pelo elevado valor de uma das suas propriedades físicas, pode ser descrito do seguinte modo: é necessário gastar mais energia para aumentar a temperatura de uma dada massa de água, no estado líquido, do que para aumentar, de outro tanto, a temperatura de uma massa igual da maior parte das outras substâncias no estado líquido! Mas este comportamento também tem benefícios: a água quente arrefece muito lentamente, uma vez que, para que a sua temperatura desça significativamente, precisa de perder uma grande quantidade de energia. Philip Ball, H2 O – Uma Biografia da Água, Temas e Debates, 2002 (adaptado) 1.1. Identifique a propriedade física a que se refere o último parágrafo do texto. 1.2. Com base na informação apresentada no texto, seleccione a alternativa que contém os termos que devem substituir as letras (a) e (b), respectivamente, de modo a tornar verdadeira a afirmação seguinte. Quando águas naturais, ligeiramente ácidas, entram em contacto com rochas calcárias, a (a) e o seu pH _____ (b) . concentração dessas águas em iões H3O+(aq) _____ (A) ... aumenta … aumenta (B) … aumenta … diminui (C) … diminui … aumenta (D) … diminui … diminui Prova 715 • Página 7/ 16 1.3. Justifique o facto de a molécula de água apresentar uma geometria angular, e também o facto de o ângulo de ligação nesta molécula (104,5º) ser inferior ao ângulo correspondente a uma geometria tetraédrica regular (109,5º). 1.4. A dureza de uma água está normalmente relacionada com a sua concentração em iões cálcio, Ca2+(aq), e magnésio, Mg2+(aq). Escreva um texto relativo à dureza de uma água, no qual: • refira uma causa antropogénica que pode influenciar a dureza de uma água de consumo doméstico; • relacione a concentração em iões cálcio e magnésio numa água com a eficiência da lavagem com sabão, referindo o efeito dessa concentração sobre a formação de espuma e de escuma; • indique o motivo pelo qual a eficiência da lavagem com detergente é pouco afectada pela dureza da água. 2. Nos barcos de pesca modernos é fundamental a utilização do sonar para a medição da profundidade das águas e para a detecção de cardumes. O funcionamento do sonar baseia-se na emissão e recepção de ultra-sons que, tal como esquematizado na figura 1, ao incidirem num obstáculo, são por este reflectidos. h Fig. 1 2.1. Admita que é possível registar, com um osciloscópio existente na cabina do barco, os instantes em que o sinal sonoro é enviado e recebido, após reflexão no fundo do mar. Para medir a profundidade da água do mar num determinado local, a base de tempo do osciloscópio foi regulada para 100 ms/cm, tendo-se obtido o registo representado na figura 2. 1 cm Fig. 2 Admita que a velocidade de propagação do som na água do mar, nas condições de temperatura e salinidade locais, é de 1524 m s –1. Calcule a profundidade da água, h, naquele local. Apresente todas as etapas de resolução. Prova 715 • Página 8/ 16 2.2. Os ultra-sons têm uma frequência superior àquela que o ouvido humano pode detectar. Seleccione a alternativa que completa correctamente a frase seguinte. Para o mesmo meio de propagação, quanto maior for a frequência de uma onda sonora... (A) ... menor será a sua amplitude. (B) ... menor será o seu comprimento de onda. (C) ... maior será o seu período. (D) ... maior será a sua velocidade de propagação. 2.3. Os tripulantes do barco, ao avistarem um cardume, têm a sensação de que os peixes estão mais próximos da superfície da água do que na realidade se encontram. Tendo em conta esta informação, seleccione a alternativa que contém os termos que devem substituir as letras letras (a) e (b), respectivamente, de modo a tornar verdadeira a afirmação seguinte. (a) à velocidade de propagação no ar, sendo o A velocidade de propagação da luz na água é _____ (b) índice de refracção da água _____ ao do ar. (A) ... superior … superior ... (B) … inferior … superior ... (C) … inferior … inferior ... (D) … superior … inferior ... 3. O amoníaco, NH3, é um dos compostos de azoto melhor conhecidos e estudados. É um gás incolor, à temperatura ambiente, com um cheiro bastante irritante. O amoníaco é muito solúvel em água, sendo as soluções aquosas de amoníaco, NH3(aq), designadas por amónia. 3.1. A libertação de amoníaco gasoso para a atmosfera constitui uma das principais fontes de poluição ambiental, uma vez que o amoníaco libertado pode dar origem, entre outros compostos, a óxidos de azoto, com implicações para a saúde e o ambiente. Destes óxidos, um dos mais tóxicos e poluentes é o dióxido de azoto, NO2, que reage rapidamente com a água para formar ácido nitroso, HNO2(aq), e ácido nítrico, HNO3(aq), de acordo com a equação química seguinte: 2 NO2(g) + H2O() → HNO2(aq) + HNO3(aq) Seleccione a alternativa que traduz como varia o número de oxidação do azoto (N) na transformação da espécie NO2(g) na espécie HNO3(aq). (A) de +2 para +6 (B) de +4 para +3 (C) de +6 para +3 (D) de +4 para +5 Prova 715 • Página 9/ 16 3.2. Nos laboratórios químicos, as soluções aquosas de amoníaco, com as quais se trabalha habitualmente, são preparadas a partir de soluções aquosas comerciais, em geral muito concentradas. 3.2.1. Uma solução aquosa comercial de amoníaco, NH3(aq) (M = 17,04 g mol–1), tem uma concentração, expressa em percentagem em massa, igual a 25 %, e uma densidade igual a 0,91 g cm–3, a uma determinada temperatura. Calcule a concentração, expressa em mol dm–3, dessa solução de amoníaco. Apresente todas as etapas de resolução. 3.2.2. O amoníaco, em solução aquosa, quando ingerido, pode originar violentas dores de estômago e estado de choque, muitas vezes acompanhados de edema da glote. Tendo em conta esta informação, seleccione a alternativa que corresponde à classificação daquela substância. (A) Tóxica (B) Radioactiva (C) Oxidante (D) Inflamável 3.3. A reacção de ionização do amoníaco em água é uma reacção reversível, que pode ser traduzida pela seguinte equação química: NH3(aq) + H2O () Þ + NH4 (aq) + OH–(aq) 3.3.1. Sendo o comportamento ácido-base da espécie NH3(aq) evidenciado pela reacção acima indicada, seleccione a alternativa que identifica correctamente um par ácido-base conjugado naquela reacção. (A) NH3(aq) e H2O() (B) NH3(aq) e OH–(aq) (C) H2O() e OH–(aq) (D) NH4 (aq) e H2O() + 3.3.2. Escreva a expressão que traduz a constante de equilíbrio, Kc, da reacção de ionização do amoníaco em água. Prova 715 • Página 10/ 16 3.3.3. Relativamente às reacções reversíveis, seleccione a alternativa que contém os termos que devem substituir as letras (a), (b) e (c), respectivamente, de modo a tornar verdadeira a afirmação seguinte. (a) das concentrações iniciais O valor da constante de equilíbrio de uma reacção química _____ (b) (c) de reagentes e de produtos da reacção, dá informação sobre a _____ da reacção e _____ com a temperatura à qual a reacção ocorre. (A) ... depende … extensão … varia … (B) … não depende … velocidade … não varia … (C) … não depende … extensão … varia … (D) … depende … velocidade … não varia … 4. A Tabela Periódica corresponde a uma forma de organização dos elementos químicos de acordo com a periodicidade das suas propriedades físico-químicas, que reflecte a periodicidade das suas configurações electrónicas. 4.1. Considerando os elementos que constituem os três primeiros períodos da Tabela Periódica e tendo em conta as suas posições relativas nessa Tabela, classifique como verdadeira (V) ou falsa (F) cada uma das afirmações seguintes. (A) O átomo de alumínio origina um ião tripositivo, A 3+, cuja configuração electrónica é idêntica à do átomo de néon. (B) O azoto forma com o hidrogénio um composto cujas moléculas têm geometria piramidal trigonal. (C) O sódio é o elemento que apresenta o valor mais baixo de raio atómico. (D) O sódio forma com o cloro um composto cujas ligações são covalentes. (E) O flúor é, dos elementos do seu grupo, aquele que apresenta maior energia de ionização. (F) O átomo de oxigénio origina um ião binegativo, O2–, cuja configuração electrónica é idêntica à do átomo de néon. (G) O átomo de alumínio tem, no estado fundamental, a configuração electrónica 1s 2 2s 2 2p 6 3s 2 3p 3. (H) O carbono forma com o hidrogénio um composto cujas moléculas têm geometria tetraédrica. Energia de ionização / kJ mol1 4.2. O gráfico da figura 3 representa a relação entre a energia de ionização e o número atómico dos elementos, ao longo do 2.º Período da Tabela Periódica. Ne 2000 F 1600 N 1200 O Be 800 C B 400 Li 0 2 4 6 8 10 12 Número atómico Fig. 3 Justifique o facto de a energia de ionização apresentar uma tendência geral para aumentar ao longo do 2.º Período da Tabela Periódica. Prova 715 • Página 11/ 16 5. Um automóvel, de massa 1200 kg, encontrava-se estacionado no cimo de uma rampa, conforme representado na figura 4, quando, acidentalmente, se destravou. Deslizou ao longo da rampa, com aceleração aproximadamente constante, até colidir com outro veículo, que se encontrava parado num semáforo. Considere que o desnível entre as posições A e B, representadas na figura, é de 8,0 m e que o automóvel percorreu 60 m entre essas duas posições. A 60 m 8,0 m B Fig. 4 5.1. Com a colisão, o ponteiro do velocímetro do automóvel que deslizou ao longo da rampa ficou encravado, indicando que a sua velocidade no instante do choque era 42 km h–1. Calcule o módulo da energia dissipada pelo sistema automóvel + Terra, no percurso considerado. Apresente todas as etapas de resolução. 5.2. Seleccione a alternativa que completa correctamente a frase seguinte. O trabalho realizado pelo peso do automóvel, no percurso entre as posições A e B, pode ser calculado pela expressão... (A) ... W = – 10 × 1200 × 8,0 J (B) ... W = 10 × 1200 × 8,0 J (C) ... W = – 10 × 1200 × 60 J (D) ... W = 10 × 1200 × 60 J Prova 715 • Página 12/ 16 5.3. Seleccione o gráfico que traduz a relação entre a energia cinética, Ec, do automóvel e a distância, d, por ele percorrida desde a posição A até à posição B. (B) (A) Ec Ec 0 Ec 0 0 d (C) Ec 0 d d (D) d 5.4. Pretende-se instalar um painel fotovoltaico para carregar a bateria que alimenta o circuito eléctrico do semáforo representado na figura 5. luz solar painel fotovoltaico bateria Fig. 5 5.4.1. Considere que uma célula fotovoltaica com a área de 1,00 × 10 –2 m2 fornece, em média, durante um dia, a energia de 3,89 × 104 J. Admitindo que a potência consumida pelo semáforo é 5,0 x 102 W, funcionando este 24 horas por dia, e que o rendimento da bateria é 50%, calcule a área de painel fotovoltaico necessária para alimentar o circuito eléctrico do semáforo. Apresente todas as etapas de resolução. Prova 715 • Página 13/ 16 5.4.2. Com base na informação apresentada no texto, seleccione a alternativa que contém os termos que devem substituir as letras (a) e (b), respectivamente, de modo a tornar verdadeira a afirmação seguinte. (a) da sua orientação relativamente aos pontos O rendimento médio do painel fotovoltaico _____ (b) cardeais e _____ da sua inclinação. (A) ... não depende … não depende ... (B) ... não depende … depende ... (C) ... depende … depende ... (D) ... depende … não depende ... A 24,0 cm 6. Para estudar a relação entre a velocidade de lançamento horizontal de um projéctil e o seu alcance, um grupo de alunos usou o seguinte material: B – uma calha polida flexível, montada sobre uma mesa, de modo a que o troço final fosse horizontal; 80,0 cm – uma fita métrica; – uma caixa, de altura muito reduzida, contendo areia; 30,0 cm C D E – uma pequena esfera de aço. 95,0 cm O material foi montado de acordo com o esquema representado na figura 6 (a figura não se encontra à escala). Fig. 6 A esfera foi abandonada no ponto A, situado sobre a calha, e acabou por cair na caixa com areia, onde deixou uma marca (ponto E). 6.1. Seleccione a alternativa que completa correctamente a frase seguinte. Para medir o alcance da esfera, os alunos devem medir a distância entre os pontos... (A) ... A e E. (B) ... C e E. (C) ... B e E. (D) ... D e E. Prova 715 • Página 14/ 16 6.2. Considere que a caixa que contém areia tem um comprimento de 30,0 cm. Verifique que, sendo desprezáveis o atrito e a resistência do ar, os alunos podem colocar a caixa na posição indicada na figura 6, quando abandonam a esfera na posição A. Apresente todas as etapas de resolução. 6.3. Seleccione a alternativa que completa correctamente a frase seguinte. Se, na experiência realizada pelos alunos, o atrito entre a calha e a esfera não for desprezável... (A) ... o tempo de voo da esfera aumenta. (B) ... o tempo de voo da esfera diminui. (C) ... a esfera cai mais próximo da mesa. (D) ... a esfera cai mais longe da mesa. FIM Prova 715 • Página 15/ 16 COTAÇÕES 1. 1.1. .................................................................................................................................................... 5 pontos 1.2. .................................................................................................................................................... 5 pontos 1.3. .................................................................................................................................................... 10 pontos 1.4. .................................................................................................................................................... 20 pontos 2.1. .................................................................................................................................................... 10 pontos 2.2. .................................................................................................................................................... 5 pontos 2.3. .................................................................................................................................................... 5 pontos 3.1. .................................................................................................................................................... 5 pontos 2. 3. 3.2. 3.2.1. ........................................................................................................................................ 3.2.2. ........................................................................................................................................ 20 pontos 5 pontos 3.3.1. ........................................................................................................................................ 3.3.2. ........................................................................................................................................ 3.3.3. ........................................................................................................................................ 5 pontos 5 pontos 5 pontos 4.1. .................................................................................................................................................... 10 pontos 4.2. .................................................................................................................................................... 10 pontos 5.1. .................................................................................................................................................... 10 pontos 5.2. .................................................................................................................................................... 5 pontos 5.3. .................................................................................................................................................... 5 pontos 3.3. 4. 5. 5.4. 5.4.1. ........................................................................................................................................ 5.4.2. ........................................................................................................................................ 20 pontos 5 pontos 6.1. .................................................................................................................................................... 5 pontos 6.2. .................................................................................................................................................... 20 pontos 6.3. .................................................................................................................................................... 5 pontos 6. ___________ TOTAL .................................................................. 200 pontos Prova 715 • Página 16/ 16
Baixar