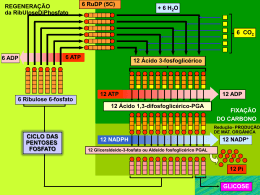
Fisiologia Vegetal Objetivos da aula: Fotossíntese: • absorção de luz • pigmentos fotossintéticos • fotossistemas • fluxo de elétrons acíclico • fotofosforilação • fluxo de elétrons cíclico Bibliografia: Lehninger – Principles of Biochemistry Taiz – Plant Physiology Fotossíntese: Processo pelo qual a energia da luz é utilizada para síntese de moléculas orgânicas. monocotiledônea cianobactérias fluxo de energia outras bactérias fotossintetizantes CO2 + H2O dicotiledônea carboidratos + O2 principal via pela qual energia entra na biosfera fotossíntese oxigênica (2,5 billion years) RECORDANDO Absorção de luz orbitais moleculares energia s* (antiligante) DE DE p*(antiligante) não ligante p ligante s ligante a luz UV e visível possui energia suficiente para promover as transições eletrônicas dos orbitais n para p* ou p para p* H H H C C c s c p e(M-1cm-1) lmax(nm) 165 15000 217 21000 256 50000 290 85000 334 125000 estado fundamental ETILENO H c s c p* p estado excitado l (comprimento de onda) indica a quantidade de energia necessária para ocorrer a transição eletrônica. e (coeficiente de extinção) indica a probabilidade da transição eletrônica ocorrer. RECORDANDO Pigmentos Fotossintéticos anel porfirínico Mg principais fotoreceptores da fotossíntese nas plantas coeficinete de extinção molar = 105 M-1 cm-1 fitol ab so rb ân cia 430 a Espectro de absorção das clorofilas a e b bb 660 Protoporfirina IX A mudança estrutural leva a diferentes espectros de absorção 400 500 600 comprimento de onda (nm) 700 RECORDANDO Pigmentos Fotossintéticos acessórios C H3 C H3 C H3 C H3 C H3 C H3 C H3 b - caroteno C H3 HOOC COOH CH3 CH3 CH3 O N H CH3 CH3 CH3 N H N H N H O ficocianina RECORDANDO estados eletrônicos da clorofila a 2o. estado excitado 430 nm Formas de uma molécula dissipar a energia (quenching) do estado excitado: 1) conversão interna (conversão para energia cinética, <10-11 s) 2) fluorescência, (+ 10-8 s) 3) transferência do estado excitado para uma molécula vizinha (ressonância) luz 4) fotoxidação calor conversão interna 1o. estado excitado Absorção de Luz fotoxidação aceptor de elétrons 660 nm fluorescência estado fundamental absorção de energia dissipação de energia • Moléculas têm vários estados de energia. • Cada um dos estados eletrônicos tem subestados rotacionais e vibracionais. 1) e 2) 3) radical livre 4) + - elétron pigmento aceptor de elétrons RECORDANDO Onde ocorre a fotossíntese? ORGANELA: CLOROPLASTO ORGÃO:FOLHA estroma (DNA, RNA, grana* epiderme superior T E C I D O S ribossomos, enzimas) parênquima palissádico lamela dos grana* parênquima lacunoso epiderme inferior CO2 lamela do estroma* membrana externa (permeável) espaço inter-membrana membrana interna (semi-permeável) No tilacóide ocorrem as reações de captação de luz. No estroma ocorrem as reações de fixação de carbono. * fazem parte da membrana do tilacóide (alta fluidez). RECORDANDO As Reações da Fotossíntese luz reações luminosas abundantes na natureza (tilacóides) reações de fixação de carbono (CO2) (estroma) ciclo de transformação de compostos simples em complexos utilizando a energia luminosa açúcares Onde se dá a captação de luz? ACEPTOR PRIMÁRIO Fotossistemas PI 700 nm PII 680 nm ressonância foto-oxidação fóton centro de reação (2 moléculas de clorofila a) pigmentos carotenóides, clorofila a e b (20-2000 moléculas/ fotossistema) complexo antena (em volta do centro de reação) energia estados excitados estados fundamentais clorofila a do centro de transferência de E reação entre pigmentos do complexo antena calor complexo antena: pigmentos associados a proteínas As moléculas de pigmentos têm espaçamento e orientações relativas precisas. Estas permitem a transmissão de energia entre as moléculas por ressonância. Esquema Z reações endergônicas reações exergônicas D = 1,4 3 ps* O acoplamento dos dois fotossistemas se dá através de uma cadeia transportadora de elétrons. 200 ps* D = 2,0 6 ms* * duração da transferência de elétrons (em bactérias) adaptado de Lehninger, 5ª. Ed., 2008 Origem e disposição dos componentes da membrana dos tilacóides vermelho: codificado no genoma do cloroplasto cinza: codificado no genoma nuclear Cyt b6f móvel proteínas integrais de membrana com disposição específica PS I ATP sint lamelas do estroma PS II lamelas dos grana Prof. Dr. Thomas Boller, botanical Institute, Section Plant Physiology, Suiça file:///C:/WINDOWS/Temporary%20Internet%20Files/Content.IE5/S1YJ0PM3/424,15,Differenzierung von Plastiden Fluxo de Elétrons Acíclico e Foto-fosforilação + fluxo de prótons fluxo de elétrons micromolécula proteína http://en.wikipedia.org/wiki/Image:Thylakoid_membrane.png (modificado) Fluxo de Elétrons Acíclico e Foto-fosforilação fluxo de efluxo de H+ cadeia de transporte de elétrons PSI - fotossistema I PSII - fotossistema II Q - plastoquinona Cyt – citocromo PC – plastocianina Fd - ferredoxina CF - ATP sintase (pH 5) estroma (pH 8) atenção: a escala de pH é logarítmica estequiometria aproximada: 2 H2O + 8 fótons + 2 NADP + 3 ADP + 3 Pi complexos proteicos carreadores móveis de eO2 + 3 ATP + 2 NADPH • Oito a dez fótons são necessários para gerar cada O2. • 8-12 H+ são translocados através da membrana para cada O2 formado. • A ATP sintase do cloroplasto produz um ATP a cada 3 - 4 H+ translocados. adaptado de Lehninger, 2008 Plastoquinona http://www.bio.davidson.edu/courses/Bio111/NADPH.html Experimento realizado por Jagendorf, 1966 no escuro grana isolados de cloroplastos geração de ATP na ausência de luz Demonstração da teoria quimiosmótica apresentada por P. Mitchell: diferenças de pH e potenciais elétricos através de membranas são fontes de energia que podem ser utilizadas para a síntese de ATP. from Biochemistry 2nd Ed. by Garrett & Grisham, modificado Fluxo cíclico de elétrons O fluxo cíclico de elétrons gera somente ATP H+ 2H2O O2 + 4H+ esquema Z Aumenta a formação de ATP durante a fotossíntese e permite à célula regular a proporção de ATP e NADPH de acordo com as suas necessidades. Fotoinibição •epiderme sem cloroplastos •espessura da folha diminui em plantas crescidas ao sol Folhas de Alocasia expostas a diferentes intensidades de luz Arabidopsis - mutantes incapazes de induzir movimento em seus cloroplastos são mais suscetíveis ao excesso de luz (clorose e necrose de seus tecidos). Regulação da captação de luz pela planta é feita ao nível do: • corpo da planta • tecidos • organelas • fisiológico • bioquímico Fotoinibição A fotoinibição ocorre quando a quantidade de luz absorvida pelas plantas é maior do que pode ser utilizada na fotossíntese. excesso de fótons calor produtos tóxicos (O-2, H2O2, OH.,1O2*) agentes fotoprotetores fotossitemas fotossistema danificado fotoinibição reparo síntese “de novo” Mecanismos de contornar a fotoinibição: • movimento das folhas • movimento dos cloroplastos • “Quenching “ com perda de E na forma de calor • agentes fotoprotetores (carotenóides, superoxide dismutase, ác. ascórbico) • reparo e síntese “de novo” do fotossistema Phenotypic change of Microcystis PCC 7806 during culture two phenotypes absorbance relativeabsorbance relative 0,23 0,22 green culture1 chlorotic culture2 0,21 ___ 3 days1 0,20 _._ 3 days 1 1515days days ....... …... days 2 3535days 0,19 590 640 690 740 wavelength (nm) wavelength (nm) Dagnino, D, et al., Environmental Microbiology, 2006 Whole cell absorption spectra of a culture collected at different growth stages. Effect of the conditioned medium of chlorotic Microcystis PCC 7806 cultures on the ultra-structure of Microcystis PCC 7806 cells cultured under nutrient replete conditions green culture chlorotic culture culture with conditioned medium Próxima aula: Reações de Fixação de Carbono Ou: Ciclo de Calvin-Benson 6 x 3-fosfoglicerato 3 x intermediário instável 6C 3 x CO2 1C 1C 6C 6C 3C 3C 3C 3C 3C 3C 6 ATP 6 NADPH 6 H+ 6 ADP 6 Pi 6 NADP+ 1C 3C 3C 3C 3C 3C 3C 5C 5C 5C 3 ADP 3 ATP 3C 6 x gliceraldeído -3-fosfato SITES INTERESSANTES: http://photoscience.la.asu.edu/photosyn/education.html Animações: http://vcell.ndsu.edu/animations/photosynthesis/index.htm http://vcell.ndsu.edu/animations/photosystemII/index.htm Para ir além: Nelson, N. e Bem-Shen, A. 2004 Nature Reviews vol. 5 THE COMPLEX ARCHITECTURE OF OXYGENIC PHOTOSYNTHESIS doi:10.1038/nrm1525
Baixar