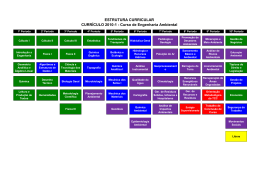
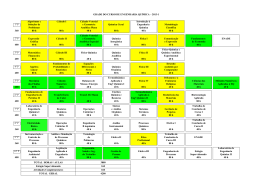
Classificassão analítica de catiões e aniões T.L.Q. II Escola da Apel Técnicas Laboratoriais Química de Trabalho elaborado por: Cátia Lucélia nº5 11ºA5 Escola da Apel Sousa e Silva Maio de 2004 Classificassão analítica de catiões e aniões T.L.Q. II Objectivos Este trabalho laboratorial tem como objectivos, analisar qualitativamente os diversos efeitos das reacções químicas, identificando e classificando os aniões e catiões aí existentes, separando-os em grupos, de acordo com as reacções ocorridas. Escola da Apel Maio de 2004 Classificassão analítica de catiões e aniões T.L.Q. II Introdução A química analítica é um ramo da química, que consiste num conjunto de técnicas e métodos que têm como objectivo determinar a composição química quantitativa e qualitativa de uma determinada amostra de matéria. Assim a química analítica qualitativa, destina-se a identificar os constituintes do referido material, enquanto que a química analítica quantitativa, tem como finalidade determinar a quantidade de cada um dos componentes que existe no material em estudo. Estas análises diferem consoante o tipo de matéria de que é constituída a amostra. Se a amostra é constituída por matéria orgânica pode realizar-se uma análise elementar ou uma identificação de compostos. Se a amostra é constituída por materiais inorgânicos, os tratamentos prévios (função do seu estado físico), a que ela é sujeita podem conduzir à formação de iões em solução, tendo então que se proceder à sua identificação; que tem como base, na maioria das vezes, alterações nas suas propriedades individuais: cor, formação ou desaparecimento de precipitados com determinados reagentes libertação de gases, entre outros. Os métodos de análise química qualitativa podem ser físicos (baseiam-se na relação entre a composição química de uma substância e as suas propriedades físicas) e químicos (transformam o elemento ou ião a identificar, num cpmposto que possui características que não permitem o erro na identificação da partícula em análise). Os métodos químicos de análise qualitativa, podem ser realizados através de: - ensaios por “via seca” quando tanto o material em estudo como os reagentes são sólidos e a reacção é efectuada em temperaturas elevadas, por exemplo o ensaio de chama , utilizado na identificação de metais; - ensaios por “via húmida” que são os mais usuais, baseiam-se em reacções entre ácidos, bases e sais, em solução aquosa; - classificação analítica de catiões que se baseia na diferença de solubilidade dos seus cloretos, sulforetos, hidróxidos e carbonatos. Uma clasificação habitual de catiões é aquela em que os associa em diferentes grupos: Escola da Apel Maio de 2004 Classificassão analítica de catiões e aniões Grupo 1º - cloretos insolúveis 2º - sulfuretos insolúveis T.L.Q. II Reagente geral HCl (aq.) H2S (g) em meio clorídrico 0,3 ml/l Catiões Ag , Pb , Hg22+ Hg2+, Cu2+, Sn2+, Sn4+, Cd2+ + 2+ 3º - hidróxidos e sulfuretos Fe3+, Al3+, Ni2+, Mn2+, insolúveis em meio NH4HO (aq) + H2S (g) Zn2+ clorídrico 4º - carbonatos insolúveis NH4HO (aq) + (NH4)2CO3 (aq) Ba2+, Sr2+, Ca2+ em meio amoniacal 5º - catiões que nã precipitam com nenhum dos Sem reagente geral Na+, K+, NH4+ reagentes gerais - classificação analítica de aniões que se recorre a uma classificação baseada nas reacções dos diferentes aniões com soluções aquosas de nitrto de prata e de cloreto de bário. Quando se utiliza esta classificação os principais aniões aparecem associados em quatro grupos: Grupo Aniões 1º - sulfato (SO42-) Apenas precipitam com BaCl2 2º - carbonato (CO32-) Precipitam com BaCl2 e AgNO3 3º - cloreto (Cl-) Apenas precipitam com AgNO3 4º - nitrato (NO3-) Não precipitam nem com BaCl2 nem com AgNO3 A identificação dos iões de uma amostra pode ser feita de uma forma sistemática (quando os iões de uma mistura se separam em grupos de acordo com reacções típicas com determinados reagentes – reagentes gerais) ou fraccionada (quando a composição do materialé conhecida, ou se deseja apenas verificar a presença ou ausência de certos iões). Reagente geral é, o reagente que permite agrupar os iões em grupos analíticos. Após esta separação, é necessário identificar cada um dos iões presentes, utilizando reagentes selectivos, que permitem a separaçõa dos iões dentro de cada grupo. Depois desta última separação, resta apenas a identificação do ião em causa, com a ajuda de um reagente específico. Neste protocolo experimental, foi utilizado mais concretamente a química analítica qualitativa para a identificação e classificação de catiões e aniões, recorrendo à análise sistemática. Escola da Apel Maio de 2004 Classificassão analítica de catiões e aniões T.L.Q. II Material - conta-gotas - rótulos - suporte de tubos de ensaio - tubos de ensaio Produtos/Reagentes - ácido clorídrico 3 mol/dm3 - ácido nítrico 3 mol/dm3 - soluções aquosas de: brometo de potássio carbonato de amónio 2 mol/dm3 carbonato de sódio cloreto de amónio (saturado) cloreto de bário cloreto de sódio hidróxido de amónio (saturado) nitrato de cálcio tetraidratado nitrato de chumbo (II) nitrato de cobre (II) nitrato de níquel (II) hexaidratado nitrato de potássio nitrato de prata sulfato de amónio tiocetamida Escola da Apel Maio de 2004 Classificassão analítica de catiões e aniões T.L.Q. II Procedimento Experimental Classificação analítica de catiões: 1- Rotulou-se 5 tubos de ensaio com Pb2+, Cu2+, Ni2+, Ca2+ e K+, respectivamente. 2- Deitou-se em cada um deles 10 gotas de solução que contenha o catião indicado no rótulo. 3- Juntou-se 10 gotas de ácido clorídrico a cada um deles, observou-se e registou-se. 4- Adicionou-se 10 gotas de solução de tiocetamida aos tubos onde não houve formação de precipitados, observou-se e registou-se. 5- Adicionou-se 10 gotas de hidróxido de amónioaos tubos onde ainda não houve formação de precipitados, observou-se e registou-se. 6- Adicionou-se 10 gotas de carbonato de amónio aos tubos onde continua a não ocorrer precipitação, observou-se e registou-se. Classificação analítica de aniões: 1- Rotulou-se 5 tubos de ensaio com CO32-, SO42-, NO3-, Cl- e Br-, respectivamente. 2- Colocou-se me cada um deles 10 gotas de solução que contenha o respectivo anião. 3- Adicionou-se 10 gotas de solução de nitrato de prata a cada um dos tubos. Observou-se e registou-se. 4- Adicionou-se 10 gotas de ácido nítrico, apenas nos tubos onde ocorreu precipitação. Observou-se e registou-se. 5- Repetiu-se os procedimentos 1 e 2. 6- Adicionou-se 10 gotas de solução de cloreto de bário a cada um dos tubos. Observou-se e registou-se. Escola da Apel Maio de 2004 Classificassão analítica de catiões e aniões T.L.Q. II 7- Nos tubos onde ocorreu a formação de precipitados adicionou-se 10 gotas de ácido nítrico. Observou-se e registou-se. Resultados Reacções dos catiões: Reagentes Ácido clorídrico Hidróxido de amónio Teocetamida Carbonato de amónio Catiões Pb2+ Precipitado branco Cu2+ ------- Precipitado branco Ni2+ ------- -------- Precipitado branco Ca2+ ------- -------- -------- K+ ------- -------- -------- Precipitado branco -------- Reacções dos aniões: Reagentes Nitrato de prata Ácido nítrico Cloreto de bário Ácido nítrico Precipitado branco Precipitado branco ---------- Solúvel Aniões CO32- Precipitado branco SO42- ---------- NO3- ---------Precipitado branco Precipitado branco ClBr- Escola da Apel solúvel Insolúvel ---------- Insolúvel ---------- Insolúvel Maio de 2004 Classificassão analítica de catiões e aniões T.L.Q. II Discussão Após a realização desta actividade experimental, poude-se constatar que os objectivos pretendidos foram alcançados com sucesso, isto é, foi possível a identificação e sucessiva classificação dos catiões e aniões nas amostras estudadas. Classificação analítica de catiões: Nesta primeira experiência pode-se observar que ao adicionar o ácido clorídrico às soluções contidas nos diferentes tubos de ensaio, e sabendo que este é o reagente geral do grupo I, apenas o catião chumbo reagiu, originando um precipitado branco, de acordo com a seguinte equação: Pb(NO3)2 (aq) + 2HCl (aq) PbCl2 (s) + 2HNO3 (aq) Constantando-se deste modo que o chumbo é um catião que pertence ao grupo I (dos cloretos insolúveis). No decorrer da actividade, quando adicionada a teocetamida (reagente geral do grupo II) aos restantes tubos, mais uma vez foi visualizada uma reacção de precipitação de cor branca, mas desta vez no tubo de ensaio que continha o catião cobre, segundo a seguinte equação: Cu(NO3)2 (aq) + S (aq) CuS (s) + 2NO3 (aq) Confirmando-se assim que este pertence ao grupo II, ou seja, o grupo dos sulfuretos insolúveis em meio ácido. Seguidamente foi registado a reacção do nóquel, verificando-se a formação de precipitado branco, quando procedeu-se à adição do hidróxido de amónio (reagente geral do grupo III) aos tubos cujas preparações ainda não tinham reagido. Com resultado chegou-se à conclusão que o catião níquel pertence ao grupo dos hidróxidos e sulfuretos insolúveis em meio clorídrico (grupo III). Esta reacção pode ser ilustrada pela seguinte equação química: Ni(NO3)2 (aq) + 2NH4OH (aq) NiOH (s) + 2NH4NO3 (aq) Restando apenas duas preparações para identificar e classificar os catiões nelas contidos, colocou-se nestes carbonato de amónio, reagente geral do grupo IV, e, apenas no tubo de ensaio com cálcio foi visualizado precipitado de cor branca, indicando Escola da Apel Maio de 2004 Classificassão analítica de catiões e aniões T.L.Q. II que este catião pertence ao grupo IV (dos carbonatos insolúveis em meio amoniacal), podendo ser traduzida pela reacção abaixo apresentada: Ca(NO3)2 (aq) + (NH4)2CO3 (aq) CaCO3 (s) + 2NH4NO3 (aq) Chegando ao fim da classificação dos catiões a estudadar, ainda pode-se concluir que o catião potássio por não ter reagido com nenhum dos reagentes gerais atrás enunciados, é considerado um catião pertencente ao grupo dos catiões que não precipitam com nenhum dos reagentes gerasi (grupo V). Classificação Analítica de aniões: Nesta segunda actividade, e para concluir o trabalho experimental sobre a identificação e classificação de iões, procedeu-se à identificação dos aniões. Numa primeira fase, foi adicionado nitrato de prata a todos os tubos, cujas soluções continham os aniões a identificar. Quando este foi adiciondo à solução de carbonato de sódio observou-se a formação de um precipitado branco de carbonato de prata, ficando o restante em solução aquosa. Para melhor compreensão e análise do sucedido realizou-se a seguinte equação desta reacçaõ: Na2CO3 (aq) + 2AgNO3 (aq) 2NaNO3 (aq) + Ag2CO3 (s) Visto que a solução reagiu adicionou-se a esta ácido nítrico, que com a ajuda da seguinte equação: Ag2CO3 (s) + 2HNO3 (aq) 2AgNO3 (aq) + H2CO3 (aq) verificou-se, então que o precipitado formado era solúvel na presença deste reagente, logo o anião carbonato pertence ao grupo dos carbonatos, pelas razões já atrás mencionadas. Recordando o procedimento, não foi só o carbonato que reagiu, mas também o cloreto e o brometo, que por, mais uma vez, terem reagido com o nitrato de prata, traduzindo-se pelas seguintes equações: NaCl (aq) + AgNO3 (aq) NaNO3 (aq) + AgCl (s) KBr (aq) + AgNO3 (aq) KNO3 (aq) + AgBr (s) foram a estas soluções resultantes, adicionado o ácido nítrico, reparou-se que tanto o precipitado de cloreto de prata como o de brometo de prata, produtos da treacção entre o cloreto de sódio e o nitrato de prata; e entre o; brometo de potássio e o nitrato de prata, Escola da Apel Maio de 2004 Classificassão analítica de catiões e aniões T.L.Q. II eram insolúveis, o que fez com que se conclui-se que estes dois aniões fazem parte do grupo dos cloretos. Para finalizar esta experiência, foi adicionado cloreto de bário a novas soluções semelhantes às iniciais. Desta vez, visualizou-se que apenas o sulfato e novamente o carbonato, reagiram, formando-se precipitados brancos. Para cada uma dessas reacções foi elaborado a equação química correspondente: BaCL2 (aq) + (NH4)2SO4 (aq) Na2CO3 (aq) + BaCl2 (aq) BaSO4 (aq) + 2H(NH4)Cl (s) 2NaCl (aq) + BaCO3 (s) Pegou-se pois nestas preparações e colocou-se ácido nítrico, nesta junção observou-se que apenas o sólido de carbonato de bário era solúvel. A equação que representa esta reacção é a seguinte: BaCO3 (s) + 2HNO3 (aq) Ba(NO3)2 (aq) + H2CO3 (aq) Observados e registados todos estes factos, pode-se concluir que o sulfato pertence ao grupo dos sulfatos, porque estes aniões apenas precipitam coma solução aquosa de cloreto de bário e são insolúveis na presença do ácido nítrico; e o nitrato, como não precepitaram com nenhum dos reagentes, fazem parte do grupo dos nitratos. Escola da Apel Maio de 2004 Classificassão analítica de catiões e aniões T.L.Q. II Conclusão Com este trabalho chegou-se à conclusão que é possível identificar e classificar catiões e aniões, agrupando-os, por meio de vários processos com reagentes e observando essas reacções. Existem pois, cinco grupos de catiões (I;II;III;IV;V) aos quais pode-se juntar tantos catiões quanto quisermos, desde que reajam da mesma forma, ou então não reajam. Acontecendo o mesmo com os aniões, que com apenas quatro grupos (sulfatos, carbonatos, cloretos e nitratos), sã sujeitos a alguns testes para visualização das reacções e só depois conforme essas reacções, são finalmente classificados. Pode-se então finalizar, este protocolo experimental, que mais uma vez pernitiu um maior conhecimento a nível laboratorial, com a certeza de que todos os objectivos propostos foram alcançados. Escola da Apel Maio de 2004 Classificassão analítica de catiões e aniões T.L.Q. II Bibliografia # SIMÕES Teresa, QUEIRÓS Maria, et al, Técnicas Laboratoriais de Química, Bloco II (1999), Porto, Porto editora. # PINTO H. C., CARVALHA M. de J., Fialho M. M. (2003), Técnicas Laboratoriais de Química, Lisboa, Texto Editora. Observações:_____________________________________________________ ________________________________________________________________________ ________________________________________________________________________ __ Escola da Apel Maio de 2004
Download