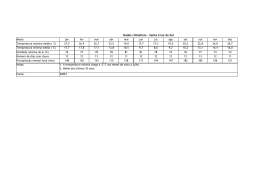
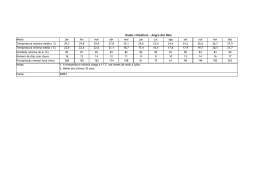
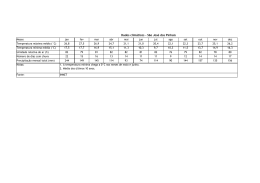
HIDROMETALURGIA E ELETROMETALURGIA Precipitação Iônica • É um processo baseado no fato de que, quando um reagente é adicionado a uma solução contendo íon metálico, é formado um composto cuja solubilidade é muito baixa, sob as condições operacionais adotadas. • Exemplo: Quando NaS é adicionado a uma solução de CuSO4, ocorre precipitação imediata de CuS porque os íons Cu2+ e S2- reagem para formar um composto de baixa solubilidade. HIDROMETALURGIA E ELETROMETALURGIA Precipitação Iônica • O reagente empregado para a formação do precipitado é chamado de agente precipitante. Cu2+ + S2- → CuS • Este fato marca a diferença entre a precipitação iônica e a cristalização. Na cristalização, o composto precipitado tem uma elevada solubilidade e condições apropriadas devem ser encontradas para possibilitar a cristalização. HIDROMETALURGIA E ELETROMETALURGIA Precipitação Iônica • A presença de íons fosfato na solução pode acarretar a precipitação de muitos metais na forma de fosfatos, conforme a reação abaixo: 3 Mx+ + x PO43- → M3(PO4)x • Esse fato pode reduzir a eficiência do processo de produção do metal de interesse já que exigirá a recuperação do metal e separação do fosfato. HIDROMETALURGIA E ELETROMETALURGIA Precipitação Iônica • A presença de arsênio no minério ou resíduo também é um fator indesejável, uma vez que contamina o precipitado ou causa problemas na disposição da solução em função da sua toxicidade. • Logo, a precipitação de arsênio, que geralmente ocorre com formação de arsenatos de cálcio e ferro, é um problema na hidrometalurgia. 2 AsO43- + 3 Ca2+ → Ca3(AsO4)2 AsO43- + Fe3+ → FeAsO4 HIDROMETALURGIA E ELETROMETALURGIA Precipitação Iônica • As reações hidrolíticas podem acarretar a precipitação dos produtos na forma de óxidos, hidróxidos ou hidróxi-sais dependendo da temperatura, da concentração da solução e das características dos íons metálicos contidos na solução. • Íons metálicos em solução aquosa encontram-se solvatados, ou seja, estão ligados a um número de moléculas de H2O orientadas de forma que a parte negativa do dipolo da água é direcionada para a carga positiva do íon metálico. HIDROMETALURGIA E ELETROMETALURGIA Precipitação Iônica • A perda de H+ da H2O ocorre rapidamente. Isso decorre do fato das soluções salinas serem ácidas. [Fe(H2O)6.OH]2+ + H+ ou simplesmente Fe3+ + H2O → FeOH2+ + H+ • Este processo é chamado de hidrólise e continua ocorrendo até que uma espécie sem carga seja formada: FeOH2+ + H2O → [FeOH2]+ + H+ [FeOH2]+ + H2O → Fe(OH)3 + H+ HIDROMETALURGIA E ELETROMETALURGIA Precipitação Iônica • Quando o íon metálico se torna eletricamente neutro, a precipitação ocorre. • A partir das reações anteriores, fica evidente que a precipitação de um produto hidrolítico pode ser favorecida pela adição de íons OH-, ou seja, pelo aumento do pH. Isto porque os íons OH- reagem com os íons H+ formados e o equilíbrio da reação é deslocado para a direita. • Porém, aumento excessivo do pH pode acarretar a formação de espécies negativas solúveis.
Baixar