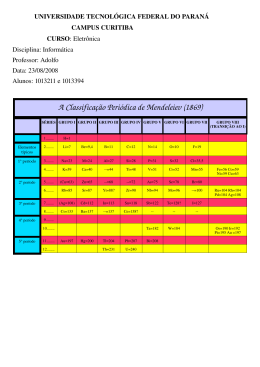
SEDF- CEM 09 Química Prof.: Cláudio Luiz Texto Base nº 2 Historia da Tabela Periódica Fonte: <www.wikipedia.com> Em 1789, Antoine Lavoisier publicou uma lista de 33 elementos químicos. Embora Lavoisier tenha agrupado os elementos em substâncias simples, metálicas, não metálicas e salificáveis ou terrosas,[1] [2] químicos passaram o século seguinte à procura de um esquema de construção mais precisa. Em 1829, Johann Wolfgang Döbereiner observou que muitos dos elementos poderiam ser agrupados em tríades (grupos de três) com base em suas propriedades químicas. Lítio, sódio e potássio, por exemplo, foram agrupados como sendo metais reativos frágeis. Döbereiner observou também que, quando organizados por peso atômico, o segundo membro de cada tríade tinha aproximadamente a média do primeiro e do terceiro.[3] Isso ficou conhecido como a lei das tríades.[4] O químico alemão Leopold Gmelin trabalhou com esse sistema e por volta de 1843 ele tinha identificado dez tríades, três grupos de quatro, e um grupo de cinco. Jean Baptiste Dumas publicou um trabalho em 1857 descrevendo as relações entre os diversos grupos de metais. Embora houvesse diversos químicos capazes de identificar relações entre pequenos grupos de elementos, não havia ainda um esquema capaz de abranger todos eles.[1] [3] Em 1869, o também químico alemão Julius Lothar Meyer publicou uma tabela com os 49 elementos conhecidos organizados pela valência, conceito desenvolvido por August Kekulé seis anos antes. A tabela revelava que os elementos com propriedades semelhantes frequentemente partilhavam a mesma valência.[5] O químico inglês John Newlands publicou uma série de trabalhos em 1863 e 1866 que descreviam sua tentativa de classificar os elementos: quando listados em ordem crescente de peso atômico, semelhantes propriedades físicas e químicas retornavam em intervalos de oito, que ele comparou a oitavas de músicas.[6] [7] Esta lei das oitavas, no entanto, foi ridicularizada por seus contemporâneos.[8] Tabela proposta por Mendeleiev em 1869. O professor de química russo Dmitri Ivanovich Mendeleiev e Julius Lothar Meyer publicaram de forma independente as suas tabelas periódicas em 1869 e 1870, respectivamente. Ambos construíram suas tabelas de forma semelhante: listando os elementos de uma linha ou coluna em ordem de peso atômico e iniciando uma nova linha ou coluna quando as características dos elementos começavam a se repetir.[9] O sucesso da tabela de Mendeleiev surgiu a partir de duas decisões que ele tomou: a primeira foi a de deixar lacunas na tabela quando parecia que o elemento correspondente ainda não tinha sido descoberto.[10] Mendeleiev não fora o primeiro químico a fazê-lo, mas ele deu um passo adiante ao usar as tendências em sua tabela periódica para predizer as propriedades desses elementos em falta, como o gálio e o germânio.[11] A segunda decisão foi ocasionalmente ignorar a ordem sugerida pelos pesos atômicos e alternar elementos adjacentes, tais como o cobalto e o níquel, para melhor classificá-los em famílias químicas. Com o desenvolvimento das teorias de estrutura atômica, tornou-se aparente que Mendeleiev tinha, inadvertidamente, listado os elementos por ordem crescente de número atômico.[12] Com o desenvolvimento das modernas teorias mecânica quânticas de configuração de elétrons dentro de átomos, ficou evidente que cada linha (ou período) na tabela correspondia ao preenchimento de um nível quântico de elétrons. Na tabela original de Mendeleiev, cada período tinha o mesmo comprimento. No entanto, como os átomos maiores têm subníveis, tabelas modernas têm períodos cada vez mais longos na parte de baixo.[13] Em 1913, através do trabalho do físico inglês Henry G. J. Moseley, que mediu as frequências de linhas espectrais específicas de raios X de um número de 40 elementos contra a carga do núcleo (Z), pôde-se identificar algumas inversões na ordem correta da tabela periódica, sendo, portanto, o primeiro dos trabalhos experimentais a ratificar o modelo atômico de Bohr. O trabalho de Moseley serviu para dirimir um erro em que a química se encontrava na época por desconhecimento: até então os elementos eram ordenados pela massa atômica e não pelo número atômico.[2] [14] Nos anos que se seguiram após a publicação da tabela periódica de Mendeleiev, as lacunas que ele deixou foram preenchidas quando os químicos descobriram mais elementos químicos. O último elemento de ocorrência natural a ser descoberto foi o frâncio (referido por Mendeleiev como eka-césio) em 1939.[15] A tabela periódica também cresceu com a adição de elementos sintéticos e transurânicos. O primeiro elemento transurânico a ser descoberto foi o netúnio, que foi formado pelo bombardeamento de urânio com nêutrons num ciclotron em 1939. Grupos e Períodos Fonte: <http://mundoeducacao.bol.uol.com.br/quimica/periodos-familias-tabela-periodica.htm> Na Tabela Periódica, os elementos químicos estão dispostos em ordem crescente de número atômico, o que faz com que eles estejam posicionados em colunas horizontais (períodos) e colunas verticais (famílias). A Tabela Periódica apresenta sete colunas horizontais, portanto, sete períodos, que indicam a quantidade de níveis que um átomo de um elemento apresenta. Isso quer dizer que, quanto maior o número do período do elemento, maior será a quantidade de níveis que cada um dos átomos do elemento apresenta. Se um determinado elemento está posicionado no 5o Período da Tabela Periódica, por exemplo, quer dizer que cada um de seus átomos apresenta cinco níveis eletrônicos ou cinco camadas eletrônicas. Veja alguns exemplos: • Na (terceiro período) = seus átomos apresentam três níveis; • Po (sexto período) = seus átomos apresentam seis níveis; • H (primeiro período) = seus átomos apresentam um nível; • Cu (quarto período) = seus átomos apresentam quatro níveis. As colunas verticais, que são em número de 18, são denominadas de famílias. A Tabela apresenta 18 colunas, que formam apenas 16 famílias divididas em oito do tipo A e oito do tipo B. Representação das 18 colunas verticais da Tabela Periódica As famílias A são formadas pelas duas primeiras e pelas seis últimas colunas verticais da Tabela. Sendo assim, cada uma das colunas recebe a seguinte indicação: • coluna 1 = Família IA • coluna 2 = Família IIA • coluna 13 = Família IIIA • coluna 14 = Família IVA • coluna 15 = Família VA • coluna 16 = Família VIA • coluna 17 = Família VIIA • coluna 18 = Família VIIIA Representação das famílias “A” da Tabela Periódica Já as famílias B são compostas pelas colunas de 3 a 12. É importante observar que temos um total de 10 colunas que formam as famílias B. Por que então só consideramos oito famílias? Os elementos químicos que compõem as colunas 8 (coluna do ferro), 9 (coluna do cobalto) e 10 (coluna do níquel) apresentam características semelhantes e, por isso, consideramos essas três colunas como sendo uma única família. Sendo assim, cada uma das colunas recebe a seguinte indicação: • coluna 3 = Família IIIB • coluna 4 = Família IVB • coluna 5 = Família VB • coluna 6 = Família VIB • coluna 7 = Família VIIB • coluna 8, 9 e 10 = Família VIIIB • coluna 11 = Família IB • coluna 12 = Família IIB Representação das Famílias B da Tabela Periódica Observação: As duas colunas horizontais localizadas do lado de fora da Tabela Periódica pertencem, respectivamente, ao sexto e sétimo períodos da família IIIB. Elas foram posicionadas assim para não descaracterizarem a tabela, já que cada uma delas apresenta 15 elementos diferentes. Representação do sexto e sétimo períodos da família IIIB Os Elementos Representativos Os elementos representativos, também chamados de elementos típicos ou característicos, são os mais estudados no Ensino Médio. De acordo com a notação mais antiga, esses elementos localizavam-se nas famílias identificadas pela letra “A”, que eram, respectivamente: IA, IIA, IIIA, IV A, VA, VIA, VIIA e VIIIA. Porém, essa notação está ultrapassada. Hoje as famílias da Tabela Periódica são representadas somente por números, indo de 1 a 18, sendo que os elementos representativos compõem as famílias 1, 2 e 13 a 18. Os elementos representativos possuem o elétron mais energético no subnível s ou p, dependendo da família a que pertence. Veja cada uma: • Família 1 (Li, Na, K, Rb, Cs, Fr): Família dos metais alcalinos — palavra que vem do árabe alcali, que significa “cinza de plantas”, de onde principalmente o sódio e o potássio eram extraídos. Todos esses elementos possuem no subnível mais energético apenas 1 elétron (ns 1). O hidrogênio encontra-se nessa família porque ele possui um elétron na sua camada de valência, porém, suas características não se enquadram nesse e em nenhum outro grupo da Tabela Periódica. Veja algumas configurações eletrônicas: 11Na: 1s 2 2s2 2p6 3s1 ; 19K: 1s2 2s2 2p6 3s2 3p6 4s1 ; 37Rb: 1s 2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 . Os metais alcalinos são sólidos, porém, macios; além disso, podem ser cortados com uma faca, mas são altamente reativos. Como é o caso do sódio, que explode violentamente ao ser colocado em contato com a água: • Família 2 (Be, Mg, Ca, Sr, Ba, Ra): Metais alcalinoterrosos, sendo que o termo “terroso” refere-se a “existir na terra”. Todos eles possuem dois elétrons no último nível e a configuração eletrônica termina em ns 2.Veja: 12Mg: 1s 2 2s2 2p6 3s2 ; 20 Ca: 1s2 2s2 2p6 3s2 3p6 4s2; 38 Sr: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2. Os mais importantes entre esses metais são o magnésio e o cálcio, sendo muito abundantes na natureza. Por exemplo, o cálcio está presente na forma de seus vários minerais, como o carbonato de cálcio do mármore e do calcário, e na gipsita (sulfato de cálcio di-hidratado) usada como gesso. • Família 13 (B, Al, Ga, In, Tl): Todos possuem três elétrons no último nível e a configuração eletrônica termina em ns 2 np 1. O alumínio é o mais importante deles, pois é bastante utilizado em estruturas e em objetos em vários setores da sociedade, tais como na construção civil, nos transportes (como em carrocerias de automóveis, embarcações, fuselagens de aviões e em aros de bicicletas), em eletroeletrônica, na indústria petroquímica e metalúrgica, em tampas de iogurte, frigideiras, papel alumínio e assim por diante. • Família 14 (C, Si, Ge, Sn, Pb): Todos possuem quatro elétrons no último nível e a configuração eletrônica termina em ns 2 np 2. O carbono é o mais importante porque ele é tetravalente, sendo capaz de formar quatro ligações com vários elementos, inclusive com ele próprio, formando as chamadas cadeias carbônicas. Em virtude da enorme quantidade de compostos do carbono, que são chamados de compostos orgânicos, criou-se um ramo na Química dedicado somente ao estudo dessas substâncias, a Química Orgânica. • Família 15 (N, P, As, Sb, Bi): Todos possuem cinco elétrons no último nível e a configuração eletrônica termina em ns 2 np 3. O nitrogênio forma o gás (N 2) mais abundante na atmosfera, possui grande importância para a manutenção da vida e é usado como gás refrigerante. • Família 16 (O, S, Se, Te, Po): Família dos calcogênios, palavra que significa “formadores de cobre”, porque os minérios de cobre contêm oxigênio ou enxofre que são elementos dessa família. Todos eles possuem 6 elétrons no último nível e a configuração eletrônica termina em ns 2 np 4 . O oxigênio é o mais importante, estando presente em muitas reações importantes, como a fotossíntese e a respiração. • Família 17 (F, Cl, Br, I, At): Família dos halogênios, palavra que significa “formadores de sais”. Todos possuem sete elétrons no último nível e a configuração eletrônica termina em ns 2 np 5 . O cloro é o mais importante, pois seus compostos são usados, por exemplo, na água, em estações de tratamento, e em piscinas tendo por objetivo desinfetar e manter a água limpa. • Família 18 (He, Me, Ar, Kr, Xe, Rn): Família dos gases nobres. Todos possuem oito elétrons no último nível e a configuração eletrônica termina em ns 2 np 6 . Eles são os únicos elementos encontrados, em sua forma isolada, estáveis na natureza.
Download