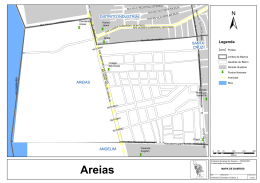
PLANO DE MANEJO DA UNIDADE DE CONSERVAÇÃO – UC SERRA DAS AREIAS - VOLUME III - DIAGNÓSTICO MEIO BIÓTICO Construindo o Plano de Manejo da UC Serra das Areias de forma participativa e sustentável Aparecida de Goiânia – Goiás 2015 Plano de Manejo UC Serra das Areias i BRANDÃO, Divino; SIQUEIRA, N. Mariana e MATTOS & CÍMACO LTDA. Plano de Manejo da Unidade Conservação - UC Serra das Areias. Diagnóstico do Meio Biótico, Aparecida de Goiânia, 2015. A MATTOS E CLIMACO LTDA E A PREFEITURA MUNICIPAL DE APARECIDA DE GOIÂNIA, autorizam a reprodução total ou parcial desta obra, por qualquer meio convencional ou eletrônico, para estudos de pesquisa, desde que citada à fonte. Nenhum uso desta publicação pode ser feito para revenda ou fins comerciais, sem prévia autorização por escrito das referidas instituições. Plano de Manejo UC Serra das Areias ii APRESENTAÇÃO DA EQUIPE TÉCNICA DO MEIO BIÓTICO COORDENAÇÃO: Biól. Divino Brandão Universidade Federal de Goiás-UFG Mestre em Ecologia Universidade de Brasília- UnB Doutor em Ecologia Universidade de Campinas- UNICAMP CFB 00466/04 - D Coordenação do Meio Biótico Biól. Mariana Nascimento Siqueira Universidade Federal de Goiás-UFG Mestre em Geografia – UFG Universidade Federal de Goiás-UFG Doutoranda em Ciências Ambientais Universidade Federal de Goiás-UFG CRBio -044524/04-D Coordenação do Meio Biótico RESPONSABILIDA TÉCNICA: GRUPO TAXONÔMICO: Biól. Luiz Gonzaga Alves Mendonça Especialista em Educação Ambiental - PUC-GO Mestre em Ecologia e Produção Sustentável - PUC-GO Avifauna Biól. Leonardo Lima Bergamini Mestre em Ecologia e Evolução - UFG Doutorando em Ecologia Evolução – UFG Entomofauna Biól. Raísa Romênia Silva Vieira Mestre em Ecologia e Evolução – UFG Herpetofauna Biól. Renan Nunes Costa Mestre em Ecologia e Evolução – UFG Doutorando em Ecologia e Conservação da Biodiversidade – UESC Herpetofauna Biól. Bruno Bastos Gonçalves Mestre em Ecologia e Evolução - UFG Doutorando em Aqüicultura –UNESP Ictiofauna Plano de Manejo UC Serra das Areias iii Biól. Maysa Farias de Almeida Araújo Mestranda em Ecologia e Conservação dos Recursos Naturais – UFU Macroinvertebrados aquáticos Biól. Túlio Max Oliveira Guimarães Mestre em Ecologia e Evolução – UFG Mastofauna Biól. Walter dos Santos Araújo Mestre em Ecologia e Evolução - UFG Doutorando em Ecologia Evolução – UFG Flora Biól. Carlos de Melo e Silva Neto Mestre em Biodiversidade Vegetal - UFG Doutorando em Agronomia – UFG Flora Biól. Mariana Nascimento Siqueira Mestre em Geografia – UFG Doutoranda em Ciências Ambientais – UFG Flora PARTICIPAÇÃO: GRUPO TAXONÔMICO: Alessandro Martins de Moura Guilherme Teodoro de Souza Jéssica Ribeiro Gonçalves Avifauna Avifauna Avifauna Bárbara Araújo Ribeiro Bergamini Entomofauna Arthur Gomes Bauer Herpetofauna Raphael Pires de Campos Ictiofauna Maysa F. Almeida Araújo Alexandre Ferreira Righi Macroinvertebrados aquáticos Fernanda Loyola Junqueira Bruno Cavalcante Gomes Mastofauna Mastofauna Pedro Henrique Coelho Ramos Mastofauna Plano de Manejo UC Serra das Areias iv Julio Miguel Grandez Rios Maísa Priscila Peres Rodolph Delfino Sartin Marco Antônio Pires Ferreira do Padro Flora Flora Flora Flora COLABORAÇÃO: Guarda Municipal do Município de Aparecida de Goiânia Plano de Manejo UC Serra das Areias Apoio Logístico e de Segurança v LISTA DE FIGURAS Figura 1: Localização das duas Unidades da Serra que comportam uma maior conservação dos recursos naturais (em vermelho) e, fora dessas unidades, a localização de uma área com predomínio de atividades antrópicas. Em preto está o limite da Unidade de Conservação Serra das Areias............................................................................13 Figura 2: Áreas estudadas em vermelho .................................................................................14 Figura 3: Localização dos pontos amostrados para cada grupo ..............................................16 Figura 4: Coleta manual de himenópteros visitantes florais. ..................................................18 Figura 5: Armadilha de essência, que atrai machos da tribo Euglossini.................................18 Figura 6: Armadilha do tipo Pit-fall, com isca de fígado bovino suspensa pela tampa plástica...18 Figura 7: Armadilha luminosa do tipo CDC, que captura insetos hematófagos atraídos pela luz. ..........................................................................................................................18 Figura 8: Exemplos de pontos amostrados nas áreas (1) mais conservadas e elevadas e (2) mais planas e antropizadas na Unidade de Conservação Serra das Areias. ...........21 Figura 9: Distribuição dos pontos amostrados nas áreas elevadas e mais conservadas (contorno vermelho) e mais planas e antropizadas (contorno preto) na Unidade de Conservação Serra das Areias ................................................................................22 Figura 10: Métodos de amostragem da herpetofauna. .............................................................23 Figura 11:Pontos amostrais de ictiofauna na Unidade de Conservação Serra das Areias. As linhas vermelhas representam os limites das unidades mais elevadas e conservadas da Unidade de Conservação. A linha preta representa o contorno da UC Serra das Areias. P1, P2 e Ponto Lagoa são os pontos de coleta da ictiofauna......................25 Figura 12:Biólogos realizando a pesca através de rede de arrasto..........................................26 Figura 13:Biólogo capturando peixes através de uso de puçá de mão....................................26 Figura 14:Pesagem e medição dos peixes...............................................................................27 Figura 15:Pontos de coleta na Unidade de Conservação Serra das Areias, situado no munícipio de Aparecida de Goiânia – Goiás. Córrego da Mata (à esquerda) e Córrego Santo Antônio (à direita). .........................................................................28 Figura 16:Amostragem de invertebrados aquáticos, utilizando amostrador do tipo súber, nas áreas de influência da UC Serra das Areias............................................................28 Plano de Manejo UC Serra das Areias vi Figura 17:Imagem de Satélite da delimitação da UC Serra das Areias (preto) e respectivas Unidades Topográficas Elevadas (vermelho), contendo os transectos feitos a pé (amarelo) e de camionete (azul), além de pontos onde as espécies foram encontradas .............................................................................................................30 Figura 18:Mapa de Vegetação da Unidade de Conservação Serra das Areias, em Aparecida de Goiânia...............................................................................................................33 Figura 19:Detalhe do mapeamento fitofisionomico................................................................34 Figura 20:Biólogos realizando o levantamento florístico da vegetação. ................................34 Figura 21:Vista geral de uma parcela de amostragem em cerrado típico. ..............................36 Figura 22:Detalhe da amostragem fitossociológica. ...............................................................36 Figura 23:Ilustração de três espécies de aves registradas na Unidade de Conservação Serra das Areias. ..............................................................................................................42 Figura 24:Mata de Galeria no Jardim Monte Sinai.................................................................43 Figura 25:Mata de Galeria do Córrego da Mata em vermelho ...............................................44 Figura 26 Adolescentes caçadores de aves na Unidade de Conservação Serra das Areias. ...44 Figura 27:Cerrado próximo à torre, onde foram realizados o levantamento de aves nas unidades topográficas elevadas na Unidade de Conservação Serra das Areias .....46 Figura 28:(a) Áreas de Pastagem na unidade topográfica plana que foi avaliada quanto à riqueza da Avifauna, na Unidade de Conservação Serra das Areias e, (b) Área Crítica (provável corredor ecológico), sendo o corredor de vegetação restrito ao córrego da Mata que une as duas unidades topográficas elevadas .........................48 Figura 29: Redes de interação entre Himenópteros polinizadores e plantas nas Unidades Topográficas Elevadas. As fileiras superiores de retângulos representam as espécies de himenópteros, e as fileiras inferiores as espécies de plantas As espécies que interagiram são conectadas por retângulos cinza, com larguras proporcionais ao número de interações observadas. São mostrados os nomes das três espécies com mais interações para cada grupo. Painel superior – UTE-1, campanha 1, Painel do meio – UTE 1, campanha 2, Painel inferior – UTE 2, campanha 2.......................................58 Figura 30:Riqueza de taxa de artrópodes de solo encontrada em cada uma das fisionomias amostradas, e números de taxa compartilhados entre as fisionomias.....................59 Figura 31:Redes de interação entre Himenópteros polinizadores e plantas nas Unidades Topográficas Planas (UTP). As fileiras superiores de retângulos representam as espécies de himenópteros, e as fileiras inferiores as espécies de plantas As espécies que interagiram são conectadas por retângulos cinza, com larguras proporcionais ao número de interações observadas. São mostrados os nomes das Plano de Manejo UC Serra das Areias vii três espécies com mais interações para cada grupo. Painel superior – UTP-1, campanha 1, Painel do meio – UTP 1, campanha 2, Painel inferior – UTP 2, campanha 2.............................................................................................................62 Figura 32:Thalestria spinosa, espécie de abelha cleptoparasita de abelhas do gênero Oxaea. Aumento de aprox.. 10 vezes..................................................................................65 Figura 33:Apis melífera, espécie exótica amplamente distribuída no Brasil. .........................65 Figura 34:Sphecini sp.01.........................................................................................................65 Figura 35:Augochloropsis sp.01. Aumento de 10 vezes .........................................................65 Figura 36:Mesocheira bicolor. Aumento de 10 vezes ............................................................66 Figura 37:Coelioxys assumptionis. Aumento de 10 vezes ......................................................66 Figura 38:Algumas das espécies registradas na UC Serra das Areias. A. Rhinella rubescens; B. Barycholos ternetzi; C. Ameerega flavopicta; D. Dendropsophus minutus; E. D. cruzi; F. Hypsiboas lundii; G. Pseudis bolbodactyla; H. Leptodactylus podicipinus; I. Scinax fuscomarginatus; J. Elachistocleis cesarii; K. Tropidurus sp.; L. Oxyrhopus trigeminus. ................................................................................69 Figura 39:Riqueza observada (rarefação) e estimada (estimador Jackknife) de anfíbios na UC Serra das Areias. As barras representam o intervalo de confiança para a riqueza estimada. .................................................................................................................70 Figura 40:Riqueza observada (rarefação) e estimada (estimador Jackknife) de répteis na UC Serra das Areias. As barras representam o intervalo de confiança para a riqueza estimada. .................................................................................................................71 Figura 41:Espécies de peixes encontradas nos pontos 1, 2 e ponto lagoa na Serra das Areias, Aparecida de Goiânia-GO. a) Astyanax altiparanae; b) Astyanax fasciatus; c) Knodus moenkhausii; d) Piabina argentea; e) Characidium zebra; f) Hoplias malabaricus; g) Hoplias sp.; h) Apareiodon sp.; i) Parodon nasus; j) Poecilia reticulata; k) Cichlasoma paranaense; l) Tilapia rendalli; m) Rhamdia quelen ...79 Figura 42:Mapa de vulnerabilidade de espécies de peixes da Unidade de Conservação Serra das Areias, Aparecida de Goiânia, GO...................................................................82 Figura 43:Mapa de potencialidades de espécies de peixes na UC Serra das Areias, Aparecida de Goiânia, GO .......................................................................................................84 Figura 44:Comparação da riqueza de espécies entre os pontos amostrados na Serra das Areias, Aparecida de Goiânia-GO..........................................................................85 Figura 45:Abundância de EPT nos córregos da Mata e Santo Antônio, durante a estação chuvosa (Março de 2014), situados nas áreas de influência da UC Serra das Areias, Aparecida de Goiânia, Goiás. .................................................................................88 Plano de Manejo UC Serra das Areias viii Figura 46:Riqueza de Espécies estimada pelo método Jackknife de primeira ordem (Jack 1, intervalo de confiança a 95%) e Riqueza Observada (Sobs - curva de acumulação de espécies) da região da Serra das Areias - Município de Aparecida de Goiânia.94 Figura 47:Detalhe da fitofisionomia campo sujo. .................................................................107 Figura 48:Detalhe da fitofisionomia cerrado sensu stricto. ..................................................108 Figura 49:Detalhe dos subtipos de cerrado sensu stricto. A) cerrado ralo e B) cerrado rupestre. ................................................................................................................109 Figura 50:Detalhe da fitofisionomia vereda..........................................................................109 Figura 51:Detalhe da fitofisionomia cerradão.......................................................................110 Figura 52:Detalhe da fitofisionomia mata seca semidecídua................................................111 Figura 53:Detalhe da fitofisionomia mata de galeria............................................................111 Figura 54:Exemplares da flora da Unidade de Conservação Serra das Areias: A. Wunderlichia mirabilis; B. Palicourea rígida; C. Palicourea coreacea; D. Mandevilla sp.; E. Indigofera sp.; F. Hirtella sp.; G. Helicteres brevispira; H. Galactia peduncularis; I. Caryocar brasiliense; J. Bromelia goyazense; K. Aldama sp.; L. Agyphylla sp.................................................................................127 Figura 55:Exemplares da flora na Unidade de Conservação Serra das Areias: A. Diplusodon sp.; B. Banisteriopsis megaphylla; C. Harpalyce brasiliana; D. Oxalis densifolia; E. Convolvulaceae sp.; F. Chamaecrista neesiana; G. Aspilia foliacea; H. Kielmeyera rubriflora; I. Trimezia juncifolia. .....................................................128 Figura 56:Exemplares da flora na Unidade de Conservação Serra das Areias: A. Davilla flexuosa; B. Bionia sp.; Cambessedesia cf. hilariana; D. Pavonia grandiflora; E. Ipomoea squamisepala; F. Dyckia sp.; G. Camarea hirsuta; H. Lessingianthus onopordioides; I. Odontadenia lutea; J. Polygala tenuis.....................................128 Figura 57:Riqueza e abundância das 10 famílias mais representativas na Unidade de Conservação Serra das Areias. .............................................................................133 Figura 58:Atividade de motocross desenvolvida na Serra das Areias. .................................135 Figura 59:Lixo deixado pelo publico próximo a área de banho............................................135 Figura 60:Quantidade de espécies da flora da Serra das Areias de acordo com diferentes tipos potenciais de uso...................................................................................................136 Figura 61:Pastagem fazendo parte da paisagem da Serra das Areias. ..................................138 Figura 62:Fragmento de vegetação natural circundado por pastagem..................................138 Plano de Manejo UC Serra das Areias ix Figura 63: Corredor de vegetação (seta) formado pela mata de galeria do Córrego da Mata..... 138 Figura 64: Vista de cima da Serra das Areias, mostrando construções que margeiam a unidade....139 Figura 65:Quantidade de espécies da flora da Serra das Areias de acordo com diferentes tipos de habitos das plantas. ..........................................................................................140 Figura 66:Comparação da diversidade florística entre as Unidades Topográficas Elevadas e Plana. ....................................................................................................................141 Figura 67:Área com potencial para a criação de um corredor ecológico (em amarelo) para ligação entre as duas áreas topográficas elevadas e mais conservadas ................145 Plano de Manejo UC Serra das Areias x LISTA DE TABELAS Tabela 1: Pontos amostrados nas áreas topograficamente elevadas (conservadas) e planas (antropizadas) na Unidade de Conservação da Serra das Areias.........................19 Tabela 2: Pontos amostrais de ictiofauna na Unidade de Conservação Serra das Areias. ..24 Tabela 3: Sistema de classificação da qualidade de água estabelecido para os córregos da Mata e Santo Antônio, localizados nas áreas de influência da UC Serra das Areias, Aparecida de Goiânia, Goiás (De acordo com Alba-Tercedor & SánchezOrtega, 1988). ......................................................................................................29 Tabela 4: Caracterização fitofisionômica e coordenada de localização das 50 parcelas de amostragem de flora. ...........................................................................................34 Tabela 5: Distribuição do número de parcelas por tipo de fitofisionomia. .........................35 Tabela 6: Dados Gerais do registro de aves na Unidade de Conservação Serra das Areias, em relação à época de registro e as áreas amostradas. ........................................38 Tabela 7: Lista de espécies registradas, suas respectivas famílias, nomes populares e total de indivíduos por campanha (Março e Julho/2014) na Unidade de Conservação Serra das Areias. ..................................................................................................38 Tabela 8: Lista dos táxons de himenópteros polinizadores registrados na Serra das Areias. Ni: número de indivíduos; UTP: Unidades topográficas planas; UTE: Unidades topográficas elevadas...........................................................................................50 Tabela 9: Lista dos táxons de artrópodes de solo registrados na Serra das Areias. Ni: número de indivíduos; UTP: Unidades topográficas planas; UTE: Unidades topográficas elevadas...........................................................................................54 Tabela 10: Lista dos táxons de vetores registrados na Serra das Areias. Ni: número de indivíduos; UTP: Unidades topográficas planas; UTE: Unidades topográficas elevadas ...............................................................................................................56 Tabela 11: Medidas estruturais das redes de interação Himenópteros-Plantas em cada um dos locais amostrados, por campanha..................................................................64 Tabela 12: Medidas de abundância, diversidade alfa, beta e gama de artrópodes de solo amostrados nas UTE e UTP. ...............................................................................64 Tabela 13: Lista das espécies representantes da Herpetofauna registradas nas unidades topográficas elevadas (UTE) e planas (UTP) da Unidade de Conservação Serra das Areias. LC= pouco preocupante; DD= deficiente de dados; NL= não listada. * Endemismo segundo Valdujo et al. 2012 e Nogueira et al. 2011. ...................66 Plano de Manejo UC Serra das Areias xi Tabela 14: Lista de espécies de peixes amostradas na serra das areias nas duas campanhas (seca e chuva), sua respectiva classificação taxonômica (ordem e família), guilda trófica a qual pertencem e estado de conservação segundo IUCN e Ministério do Meio Ambiente. NE: Não avaliado; LC: Pouco preocupante. ............................78 Tabela 15: Táxons de Invertebrados Aquáticos amostrados nos córregos da Mata e Santo Antônio, localizados no entorno da Unidade de Conservação Serras das Areias, Aparecida de Goiânia - Goiás, 2014. Mata/M= córrego da Mata, coleta realizada em março; SA/M= Santo Antônio, coleta realizada em março; Mata/J= córrego da Mata, coleta realizada em julho; SA/J= Santo Antônio, coleta realizada em julho.....................................................................................................................86 Tabela 16: Espécies encontradas na região de estudo por campanha (Chuva e Seca). .........91 Tabela 17: Espécies encontradas na região de estudo por campanha (Chuva e Seca). .........92 Tabela 18: Lista de espécies de mamíferos encontradas na região da Serra das Areias Município de Aparecida de Goiânia. Categorias de ameaça em toda a distribuição da espécie pela União Internacional para Conservação da Natureza (IUCN, 2014) e ameaça na distribuição apenas no território nacional pela lista vermelha nacional de 2003 e livro vermelho da fauna ameaçada de extinção do Ministério do Meio Ambiente (MMA 2008).......................................................93 Tabela 19: Espécies de mamíferos encontradas na região da Serra das Areias delimitada como unidades topográficas elevadas. ................................................................95 Tabela 20: Espécies de mamíferos encontradas na região da Serra das Areias delimitada como Unidade Topográfica Plana. ....................................................................105 Tabela 21: Check list das espécies vegetais registradas na Serra das Areias, tanto nas unidades topográficas elevadas, como nas planas. ............................................113 Tabela 22: Comparação da riqueza de espécies vegetais entre diferentes unidades de conservação municipais, estaduais e federais de Goiás e Distrito Federal........129 Tabela 23: Parâmetros fitossociológicos das espécies arbóreas registradas na Unidade de Conservação Serra das Areias. ..........................................................................130 Tabela 24: Parâmetros fitossociológicos das 10 espécies arbóreas mais representativas registradas nas Unidades Topográficas Elevadas da Unidade de Conservação Serra das Areias. ................................................................................................135 Tabela 25: Parâmetros fitossociológicos das 10 espécies arbóreas mais representativas registradas nas Unidades Topográficas Planas da Unidade de Conservação Serra das Areias. .........................................................................................................137 Plano de Manejo UC Serra das Areias xii SUMÁRIO 1. INTRODUÇÃO AO MEIO BIÓTICO...............................................................................1 1.1. Avifauna ..............................................................................................................................2 1.2 Entomofauna.........................................................................................................................3 1.3 Herpetofauna ........................................................................................................................4 1.4 Ictiofauna ..............................................................................................................................5 1.5 Macroinvertebrados Aquáticos.............................................................................................6 1.6 Mastofauna ...........................................................................................................................7 1.7 Flora....................................................................................................................................10 2. METODOLOGIA DO DIAGNÓSTICO AMBIENTAL DO MEIO BIÓTICO ..........12 2.1 Avifauna .............................................................................................................................14 2.2 Entomofauna.......................................................................................................................15 2.3 Herpetofauna ......................................................................................................................18 2.4 Ictiofauna ............................................................................................................................23 2.5 Macroinvertebrados Aquáticos...........................................................................................27 2.6 Mastofauna .........................................................................................................................29 2.7 Flora....................................................................................................................................31 3. DIAGNÓSTICO AMBIENTAL DO MEIO BIÓTICO ..................................................37 3.1 Avifauna .............................................................................................................................37 3.1.1 Unidades Topográficas Elevadas ....................................................................................45 3.1.2 Unidades Topográficas Planas ........................................................................................47 3.1.3 Entorno da Unidade de Conservação...............................................................................49 3.1.4 Heterogeneidades.............................................................................................................49 3.2 Entomofauna.......................................................................................................................49 3.2.1 Unidades Topográficas elevadas e com vegetação contínua...........................................56 3.2.2 Unidades Topográficas Planas e antropizadas ................................................................60 3.2.3 Entorno da Unidade de Conservação...............................................................................63 3.3 Herpetofauna ......................................................................................................................66 3.3.1 Unidades de Topográficas elevadas ................................................................................71 3.3.2 Unidades Topográficas Planas ........................................................................................74 3.3.3 Heterogeneidade .............................................................................................................76 3.4 Ictiofauna ............................................................................................................................77 3.4.1 Unidades Topográficas baixas.........................................................................................77 3.4.2 Área do entorno da Serra das Areias ...............................................................................83 3.4.3 Heterogeneidades.............................................................................................................85 3.5 Macroinvertebrados Aquáticos...........................................................................................85 3.5.1 Unidades topográficas baixas ..........................................................................................85 3.5.2 Área do entorno da Serra das Areias ...............................................................................90 3.5.3 Heterogeneidades.............................................................................................................90 3.6 Mastofauna .........................................................................................................................91 3.6.1 Unidades Topográficas elevadas .....................................................................................94 3.6.2 Unidades Topográficas Planas ......................................................................................104 Plano de Manejo UC Serra das Areias xiii 3.6.3 Entorno ..........................................................................................................................106 3.6.4 Heterogeneidade ............................................................................................................106 3.7 Flora..................................................................................................................................106 3.7.1 Fitofisionomias ..............................................................................................................106 3.7.2 Diversidade florística.....................................................................................................112 3.7.3 Estrutura da vegetação...................................................................................................129 3.7.4 Unidades Topográficas Elevadas ..................................................................................134 3.7.5 Unidades Topográficas Planas ......................................................................................136 3.7.6 Entorno ..........................................................................................................................140 3.7.7 Heterogeneidade ............................................................................................................141 4. ESTRATÉGIAS PARA CONSERVAÇÃO DO MEIO BIÓTICO..............................142 4.1 Avifauna ...........................................................................................................................142 4.2 Entomofauna.....................................................................................................................143 4.3 Herpetofauna ....................................................................................................................143 4.4 Ictiofauna ..........................................................................................................................145 4.5 Macroinvertebrados Aquáticos.........................................................................................146 4.6 Mastofauna .......................................................................................................................146 4.7 Flora..................................................................................................................................147 CONSIDERAÇÕES FINAIS...............................................................................................149 REFERÊNCIAS BIBLIOGRÁFICAS ...............................................................................151 Plano de Manejo UC Serra das Areias xiv 1. INTRODUÇÃO AO MEIO BIÓTICO A Lei Nº 9.985, de 18 de julho de 2000 que institui o Sistema Nacional de Unidades de Conservação (SNUC), foi regulamentada pelo Decreto Nº 4.340, de 22 de agosto de 2002 e, prevê que a função legal de Unidade de Conservação está vinculada ao objetivo de conservação do espaço territorial e seus recursos ambientais, que sejam legalmente instituídos e delimitados pelo Poder Público, ficando esse espaço e seus recursos naturais sob o regime especial de administração, ao qual se aplicam garantias adequadas de proteção. Diante desse contexto e de acordo com o SNUC (2000), a contextualização e proposição do objetivo “conservação da natureza”, inserido dentre as demais funções ambientais de Unidade de Conservação, vem de encontro ao “manejo do uso humano da natureza, compreendendo a preservação, a manutenção, a utilização sustentável, a restauração e a recuperação do ambiente natural, para que possa produzir o maior benefício, em bases sustentáveis, às atuais gerações, mantendo seu potencial de satisfazer as necessidades e aspirações das gerações futuras, e garantindo a sobrevivência dos seres vivos em geral”. O SNUC determina a elaboração de um Plano de Manejo para esses espaços territoriais protegidos nas duas categorias de Unidades de Conservação: as de uso sustentável e as de proteção integral. Ambas as categorias devem apresentar seus Planos de Manejo elaborados em até 5 anos após o seu ato de criação. Deste modo, esse documento referente ao planejamento da Unidade de Conservação resultará em um zoneamento ambiental que definirá normas que devem ser aplicadas para o uso da área e o manejo dos recursos naturais existentes. Este documento deve abranger tanto os limites legais da unidade de conservação, mas também sua zona de amortecimento e os corredores ecológicos, propondo medidas necessárias à assegurar a integração da unidade territorial protegida à vida econômica e social das comunidades vizinhas. Esse Instrumento das Políticas Públicas, o SNUC tem os seus objetivos detalhados no Artigo 4º da Lei que o institui e estes premeiam: “contribuir para a manutenção da diversidade biológica e dos recursos genéticos no território nacional e nas águas jurisdicionais; proteger as espécies ameaçadas de extinção no âmbito regional e nacional; contribuir para a preservação e a restauração da diversidade de ecossistemas naturais; Plano de Manejo UC Serra das Areias 1 promover o desenvolvimento sustentável a partir dos recursos naturais; promover a utilização dos princípios e práticas de conservação da natureza no processo de desenvolvimento; proteger paisagens naturais e pouco alteradas de notável beleza cênica; proteger as características relevantes de natureza geológica, geomorfológica, espeleológica, arqueológica, paleontológica e cultural; proteger e recuperar recursos hídricos e edáficos; recuperar ou restaurar ecossistemas degradados; proporcionar meios e incentivos para atividades de pesquisa científica, estudos e monitoramento ambiental; valorizar econômica e socialmente a diversidade biológica; favorecer condições e promover a educação e interpretação ambiental, a recreação em contato com a natureza e o turismo ecológico; proteger os recursos naturais necessários à subsistência de populações tradicionais, respeitando e valorizando seu conhecimento e sua cultura e promovendo-as social e economicamente.”. Portanto, a integração do conhecimento sobre os Recursos Ambientais de uma Unidade de Conservação, no caso a Serra das Areias, devem considerar situações além de um diagnóstico ambiental integrado entre os meios físico, socioeconômico e o biótico. Cabe, no que se refere ao levantamento dos recursos naturais para a conservação da biodiversidade, levantar detalhadamente os principais grupos taxonômicos da fauna e flora dependentes daquele espaço territorial em todo o seu ciclo de vida ou parcialmente, de modo a descrever a qualidade de seu habitat, a sua integração com as questões socioambientais, apontando potencialidades, fragilidades e vulnerabilidades do grupo estudado, bem como as medidas necessárias para sua conservação frente às condições atuais observadas. 1.1. Avifauna As aves são importantes componentes ecológicos, uma vez que desempenham papel fundamental na cadeia alimentar, alimentando-se de diversos itens. Neste sentido, alguns serviços ecológicos são prestados por estes animais, uma vez que podem atuar no controle populacional de vetores de pragas e dispersão de sementes e frutos. Adicionalmente, ressaltase que a ocorrência de espécies de aves se dá em uma escala de paisagem, portanto, é provável diferentes fragmentos florestais possam ser utilizados por estas espécies durante as suas atividades de forrageio. Plano de Manejo UC Serra das Areias 2 O Brasil é um país com extensão continental e que apresenta a maior diversidade de aves no mundo, uma vez que aproximadamente 1700 espécies podem ser encontradas (Marini & Garcia, 2005). O Cerrado é o segundo maior domínio fitogeográfico do Brasil, o qual foi considerado como uma prioridade de conservação por Myers et al. (2000). Neste sentido, a diversidade de aves neste domínio é de aproximadamente 840 espécies, das quais 4% são consideradas endêmicas do Cerrado (Marini & Garcia, 2005). No estado de Goiás, os estudos com aves tem se destacado nas últimas décadas, portanto, atualmente, é possível encontrar neste estado aproximadamente 600 espécies de aves (Ferreira et al. 2008). As aves como vários outros animais estão suscetíveis a qualquer alteração no ambiente, por isso desenvolvem um importante papel como bioindicadores e, para Vieira (2006) devido a aves estarem em um nível trófico elevado e ocupando diferentes nichos ecológicos, elas são potenciais indicadores de contaminação nos ambientes aquáticos e na cadeia alimentar. Além de várias funções na cadeia alimentar, as aves possuem papeis notórios e essenciais para a flora, sendo dispersores de sementes, agente de quebra de dormência, polinizadores, entre outras. Estudos envolvendo a avifauna brasileira têm ganhado uma importância significativa nos últimos anos, tal como em parques, praças publicas, clubes recreativos e lagos dentro de cidades, abrangendo tanto aspectos faunísticos, abundância, padrões de riqueza, diversidade e frequência de ocorrência, da avifauna estudada analisando a ação antrópica nessas comunidades. Estudos com aves são muito importantes para entender e registrar interferências na qualidade de vida das cidades, uma vez que aves silvestres tendem migrar cada vez mais para o meio urbano, principalmente aves insetívoras devido a grande oferta de alimento, afirma Blamires et al (2001). O processo de urbanização transforma ambientes naturais em ambientes com pouca diversidade biológica, embora aves façam parte da paisagem urbana, nas ultimas décadas tem sido mais estudados. 1.2 Entomofauna Compreendendo a maior parte da biodiversidade conhecida da Terra (Oodegard 2008), invertebrados terrestres são de extrema importância por exercerem papéis fundamentais em inúmeros processos ecológicos (Kevan & Baker 1983, Moore et al. 1988, Huntly 1991, Gratz Plano de Manejo UC Serra das Areias 3 1999). Por esse motivo, conhecer a diversidade de artrópodes e sua distribuição é um passo importante no entendimento do funcionamento dos ecossistemas e indispensável para o direcionamento de esforços e manejo de áreas para a conservação da biodiversidade. Para representar alguns dos diferentes processos ecológicos em que os insetos participam amostramos três grupos que estão diretamente relacionados a importantes processos ecológicos – polinizadores, artrópodes de solo e mosquitos hematófagos. Os insetos são os principais agentes polinizadores biológicos (Kevan & Baker 1983) e dentre eles os himenópteros, em especial da superfamília Apoidea, se destacam com grande importância para espécies de plantas silvestres e cultivadas. Artrópodes de solo, como formigas, aranhas e besouros participam de complexas teias tróficas, que se baseiam principalmente na energia proveniente da matéria orgânica morta, contribuindo para sua particularização e promovendo a ciclagem dos nutrientes. Finalmente, os mosquitos hematófagos são de interesse médico, por agirem como vetores de vários patógenos causadores de doenças em humanos e outros vertebrados. 1.3 Herpetofauna Os anfíbios e répteis são elementos-chave nas cadeias ecológicas, principalmente como controladores de insetos e pequenos vertebrados. Segundo a mais recente listagem de espécies realizada pela Sociedade Brasileira de Herpetologia (SBH, 2012) são conhecidas 946 espécies de anfíbios e 744 espécies de répteis no Brasil. No entanto, novas espécies foram e estão sendo descobertas recentemente, aumentando a riqueza conhecida no país. Apesar da alta riqueza de espécies, diversos pesquisadores têm relatado declínios populacionais e até mesmo extinções locais de anuros, as quais podem ser oriundas de ações naturais ou em função de ações antrópicas (Bastos et al. 2003). O Cerrado apresenta uma Herpetofauna biodiversa, sendo conhecidas 209 espécies de anfíbios, 107 serpentes, 47 lagartos, 15 anfisbenas, 10 quelônios e cinco jacarés, o que representa cerca de 22% das espécies de anfíbios e 25% das espécies de répteis do Brasil (Colli et al. 2002, Valdujo 2012). Do total de espécies conhecidas, aproximadamente 50% das anfisbenas, 26% dos lagartos, 10% das serpentes e 51% dos anfíbios são endêmicos. Neste caso, devido ao alto número de espécies endêmicas e ao acelerado processo de redução e Plano de Manejo UC Serra das Areias 4 perda de hábitats naturais, o Cerrado é considerado um hotspot de biodiversidade (Myers et al. 2000). A ocupação e o uso do solo do Cerrado modificam as características naturais e podem prejudicar a relação entre os representantes da Herpetofauna e o meio natural, acelerando o processo de perda de diversidade biológica. Estimativas recentes mostram que cerca de 50% da cobertura vegetal nativa foi destruída e menos de 5% da área restante está protegida na forma de unidades de conservação (Ratter 1991, Dias 1992, Lapola et al. 2014). No presente estudo, o objetivo foi realizar o levantamento e a identificação da riqueza de espécies de anfíbios e répteis na Unidade de Conservação Serra das Areias e em áreas adjacentes, contribuindo com a elaboração do plano de manejo da Unidade de Conservação e com a aquisição de novas áreas para a conservação. 1.4 Ictiofauna Os peixes são animais do filo Chordata e são divididos em duas classes: Chondrichthyes que são os peixes cartilaginosos e os Osteichthyes que são os peixes ósseos (STORER et al., 1998). Existem aproximadamente 25.000 espécies de peixes descritas para o meio aquático, das quais 40% são encontradas em ambientes de água doce (MELO et al., 2007). Na região Neotropical são conhecidas 8.000 espécies de peixes de água doce. O Brasil é conhecido pela sua alta diversidade de espécies, inclusive quando se trata de peixes. A bacia hidrográfica com maior diversidade de espécies de peixes do Brasil é a Amazônica, onde foram descritas 2000 espécies (Schaefer, 1998; Reis et al., 2003; Winemiller et al., 2005). Em Goiás, estão as principais nascentes de três bacias hidrográficas importantes: Araguaia, Tocantins (fazem parte da grande bacia amazônica) e Paraná (desagua no rio Paraguai). Isso torna o estado de Goiás e o bioma Cerrado fundamentais quando se trata de conservação, não só de peixes, como de todos as outras formas de vida que dependem dessas bacias para sua sobrevivência. Com o grande desenvolvimento de atividades agrárias no estado de Goiás, as nascentes destas bacias e seus cursos d’água principais, assim como a biota associada, podem estar ameaçadas por tais atividades econômicas. Com isso, faz-se necessário o estudo dessas bacias, assim como dos organismos, que fazem parte de seu contexto, e seu monitoramento, Plano de Manejo UC Serra das Areias 5 para que os recursos animais, vegetais e minerais ainda estejam disponíveis com qualidade para a população e para suas gerações futuras, como prevê a constituição federal de 1988, artigo 225: “Todos têm direito ao meio ambiente ecologicamente equilibrado, bem de uso comum do povo e essencial à sadia qualidade de vida, impondo-se ao Poder Público e à coletividade o dever de defendê-lo e preservá-lo para as presentes e futuras gerações.” Apesar de existir uma forte pressão antrópica na continuidade dos peixes, e de toda a biota em geral, o homem, reconhecendo seu impacto danoso, tenta estabelecer medidas mitigatórias, como a criação de parques com objetivos preservacionistas. O cercamento de determinadas áreas para impedir a ação do homem e preservar o que há nessa área envolve uma série de estudos para responder algumas questões como: Qual o tamanho da área a ser preservada? Quais taxa pretende-se conservar naquela área? Em que contexto sócioeconômico aquela área está inserida? Qual a relação da área preservada com outros fragmentos preservados? É evidente que a preservação de determinadas áreas contribuem para a preservação da assembleia de peixes, principalmente devido ao fato de conservar a mata ciliar dos riachos, que, de acordo com Vannote (1980) possui íntima relação com organismos que vivem em riachos. Portanto, a criação e manutenção de parques conservacionistas torna-se de elevada importância para o manejo e preservação desse táxon. 1.5 Macroinvertebrados Aquáticos A preservação dos ambientes aquáticos é fundamental para a sustentabilidade dos recursos naturais. Diante disso, o monitoramento ambiental torna-se um aliado para a avaliação do estado de preservação e/ou degradação desses ambientes naturais, auxiliando na elaboração de planos de manejo e recuperação das áreas degradadas (Guereschi, 2004). Na resolução do Conselho Nacional do Meio Ambiente (CONAMA) nº 357 de 17 de março de 2005 já são feitas algumas referências a esta técnica de monitoramento ambiental, segundo o Art. 8º, § 3º, “a qualidade dos ambientes aquáticos poderá ser avaliada por indicadores biológicos, quando apropriado, utilizando-se organismos e/ou comunidades aquáticas” (MMA, 2005). Plano de Manejo UC Serra das Areias 6 O método de monitoramento ambiental de qualidade da água tem destaque para o uso dos invertebrados aquáticos, pois eles apresentam adaptações a variadas condições ambientais e apresentam limite de tolerância a diferentes perturbações. Esses organismos variam de “sensíveis” a “tolerantes”, os sensíveis são aqueles que não suportam grandes variações no ambiente e os tolerantes são aqueles que resistem a condições adversas no ambiente, tais como grande acúmulo de matéria orgânica, pouco oxigênio dissolvido, entre outras adversidades e, portanto, refletem algum tipo de contaminação ou perturbação que possa haver no ambiente (Alba-Tercedor, 1996). O uso dos invertebrados aquáticos como bioindicadores deve-se a fatores como: (a) tamanho do corpo relativamente grande; (b) ciclo de vida suficientemente longo; (c) fácil amostragem; (d) custo relativamente baixo; (e) diversidade de espécies e; (f) técnicas padronizadas (Alba-Tercedor, 1996). Além disso, já são conhecidos índices de avaliação da qualidade da água, utilizando os invertebrados aquáticos, tais como o índice BMWP (Biological Monitoring Working Party). Tal índice é o somatório das pontuações que cada família que ocorre no local possui e é bastante utilizado em estudos de monitoramento de fauna em ambientes aquáticos, no entanto, é necessário adaptação deste índice às diferentes ecorregiões do globo (Monteiro et al. 2008). Diante disso, apresentaremos os resultados da avaliação de dois riachos situados no entorno da Unidade de Conservação Serra das Areias, no munícipio de Aparecida de GoiâniaGO utilizando os invertebrados aquáticos como bioindicadores da qualidade da água. 1.6 Mastofauna Os impactos ambientais diretos causados por alterações na paisagem resultam na perda de biodiversidade em toda a região tropical. Esses impactos são causados pelo desenvolvimento de infraestruturas em grande escala; conversão dos usos da terra; energia e mineração; ações humanas não sustentáveis; poluição; urbanização e turismo (Brandon et al., 2005). O Brasil está entre os maiores países do mundo, líder em diversidade biológica (Mittermeier et al. 1997, Costa et al. 2005), e representa cerca de 13% da biota mundial (Lewinsohn & Prado 2005), possuindo a maior diversidade de mamíferos (Costa et al. 2005), Plano de Manejo UC Serra das Areias 7 com cerca de 658 espécies descritas (652 nativas e 6 exóticas) (Reis et al. 2006). Segundo estimativas da IUCN (União Internacional para a Conservação da Natureza), cerca de 735 táxons de plantas e animais brasileiros estão ameaçados de extinção (Paglia et al. 2004). Destes, cerca de 69 são mamíferos (Reis et al. 2006, MMA 2008). Porém, acredita-se que esse número representa uma subestimativa do estado de ameaça real no qual o Brasil se encontra, tendo em vista que muitos grupos taxonômicos não foram apropriadamente avaliados (Paglia et al. 2004). A ameaça às espécies não se encontra distribuída de forma homogênea pelo território nacional, ao passo que os dois hotspots de biodiversidade brasileiros (Mata Atlântica e o Cerrado) (Mittermeier et al. 1999, Myers et al. 2000) respondem por cerca de 78% dos táxons ameaçados (Paglia et al. 2004). O Cerrado é o segundo maior bioma brasileiro e ocupa cerca de 21% do território nacional, sendo superado em área apenas pela Amazônia. Nos últimos 35 anos mais da metade dos seus 2 milhões de Km² originais foram cultivados com pastagens plantadas e culturas anuais (Klink & Machado, 2005). O termo Cerrado é comumente utilizado para designar o conjunto de ecossistemas (savanas, matas, campos e matas de galeria) que ocorrem no Brasil Central, distribuindo-se também como manchas de pequenas extensões na Mata Atlântica, Floresta Amazônica e Caatinga (Ribeiro & Walter 2008; Eithen, 1977). Em virtude dessa heterogeneidade de hábitats, diversas espécies de animais encontram abrigo no bioma (Dias, 1992), distribuindo-se conforme a preferência por hábitats específicos e de acordo com os recursos disponíveis (Alho, 1981). A fauna do Cerrado é rica e diversificada, com muitas espécies endêmicas, raras e/ou ameaçadas de extinção. Os mamíferos correspondem ao segundo grupo mais diverso entre os vertebrados terrestres no bioma, totalizando aproximadamente 15% das espécies conhecidas (Aguiar et al., 2004), representados por cerca de 194 espécies (Marinho-Filho et al., 2002), e inclui representantes das ordens Didelphiomorphia, Pilosa, Cingulata, Primates, Carnivora, Chiroptera, Rodentia, Perissodactyla, Cetartiodactyla e Lagomorpha (Reis et al., 2006), sendo que estes se apresentam extremamente influenciados pelas ações antrópicas e suas consequências na paisagem (Costa et al., 2005). Cerca de 23% de todos os mamíferos estão sob ameaça de extinção, porém perdas populacionais, que são um grande sinal da perda de biodiversidade, chegam a 50% (Ceballos & Ehrlich, 2002). Plano de Manejo UC Serra das Areias 8 Os mamíferos representam o grupo de vertebrados mais derivado do ponto de vista evolutivo, sendo compostos por cerca de 5488 espécies distribuídas pelo mundo (Wilson & Reeder 2005). São caracterizados por possuírem glândulas mamárias que produzem substâncias nutritivas com a finalidade de alimentar os filhotes em seu tempo de vida inicial pós-nascimento (Storer et al. 2003). Outra característica principal destes animais são os pelos, apêndices cutâneos que possuem diversas funções como a camuflagem, comunicação, sensação e isolamento térmico (Pough et al. 2008). Dentro do grupo existe uma variação muito grande de tamanho corpóreo, hábitos de vida e preferência de habitat. A mastofauna silvestre brasileira dificilmente é vista na natureza, e isto se deve, principalmente, ao fato de terem hábitos discretos, crepusculares e noturnos. Entretanto, durante as suas várias atividades, esses animais frequentemente deixam sinais típicos no ambiente, como rastros, fezes, tocas e restos alimentares; vestígios que fornecem através de observações indiretas uma identificação segura do animal que os produziu, além de informações sobre sua ecologia (Becker & Dalponte, 1991;Vendramim et al., 2005). Por isso, pesquisas e inventários requerem a utilização de várias metodologias específicas para diferentes grupos de espécies (Pardini, 2003) podendo ser separadas em métodos diretos e indiretos. Os métodos diretos englobam a captura através de armadilhamento (Pardini, 2003) e observação direta utilizando censos visuais através de transectos lineares (Cullen, 2000), enquanto os métodos indiretos direcionam o esforço de amostragem na busca por sinais típicos deixados pelos animais no ambiente. Deste modo, a utilização de indicadores indiretos da presença de mamíferos é mais rápida e de fácil observação no campo, comparados com os métodos diretos (Scoss, 2004). Alguns grupos de mamíferos podem ser usados como indicadores de qualidade ambiental e características como presença ou ausência podem indicar sustentabilidade ambiental do lugar (Carvalho Jr. & Luz, 2008). Mamíferos são animais geralmente elusivos, noturnos e ocorrem em baixas densidades. Dessa forma, o trabalho de levantamento é uma tarefa bastante complexa. Apesar de ser um grupo bastante conhecido ainda há muito que se inventariar. Listas de ocorrência de espécies são necessárias e essas lacunas dificultam atitudes de conservação (Brito, 2004). Plano de Manejo UC Serra das Areias 9 1.7 Flora Importantes pesquisas têm apontado que o Cerrado abriga algo entre 20 e 50% das espécies brasileiras, dependendo do grupo de organismos avaliado (Klink & Machado 2005), sendo este destacado como uma região prioritária para a conservação da diversidade no planeta (Myers et al. 2000). Boa parte da diversidade do Cerrado está relacionada à alta diversidade florística e fitofisionômica que a região apresenta. Segundo Ribeiro & Walter (2008) o Cerrado apresenta mais de 12.000 espécies de plantas vasculares distribuídas em três grandes grupos de vegetações: campestres, savânicas e florestais. O Cerrado é o segundo maior bioma brasileiro ocupando uma área de 2 milhões de km2, o que corresponde a 23% do território nacional, abrangendo estados em todas as regiões do país (Oliveira & Ratter 2002). Nas últimas décadas a diversidade florística e faunística do Cerrado têm sofrido grandes perdas devido à fragmentação e a perda de habitat causados pelos avanços antrópicos, como crescimento dos centros urbanos e avanço da fronteira agropecuária (Klink & Machado 2005). No Estado de Goiás, a fragmentação da paisagem natural também se deve à expansão da fronteira agrícola proveniente da região Sul e Sudeste do Brasil e se intensificou a partir dos anos 60 com a construção de Brasília (GOIÁS 2002). Em um trabalho pioneiro Cunha et al. (2007), realizaram o mapeamento da composição e fragmentação do bioma Cerrado em Goiás, estimando que existem no estado 3.470.039 fragmentos, que correspondem a 21% do seu território. Segundo os autores 21,87% da área remanescente de vegetação nativa de Goiás é constituída por savanas (cerrado típico), 17,68% é constituída por matas e 8,76% por fitofisionomias campestres. Ainda segundo eles, das áreas remanescentes, mais de 82% apresentam tamanho menor do que 1 ha. Esses dados indicam que além de poucas áreas naturais, as existentes estão muito fragmentadas e desconexas. Por apresentar um elevado grau de desenvolvimento socioeconômico e uma elevada taxa de ocupação humana, a região de Goiânia e seu entorno é o maior centro urbano de Goiás, e também uma das regiões onde existe a maior densidade de fragmentos de vegetação (Cunha et al. 2007). Nesse contexto, a área da Unidade de Conservação Serra das Areias, com mais de 2.800 ha, representa um importante remanescente de vegetação natural do Cerrado, em uma região altamente fragmentada, justificando a implantação de estratégias específicas Plano de Manejo UC Serra das Areias 10 para o manejo e conservação da unidade. Desse modo, o objetivo do presente trabalho foi fornecer subsídios para a elaboração do Plano de Manejo da unidade, no que diz respeito ao grupo biótico de Flora. Os resultados apresentados correspondem à caracterização fitofisionomia da área, bem como o inventário florístico quantitativo e qualitativo da comunidade arbóreo-arbustiva da Unidade de Conservação Serra das Areias. Plano de Manejo UC Serra das Areias 11 2. METODOLOGIA DO DIAGNÓSTICO AMBIENTAL DO MEIO BIÓTICO O levantamento de dados referente ao Meio Biótico da Unidade de Conservação Serra das Areias ocorreu em dois momentos sazonais específicos que contemplaram os meses de março e julho de 2014. A questão da sazonalidade, com dois períodos de estações específicas, visa contemplar períodos reprodutivos distintos da vegetação e também da fauna. A sazonalidade influencia o comportamento de forrageamento de grupos de fauna e até mesmo o avistamento dos indivíduos. Adicionalmente, em relação a determinados grupos de fauna, a sazonalidade influencia na presença ou ausência da espécie no ambiente estudado. O meio biótico contempla sete grupos distintos, que trabalharam em coletas de dados com suas metodologias próprias. Assim, o Plano de Trabalho proposto para a Unidade de Conservação estudada, buscou trabalhar, no que se refere ao Meio Biótico, com metodologias e metas que apontassem: (1) os principais tipos ou formações (feições) da vegetação (fitofisionomia) com individualização (localização) das unidades presentes no âmbito da Unidade de Conservação e sua Zona de Amortecimento (lista geral das espécies de flora amostradas, lista das espécies mais comuns, bioindicadoras, endêmicas, e importância econômica, raras, ameaçadas de extinção, invasoras, exóticas, que sofrem pressão de extração e coleta) com comparações com classificações locais ou regionais; (2) as paisagens florestais do ponto de vista ecológico estabelecendo suas interações com o entorno da Unidade de Conservação; (3) as espécies relevantes da flora local com pesquisa e identificação botânica das espécies existentes; (4) as atividades e ações de manejo que devem ser implantadas na Unidade de Conservação objetivando a manutenção das áreas de vegetação conservadas e a melhoria e recuperação da vegetação degradada; (5) a fauna existente no âmbito da Unidade de Conservação e sua Zona de Amortecimento com levantamento sistemático das espécies mais comuns existentes, inclusive de espécies endêmicas, espécies ameaçadas de extinção, espécies migratórias, invasoras, exóticas, que sofrem pressão de pesca, caça e captura; (6) as relações e correlação de ocorrência de espécies da fauna com tipo de vegetação existente, seu grau e conservação e as implicações para o manejo da UC, por exemplo, espécies características de ambientes abertos ou só e matas; (7) as espécies de vegetação típicas da dieta alimentar de uma ou mais espécies e fauna; (8) as atividades e ações de manejo que devem ser implantadas na Unidade de Conservação com vistas à manutenção e ou melhoria do atual status de conservação da fauna local. Plano de Manejo UC Serra das Areias 12 Os levantamentos do meio biótico se deram nas Unidades Representativas no que se refere ao habitat do grupo estudado, dividindo-se em duas unidades diferenciadas do ponto de vista da conservação dos atributos bióticos, sendo uma unidade mais conservada e compatível com as unidades topográficas elevadas (UTE) e, outra unidade já bastante alterada das condições originais, como predomínio de uso do solo antrópico e, compatível com as unidades topográficas mais planas (UTP) e baixas (Figura 1). Figura 1: Localização das duas Unidades da Serra que comportam uma maior conservação dos recursos naturais (em vermelho) e, fora dessas unidades, a localização de uma área com predomínio de atividades antrópicas. Em preto está o limite da Unidade de Conservação Serra das Areias. Fonte: Mattos e Climaco Ltda, 2014 Plano de Manejo UC Serra das Areias 13 2.1 Avifauna O presente estudo foi realizado em duas fitofisionomias distintas nas proximidades da Serra das Areias (16°50'57.05"S e 49°20'34.56"O), no município de Aparecida de Goiânia, sendo Mata de Galeria e Cerrado Típico (unidades topográficas elevadas e plana) e, em áreas antropizadas com predomínio de pastagem que também foram amostradas (unidades topográficas planas) (Figura 2). As fitofisionomias correspondem às unidades topográficas elevadas e, o uso antrópico por pastagem corresponde a área topográfica plana da Unidade de Conservação Serra das Areias. A metodologia utilizada foi o levantamento através de transectos lineares nos quais foram empregadas caminhadas intermitentes. Os transectos ocorreram no período matutino iniciando as 06:00 hs e concluídos aproximadamente as 11:00 hs, sendo que o mesmo procedimento ocorreu com as visitas do período vespertino, quando estas aconteceram das 14:00 hs até às 18:30 hs. Foram realizadas 06 campanhas com duração de 04 horas cada, totalizando assim, 24 horas de levantamentos nos meses de março e julho de 2014. Figura 2: Áreas estudadas em vermelho Fonte: Google Earth, 2014 Plano de Manejo UC Serra das Areias 14 O procedimento de registro das espécies foi baseado em Biby et al (2000). Foi estabelecida uma transecção de aproximadamente 3 km no perímetro de cada área estudada totalizando aproximadamente 18 km de extensão. Os registros foram feitos considerando um raio de 50m a fim de analisar a presença de aves do local. Para a identificação das espécies foi adotado o uso de binóculos 12x36 mm e registros sonoros tomando-se o máximo de cuidado para não registrar um mesmo indivíduo mais de uma vez. A identificação das espécies seguiu o método descrito por Sick (1997). Os nomes científicos e a classificação taxonômica empregada neste estudo seguiram a listagem do Comitê Brasileiro de Registros Ornitológicos (CBRO, 2014). Os dados referentes á abundância de cada espécie foram extraídos do total de encontros com os indivíduos registrados ao longo dos turnos e áreas de coleta. Em relação ao estado de conservação das espécies, foram consultadas as listas oficiais, sendo o livro vermelho da fauna ameaçada de extinção do Ministério do Meio Ambiente (MMA, 2008; Olmos, 2005) e as categorias de ameaça da União Internacional para Conservação da Natureza (IUCN, 2014; Baillie et al, 2004). 2.2 Entomofauna Área de estudo A região amostrada localiza-se na Unidade de Conservação Serra das Areias, sendo nas (1) Unidades Topográficas mais Conservadas e elevadas e, nas (2) Unidades planas e com o uso do solo antrópico predominando, em sete pontos amostrais representando três fitofisionomias – Mata de Galeria, Cerrado strictu-sensu e Campo Sujo (Figura 3). Foram utilizados quatro métodos de coleta, sendo elas, coleta ativa com puçá (Figura 4), armadilha com essência (Figura 5), pit-fall (Figura 6), e armadilha luminosa (tipo CDC, Sudia & Chamberlain, 1962) (Figura 7). Plano de Manejo UC Serra das Areias 15 Figura 3: Localização dos pontos amostrados para cada grupo Fonte: Google Earth, 2014 Himenópteros polinizadores As coletas ativas com puçá tiveram o objetivo de amostrar himenópteros potencialmente polinizadores, coletados durante visitas a flores. Material botânico foi coletado para posterior identificação. As fitofisionomias amostradas foram Cerrado strictusensu na unidade mais conservada e Campo Sujo na unidade plana e mais antropizada, em dois pontos de amostragem na estação chuvosa e em quatro pontos de amostragem na estação seca. Dois coletores realizaram coletas com total de aproximadamente 10 horas cada na unidade elevada e na unidade plana, caminhando a passo lento em trilhas pré-existentes e em meio à vegetação à procura de plantas floridas nas quais os himenópteros visitantes foram coletados. Sempre que possível a identificação foi realizada em campo, e a espécie do polinizador, da planta visitada e o horário foram anotados. As coletas restringiram-se a momentos não chuvosos, sempre no fim da manhã, em média, entre 9:30h e 12:00h, e à tarde, entre 14:00h e 16:30h, na segunda quinzena de Março (primeira campanha) e na primeira Plano de Manejo UC Serra das Areias 16 quinzena de Julho (segunda campanha) de 2014. No total, 41 horas foram amostradas. Adicionalmente, foram amostradas abelhas da tribo Euglossini, utilizando-se armadilhas de essência. As essências utilizadas foram eucaliptol, vanilina e salicilato de metila. Por não ter atraído abelhas na primeira campanha a essência do tipo eucaliptol não foi utilizada na segunda. As armadilhas foram instaladas em dois pontos da unidade elevada e em dois pontos da unidade plana, nas duas campanhas. Em cada ponto amostral, duas armadilhas de cada essência foram instaladas às 9:30h e removidas às 16:30h. Artrópodes de solo Para a amostragem de artrópodes de solo, com ênfase em decompositores, foram utilizadas armadilhas do tipo pit-fall cobertas e iscadas com pedaços de fígado bovino. As armadilhas foram instaladas em dois pontos da unidade elevada e em um ponto da unidade plana, nas duas campanhas. Em cada ponto amostral, foram estabelecidas quatro parcelas, com distância de 50 metros entre elas. Em cada uma delas foram instaladas quatro armadilhas, separadas entre si por aproximadamente cinco metros, totalizando 48 armadilhas por campanha. As armadilhas ficaram instaladas por 48h, para potencializar a atratividade das iscas. Uma solução salina foi utilizada nas armadilhas para preservação dos espécimes. Os espécimes foram triados inicialmente em peneira de 1,5mm antes da triagem em laboratório. Mosquitos hematófagos A armadilha luminosa teve o objetivo de amostrar insetos hematófagos. As armadilhas foram instaladas em um ponto da unidade elevada e em dois pontos da unidade plana, nas duas campanhas, em áreas de Mata de Galeria onde há presença de pessoas que fazem uso dos corpos d’água. As armadilhas foram instaladas no período crepuscular, cerca de 17:00h, e removidas no dia seguinte às 9:00h. Plano de Manejo UC Serra das Areias 17 Figura 4: Coleta manual de himenópteros visitantes florais. Figura 5: Armadilha de essência, que atrai machos da tribo Euglossini. Fonte: Mattos e Clímaco Ltda, 2014. Fonte: Mattos e Clímaco Ltda, 2014. Figura 6: Armadilha do tipo Pit-fall, com isca de fígado bovino suspensa pela tampa plástica. Figura 7: Armadilha luminosa do tipo CDC, que captura insetos hematófagos atraídos pela luz. Fonte: Mattos e Clímaco Ltda, 2014. Fonte: Mattos e Clímaco Ltda, 2014. 2.3 Herpetofauna Área de estudo A Unidade de Conservação Serra das Areias se localiza no município de Aparecida de Goiânia, Goiás. Áreas adjacentes importantes para a ampliação da Unidade de Conservação, e que apresentam a mesma formação fitofisionômica abrangem parte do município de Hidrolândia, Goiás. A região está inserida no bioma Cerrado e se caracteriza pela presença de duas formações montanhosas separadas por uma área mais baixa, a qual não apresenta Plano de Manejo UC Serra das Areias 18 vegetação contínua. Devido ao relevo acidentado, há um predomínio de corpos d’água lóticos associados à Mata de Galeria. Foram amostrados 17 pontos no interior das unidades elevadas e nove pontos nas unidades plana, totalizando 26 pontos (Tabela 1, Figuras 8 e 9). Os pontos foram selecionados buscando abranger as diferentes fitofisionomias da Unidade de Conservação, priorizando áreas com a presença de corpos d’água e com fragmentos de vegetação nativa, além de áreas alagadas de origem antrópica (e.g. poços artificiais). Tabela 1: Pontos amostrados nas áreas topograficamente elevadas (conservadas) e planas (antropizadas) na Unidade de Conservação da Serra das Areias. Ponto P1 P2 P3 P4 P5 Descrição do Ambiente Cerrado rupestre e Cerrado Sensu Stricto Área antropizada com rochas expostas pela exploração de cascalho Vereda Tipo de unidade Unidade Elevada Corpo d’água lêntico em área antropizada Cerrado Sensu Stricto Unidade Plana Unidade Plana Unidade Plana Unidade Elevada P6 Corpo d’água lêntico (artificial) na borda de Mata de Galeria Unidade Elevada P7 Cerradão Unidade Plana P8 Riacho no interior de Mata de Galeria Corpo d’água lêntico em área de Campo Cerrado Riacho em Mata de Galeria com influência de atividades recreativas (clube) Borda externa de Mata de Galeria com influência de pastagem Unidade Elevada P9 P10 P11 Plano de Manejo UC Serra das Areias Unidade Elevada Unidade Plana Unidade Elevada Coordenadas S 16º50’28.8” W 49º19’32,2” S 16º50’42.5” W 49º19’47.4” S 16º50’26.4” W 49º19’41.3” S 16º49’57.7” W 49º18’12.5” S 16º50’19.4” W 49º18’43.2” S 16º51’45.2” W 49º21’08.2” S 16º51’09.5” W 49º20’25.1” S 16º51’12.9” W 49º20’57.2” S 16º52’00.8” W 49º19’58.7” S 16º51’19.7” W 49º20’24.2” S 16°52’48.4” W 49°19’55.5” 19 Cont. Ponto P12 Tipo de unidade Unidade Plana P18 Descrição do Ambiente Riacho permanente em área aberta Riacho no interior de Mata de Galeria Riacho permanente no interior de Mata de Galeria Corpo d'água lêntico temporário (quase seco) Cerrado rupestre em topo de morro Riacho temporário (quase seco) em área transicional entre Cerrado rupestre e Mata de Galeria Campo Cerrado P19 Riacho associado ao brejo Unidade Elevada P20 Riacho em Mata de Galeria (Cachoeira) - Fazendo do Cléber Corpo d'água lêntico na borda interna de Mata (Poço artificial) - Fazenda do Cléber Riacho associado ao brejo Unidade Elevada P23 Corpo d'água lêntico em área com influência de pastagem Unidade Plana P24 Corpo d'água lêntico na borda externa de Mata de Galeria com influência de pastagem Riacho em Mata de Galeria (Cachoeira) Mata de Galeria Unidade Elevada S 16°50’58.4” W 49°18’04.1” Unidade Elevada S 16°50’50.3” W 49°18’36.3” S 16°50’50.9” W 49°18’24.8” P13 P14 P15 P16 P17 P21 P22 P25 P26 Plano de Manejo UC Serra das Areias Unidade Plana Unidade Elevada Unidade Plana Unidade Elevada Unidade Elevada Unidade Elevada Coordenadas S 16°53’02.7” W 49°19’54.3” S 16°52’57.0” W 49°20’32.2” S 16°52’57.0” W 49°19’57.9” S 16°51’21.2” W 49°21’53.7” S 16°51’31.4” W 49°22’05.7” S 16°51’25.8” W 49°21’59.1” S 16° 51’40.5” W 49°21’40.0” S 16°51’25.0” W 49°21’47.4” S 16°52’22.9” W 49°20’47.4” Unidade Elevada S 16°52’19.9” W 49°20’46.9” Unidade Elevada S 16°51’58.2” W 49°20’57.8” S 16°51’33.5” W 49°20’36.3” Unidade Elevada 20 Ponto 14 Ponto 15 Ponto 17 Ponto 18 Ponto 21 Ponto 25 Figura 8: Exemplos de pontos amostrados nas áreas (1) mais conservadas e elevadas e (2) mais planas e antropizadas na Unidade de Conservação Serra das Areias. Fonte: Mattos e Climaco Ltda, 2014 Plano de Manejo UC Serra das Areias 21 Figura 9: Distribuição dos pontos amostrados nas áreas elevadas e mais conservadas (contorno vermelho) e mais planas e antropizadas (contorno preto) na Unidade de Conservação Serra das Areias Fonte: Google Earth, 2014 Coleta de dados Foram realizadas duas campanhas, sendo uma na estação chuvosa (17 a 20 de abril de 2014) e outra na estação seca (10 a 14 de julho de 2014). A busca ativa de répteis e anfíbios foi realizada no período vespertino (14:00 às 18:00) e noturno (19:00 às 24:00), utilizando os métodos de “amostragem por encontros visuais” (Crump e Scott 1994) e “transectos auditivos” (Zimmerman 1994) (Figura 10). O esforço amostral foi direcionado aos sítios reprodutivos e possíveis áreas de refúgio com duração de 60 minutos em cada ambiente. As espécies encontradas foram registradas através de recursos fotográficos (máquina fotográfica) e acústicos (gravador portátil). Espécies encontradas durante o deslocamento entre pontos e as espécies relatadas por moradores da região (entrevista) também foram consideradas. Plano de Manejo UC Serra das Areias 22 Busca ativa diurna Busca ativa noturna Figura 10: Métodos de amostragem da herpetofauna. Fonte: Mattos e Clímaco Ltda, 2014. Análise de dados Para avaliar a eficiência da coleta foi construída uma curva do coletor e uma curva de riqueza estimada pelo método Jackknife de primeira ordem para cada grupo, separadamente (anfíbios e répteis). Este método não paramétrico permite produzir intervalos de confiança para a riqueza de espécies com base nas espécies raras encontradas durante a amostragem (Krebs 1999). As analises foram realizadas utilizando o software ESTIMATES 9.1 (Colwell 2000) com 100 aleatorizações. 2.4 Ictiofauna Pontos Amostrais Foram amostrados três pontos localizados na Unidade de Conservação Serra das Areias (Tabela 2; Figura 11). Os pontos foram escolhidos visando, além da acessibilidade, amostrar os principais cursos d’água da respectiva Unidade de Conservação, que são: Ribeirão Santo Antônio (afluente do rio Meia Ponte) e Córrego da Mata (Afluente do rio Dourado que, por sua vez, é afluente do rio Meia Ponte), que por apresentarem maior volume de água, coincidem com a unidade mais plana da Unidade de Conservação. Plano de Manejo UC Serra das Areias 23 Tabela 2: Pontos amostrais de ictiofauna na Unidade de Conservação Serra das Areias. Ponto LOCAL LATITUDE LONGITUDE P1 Ribeirão Santo Antônio 16º49'44,9''S 49º18'46,0''W P2 Córrego da Mata 16º51'17,7''S 49º20'14,3''W Ponto lagoa Córrego da Mata 16°51'50.87"S 49°21'15.20"W Procedimentos em campo Os pontos foram amostrados no dia 13/03/2014 e 14/07/2014, sendo que o P1 (Ribeirão Santo Antônio) e Ponto lagoa foi amostrado pela manhã e o P2 (Córrego da Mata) foi amostrado no período da tarde. Devido ao fato de os pontos amostrais serem cursos d’água de baixa ordem, segundo Strahler (1957), os peixes foram coletados através de redes de arrasto de malha, percorrendo algumas vezes um trecho de 50 metros (5 mm; figura 12), peneiras, puçás (Figura 13), e batendo tarrafas (principalmente no ponto lagoa), padronizando esforço amostral de uma hora. Também foi deixado uma câmera subaquática da marca GoPRO® em uma região de cada ponto amostral, durante meia hora, no intuito de constatar espécies que não foram coletadas (espécies raras). Os peixes capturados foram identificados taxonomicamente, com ajuda de chaves de identificação (Graça & Pavanelli, 2007 e Britski et al. 1988), pesados através de uma balança de bolso de precisão de 0,1g e medidos com uma fita métrica (Figura 14), onde foram retirados o comprimento total (comprimento do focinho até o final da nadadeira caudal) e comprimento padrão (comprimento que vai desde o focinho até o pedúnculo caudal) e devolvidos ao curso d’água. Todos os dados foram anotados e transferidos para planilhas no software Excel®. Plano de Manejo UC Serra das Areias 24 Figura 11: Pontos amostrais de ictiofauna na Unidade de Conservação Serra das Areias. As linhas vermelhas representam os limites das unidades mais elevadas e conservadas da Unidade de Conservação. A linha preta representa o contorno da UC Serra das Areias. P1, P2 e Ponto Lagoa são os pontos de coleta da ictiofauna Fonte: Google Earth, 2014. 25 Plano de Manejo UC Serra das Areias Figura 12: Biólogos realizando a pesca através de rede de arrasto. Fonte: Mattos e Clímaco Ltda, 2014. Figura 13: Biólogo capturando peixes através de uso de puçá de mão. Fonte: Mattos e Clímaco Ltda, 2014. Plano de Manejo UC Serra das Areias 26 Figura 14: Pesagem e medição dos peixes. Fonte: Mattos e Clímaco Ltda, 2014. 2.5 Macroinvertebrados Aquáticos Área Amostral A primeira coleta de invertebrados aquáticos ocorreu nos dias 22 e 23 de março de 2014, onde foram amostrados os córregos Santo Antônio (16º49’44,9”S, 49º18’46,0”W) e da Mata (16º51’17,7”S, 49º20’14,3”W) (Figura 15). A campanha seguinte ocorreu no dia 14 de julho de 2014, durante o período de seca. Os córregos da Mata e Santo Antônio foram escolhidos para verificar se há diferenças entre as comunidades bentônicas e qual a melhor forma de manejo para essas comunidades aquáticas. A coleta dos invertebrados aquáticos ocorreu, nos mesmos pontos que a coleta da Ictiofauna, em unidade plana, portanto, visualizados na figura 11, do ítem Metodologia do diagnóstico ambiental do meio biótico: Ictiofauna. Plano de Manejo UC Serra das Areias 27 Figura 15: Pontos de coleta na Unidade de Conservação Serra das Areias, situado no munícipio de Aparecida de Goiânia – Goiás. Córrego da Mata (à esquerda) e Córrego Santo Antônio (à direita). Fonte: Mattos e Clímaco Ltda, 2014. Amostragem dos Invertebrados Aquáticos Em cada córrego foi determinado um trecho de aproximadamente 100 metros, no qual foram realizadas dez sub-amostras aleatórias de substrato (folhiço e areia). A amostragem foi realizada com amostrador do tipo Súber, com área de fundo de 0,1m² (Figura 16). O material coletado foi condicionado em frascos plásticos, fixados com álcool 70% e encaminhado para triagem, identificação e quantificação em laboratório com microscópio estereoscópio. Figura 16: Amostragem de invertebrados aquáticos, utilizando amostrador do tipo súber, nas áreas de influência da UC Serra das Areias. Fonte: Mattos e Clímaco Ltda, 2014. Plano de Manejo UC Serra das Areias 28 Análise dos Dados A identificação dos táxons foi realizada até o menor nível taxonômico possível. Foram realizados os cálculos de abundância total dos táxons em cada córrego, índice de diversidade de Shannon-Wiener (H’), índice de equitabilidade de Pielou (J’) e riqueza taxonômica para cada ponto amostral, nas diferentes estações seca/chuvosa. Para a avaliação da água utilizando os invertebrados aquáticos como bioindicadores, foi utilizado o índice BMWP (Biological Monitoring Working Party) adaptado por Monteiro et al. (2008). O índice adaptado por Monteiro e colaboradores é o mais indicado para uma avaliação mais precisa no estado de Goiás, uma vez que a pontuação atribuída por ele é mais condizente com a sensibilidade dos táxons amostrados já que o estudo foi realizado também no estado de Goiás. Só foi atribuído pontuação às famílias que se encontravam no índice, as demais famílias amostradas foram excluídas da análise. Como o método BMWP não faz referência a um sistema de classificação da qualidade da água, foram utilizadas faixas de pontuação para determinar as classes de qualidade da água dos pontos amostrados, conforme proposto por Alba-Tercedor & Sánchez-Ortega (1988). Esta classificação é baseada no somatório das famílias encontradas nos locais à partir do índice BMWP e cada ponto recebe então uma classe de classificação da água, que pode ser: excelente, boa, satisfatória, ruim e muito ruim (Tabela 3). Tabela 3: Sistema de classificação da qualidade de água estabelecido para os córregos da Mata e Santo Antônio, localizados nas áreas de influência da UC Serra das Areias, Aparecida de Goiânia, Goiás (De acordo com Alba-Tercedor & Sánchez-Ortega, 1988). Classe Somatório da pontuação I II III IV V ≥ 150 149 – 100 99 – 60 59 – 20 ≤19 Qualidade Excelente Boa Satisfatória Ruim Muito Ruim 2.6 Mastofauna A amostragem de mamíferos na região da Serra das Areias – Município de Aparecida de Goiânia - foi realizada durante duas estações do ano – chuvosa e seca - entre os dias 17 e Plano de Manejo UC Serra das Areias 29 22 de março de 2014 e entre os dias 7 e 11 de julho de 2014, totalizando onze dias de coletas. Devido às características da região como tamanho, segurança e presença contínua de visitantes/moradores, além do curto período disponível para a realização das coletas, evitamos a utilização de métodos diretos de amostragem, como a utilização de armadilhamento (e.g. fotográfico, gaiolas) para alguns grupos (pequenos, médios e grandes mamíferos terrestres). Tais métodos, além de muito caros, possuem um sucesso de captura relativamente baixo e são frequentemente danificados por vândalos. Assim, optamos por uma amostragem extensiva baseada em métodos indiretos (busca por rastros, fezes, tocas e outros vestígios), a fim de cobrir a maior área possível da região. A busca por esses vestígios ocorreu em transectos condicionados à existência de trilhas, com especial cuidado na observação dos cursos d’água presentes em suas proximidades (localidades para dessedentação), que são locais mais propícios de serem encontrados sinais deixados pelos animais, devido ao tipo de solo ali presente. Desta forma, os transectos foram conduzidos a pé no período diurno, percorrendo-se a maior distância possível durante quatro horas diárias (08:00-12:00). Deste modo, buscamos realizar uma amostragem que apresentasse maior representatividade dos ambientes encontrados na região de estudo (Figura 17). Figura 17: Imagem de Satélite da delimitação da UC Serra das Areias (preto) e respectivas Unidades Topográficas Elevadas (vermelho), contendo os transectos feitos a pé (amarelo) e de camionete (azul), além de pontos onde as espécies foram encontradas Fonte: Google Earth, 2014 Plano de Manejo UC Serra das Areias 30 Os vestígios encontrados foram fotografados com uma câmera fotográfica Nikon D7100 sendo utilizada uma escala de medida (trena ou algum objeto) nas fotos. Os vestígios foram identificados à partir de Guias Específicos (Becker & Dalponte 2013, Borges & Tomás 2004) e os pontos de ocorrência foram marcados com o auxílio de um GPS Garmin GPSMap 76CSx. Essa metodologia apresentou um esforço amostral de cerca de 40 horas. Durante o período noturno (20:00-00:00/01:00) foram realizados transectos (método direto) de quarenta minutos cada e com intervalos de vinte minutos, aproximadamente, a fim de se visualizar indivíduos. Os transectos foram realizados tanto de camionete pelas estradas de acesso, a uma velocidade média de 20 km/h e utilizando um cilibrim Coleman Spotlight, quanto a pé, percorrendo as trilhas da região. Do mesmo modo, locais de avistamento de indivíduos foram marcados com auxílio do GPS. De forma similar aos transectos diurnos, esse método apresentou esforço amostral de cerca de 40 horas. Com relação ao grupo de mamíferos voadores, utilizamos um método direto de armadilhamento por redes de neblina. Selecionamos sete pontos, condicionados à proximidade de cursos d’água, matas/corredores e em locais com maior influência antrópica (clube abandonado, antigas construções e pequenos fragmentos florestais). Em cada ponto foram montadas cerca de oito redes de neblina Zootech (dez metros de comprimento por três metros de altura), seguindo padrões diversos a fim de aumentar a área de coleta (maior sucesso de captura). Em cada noite, as redes permaneceram montadas durante 4-5 horas, e foram vistoriadas a cada hora. Os morcegos coletados foram identificados no menor nível taxonômico, utilizando a chave de identificação (e.g. Gardner, 2007) e importantes medidas foram coletadas (medidas de antebraço; peso) com o auxílio de equipamentos de precisão (paquímetro e balança digital), a fim de auxiliar na identificação das espécies. 2.7 Flora A caracterização da vegetação da unidade de conservação foi feita em duas campanhas, sendo uma no período chuvoso (março de 2014) e uma no período seco (julho de 2014). O presente estudo compreendeu tanto áreas mais conservadas e elevadas quanto as áreas planas e com uso do solo antrópico. A amostragem foi feita basicamente através da caracterização fitofisionômica, florística e fitossociológica da região, cujos detalhes são descritos a seguir. Plano de Manejo UC Serra das Areias 31 Metodologia para levantamento fitofisionômico Utilizou-se do Mapa de Vegetação da área, produzido por Rosa (2014), para orientação quanto as principais formações da vegetação existentes na Unidade de Conservação (Figura 18). Portanto, para devido à escala do mapa produzido por Rosa (2014) e diante da formação em mosaicos da vegetação de Cerrado, foi utilizada a vistoria em toda a área da unidade para uma avaliação das principais características da vegetação (Figura 19), incluindo a categorização das fitofisionomias, como baseados na estrutura da vegetação (densidade de plantas, medidas do porte da vegetação e altura do dossel) e composição das espécies de plantas. As fitofisionomias foram categorizadas de acordo com Ribeiro & Walter (2008). Metodologia para levantamento florístico A listagem de espécies de plantas (amostragem qualitativa) foi feita através do método de caminhamento (transect), onde foram feitos o registro fotográfico e a catalogação das espécies de plantas herbáceas, arbustivas e arbóreas ocorrentes na vegetação (Figura 20). Em alguns casos, foi feita a coleta de material reprodutivo (flores e frutos) ou vegetativo (folhas e ramos), para identificação em laboratório bem como para o depósito em herbário. O material coletado foi preparado e montado em exsicatas para posterior depósito no Herbário da Universidade Federal de Goiás. Como uma forma de complementar a listagem de espécies registradas na área, bancos de dados de flora nacionais e internacionais, bem como publicações especializadas, foram inspecionados na tentativa de compilar registros de ocorrência de espécies vegetais para a Unidade de Conservação. Plano de Manejo UC Serra das Areias 32 Figura 18: Mapa de Vegetação da Unidade de Conservação Serra das Areias, em Aparecida de Goiânia. Fonte: Mattos e Clímaco Ltda, 2014. 33 Plano de Manejo UC Serra das Areias Figura 19: Detalhe do mapeamento fitofisionomico. Figura 20: Biólogos realizando o levantamento florístico da vegetação. Fonte: Mattos e Clímaco Ltda, 2014. Fonte: Mattos e Clímaco Ltda, 2014. Metodologia para levantamento fitossociológico Para o levantamento fitossociológico (amostragem quantitativa) da vegetação foram estabelecidas 50 parcelas de 10x10 m em diferentes fitofisionomias da unidade (Tabela 4). A quantidade de parcelas alocadas nas fitofisionomias foi estabelecida buscando acompanhar a representatividade de cada tipo de fisionomia no contexto geral da unidade (Tabela 5). As parcelas foram demarcadas de maneira permanente com estacas de madeira de 1m e as plantas amostradas foram marcadas com plaquetas metálicas de 2x2cm, com o intuito de fornecer subsídios para o monitoramento da vegetação e o desenvolvimento de futuras pesquisas. Tabela 4: Caracterização fitofisionômica e coordenada de localização das 50 parcelas de amostragem de flora. Parcela Fitofisionomia 22k UTM Parcela Fitofisionomia 22k UTM 1 Cerrado ralo 675868 8135988 26 Cerrado típico 679377 8137144 2 Cerrado ralo 675861 8135994 27 Cerrado típico 679370 8137135 3 Cerrado ralo 675879 8135983 28 Cerrado típico 679380 8137129 4 Campo sujo 675810 8135920 29 Cerrado típico 679375 8137125 5 Campo sujo 675809 813592 30 Cerrado típico 679366 8137132 6 Campo sujo 675803 8135929 31 Cerrado típico 678283 8136099 7 Campo sujo 675803 8135921 32 Cerrado típico 678287 8136107 8 Mata de galeria 677107 8135678 33 Cerrado típico 678381 8136142 Plano de Manejo UC Serra das Areias 34 Cont. Parcela Fitofisionomia 22k UTM Parcela Fitofisionomia 22k UTM 9 Mata de galeria 677114 8135689 34 Cerrado típico 678378 8136148 10 Mata de galeria 677113 8135699 35 Cerrado típico 678127 8135848 11 Cerradão 676823 8135916 36 Cerrado típico 678134 8135855 12 Cerradão 676828 8135907 37 Cerrado típico 675226 8134901 13 Cerradão 676824 8135896 38 Cerrado típico 675220 8134906 14 Cerradão 676822 8135889 39 Cerrado típico 675213 8134911 15 Cerrado rupestre 678442 8136944 40 Cerrado típico 675208 8134918 16 Cerrado rupestre 678452 8136943 41 Cerrado típico 675201 8134927 17 Cerrado rupestre 678465 8136948 42 Mata de galeria 675544 8134785 18 Cerrado rupestre 678477 8136948 43 Mata de galeria 675548 8134793 19 Cerrado rupestre 678485 8136948 44 Mata de galeria 675552 8134800 20 Cerrado típico 679756 8137489 45 Mata de galeria 675559 8134799 21 Cerrado típico 679749 8137499 46 Cerrado típico 675969 8134746 22 Cerrado típico 679748 8137508 47 Cerrado típico 675964 8134751 23 Cerrado típico 679746 8137515 48 Cerrado típico 675958 8134757 24 Cerrado típico 679740 8137526 49 Cerrado típico 675952 8134760 25 Cerrado típico 679384 8137135 50 Cerrado típico 675945 8134777 Tabela 5: Distribuição do número de parcelas por tipo de fitofisionomia. Tipo de formação Quantidade de parcelas Representatividade 4 11 35 8% 22% 70% Campestre Florestal Savânica Em cada parcela (Figura 21) foram amostrados todos os indivíduos arbóreo-arbustivos com circunferência maior que 15 cm à altura do peito (CAP) para as vegetações florestais e à altura de 30 cm do solo (CNS) para as vegetações savânicas (Figura 22). Cada indivíduo amostrado foi identificado em espécie (quando possível), fotografado e teve sua altura anotada. Para se ter uma ideia da taxa de mortalidade em cada parcela amostrada também foram coletados dados de todos os indivíduos mortos em pé. Os dados coletados foram anotados em planilha de campo para posterior análise. Plano de Manejo UC Serra das Areias 35 Figura 21: Vista geral de uma parcela de amostragem em cerrado típico. Figura 22: Detalhe da amostragem fitossociológica. Fonte: Mattos e Clímaco Ltda, 2014. Fonte: Mattos e Clímaco Ltda, 2014. A partir dos dados coletados em campo foram calculados diferentes parâmetros fitossociológicos, como densidade, frequência, dominância, índice de valor de importância e de cobertura e índices de diversidade e equitabilidade. Essas análises identificam os parâmetros quantitativos da comunidade vegetal, definindo parâmetros de abundância e relações de dominância e importância relativas; o que permite ainda inferências sobre a distribuição espacial de cada espécie (Imaña-Encinas et al. 2009). Isso possibilita determinar quais espécies são mais importantes para a composição da comunidade vegetal, bem como estudar o agrupamento das plantas e sua inter-relação e dependência de fatores bióticos. Plano de Manejo UC Serra das Areias 36 3. DIAGNÓSTICO AMBIENTAL DO MEIO BIÓTICO De maneira geral a Unidade de Conservação Serra das Areias apresenta duas situações distintas do ponto de vista da conservação dos recursos naturais, sendo: (1) duas unidades topográficas elevadas e movimentadas, com vegetação contínua, mas também com a presença de áreas com degradação ambiental; (2) uma unidade topográfica plana e bastante modificada do ponto de vista da cobertura vegetal original, porém apresentando fragmentos essenciais à manutenção da biodiversidade das unidades mais conservadas. É na unidade plana que estão inseridos os principais corredores de biodiversidade, sendo um corredor entre as unidades topográficas elevadas através do córrego da Mata e, outros corredores conectando a Unidade de Conservação à zona rural de Aragoiânia e Hidrolândia. Portanto, apesar das unidades planas estarem mais alteradas do ponto de vista dos recursos naturais, ela também apresenta habits importantes, especialmente aqueles florestais. Some-se a isto uma diversidade de organismos vivos também utilizam de áreas antropizadas em seus nichos ecológicos, ressaltando a importância de controlar as atividades antrópicas nas unidades planas da Unidade de Conservação. Diante das duas situações bem distintas do ponto de vista da conservação de habitats, o diagnóstico do meio biótico contempla as principais particularidades de ambas, com exceção dos organismos cujo habitat é aquático, ficando tais grupos (ictiofauna e macroivertebrados aquáticos) diagnosticados apenas nas unidades topográficas planas, onde os cursos d’água apresentam uma maior vazão e disponibilidade de recursos hídricos. Além da descrição dos habitas, identificação de espécies, quantificação de espécimes, dentre outras informações ecológicas dos grupos estudados, buscou-se apontar as vulnerabilidades, fragilidades e potencialidades de cada grupo em relação ao habitat inserido na Serra das Areias. 3.1 Avifauna Nas duas campanhas realizadas nos meses de março e julho de 2014, foram registrados um total de 618 indivíduos, sendo 252 indivíduos na campanha de março e 366 na campanha de julho (Tabela 6). Estes estavam distribuídas em 80 espécies e 30 famílias (tabela 7). Não houve registro de espécies ameaçadas conforme as listas oficiais consultadas (IUCN e MMA). As Plano de Manejo UC Serra das Areias 37 informações contidas neste diagnóstico de aves retratam a distribuição das áreas levantadas da seguinte forma: (1) Mata de Galeria, Cerrado Típico e áreas antropizadas (pastagens) e, (2) áreas topográficas elevadas e topográficas planas. Esta última, bastante antropizada e com predomínio de pastagem. Alguns indivíduos foram registrados na figura 25. Tabela 6: Dados Gerais do registro de aves na Unidade de Conservação Serra das Areias, em relação à época de registro e as áreas amostradas. REGISTROS MARÇO JULHO TOTAL POR ÁREA Mata de Galeria Cerrado Típico Áreas Antropizadas TOTAL 102 95 55 252 131 152 83 366 233 247 138 618 Tabela 7: Lista de espécies registradas, suas respectivas famílias, nomes populares e total de indivíduos por campanha (Março e Julho/2014) na Unidade de Conservação Serra das Areias. FAMÍLIA/NOME CIENTÍFICO TINAMIDAE Crypturellus parvirostris (Wagler, 1827) Crypturellus tataupa (Temminck, 1815) Nothura maculosa (Temminck, 1815) Rhynchotus rufescens (Temminck, 1815) THRESKIORNITHIDAE Mesembrinibis cayennensis (Gmelin, 1789) Theristicus caudatus (Boddaert, 1783) CATHARTIDAE Coragyps atratus (Bechstein, 1793) ACCIPITRIDAE Rupornis magnirostris (Gmelin, 1788) Buteo brachyurus (Vieillot, 1816) Ictinia plumbea (Gmelin, 1788) RALLIDAE Porzana albicollis (Vieillot, 1819) CHARADRIIDAE Vanellus chilensis (Molina, 1782) COLUMBIDAE Columbina talpacoti (Temminck, 1811) Columbina squammata (Lesson, 1831) Leptotila verreauxi (Bonaparte, 1855) Plano de Manejo UC Serra das Areias NOME COMUM coró-coró curicaca Março 2 1 1 - Julho 2 2 3 2 1 urubu-de-cabeça-preta 2 5 gavião-carijó gavião-de-cauda-curta sovi 2 1 - 4 1 sanã-carijó - - quero-quero 4 6 rolinha - roxa fogo-apagou juriti-pupu 13 12 3 8 11 4 inhambu-chororó inhambu-chintã codorna-amarela perdiz 38 Cont. FAMÍLIA/NOME CIENTÍFICO Patagioenas picazuro (Temminck, 1813) Zenaida auriculata (Des Murs, 1847) Patagioenas cayennensis (Bonnaterre, 1792) Patagioenas speciosa (Gmelin, 1789) CUCULIDAE Piaya cayana (Linnaeus, 1766) Crotophaga ani Linnaeus, 1758 Guira guira (Gmelin, 1788) Tapera naevia (Linnaeus, 1766) NYCTIBIIDAE Nyctibius griseus (Gmelin, 1789) TROCHILIDAE Phaethornis pretrei (Lesson & Delattre, 1839) Eupetomena macroura (Gmelin, 1788) Colibri serrirostris (Vieillot, 1816) MOMOTIDAE Momotus momota (Linnaeus, 1766) GALBULIDAE Galbula ruficauda (Cuvier, 1816 ) BUCCONIDAE Monasa nigrifrons (Spix, 1824) Nystalus chacuru (Vieillot, 1816) RAMPHASTIDAE Ramphastos toco Statius (Muller, 1776) PICIDAE Picumnus albosquamatus d'Orbigny, 1840) Colaptes melanochloros (Gmelin, 1788) Veniliornis passerinus (Linnaeus, 1766) Dryocopus lineatus (Linnaeus, 1766) Colaptes campestris (Vieillot, 1818) CARIAMIDAE Cariama cristata (Linnaeus, 1766) FALCONIDAE Herpetotheres cachinnans (Linnaeus, 1758) Caracara plancus (Miller, 1777) Falco sparverius (Linnaeus, 1758) Milvago chimachima (Vieillot, 1816) PSITTACIDAE Plano de Manejo UC Serra das Areias NOME COMUM pombão pomba-de-bando pomba-galega pomba-trocal Março 10 10 - Julho 25 4 1 1 alma-de-gato anu-preto anu-branco 1 10 9 - 3 4 10 1 mãe-da-lua 1 - rabo-branco-acanelado beija-flor-tesoura beija-flor-de-orelha-violeta 1 1 2 2 2 8 udu-de-coroa-azul 3 4 ariramba-de-cauda-ruiva 2 2 chora-chuva-preto joão-bobo 9 - 2 6 tucanuçu 7 2 pica-pau-anão-escamado pica-pau-verde-barrado picapauzinho-anão pica-pau-de-banda-branca pica-pau-do-campo 2 1 1 1 - 1 1 2 4 7 seriema 2 2 acauã caracará quiriquiri carrapateiro 2 3 1 - 2 2 1 4 39 Cont. FAMÍLIA/NOME CIENTÍFICO Ara ararauna (Linnaeus, 1758) Psittacara leucophthalmus (Statius Muller, 1776) Aratinga auricapillus (Kuhl, 1820) Brotogeris chiriri (Vieillot, 1818) TYRANNIDA Tyrannus melancholicus (Vieillot, 1819) Camptostoma obsoletum (Temminck, 1824) Myiarchus swainsoni Cabanis & Heine, 1859 Pitangus sulphuratus (Linnaeus, 1766) Philohydor lictor (Lichtenstein, 1823) Myiodynastes maculatus (Statius Muller, 1776) Griseotyrannus aurantioatrocristatus (d'Orbigny & Lafresnaye, 1837) Myiarchus ferox (Gmelin, 1789) DENDROCOLAPTIDAE Lepidocolaptes angustirostris (Vieillot, 1818) VIREONIDAE Cyclarhis gujanensis (Gmelin, 1789) CORVIDAE Cyanocorax cyanopogon (Wied, 1821) HIRUNDINIDAE Progne tapera (Vieillot, 1817) Progne chalybea (Gmelin, 1789) Pygochelidon cyanoleuca (Vieillot, 1817) Riparia riparia (Linnaeus, 1758) TROGLODYTIDAE Pheugopedius genibarbis (Swainson, 1838) POLIOPTILIDAE Polioptila dumicola (Vieillot, 1817) TURDIDAE Turdus leucomelas (Vieillot, 1818 ) MIMIDAE Mimus saturninus (Lichtenstein, 1823) THRAUPIDAE Lanio pileatus (Wied, 1821) Lanio cucullatus (Statius Muller, 1776) Tangara sayaca (Linnaeus, 1766) Nemosia pileata (Boddaert, 1783) Tangara cayana (Linnaeus, 1766) Plano de Manejo UC Serra das Areias NOME COMUM Março arara-canindé periquitão-maracanã jandaia-de-testa-amarela periquito-de-encontro-amarelo 6 Julho 8 10 15 suiriri risadinha irré bem-te-vi bentevizinho-do-brejo bem-te-vi -rajado 8 7 2 4 2 1 11 5 7 12 2 peitica-de-chapéu-preto 2 1 maria-cavaleira 6 3 arapaçú-do-cerrado - 2 pitiguari - 3 gralha-cancã 4 6 andorinha-do-campo andorinha-doméstica-grande andorinha-pequena-de-casa andorinha-de-barranco 5 2 5 - 3 5 2 14 garrinchão-pai-avô 2 2 balança-rabo-de-máscara 2 5 sabiá-barranco 1 4 sabiá-do-campo 5 7 tico-tico-rei-cinza tico-tico-rei sanhaçu-cinzento saíra-de-chapéu-preto saíra-amarela 2 4 4 6 5 4 4 9 6 8 40 Cont. FAMÍLIA/NOME CIENTÍFICO Volatinia jacarina (Linnaeus, 1766) Saltatricula atricollis (Vieillot, 1817) Tersina viridis (Illiger, 1811) Sporophila nigricollis (Vieillot, 1823) Emberizoides herbicola (Vieillot, 1817) Dacnis cayana (Linnaeus, 1766) Sicalis flaveola (Linnaeus, 1766) Sicalis luteola (Sparrman, 1789) CARDINALIDAE Piranga flava (Vieillot, 1822) FRINGILLIDAE Euphonia chlorotica (Linnaeus, 1766) NOME COMUM tiziu bico-de-pimenta saí-andorinha baiano canário-do-campo saí-azul canário-da-terra-verdadeiro típio Março 7 10 4 8 2 2 8 - Julho 6 8 6 12 6 8 sanhaçu-de-fogo 2 3 fim-fim TOTAL 4 252 6 366 Piranga flava sanhaçu-de-fogo Dacnis cayana saíra-azul Dryocopus lineatus pica-pau-de-banda-branco Vanellus chilensis Quero-quero Plano de Manejo UC Serra das Areias 1 41 Crotophaga ani Anu-preto Guira guira Anu-branco Theristicus caudatus Curicaca Lepidocolaptes angustirostris Arapaçu-do-cerrado Coragyps atratus Urubu-de-cabeça-preta Colaptes campestris Pica-pau-do-campo Figura 23: Ilustração de três espécies de aves registradas na Unidade de Conservação Serra das Areias. Fonte: Mattos e Clímaco Ltda, 2014 Plano de Manejo UC Serra das Areias 42 Área de Mata de Galeria Legalmente as matas de galeria são áreas consideradas de proteção integral. Foram feitas campanhas em duas áreas de Mata de Galeria em locais diferentes. Uma área próxima às torres nas imediações do setor Jardim Monte Sinai (16º49’48.30 S 49º18’52.82” O) e, outra na região do córrego da Mata (16º51’17.55”S) conforme figura 24 e 25. Foram registrados 233 espécimes nas duas áreas com 102 indivíduos distribuídos em 35 espécies na campanha do mês de março e 131 indivíduos distribuídos em 43 espécies na segunda campanha de julho. Na área de Mata de Galeria próxima ao setor Jardim Monte Sinai foram encontrados adolescentes caçadores de aves portando “estilingues” (Figura 26). Possivelmente tal fato indique a necessidade de campanhas de Educação Ambiental na região. Figura 24: Mata de Galeria no Jardim Monte Sinai Fonte: google earth, 2014 Plano de Manejo UC Serra das Areias 43 Figura 25: Mata de Galeria do Córrego da Mata em vermelho Fonte: Google Earth, 2014 Figura 26: Adolescentes caçadores de aves na Unidade de Conservação Serra das Areias. Fonte: Mattos e Clímaco Ltda, 2014 Plano de Manejo UC Serra das Areias 44 Há também sinais da presença humana através de material descartável em vários pontos ao longo do curso do córrego. Há sinais da presença humana, como trilhas e vasilhames descartáveis nas margens e no leito do córrego. Os sinais encontrados indicam que possivelmente, o local é utilizado para lazer, pesca, caça e outros fins. Apesar das degradações ambientais, nos ambientes de Matas de Galeria foram registrados 131 indivíduos distribuídos em 44 espécies das quais 5 delas são muito sensíveis a alterações ambientais por apresentarem na sua maioria um comportamento especializado quanto à sua dieta e comportamento reprodutivo. Estudos mostram que a avifauna de ambientes de mata de galeria são aves na sua maioria especialistas que dependem muito da conservação do ecossistema preservado (PIROVANI, 214). Algumas aves não visitam áreas abertas e sendo assim são espécies restritas a esse tipo de ambiente. Geralmente as matas de galeria servem como refúgios para espécies para alocação de recursos alimentares bem como campos de nidificação. A caça de aves nesses locais interfere significantemente no decréscimo da maioria das espécies. Outro aspecto importante a ser observado é o fato dos ambientes de matas de galeria serem utilizados como corredores migratórios. Muitas aves não migram por áreas abertas, mas pelas matas. Dentre as aves mais sensíveis às alterações nos ambientes de mata de galeria pode-se destacar: udu-de-coroa-azul (Momotus momota) e alma-de-gato (Piaya cayana), ambas presentes nas duas campanhas. 3.1.1 Unidades Topográficas Elevadas As áreas elevadas, nas proximidades das torres de telecomunicações (16°50'30.15"S 49°19'8.42"O) (figura 27) apresentam características típicas de cerrado sentido restrito, apresentando além de vegetação arbustivo-arbórea, vegetação herbácea e gramíneas presentes. É considerável a presença de sinais de ações antrópicas ao longo de todo o percurso onde foi feito o transecto. Trilhas de ciclismo são comuns no local. Contudo a vegetação apresenta-se preservada na sua maioria. Nessa área foram registradas 95 indivíduos distribuídos em 37 espécies na primeira campanha (março de 2014) e, 152 espécimes distribuídos em 33 espécies Plano de Manejo UC Serra das Areias 45 na segunda campanha (julho de 2014), totalizando 247 registros para as duas campanhas (Tabelas 6 e 7). Figura 27: Cerrado próximo à torre, onde foram realizados o levantamento de aves nas unidades topográficas elevadas na Unidade de Conservação Serra das Areias Fonte: Google earth, 2014 Fragilidades Algumas espécies desse tipo de ambiente podem ser consideras vulneráveis em função do encolhimento dos seus sítios de alimentação e reprodução. Dentre as espécies mais vulneráveis encontradas destacam-se: joão-bobo (Nystalus chacuru) e sanhaço-de-fogo (Piranga flava), respectivamente. Não houve registrode espécies ameaçadas conforme as listas oficiais consultadas (IUCN e MMA). Vulnerabilidades Muitas aves não conseguem viver em áreas antropizadas, pois as mudanças ambientais interferem diretamente em seu ciclo, mudando e prejudicando seu período de reprodução e dificultando a captura de alimentos em virtude da escassez do mesmo ou da dificuldade em Plano de Manejo UC Serra das Areias 46 capturá-lo. Ambientes fragmentados ilustram a interferência na dieta e os perigos devido à exposição do animal, a busca que ele trava muitas vezes em rodovias, entre outros. A área estudada apresenta significativas alterações provocadas principalmente pela presença de práticas de ciclismo e motociclismo (trilhas). Essas práticas provocam erosões do solo nas trilhas trafegadas além de causar alto índice de poluição sonora o que prejudica drasticamente as comunidades de aves sensíveis a ambientes antropizados. Potencialidades Algumas aves, dentre elas os beija flores (Trochilidae), voam acompanhando os recursos oferecidos em cada estação do ano, acompanhando os ciclos de floração. Algumas espécies fazem migrações sazonais, variando a floração anual de certas plantas. A maioria das espécies endêmicas habita campos rupestres, e também fazem deslocamentos entre as bordas das matas de galerias, cerrados e jardins (Sigrist, 2009). A avifauna compõe um dos mais relevantes grupos de dispersores de sementes das plantas zoocóricas em florestas tropicais (Soto e Anjos, 2009). 3.1.2 Unidades Topográficas Planas Foram feitos 138 registros de aves na área de pastagem (Figura 28a) somando as duas campanhas, sendo 55 indivíduos distribuídos em 22 espécies no mês de março e 83 indivíduos distribuídos em 27 espécies no mês de julho (Tabelas 6 e 7). Este estudo permite sugerir que tanto as áreas topograficamente elevadas quanto a área topográfica plana carecem de um trabalho significante no que se refere a Educação Ambiental, pois esta é uma ferramenta muito importante na conscientização ecológica das pessoas. É notório que o espaço entre as duas unidades topográficas elevadas, constituído de matas de galeria e áreas abertas, permitem compreender a importância destes ambientes para a manutenção da vida e para troca de informações genéticas entre as espécies que vivem no alto das serras (Figura 28b). Plano de Manejo UC Serra das Areias 47 b a Figura 28: (a) Áreas de Pastagem na unidade topográfica plana que foi avaliada quanto à riqueza da Avifauna, na Unidade de Conservação Serra das Areias e, (b) Área Crítica (provável corredor ecológico), sendo o corredor de vegetação restrito ao córrego da Mata que une as duas unidades topográficas elevadas Fonte: Google Earth, 2014 Fragilidades As áreas de pastagem são, na sua maioria, ambientes habitados por espécies generalistas muito bem adaptadas aos ambientes antropizados e apresentam alto grau de antropização. Dentre as espécies mais vulneráveis destacam-se: codorna-amarela (Nothura maculosa) e perdiz (Rhynchotus rufescens), amplamente caçadas para consumo humano. De uma forma geral as áreas de proteção integral apresentam consideráveis alterações nos seus ecossistemas naturais. Nestas unidades planas também não houve registrode espécies ameaçadas conforme as listas oficiais consultadas (IUCN e MMA). Vulnerabilidades A antropização tem imposto a adaptação de diversas espécies de aves e extinção de algumas. Algumas espécies típicas do Cerrado se tornaram mais abundantes em áreas urbanas, e demonstraram uma excelente adaptação ao ambiente dominado pelo homem. Sobretudo, grandes partes das aves brasileiras estão no Cerrado (Sigrist, 2009). A intervenção humana se tornou a principal ameaça para as aves brasileiras, através de deteriorações de seus hábitats naturais, deixando nítida a fragmentação dos mesmos (Marini, 2005). Tudo indica que as áreas são utilizadas por pessoas que procuram esses ambientes para explorar ou até mesmo acampar e praticar atividades de lazer sem maiores cuidados, o que traz sérios riscos para a conservação da avifauna no local. O mesmo acontece com os ambientes de cerrado Plano de Manejo UC Serra das Areias 48 onde andarilhos, ciclistas e motociclistas exploram de forma desordenada as trilhas favorecendo o processo de erosão no solo com o consequente assoreamento das nascentes da região e córregos da região. 3.1.3 Entorno da Unidade de Conservação Possivelmente existam corredores migratórios (matas ciliares) nos ambientes antropizados como pastagens e lavouras que servem para interligar os territórios que formam o complexo da Serra das Areias. Tais corredores carecem ser mapeados e preservados através de um esforço popular onde o poder público e população em geral assumam a responsabilidade pela preservação desses ambientes. 3.1.4 Heterogeneidades A dispersão de sementes geralmente é mais significante em ambientes com vegetação mais fechada. Entretanto algumas espécies de aves dispersam sementes voando por áreas abertas. Identificar as espécies potencialmente disseminadoras de sementes nas Unidades Topográficas Planas possibilitará a elaboração de ações que visem a manutenção do equilíbrio ambiental local. As Unidades Topográficas Elevadas visitadas apresentam um mosaico de vegetação variando entre mata, cerradão, cerrado ralo e cerrado sujo. Essas diferentes fitofisionomias permitem a sobrevivências de várias espécies de aves desses ambientes mais preservados. Interferir nesses ecossistemas pode alterar a distribuição dessas espécies isolando-as de forma a empobrecer seu fluxo gênico na dinâmica do equilíbrio populacional. 3.2 Entomofauna Considerando os limites territoriais da Unidade de Conservação Serra das Areias, foram registrados 146 táxons de himenópteros polinizadores distribuídos em 11 famílias (tabela 08), 70 táxons de artrópodes de solo registrados em 11 ordens (tabela 09) e apenas três táxons de vetores distribuídos em três gêneros (tabela 10). Plano de Manejo UC Serra das Areias 49 Tabela 8: Lista dos táxons de himenópteros polinizadores registrados na Serra das Areias. Ni: número de indivíduos; UTP: Unidades topográficas planas; UTE: Unidades topográficas elevadas. Família/Morfoespécie Andrenidae Oxaea flavescens Apidae Alepidosceles sp.01 Apis mellifera Bombus morio Centris aenea Centris fuscata Centris sp.01 Centris sp.02 Centris sp.03 Centris sp.04 Centris tarsata Centris varia Ceratina sp.01 Ceratina sp.02 Diadasina sp.01 Diadasina sp.02 Epicharis analis Epicharis bicolor Epicharis flava Epicharis iheringi Eufriesea nigrescens Euglossa imperialis Euglossa sp. Euglossa sp.01 Euglossa sp.02 Euglossa sp.03 Euglossa sp.04 Eulaema cingulata Eulaema nigrita Exomalopsis auropilosa Exomalopsis fulvofasciata Florilegus melectoides Frieseomelitta sp.01 Plano de Manejo UC Serra das Areias Ni UTP Ni UTE Ni Total Geral 4 4 1 1 17 1 17 1 4 1 2 4 2 1 11 3 2 3 1 1 5 1 1 1 1 1 1 1 1 1 1 1 3 2 1 2 38 1 7 6 18 2 13 4 1 2 4 2 1 11 3 3 4 1 1 5 1 1 1 2 1 2 1 3 2 1 2 56 3 7 6 13 50 Cont. Família/Morfoespécie Ni UTP Ni UTE Ni Total Geral 1 11 2 4 1 1 1 1 4 6 Geotrigona sp.01 Melipona quinquefasciata Mesocheira bicolor Mesoplia sp.01 Paratetrapedia fervida Paratetrapedia gr. Flavipennis Paratetrapedia gr. lineata Paratetrapedia sp.01 Paratrigona lineata 11 2 4 1 Partamona cupira Tetragonisca angustula Tetrapedia sp.01 Tetrapedia sp.02 Thalestria spinosa Trichocerapis mirabilis Trigona sp.01 Trigona sp.02 Xylocopa grisescens Xylocopa hirsutissima Xylocopa ordinaria Xylocopa subcyanea 1 Crabronidae Astatini sp.01 Bembecinus sp.01 Bembicini sp.02 Bembicini sp.03 Bembicini sp.04 Bembicini sp.05 Bembicini sp.06 Cerceris sp.01 Cerceris sp.02 Larrini sp.01 Larrini sp.02 Sphecius spectabilis Halictidae Augochlora sp.01 Plano de Manejo UC Serra das Areias 1 2 1 4 4 3 1 1 1 1 1 3 2 2 6 2 1 1 4 1 4 12 1 1 1 1 1 1 1 1 1 1 1 1 3 2 1 1 3 1 1 1 1 5 15 1 3 2 7 3 1 1 2 5 2 1 1 1 1 3 2 1 51 Cont. Família/Morfoespécie Ni UTP Augochlorella sp.01 Augochloropsis sp.01 Augochloropsis sp.02 Augochloropsis sp.03 Dialictus sp.01 Temnosoma sp.01 Thectochlora alaris 1 4 6 Ni UTE Ni Total Geral 5 2 1 2 1 1 9 8 1 2 1 2 1 1 1 1 1 10 1 2 1 2 1 2 1 2 Ichneumonidae Ichneumonidae sp.01 Megachilidae Ananthidium sp.01 Anthidiini sp.01 Anthidium latum Coelioxys assumptionis Coelioxys sp.01 Coelioxys sp.02 Coelioxys sp.03 Coelioxys sp.04 Coelioxys sp.05 Coelioxys sp.06 Coelioxys sp.07 Coelioxys sp.08 Lithurgus huberi Megachile laeta Megachile sp.01 Megachile sp.02 Megachile sp.03 Megachile sp.04 Megachile sp.05 Megachile sp.06 Megachile sp.07 Megachile sp.08 Megachile sp.09 Megachile sp.10 Megachile sp.11 Megachile sp.12 Megachile sp.13 Plano de Manejo UC Serra das Areias 1 10 1 2 1 2 1 1 1 1 1 1 1 1 2 2 1 2 1 1 8 1 1 1 1 1 1 1 1 1 1 1 1 2 3 1 10 1 1 1 1 1 1 1 1 1 52 Cont. Família/Morfoespécie Ni UTP Ni UTE Ni Total Geral Pompilidae Austrochares gastricum Notocyphus sp.01 Paracyphononyx sp.01 Paracyphononyx sp.02 3 4 1 2 1 5 5 1 1 1 Scoliidae Campsomeris sp.01 Campsomeris sp.02 Campsomeris sp.03 1 1 2 Sphecidae Ammophilini sp.01 Sphecini sp.01 Sphecini sp.02 Sphecini sp.03 Sphecini sp.04 Sphecini sp.05 3 1 2 1 1 4 3 1 1 2 1 6 2 2 2 3 5 Tiphiidae Myzinum sp.01 Myzinum sp.02 Myzinum sp.03 2 1 1 2 1 1 4 2 2 17 5 1 22 1 2 2 4 1 1 6 2 5 2 2 2 1 9 2 Vespidae Agelaia sp.01 Agelaia sp.02 Agelaia sp.03 Agelaia sp.04 Ancistroceroides sp.01 Ancistroceroides sp.02 Brachygastra lecheguana Chartergus sp.01 Chartergus sp.02 Chartergus sp.03 Chartergus sp.04 Chartergus sp.05 Eumenes sp.01 Eumenes sp.02 Metapolybia sp.01 Monobia sp.01 Plano de Manejo UC Serra das Areias 2 1 4 1 3 1 1 1 7 2 1 1 1 5 2 2 1 1 1 1 2 2 1 3 2 53 Cont. Família/Morfoespécie Ni UTP Ni UTE Ni Total Geral 1 1 1 2 1 1 1 5 4 1 1 2 1 2 Montezumia sp.01 Myschocyttarus sp.01 Pachodynerus sp.01 Pachodynerus sp.02 Pachymenes sp.01 Polistes sp.01 Polistes sp.02 Polistes sp.03 Polistes sp.04 Polistes sp.05 Polistes sp.06 Trimeria americana Total Geral 4 2 1 2 1 2 1 1 1 1 187 470 1 1 283 Tabela 9: Lista dos táxons de artrópodes de solo registrados na Serra das Areias. Ni: número de indivíduos; UTP: Unidades topográficas planas; UTE: Unidades topográficas elevadas. Ordem/Táxon Aranaeomorpha Araneidae Dysderidae Lycosidae Oxyopidae Salticidae Theridiidae Thomisidae Trocanteridae Uloboridae Blattodea Blattidae Coleoptera Aphodiinae Canthon Carabidae Curculionidae Dendropaemon Dynastinae Plano de Manejo UC Serra das Areias Ni UTP Ni UTE Ni Total Geral 1 1 2 1 1 1 12 4 3 2 1 1 3 13 34 47 2 1 1 1 2 2 8 1 1 1 1 4 2 8 2 3 2 1 2 7 1 54 Cont. Ordem/Táxon Ni UTP Ni UTE Ni Total Geral Histeridae Leiodidae Nitidulidae Scarabaeidae Staphylinidae Tenebrionidae Collembola Entomobryidae Diptera Cecidomyidae Drosophilidae Phoridae Hemiptera Aradidae Cercopidae Cicadellidae Cydnidae Largidae Lygaeidae Membracidae Nabidae Pentatomidae Reduviidae Thaumastaneis Hymenoptera Acromyrmex Agelaia Anochetus Asteca Atta Brachymyrmex Camponotus Cephalotes Crematogaster Dinoponera Dolichoderus Dorymyrmex Ectatomma Geotrigona Odontomachus 1 2 1 4 2 3 5 3 1 4 2 7 14 Plano de Manejo UC Serra das Areias 4 9 1 1 1 2 10 3 1 1 1 5 1 1 4 356 91 674 392 8 68 19 1 2 44 1 1 1 1 2 46 2 8 11 1 4 1 10 1 1 6 1 2 9 6 1 1 1 566 446 1085 25 120 2 43 140 41 451 2 6 1 5 1 922 537 1759 25 512 10 43 208 60 451 3 9 1 1 55 Cont. Ordem/Táxon Ni UTP Ni UTE Ni Total Geral 1 782 11 1 92 1 19 1534 4 3 6 175 20 2316 15 4 98 1 175 13 35 1 2 10 13 35 1 2 10 Pachycondyla Pheidole Pogonomyrmex Pseudomyrmex Solenopsis Sphecidae Trachymyrmex Isoptera Cornitermes Nasutitermes Syntermes Termitidae Velocitermes Mantodea Mantidae Mygalomorphae Dipluridae Theraphosidae Orthoptera Acrididae Gryllidae Romalaeidae Total Geral 1 1 18 14 1 2611 1 1 1 1 9 8 27 22 1 7504 4893 Tabela 10: Lista dos táxons de vetores registrados na Serra das Areias. Ni: número de indivíduos; UTP: Unidades topográficas planas; UTE: Unidades topográficas elevadas Morfoespécie Culex (Anaedioporpa) sp.01 Mansonia sp.01 Uranotenia sp.01 Total Geral Ni UTB 3 1 1 5 Ni UTE 1 1 Total Geral 4 1 1 6 3.2.1 Unidades Topográficas elevadas e com vegetação contínua Himenópteros polinizadores Nas unidades mais conservadas e topograficamente elevadas (UTE), foram observadas ao todo 187 interações entre himenópteros e flores, compreendendo 73 espécies de Plano de Manejo UC Serra das Areias 56 himenópteros em 28 plantas (Figura 29). Das 73 espécies registradas na Serra das Areias, 61% foram exclusivas das unidades topográficas elevadas. Apesar da presença marcante de impactos antrópicos como a abertura de trilhas e a presença de gado em um dos pontos, a riqueza observada foi consideravelmente alta. A vegetação ao longo das trilhas amostradas nas UTE consistia principalmente de Cerrado stricto-sensu, com pequenos trechos de floresta de galeria e Campo Sujo. As plantas visitadas foram principalmente herbáceas das famílias Asteraceae e Lamiaceae que ocorreram em grandes abundâncias nas formações vegetais mais abertas. Nas armadilhas de essências foram coletadas três morfoespécies, sendo duas morfoespécies do gênero Euglossa e a espécie Eulaema nigrita. A presença de espécies exóticas, como Apis melifera, no interior das UTEs é preocupante, devido aos possíveis impactos sobre a comunidade de plantas e polinizadores nativos (Aizen et al., 2014), embora a verdadeira extensão desses efeitos negativos ainda não seja bem estabelecida empiricamente (Paini, 2004). Dentre as espécies de himenópteros encontradas nas unidades Topográficas elevadas, os Meliponíneos Frieseomelitta sp.01, Tetragonisca angustula e Trigona sp.02 se destacam por serem espécies sociais que dependem da presença de árvores grandes para a construção dos seus ninhos, o que as torna mais susceptíveis às alterações do habitat. Além disso, a coleta de colônias para extração de mel pode ser uma ameaça importante para essas abelhas (Carvalho-Zilse e Nunes-Silva, 2012) e por esse motivo, a presença de acessos e trilhas no interior das UTE pode representar uma ameaça por facilitar o acesso dos habitantes locais aos ninhos. Por outro lado, a implantação de programas de manejo e criação das espécies de meliponíneos nativas da região possibilitaria o uso sustentável dessa fauna, através da exploração de diversos produtos como o mel, própolis e colônias destinadas à polinização de culturas em estufa (Contrera et al., 2011). Além do serviço de polinização, os himenópteros da superfamília Vespoidea, encontrados em abundância na UTE, são importantes inimigos naturais de outros artrópodes (Richards, 1971) e apresentam potenciais usos no controle biológico de pragas (Santana et al., 2012). Uma vez que as duas UTE se encontram separadas por áreas ocupadas por agricultura e pastagem, a manutenção dos remanescentes de vegetação nativa ainda existentes na unidade topográfica plana (UTP) é importante para facilitar o fluxo de indivíduos entre elas. Adicionalmente, como a maioria das espécies de himenópteros visitantes florais ocorre naturalmente em áreas abertas, áreas de pastagem abandonada ou mesmo a vegetação ruderal também facilitam a conexão entre as áreas. Plano de Manejo UC Serra das Areias 57 Figura 29: Redes de interação entre Himenópteros polinizadores e plantas nas Unidades Topográficas Elevadas. As fileiras superiores de retângulos representam as espécies de himenópteros, e as fileiras inferiores as espécies de plantas As espécies que interagiram são conectadas por retângulos cinza, com larguras proporcionais ao número de interações observadas. São mostrados os nomes das três espécies com mais interações para cada grupo. Painel superior – UTE-1, campanha 1, Painel do meio – UTE 1, campanha 2, Painel inferior – UTE 2, campanha 2. Fonte: Mattos e Climaco Ltda, 2014 Plano de Manejo UC Serra das Areias 58 Artrópodes de solo Nas duas fisionomias amostradas nas UTE foram encontrados ao todo 4893 indivíduos distribuídos em 57 taxa de artrópodes de solo. Cerrado e mata tiveram cada um 11 taxa exclusivos, e 19 compartilhados entre si (Figura 30). Mesmo se considerando a baixa resolução taxonômica, a similaridade na composição das faunas dos dois ambientes (UTE e UTP) foi alta. Figura 30: Riqueza de taxa de artrópodes de solo encontrada em cada uma das fisionomias amostradas, e números de taxa compartilhados entre as fisionomias. Fonte: Mattos e Climaco Ltda, 2014 As formigas foram o grupo mais representativo, representando 76% dos indivíduos amostrados na área de mata e 96% dos indivíduos na área de Cerrado. Dentre os taxa exclusivos da área de mata, Geotrigona sp.01 merece destaque por também ter sido amostrado nas coletas ativas, evidenciando que esta espécie de abelha utiliza tanto as áreas florestais como as áreas de cerrado adjacentes. O taxa exclusivo da área de Cerrado com maior abundância foi o Gênero de cupim Cornitermes, um importante agente na ciclagem de nutrientes e uma espécie-chave para a ecologia das comunidades de Cerrado (Redford, 1984). Plano de Manejo UC Serra das Areias 59 Mosquitos hematófagos Apenas um indivíduo foi coletado durante a amostragem no interior da UTE, sendo uma fêmea da morfoespécie Culex (Anoedioporpa) sp. Os estágios imaturos deste subgênero de Culex se criam em habitats fitotelmatas, principalmente em buracos em árvores, mas também são ocasionalmente encontrados em recipientes artificiais. Os adultos são encontrados em florestas e raramente em áreas peri-urbanas. As fêmeas não costumam atacar humanos, e por isso, não são de importância epidemiológica (Berlin e Belkin, 1980). 3.2.2 Unidades Topográficas Planas e antropizadas Himenópteros polinizadores Nas unidades topográficas planas (UTP), foram observadas ao todo 310 interações entre himenópteros e flores, compreendendo 100 espécies de himenópteros em 25 plantas (Figura 31). Das 100 espécies 66% foram exclusivas das unidades de uso sustentável. A vegetação ao longo das trilhas amostradas nas UTP consistia principalmente de pastagens abandonadas e Campo Sujo, com pequenos trechos de Cerrado stricto-sensu. As plantas mais visitadas nestas áreas também pertenciam às famílias Lamiaceae e Asteraceae, com várias espécies que também ocorreram nas UTE’s, principalmente na amostragem da estação seca. Nas armadilhas de essência foram coletadas também três espécies – Eulaema nigrita, Eulaema cingulata e Euglossa imperialis. Dentre as espécies exclusivas das UTP, as abelhas solitárias de médio porte como as dos gêneros Megachile e Centris se destacam por apresentarem maior diversidade e abundância nessas áreas. Esses foram os dois gêneros mais ricos encontrados neste trabalho, com 14 e 8 morfoespécies, respectivamente, e apresentaram várias morfoespécies com poucos indivíduos coletados. Outro grupo de abelhas que merece destaque são as abelhas coletoras de óleo. Compreendendo principalmente espécies das tribos Centridini, Tetrapediini e Tapinotaspidini, essas abelhas possuem uma estreita relação com plantas produtoras de óleo (Buchmann, 1987), principalmente da família Malpighiaceae, sendo Plano de Manejo UC Serra das Areias 60 importantes polinizadoras destas plantas e, por sua vez, dependendo da presença destas espécies para sua conservação. Apesar de ocorrerem em áreas já impactadas pela presença humana, os himenópteros encontrados nas UTP dependem da manutenção da diversidade de plantas como fonte de recursos tanto para os adultos como para as larvas. Além disso, a presença de sítios de nidificação também é imprescindível para a dinâmica dessas populações. Portanto, a manutenção da diversidade de plantas observada e da heterogeneidade de fisionomias presentes é importante para a conservação da biodiversidade de abelhas e vespas. Assim como o comentado para as UTE, a presença de espécies invasoras, tanto de insetos como de plantas, pode gerar graves impactos nas comunidades nativas ao alterar a estrutura das redes de interação. Plano de Manejo UC Serra das Areias 61 Figura 31: Redes de interação entre Himenópteros polinizadores e plantas nas Unidades Topográficas Planas (UTP). As fileiras superiores de retângulos representam as espécies de himenópteros, e as fileiras inferiores as espécies de plantas As espécies que interagiram são conectadas por retângulos cinza, com larguras proporcionais ao número de interações observadas. São mostrados os nomes das três espécies com mais interações para cada grupo. Painel superior – UTP-1, campanha 1, Painel do meio – UTP 1, campanha 2, Painel inferior – UTP 2, campanha 2. Fonte: Mattos e Climaco Ltda, 2014 Nas UTP também foram encontradas espécies de meliponíneos e uma grande diversidade de vespas sociais e solitárias. Como já discutido para as UTE, ambos os grupos apresentam potenciais benefícios, principalmente nestas áreas mais próximas das atividades humanas. Além disso, todas as espécies contempladas neste estudo contribuem em maior ou menor grau ao serviço de polinização das espécies nativas e potencialmente de espécies cultivadas também. Artrópodes de solo Na UTP foram coletados 2611 indivíduos de 43 taxa (Figura 30). Entre os 13 taxa, exclusivamente encontrados na UTP, se encontram várias famílias de aranhas e alguns Hemípteros, principalmente associados à vegetação formada predominantemente por gramíneas. Novamente as formigas foram o grupo mais representativo, com um total de 76% dos indivíduos amostrados. Plano de Manejo UC Serra das Areias 62 Mosquitos hematófagos Apenas cinco indivíduos de mosquitos hematófagos foram coletados nas UTP, sendo dois machos e uma fêmea da morfoespécie Culex (Anoedioporpa) sp., já discutida anteriormente, uma fêmea da morfoespécie Mansonia sp. e uma fêmea da morfoespécie Uranotaenia sp. Mosquitos do Gênero Uranotaenia utilizam diversos tipos de criadouros e, apesar de algumas espécies atacarem humanos, nenhuma está envolvida na transmissão de patógenos (Galindo et al., 1954). As larvas do Gênero Mansonia se desenvolvem em corpos d’água com presença de vegetação. Apesar de serem agressivos e atacarem prontamente humanos não são vetores de doenças endêmicas no Brasil (Consoli e Oliveira, 1994), sendo também de baixo interesse epidemiológico. 3.2.3 Entorno da Unidade de Conservação A Unidade de Conservação Serra das Areias é inserida em uma matriz composta principalmente por áreas urbanas ao norte e áreas rurais ao sul. Apesar de intensamente fragmentadas, as áreas rurais apresentam vários remanescentes de vegetação nativa, formados principalmente por áreas de vegetação de galeria e áreas de Cerrado nas regiões de relevo mais acidentado. A preservação dessas áreas facilitaria o fluxo biológico entre a UC Serra das Areias e outros locais com maior área de vegetação nativa, como o Morro Feio, situado a sudeste da Unidade de Conservação. Como já discutido anteriormente, mesmo as áreas de pastagem com pouco uso são capazes de sustentar uma razoável diversidade de plantas herbáceas que fornecem recurso para entomofauna em geral e para os himenópteros visitantes florais em particular. 3.2.4 Heterogeneidade Himenópteros polinizadores As redes de interação entre Himenópteros polinizadores e plantas apresentaram baixos valores de conectância e aninhamento, com valores moderados a altos de especialização, tanto nas UTE quanto nas UTP (Tabela 11, Figuras 29 e 31). Isso indica que as redes de ambas as Plano de Manejo UC Serra das Areias 63 áreas são compostas por uma grande propoção de espécies raras que interagem com poucos parceiros. A presença abundante de Apis mellifera em todos os pontos indica que as redes de ambas as áreas sofrem influência desta espécie invasora, principalmente nas áreas mais próximas do perímetro urbano de Aparecida de Goiânia (UTE-1 e UTP-2). Apesar disso, os valores de riqueza não foram baixos, ressaltando o valor de conservação tanto das UTE quanto das UTP. Tabela 11: Medidas estruturais das redes de interação Himenópteros-Plantas em cada um dos locais amostrados, por campanha. UTE-1 UTE-2 UTP-1 UTP-2 Campanha 1 2 1 2 1 2 1 2 Conectância 9.70% 12% - 14% 11% 18% - 12% Aninhamento (wNODF) 8.66 7.16 - 16.7 20.28 8.04 - 3.55 Especialização (H2) 0.72 0.76 - 0.48 0.53 0.62 - 0.95 Proporção Apis 48% 0% - 5.7% 8.3% 3.4% - 45% Artrópodes de solo Apesar das diferenças na composição de espécies entre as UTE e as UTP, várias medidas ecológicas apontam para uma situação similar nas duas áreas (tabela 12), mostrando que mesmo as comunidades de áreas abertas também suportam uma grande diversidade de artrópodes. Tabela 12: Medidas de abundância, diversidade alfa, beta e gama de artrópodes de solo amostrados nas UTE e UTP. Medidas Ecológicas UTE UTP Abundância média por parcela (indivíduos) 92.32 90.03 Proporção de espécies exclusivas 40% 37% Riqueza média por armadilha (α) 6 7.4 0.753 0.755 38 43 Dissimilaridade média entre parcelas (β) Riqueza média por fisionomia (γ) Plano de Manejo UC Serra das Areias 64 Mosquitos hematófagos Em ambas as unidades a taxa de captura de mosquitos hematófagos foi baixa, e apenas espécies sem grande interesse médico foram encontradas. Portanto, o potencial epidemiológico da fauna silvestre da região é baixo e não gera maiores preocupações. Ilustração de espécies amostradas As figuras 32 à 37 ilustram alguns exemplares identificados na Unidade de Conservação. Figura 32: Thalestria spinosa, espécie de abelha cleptoparasita de abelhas do gênero Oxaea. Aumento de aprox.. 10 vezes. Figura 33: Apis melífera, espécie exótica amplamente distribuída no Brasil. Fonte: Mattos e Clímaco Ltda, 2014 Fonte: Mattos e Clímaco Ltda, 2014 Figura 34: Sphecini sp.01 Fonte: Mattos e Clímaco Ltda, 2014 Figura 35: Augochloropsis sp.01. Aumento de 10 vezes Fonte: Mattos e Clímaco Ltda, 2014 Plano de Manejo UC Serra das Areias 65 Figura 36: Mesocheira bicolor. Aumento de 10 vezes Figura 37: Coelioxys assumptionis. Aumento de 10 vezes Fonte: Mattos e Clímaco Ltda, 2014 Fonte: Mattos e Clímaco Ltda, 2014 3.3 Herpetofauna Considerando todos os pontos amostrados, foram registradas 37 espécies, sendo 28 espécies de anfíbios e nove espécies de répteis (Tabela 13, Figura 38). Do total, 32,4% das espécies foram registradas nas duas unidades (topográficas elevadas – UTE e topográficas planas - UTP). Quanto aos tipos de registros, 81% das espécies foram registradas através do método de busca ativa noturna, 5,4% foram encontradas exclusivamente pelo método de transecção linear no período diurno e 13,51% através de entrevistas com moradores da região. Tabela 13: Lista das espécies representantes da Herpetofauna registradas nas unidades topográficas elevadas (UTE) e planas (UTP) da Unidade de Conservação Serra das Areias. LC= pouco preocupante; DD= deficiente de dados; NL= não listada. * Endemismo segundo Valdujo et al. 2012 e Nogueira et al. 2011. ORDEM/Família/Espécie Pontos de registro Unidade Registro IUCN End.* ANURA Bufonidae Rhinella rubescens Rhinella schneideri Plano de Manejo UC Serra das Areias P12 P8, P10, P15, P24 UTP Ambos Visual e acústico Visual e acústico LC LC Sim Não 66 Cont. ORDEM/Família/Espécie Pontos de registro Unidade Registro IUCN End.* Craugastoridae Barycholos ternetzi P17 UTE Visual LC Sim Dendrobatidae Ameerega flavopicta P17 UTE Visual LC Sim P6, P12, P23 P2, P3, P4, P9, P12, P15, P19, P22, P23, P24 P2 P2, P3 P2, P6, P14 P8, P13, P14, P15, P21, P25 P23, P24 Ambos Visual e acústico LC Sim Ambos Visual e acústico LC Não UTP UTP UTE Ambos Visual e acústico Visual e acústico Visual e acústico Visual e acústico LC LC LC LC Não Sim Não Sim Ambos Visual LC Não P3, P4 P2, P20 P19, P24 P8 UTP Ambos UTE UTE Visual e acústico Visual Visual Acústico LC LC LC DD Não Não Não Sim P5, P6 P2, P4, P6, P12, P13 P4, P12 P21, P24 P2, P3, P4 UTE Ambos Visual e acústico Visual LC LC Não Não UTP UTE UTP Visual Visual e acústico Visual e acústico LC LC LC Não Não Não P2, P3, P4 P12 P14, P19 P2, P5, P6, P9 P3, P19 UTP UTP UTE Ambos Visual e acústico Visual Visual Visual e acústico LC LC LC NL Não Não Sim NL Ambos Visual NL NL Hylidae Dendropsophus cruzi Dendropsophus minutus Dendropsophus nanus Dendropsophus rubicundulus Hypsiboas albopunctatus Hypsiboas lundii Hypsiboas raniceps Scinax fuscomarginatus Scinax fuscovarius Scinax similis Phyllomedusa azurea Leptodactylidae Leptodactylus fuscus Leptodactylus labyrinthicus Leptodactylus latrans Leptodactylus podicipinus Physalaemus cuvieri Pseudis bolbodactyla Pseudopaludicola mystacalis Pseudopaludicola saltica Pseudopaludicola sp.1 Pseudopaludicola sp.2 Plano de Manejo UC Serra das Areias 67 Cont. ORDEM/Família/Espécie Pontos de registro Unidade Registro IUCN End.* P2, P3 UTP Visual NL Não P12, P13, P21 P10, P14, Ambos Acústico LC Sim Ambos Acústico LC Sim P16 Não consta UTE Não consta Visual Entrevista NL NL NL NL P1, P10, P16 Ambos Visual NL NL Boa constrictor Não consta Não consta Entrevista NL Não Colubridae Spilotes pullatus Não consta Não consta Entrevista NL Não P17 UTE Visual NL Não Não consta Não consta Não consta Não consta Entrevista Entrevista NL LC NL Não P22 UTE Visual NL NL Microhylidae Elachistocleis cesarii Odontophrynidae Odontophrynus cultripes Proceratophrys goyana P17, P20, P25 SQUAMATA Teidae Kentropyx sp. Salvator cf merianae Tropiduridae Tropidurus sp. SERPENTES Boidae Dipsadidae Oxyrhopus trigeminus Viperidae Bothrops sp. Crotalus durissus TESTUDINES Chelidae Plano de Manejo UC Serra das Areias 68 Figura 38: Algumas das espécies registradas na UC Serra das Areias. A. Rhinella rubescens; B. Barycholos ternetzi; C. Ameerega flavopicta; D. Dendropsophus minutus; E. D. cruzi; F. Hypsiboas lundii; G. Pseudis bolbodactyla; H. Leptodactylus podicipinus; I. Scinax fuscomarginatus; J. Elachistocleis cesarii; K. Tropidurus sp.; L. Oxyrhopus trigeminus. Fonte: Mattos e Clímaco Ltda, 2014 Plano de Manejo UC Serra das Areias 69 Na curva de acumulação de espécies rarefeita e na curva de espécies estimadas de anfíbios, percebe-se que há uma tendência à estabilização (Figura 39). Por outro lado, analisando a curva de acumulação de espécies rarefeita e a de espécies estimadas de répteis, percebe-se que não há tendência à estabilização, o que sugere que muitas espécies ainda podem ser encontradas com a continuidade dos trabalhos de amostragem na área (Figura 40). 50 Riqueza observada (Rarefação) Riqueza estimada (Jackknife1) 40 Número de espécies 30 20 10 0 -10 -20 1 3 5 7 9 11 13 15 17 Número de amostras 19 21 23 25 27 Figura 39: Riqueza observada (rarefação) e estimada (estimador Jackknife) de anfíbios na UC Serra das Areias. As barras representam o intervalo de confiança para a riqueza estimada. Fonte: Mattos e Clímaco Ltda, 2014 Plano de Manejo UC Serra das Areias 70 26 Riqueza observada (Rarefação) Riqueza estimada (Jackknife1) 24 22 20 18 Número de espécies 16 14 12 10 8 6 4 2 0 -2 -4 -6 1 3 5 7 9 11 13 15 17 Número de amostras 19 21 23 25 27 Figura 40: Riqueza observada (rarefação) e estimada (estimador Jackknife) de répteis na UC Serra das Areias. As barras representam o intervalo de confiança para a riqueza estimada. Fonte: Mattos e Clímaco Ltda, 2014 3.3.1 Unidades de Topográficas elevadas Considerando apenas as unidades topográficas elevadas (UTE) foram registradas 23 espécies, sendo 19 espécies de anfíbios e quatro espécies de répteis (Tabela 13). Conhecidamente, a ocorrência da maioria das espécies de anfíbios no Cerrado está associada à presença de corpos d’água lênticos e áreas brejosas em áreas abertas. Esses tipos de ambientes são relativamente escassos no interior da área topográfica elevada, a qual é bem representada por riachos inseridos em Mata de Galeria e áreas altas com predomínio de Cerrado Rupestre, Cerrado Sensu Stricto e Campo Cerrado. Dentre os corpos d’água lênticos amostrados, a maioria é de hidroperíodo temporário e depende do volume de chuvas na região. Há um predomínio de riachos temporários que secam totalmente na época de estiagem. Em contrapartida, esses riachos temporários e permanentes no interior de Mata de Galeria e as áreas altas com afloramentos rochosos abrigam espécies de anuros que apresentam Plano de Manejo UC Serra das Areias 71 especificidade de habitat e de sítios reprodutivos (e.g. Ameerega flavopicta, Hypsiboas lundii, Proceratophrys goyana), além de fornecerem uma grande quantidade de abrigos específicos aos répteis, como buracos em barrancos, sob as pedras e no folhiço (Duellman e Trueb 1994, Haddad e Prado 2005, Martins e Molina 2008). Entretanto, o baixo número de répteis registrados no estudo pode estar subestimado em relação ao potencial da área topográfica elevada e que, provavelmente, é resultante da pouca eficiência do método utilizado. Fragilidades naturais do grupo Do total de espécies registradas na área topográfica elevada, nenhuma está na Lista Oficial das Espécies da Fauna Brasileira Ameaçadas de Extinção (Instrução Normativa MMA nº 03, de 27 de maio de 2003). Igualmente, não há espécies ameaçadas segundo a classificação da IUCN (2014). Foram registradas 10 espécies de anfíbios consideradas endêmicas do Cerrado de acordo com Valdujo et al. (2012). Não houve registros de répteis endêmicos ao bioma segundo Nogueira et al. 2011 (Tabela 13). Todas as espécies registradas são comuns no estado de Goiás, sendo que apenas a espécie Proceratophrys goyana apresenta certo grau de raridade e não ocorre em toda a extensão do estado (Frost 2014). Não foi possível confirmar a identidade de algumas espécies potencialmente interessantes (e.g. Kentropyx sp. e um representante da família Chelidae), pois, não houve a captura dos indivíduos. Anfíbios são organismos com características ecofisiológicas específicas (e.g. respiração cutânea, pele permeável, ovos não-amnióticos) que os tornam bastante sensíveis às alterações ambientais. Sua distribuição é restrita a habitats úmidos e seu potencial de dispersão é limitado (Duellman e Trueb 1994; Wells 2007). Igualmente, os répteis também são sensíveis às variações microclimáticas dos ambientes. Espécies florestais de menor porte são as mais vulneráveis por serem incapazes de suportar as altas temperaturas de formações abertas (Rodrigues, 2005). A maioria das espécies de répteis é especialista de habitat e tem sua ocorrência restrita a determinados ambientes. De modo geral, os representantes da herpetofauna, especialmente os anfíbios, são bons modelos bioindicadores de integridade ambiental (Blaustein e Wake, 1995), pois são sensíveis ao estresse e podem ser negativamente influenciados pela redução e fragmentação de habitats (Silvano e Segalla, 2004, Marques et al., 2010). Igualmente, fatores como o ruído sonoro, a Plano de Manejo UC Serra das Areias 72 poluição, animais domésticos e a contaminação podem contribuir com a redução da abundância e do número de espécies. Dessa forma, identificamos alguns pontos de maior fragilidade dentro dos limites da área de proteção integral considerando a ocorrência de espécies com maior especificidade de habitat e seus respectivos pontos de ocorrência que apresentam maior pressão antrópica (Pontos P1, P5, P9, P11, P14, P15, P16, P17 e P18). Vulnerabilidade às atividades antrópicas A destruição e alteração dos habitats naturais são as maiores ameaças aos dois grupos, aumentando a vulnerabilidade das espécies. Essas alterações oriundas de atividades antrópicas foram registradas ao longo de toda a região. Para tanto, identificamos uma série de fatores contribuintes ao estresse ambiental e destacamos pontos e regiões na área de proteção integral com maior influência destas variáveis antrópicas. (1) A deposição de lixo às margens dos corpos d’água e a consequente contaminação pode afetar primariamente os organismos mais vulneráveis, como as larvas de anfíbios (pontos P25 e P26). (2) O ruído sonoro e a abertura de trilhas por ciclistas e motociclistas (pontos P15, P16, P17, P18 e P19) tem modificado drasticamente o ambiente natural, aumentando a possibilidade de atropelamentos, especialmente de serpentes e lagartos. (3) Igualmente, a abundância de animais domésticos pode reduzir as populações de anfíbios e répteis na região. (4) Em outros pontos, principalmente nas bordas da área de proteção integral, a pressão é resultante do avanço de áreas de pastagem e do pisoteio do gado que altera a composição física dos ambientes reduzindo a quantidade de refúgios e de sítios reprodutivos (Pontos P11, P14 e P24). Potencialidades do grupo Os anfíbios anuros fazem parte da dieta de uma série de vertebrados e invertebrados e tem um importante papel ecológico como predadores, controlando as populações de insetos que podem ser vetores ou não de doenças (Duellman e Trueb, 1994). A facilidade em capturar e manusear anuros também favorece estudos científicos, principalmente experimentais, permitindo testar hipóteses de como as espécies interagem na natureza. Além do grande potencial farmacêutico oriundo de compostos químicos liberados em sua pele, como nas espécies Rhinella schneideri (Pontos P8, P10, P15, P24) e Ameerega flavopicta (Ponto P17). Plano de Manejo UC Serra das Areias 73 Considerando as relações predador-presa, os répteis tem grande importância ecológica e estão entre os principais responsáveis pela manutenção da homeostase ambiental, além de contribuir com a dispersão de sementes e no consumo de matéria vegetal, como no caso de algumas espécies de lagartos e quelônios herbívoros (Martins e Molina 2008). A extração de toxinas dos répteis, especialmente de serpentes peçonhentas, também aumenta o potencial econômico e o interesse das indústrias farmacêuticas para a produção de remédios (Martins e Molina 2008), o que pode colaborar com argumentos favoráveis para a conservação da área e do grupo. Corredores ecológicos Entre as duas áreas topográficas elevadas há um maior impacto antrópico decorrente do aumento das áreas de pastagem em propriedades particulares e das estradas que podem, através de dessecação, atropelamentos, entre outros fatores, dificultar o deslocamento de anfíbios e répteis. Ambas as áreas são parcialmente interligadas por um único e estreito corredor oriundo da Mata Ripária que acompanha um riacho (ponto P10). No entanto, nesta área que, teoricamente, ocorreriam a maior parte dos deslocamentos, há um clube de lazer que recebe visitantes com bastante frequência. Neste mesmo ponto, foi observado o excesso e a falta de cuidado com o lixo, barulho e movimentação de pessoas, além do barramento e desvio do riacho para formação de um balneário. Além de utilizarem estes corredores riacho-dependentes para deslocamento, os anfíbios e répteis são considerados “moradores de corredores” (corridor dwellers) e se reproduzem nestas áreas (Beier e Lowe, 1992). Dessa forma, as características físicas dos corredores, principalmente a pequena largura e a existência de atividades humanas podem limitar sua utilidade (Harrison 1992), prejudicando a entrada ou saída de espécimes das áreas de proteção integral. 3.3.2 Unidades Topográficas Planas Nas unidades topográficas planas foi registrado um total de 21 espécies, sendo 20 espécies de anfíbios e uma espécie de réptil (Tabela 13). Apesar do baixo nível de integridade em escala local e da supressão da vegetação nativa, registramos um número de espécies Plano de Manejo UC Serra das Areias 74 aproximado à riqueza registrada nas unidades topográficas elegadas. Entretanto, a maioria das espécies é comum, amplamente distribuídas no Cerrado e são facilmente encontradas em áreas abertas e com influência de pastagem (Valdujo et al. 2012, Rodrigues 2005). A maioria dos poços lênticos amostrados nestas unidades de uso sustentável são de origem antrópica e localizados em áreas abertas, favorecendo o aparecimento de espécies que conseguem colonizar estes ambientes. Em longo prazo, espécies que colonizam facilmente as áreas abertas, como a cascavel (Crotallus durissus) podem se tornar mais comuns à medida que surgem novas áreas decorrentes da derrubada da vegetação nativa (Marques et al. 2004). Provavelmente, este é um fator contribuinte para a abundância de serpentes relatada pelos moradores da região, especialmente as serpentes peçonhentas. Além disso, espécies que melhor se adequam às condições não naturais e que são predadores vorazes de anfíbios e répteis podem aumentar sua abundância significativamente e excluir outras espécies. Em suma, as unidades de uso sustentável apresentam um número considerável de propriedades particulares, nas quais acontecem diferentes tipos de uso do solo, restando ainda poucos remanescentes de Cerrado que estão sendo suprimidos pelas pastagens e outros tipos de uso. Fragilidades naturais do grupo Nenhuma das espécies registradas nas Unidades Topográficas Planas está na Lista Oficial das Espécies da Fauna Brasileira Ameaçadas de Extinção (Instrução Normativa MMA nº 03, de 27 de maio de 2003) e não há espécies ameaçadas segundo a classificação da IUCN (2014). Seis espécies de anfíbios são endêmicos do Cerrado de acordo com Valdujo et al. (2012) e não há registros de répteis endêmicos (Tabela 13). A espécie Proceratophrys goyana foi encontrada em apenas um riacho adjacente à área de proteção integral (Ponto P10) e é a única espécie que apresenta certo grau de raridade. Dentre as áreas de maior fragilidade identificamos os pontos P7 e P10 por estarem sofrendo forte pressão antrópica e o ponto P3 por se tratar de uma Vereda. Vulnerabilidade às atividades antrópicas (1) A enorme deposição lixo e entulho no decorrer das estradas de acesso às propriedades. (2) Extração de cascalho (P2 e P3). (3) A abundância de animais domésticos. Plano de Manejo UC Serra das Areias 75 (4) A pressão agropastoril na maior parte das unidades de uso sustentável, isolando parcialmente as áreas de proteção integral. (5) As recorrentes queimadas não naturais relatadas pelos moradores. Potencialidades do grupo O potencial dos anfíbios e répteis registrados é o mesmo das espécies encontradas nas áreas topográficas elevadas, com maior ênfase aos serviços ecossistêmicos oriundos do controle biológico. Corredores ecológicos A localidade P10 é considerada um ponto de fragilidade na área de uso sustentável e que necessita de esforços direcionados, visto que é o único corredor que liga as duas unidades topográficas elevadas. Considerando as observações em campo e as imagens de satélite, os corredores na borda externa dos limites da área topográfica plana mantêm o formato padrão dos demais observados no interior dessa unidade e apenas seguem os cursos d’água, aparentemente respeitando a largura mínima exigida pelo Código Florestal Brasileiro na maior parte dos cursos d’água. No entanto, a pressão agropastoril que reduz a quantidade e qualidade da vegetação ripária, a proximidade com o centro urbano e a existência de rodovias compromete a eficiência destes corredores. 3.3.3 Heterogeneidade A destruição e fragmentação de hábitats são os principais responsáveis pela perda de espécies de anfíbios e répteis no Brasil e no mundo (Gibbons et al. 2000, Silvano e Segalla 2004, Becker et al. 2007). Habitats contínuos e preservados permitem o deslocamento e podem reduzir o risco de predação, o dessecamento (no caso dos anfíbios), atropelamento e outros fatores que afetam negativamente a herpetofauna. As unidades topográficas elevadas apresentam, em sua maior parte, áreas altas com predominância de Cerrado Rupestre e riachos Plano de Manejo UC Serra das Areias 76 no interior de Mata de Galeria. Estes tipos de ambientes, principalmente áreas altas, são raros nas unidades topográficas planas, ressaltando a importância das unidades topográficas elevadas para a manutenção destas formações fitofisionômicas. Devido ao seu relevo acidentado, estas áreas elevadas dificultam ou inviabilizam o plantio e a criação de animais, o que favorece a manutenção de fragmentos com vegetação contínua. Nestes ambientes há registros de espécies com maior especificidade de habitat (e.g. Ameerega flavopicta, Barycholos ternetzi, Hypsiboas lundii, Proceratophrys goyana) e que não suportam áreas abertas ou corpos d’água lênticos. A retirada de vegetação nativa nestes pontos pode ser irreparável. Para tanto, a manutenção da integridade das áreas topográficas elevadas evita a degradação destes ambientes singulares e que abrigam espécies sensíveis e especialistas. Em contrapartida, corpos d’água lênticos, veredas e brejos em áreas abertas são mais comuns nas unidades topográficas planas e favorecem a ocorrência de muitas espécies que não utilizam riachos e campos de altitude. É possível observar através de imagens de satélite recentes que as regiões que não estão associadas aos corpos d’água foram suprimidas por pastagem ou algum tipo de uso do solo de origem antrópica. A manutenção de fragmentos de vegetação nativa próximo aos corpos d’água é extremamente importante, pois, muitas espécies, principalmente de anfíbios, utilizam ambientes aquáticos durante o período reprodutivo e áreas florestais para abrigo e/ou alimentação após este período (Becker et al. 2007). Neste caso, a fragmentação e a supressão dos corredores que ligam áreas aquáticas com áreas florestais podem comprometer os deslocamentos de espécies que possuem diferentes fases de vida em cada tipo de ambiente, afetando negativamente a riqueza de espécies e levando a um efeito conhecido como “habitat split” (Becker et al. 2007). Além disso, a fragmentação e redução de habitats nas unidades topográficas planas podem reduzir o “escoamento” de espécies para as áreas adjacentes à reserva e entorno, comprometendo processos migratórios e o fluxo gênico. 3.4 Ictiofauna 3.4.1 Unidades Topográficas baixas Foram encontradas 13 espécies de peixes, distribuídas em sete famílias e quatro ordens (Tabela 14; Figura 41), sendo que apenas a Tilápia (Tilapia rendalli) foi analisada pela IUCN Plano de Manejo UC Serra das Areias 77 e classificada como pouco preocupante. Nenhuma outra espécie foi analisada e classificada quanto ao estado de conservação pela IUCN e lista de espécies vermelhas do Ministério do Meio Ambiente. A maioria das espécies encontradas são onívoras (38%) e, portanto, generalistas. Espécies generalistas são consideradas resistentes à impactos ambientais, por possuírem maior plasticidade alimentar. Porém, também foram encontradas espécies insetívoras (23%), piscívoras (16%), herbívoras (16%) e algívoras (7%). Espécies insetívoras e herbívoras são intimamente relacionadas com a mata ciliar e dependem diretamente delas para sobreviver. Portanto, a preservação da mata ciliar dos cursos d’água amostrado são essenciais para a continuidade da assembleia de peixes amostrada. Tabela 14: Lista de espécies de peixes amostradas na serra das areias nas duas campanhas (seca e chuva), sua respectiva classificação taxonômica (ordem e família), guilda trófica a qual pertencem e estado de conservação segundo IUCN e Ministério do Meio Ambiente. NE: Não avaliado; LC: Pouco preocupante. Ordem Characiforme Família Characidae Espécie Astyanax altiparanae Guilda trófica Onívoro IUCN NE MMA NE Characiforme Characidae Astyanax fasciatus Onívoro NE NE Characiforme Characidae Knodus moenkhausii Herbívoro NE NE Characiforme Characidae Piabina argentea Onívoro NE NE Characiforme Crenuchidae Characidium zebra Insetívoro NE NE Characiforme Erythrinidae Hoplias malabaricus Piscívoro NE NE Characiforme Erythrinidae Hoplias sp. Piscívoro NE NE Characiforme Parodontidae Apareiodon sp. Herbívoro NE NE Characiforme Parodontidae Parodon nasus Algívoro NE NE Poeciliidae Poecilia reticulata Insetívoro NE NE Perciforme Cichlidae Cichlasoma paranaense Insetívoro NE NE Perciforme Cichlidae Tilapia rendalli Onívoro LC NE Siluriforme Heptapteridae Rhamdia quelen Onívoro NE NE Cyprinodontiformes Plano de Manejo UC Serra das Areias 78 Figura 41: Espécies de peixes encontradas nos pontos 1, 2 e ponto lagoa na Serra das Areias, Aparecida de Goiânia-GO. a) Astyanax altiparanae; b) Astyanax fasciatus; c) Knodus moenkhausii; d) Piabina argentea; e) Characidium zebra; f) Hoplias malabaricus; g) Hoplias sp.; h) Apareiodon sp.; i) Parodon nasus; j) Poecilia reticulata; k) Cichlasoma paranaense; l) Tilapia rendalli; m) Rhamdia quelen Fonte: Mattos e Clímaco Ltda, 2014 Os pontos amostrais encontravam-se relativamente bem preservados, com mata ciliar respeitando o previsto em lei. A mata ciliar é de grande importância para riachos, pois, além de proteger o leito do rio de assoreamento, é fonte de alimento e funciona como corredor ecológico para espécies migradoras, que utilizam esse sistema (riachos) para a desova. Porém, nos três pontos amostrados a interferência humana era evidente. Plano de Manejo UC Serra das Areias 79 No ponto 1, há residências inseridas dentro do perímetro de mata ciliar, indicando intenso uso do curso d’água para abastecimento doméstico e despejo de resíduos. Além disso, foram construídas barragens ao longo do ribeirão Santo Antônio, criando barreiras intransponíveis para os peixes, podendo reduzir o tamanho efetivo populacional, já que se criam subpopulações parcialmente isoladas, impedindo o fluxo gênico, podendo afetar a sua permanência. Já no ponto 2, a influência humana no ponto de coleta é menor, pois está inserida em uma propriedade que restringe o acesso, apesar de termos visto a população local utilizar o local para recreação. Porém, um pouco a jusante do ponto amostral, existe um clube que é amplamente utilizado para recreação e criação de espécies de peixes. No ponto lagoa, o impacto antrópico é de maior proporção. O riacho foi represado e foi destinado à criação de peixes como o Cará (Cichlasoma paranaense) e a Tilápia (T. rendalli), que são peixes com grande valor comercial. Essa última é considerada como espécie exótica de grande impacto ambiental (Froese & Pauly, 2014), devido à sua alta competitividade por recursos, agressividade e sucesso reprodutivo. Vulnerabilidade Foram encontrados três pontos de vulnerabilidade nos dois principais cursos d’água da Serra das Areias (Figura 42). No ponto lagoa, foram encontradas espécies exóticas. Espécies exóticas são consideradas um problema, pois alteram todo o equilíbrio ecológico do sistema, pois ocupam o nicho de outras espécies, criando competição interespecífica, podem ser predadores muito eficientes (como é o caso da tilápia), causando perda de biodiversidade e de funções ecológicas. O ponto 2 encontra-se bastante preservado, com mata ciliar abundante, além de o proprietário controlar a entrada de pessoas no local. Porém, foi classificado como ponto de vulnerabilidade, pois mesmo com o controle de entrada, foram vistos alguns turistas recreando no local. Além disso, aproximadamente a 500 metros a jusante do ponto, existe um centro de recreação. A recreação, desde que com responsabilidade e consciência ambiental, causa poucos danos à biodiversidade. Porém, é preciso estabelecer limites de visitação, possuir um projeto de infraestrutura para evitar que turistas poluam o local com lixo e Plano de Manejo UC Serra das Areias 80 substâncias químicas. Além disso, a simples presença humana é causador de estresse nos animais (Rubio et. al, 2010), que podem causar a morte dos mesmos. Já no ponto 1, a mata ciliar do curso d’água encontrava-se relativamente bem preservada. Porém, nas proximidades do ponto, existe atividade intensa de agricultura. Esse tipo de atividade pode deteriorar a biodiversidade aquática devido ao uso de defensivos agrícolas, que acidentalmente vão parar no corpo d’água. Portanto, a preservação da mata ciliar próximo a essas atividades é de extrema importância, pois exerce função de barreira física para agrotóxicos, evitando que alcancem os rios e riachos. Plano de Manejo UC Serra das Areias 81 Figura 42: Mapa de vulnerabilidade de espécies de peixes da Unidade de Conservação Serra das Areias, Aparecida de Goiânia, GO Fonte: Google Earth, 2014 82 Plano de Manejo UC Serra das Areias Potencialidades do Grupo Os peixes, normalmente, são de grande interesse para o ser humano. Principalmente para alimentação e aquarismo. Espécies com potencial comercial foram encontradas em todos os pontos (Figura 7). No ponto lagoa, encontramos a Tilápia (T. rendalli), o cará (C. paranaense) e a Traíra (H. malabaricus), que são bastante apreciados para alimentação. No ponto 2, foram encontradas lambaris (P. argentea, A. fasciatus e K. moenkhausii) que são usados tanto para alimento quanto para isca de pesca. No ponto 1, além do lambari (A. altiparanae) e da traíra (Hoplias sp.), existe o Guppy (P. reticulata) que bastante apreciado para aquarismo, devido à sua ornamentação. Além de importância econômica, os peixes apresentam função ecológica fundamental no fluxo de matéria e energia. Percebe-se que existem diferentes guildas tróficas no local (onívoros, piscívoros, insetívoros, e herbívoros), onde cada guilda contribui com os processos ecológicos existentes, permitindo a continuidade da vida ao longo do tempo nos corpos d’água. 3.4.2 Área do entorno da Serra das Areias Os corpos d’água analisados nascem na região da Serra das Areias, mas continuam seu curso até desaguarem no rio Meia Ponte. Até atingirem esse rio, passam por ambiente urbano na região norte/nordeste da Unidade de Conservação e por ambiente rural nas demais áreas. Frequentemente, áreas urbanas e rurais deterioram o curso d’água através depósito de lixo, despejo de esgoto, produtos químicos, pisoteamento por animais e retirada da mata ciliar. Portanto, a preservação do corpo d’água em toda a sua extensão, na íntegra (mata ciliar + corpo d’água) torna-se importante, pois muitos peixes transitam entre ambientes de nascentes (cursos d’água do interior da Serra das Areias) e leitos de rios, seja para reprodução ou forrageamento. Plano de Manejo UC Serra das Areias 83 Figura 43: Mapa de potencialidades de espécies de peixes na UC Serra das Areias, Aparecida de Goiânia, GO Fonte: Google Earth, 2014 84 Plano de Manejo UC Serra das Areias 3.4.3 Heterogeneidades Os pontos amostrados possuem estruturas de assembleias de peixes bem diferenciados, com algumas espécies sendo encontradas apenas em um local e em outro não. Na verdade, a única espécie que ocorreu em dois pontos (P1 e P2), foi a P. reticulata, as demais espécies tiveram ocorrência apenas nos seus locais de coleta. Esse fato demonstra a alta complementariedade das áreas, e a conservação simultânea delas. Apesar de o ponto 2 ocorrer fora do limite das áreas mais conservadas vinculadas as unidades topográficas elevadas, é o que apresentou maior diversidade de espécies (Figura 44), maior quantidade de guildas tróficas e ausência de espécies exóticas. Portanto, do ponto de vista conservacionista, esse ponto é de grande importância para a conservação da ictiofauna do córrego da Mata (principal curso d’água da Serra das Areias). Figura 44; Comparação da riqueza de espécies entre os pontos amostrados na Serra das Areias, Aparecida de Goiânia-GO. Fonte: Mattos e Clímaco Ltda, 2014 3.5 Macroinvertebrados Aquáticos 3.5.1 Unidades topográficas baixas A amostragem dos macroinvertebrados aquáticos se deu em cursos d’água mais representativos, os quais estão nas unidades topográficas planas, assim como a amostragem da Plano de Manejo UC Serra das Areias 85 ictiofauna. Ao longo de todas as campanhas, foram amostrados 4235 invertebrados bentônicos, distribuídos em 51 táxons, pertencentes a oito ordens de insetos aquáticos (Tabela 15). Tabela 15: Táxons de Invertebrados Aquáticos amostrados nos córregos da Mata e Santo Antônio, localizados no entorno da Unidade de Conservação Serras das Areias, Aparecida de Goiânia - Goiás, 2014. Mata/M= córrego da Mata, coleta realizada em março; SA/M= Santo Antônio, coleta realizada em março; Mata/J= córrego da Mata, coleta realizada em julho; SA/J= Santo Antônio, coleta realizada em julho. Ordem Diptera Coleoptera Ephemeroptera Família Ceratopogonidae Chironomidae Empididae Simuliidae Tabanidae Tipulidae Dryopidae Dysticidae Elmidae Gyrinidae Hydrophilidae Noteridae Staphylinidae Torrindicolidae Baetidae Leptohyphidae Gênero Leptohyphes Traverhyphes Leptophlebiidae Farrodes Hagenulopsis Terpides Ulmeritoides Hemiptera Megaloptera Belostomatidae Naucoridae Nepidae Noteridae Notonectidae Pleidae Veliidae Corydalidae Plano de Manejo UC Serra das Areias Corydalus Mata/M Mata/J SA/M 5 13 2 299 997 363 8 28 1 6 24 2 0 2 0 2 6 0 0 2 2 0 1 0 71 185 7 0 11 1 0 0 0 0 0 0 0 0 0 0 0 2 157 104 1 18 110 0 2 0 0 2 9 0 17 61 0 1 2 0 6 12 1 0 4 0 0 1 0 0 0 1 15 17 3 0 0 0 0 1 0 0 1 0 0 19 0 9 3 13 0 2 0 SA/J 46 872 15 123 0 7 47 2 21 4 4 1 3 2 11 2 0 0 0 0 0 0 0 1 0 1 0 0 0 7 2 86 Cont. Ordem Odonata Plecoptera Trichoptera Família Calopterygidae Coenagrionidae Gomphidae Libellulidae Perlidae Calamoceratidae Hydropsychidae Hydroptilidae Leptoceridae Odontoceridae Philopotamidae Polycentropodidae Abundância Total Riqueza Índice de Shannon Equitabilidade Gênero Anacroneuria Phylloicus Leptonema Macronema Macrostemum Smicridea Neotrichia Oxyethira Nectopsyche Oecetis Marilia Chimarra Cernotina Cyrnellus Polyplectropus Mata/M Mata/J SA/M 0 8 3 0 8 0 2 1 1 1 19 2 11 14 0 1 8 1 0 12 0 0 8 0 0 11 0 0 2 0 4 7 0 1 0 0 0 26 0 12 0 0 0 2 0 2 5 0 0 1 0 0 2 0 1 0 0 1 1 0 654 2404 406 25 42 17 1.779 1.85 0.5872 0.5527 0.49 0.2073 SA/J 8 9 8 54 9 13 102 3 6 8 27 2 0 0 0 0 5 0 0 0 1831 32 1.68 0.48 A ordem mais representativa em ambos os riachos foi Diptera, com 2821 indivíduos, representada basicamente pela família Chironomidae (2531 indivíduos). Os insetos desta ordem formam um dos grupos mais importantes de insetos aquáticos, as larvas apresentam uma elevada capacidade adaptativa e, portanto, são considerados um grupo bastante tolerante as perturbações no ambiente, com representantes de todos os grupos tróficos funcionais. Chironomidae é uma das famílias mais diversas dentro da ordem Diptera, reunindo um total de aproximadamente 355 gêneros, que ocorrem nos mais diversos habitats aquáticos, somente no Brasil são registradas aproximadamente 379 espécies (Mendes & Pinho, 2014). A sua resistência às adversidades do ambiente está relacionada principalmente com a sua capacidade de respiração, uma vez que as suas larvas respiram oxigênio dissolvido na água Plano de Manejo UC Serra das Areias 87 através da superfície corporal e, além disso, a hemoglobina participa da respiração quando há pouca concentração de oxigênio dissolvido (Trivinho-Strixino, 2014). O período de seca foi o mais representativo em ambos os riachos (córrego da Mata e Ribeirão Santo Antonio), com um total de 3175 indivíduos amostrados (75% do total de indivíduos) e com maior riqueza de táxons também observada neste período (Tabela 15). Este resultado era esperado, uma vez que, durante a estação seca há maior estabilidade dos habitats e por isso, é também o período mais recomendado para estudos de avaliação de impactos sobre o grupo estudado (Buss et al., 2004; Diniz-Filho et al., 1998). A diversidade de Shannon, abundância, equitabilidade de Pielou e riqueza observada variaram mais entre os dois riachos durante a estação chuvosa, com o córrego da Mata apresentando maior diversidade e equitabilidade durante este período. Durante a estação de seca esses valores não diferiram muito entre os dois riachos (Tabela 15). Isto mostra no córrego da Mata há maior representatividade de insetos resistentes a perturbações no ambiente, em comparação com o Ribeirão Santo Antônio. Esse fato pode ser observado comparando a abundância das ordens consideradas como intolerantes - Ephemeroptera, Plecoptera e Trichoptera - a perturbação no ambiente aquático, durante a estação chuvosa (Figura 45) (Callisto, 2004). Figura 45: Abundância de EPT nos córregos da Mata e Santo Antônio, durante a estação chuvosa (Março de 2014), situados nas áreas de influência da UC Serra das Areias, Aparecida de Goiânia, Goiás. Fonte: Mattos e Clímaco Ltda, 2014 Plano de Manejo UC Serra das Areias 88 O resultado do Índice BMWP, que avalia a qualidade da água de acordo com as famílias de invertebrados amostradas, mostrou que o córrego da Mata apresenta-se em melhor estado de conservação, sendo classificado como boa a qualidade da água (121 pontos). Já o Ribeirão Santo Antônio apresentou qualidade da água satisfatória (94 pontos). O fato de o córrego da Mata apresentar-se com melhor qualidade da água pode estar relacionado com a qualidade da vegetação no entorno e menor perturbação no ambiente aquático. Diversos estudos confirmam que os fatores que mais influenciam a estrutura das comunidades de insetos aquáticos são a sazonalidade (Oliveira et al., 1997; Bispo & Oliveira, 1998, Callisto, 2004), diversidade de habitats (Galdean et al., 2000; Callisto et al., 2001) e estado de conservação das matas no entorno do riacho (Aguiar et al., 2002, Vannote et al., 1980). Vulnerabilidades O Ribeirão Santo Antônio encontra-se mais vulnerável à perturbação em relação ao córrego da Mata. A área no entorno do córrego de Santo Antônio encontra-se mais antropizada o que pode ter influenciado a qualidade da água apresentar resultado satisfatório. Como está situado próximo as áreas delimitadas como de uso sustentável, especial atenção deve ser dada a este riacho dentro da Unidade de Proteção, uma vez que a jusante já encontrase com extensivas ações antrópicas no entorno. Já o córrego da Mata apresenta alta diversidade e abundância de táxons sensíveis a perturbação ambiental (Figura 45), pois abriga uma fauna única, característica de ambientes bem preservados. Atividades de recreação foram observadas no local e desde que realizadas de forma consciente não oferecem grandes riscos à biota aquática. No entanto, o lixo resultante dessas atividades dentro e no entorno do riacho pode vir a ser um problema para as comunidades aquáticas. Potencialidades do Grupo Os invertebrados aquáticos, apesar de não possuírem valor econômico direto, são a base da alimentação de pequenos peixes e outros vertebrados aquáticos e quando emergem, servem de alimento para outros invertebrados e aves. Perturbações na biota de invertebrados Plano de Manejo UC Serra das Areias 89 aquáticos pode ter efeito tanto no ambiente aquático quanto no terrestre, uma vez que eles fazem parte da cadeia trófica de ambos os ecossistemas (Baxter, et al. 2004). 3.5.2 Área do entorno da Serra das Areias O córrego da Mata coneta as duas unidades topográficas elevadas e mais conservadas da Serra das Areias, portanto, já é um corredor de biodiversidade natural entre estas unidades. Esse curso d’água permite a capacidade de movimentação de organismos aquáticos por uma ampla área preservada dentro da Unidade Territorail da Serra e dessa Unidade para a Zona Rural do município de Hidrolândia ao desaguar em outros cursos d’água, corroborando sua qualidade ambiental mais significativa em relação ao outro curso d’água estudo. Porém a capacidade de fluxo de organismos e matéria no córrego da Mata fica sujeito às ações negativas do manejo inadequado do curso d’água em algmas propriedades. Já o Ribeirão Santo Antônio tem a qualidade de seu curso d’água perturbado por atividades urbanas (e.g. assoreamento, barramentos d’água, ocupação irregular da Área de Preservação Permanente (APP), horticultura, lixo doméstico, dentre outros) já nos limites da Unidade de Conservação com o entorno, comprometendo a qualidade do curso d’água e a manutenção da comunidade de macroinvertebrados aquáticos por um gradiente extenso do Ribeirão. 3.5.3 Heterogeneidades O diagnóstico da riqueza e da abundância de espécies apontou que o córrego da Mata apresenta uma qualidade ambiental mais expressiva em relação ao Ribeirão Santo Antônio no que se refere aos macroinvertebrados aquáticos, fato que é consequência das diferenças de uso do solo e medidas de conservação ao longo dos dois cursos d’água. Como o córrego da Mata conecta as duas unidades topográficas elevadas, apresentando extensas áreas preservadas ao longo de seu percurso, essa situação corrobora a relevância da conservação dos habitats terrestres para a qualidade dos habitats aquáticos. Plano de Manejo UC Serra das Areias 90 3.6 Mastofauna Foram encontradas 14 espécies de mamíferos na região da Serra das Areias, município de Aparecida de Goiânia, conforme as tabelas 16 e 17 a seguir, que trazem respectivamente, (1) as espécies encontradas na região de estudo por campanha, sendo 12 espécies no período de chuva e 7 espécies no período de seca e, (2) a lista de espécies amostradas por método, considerando que foram utilizados transectos diurno/rastros (7 espécies) e transecto noturno (3 espécies) e rede de neblina (7 espécies). A tabela 18 traz a lista de espécies de mamíferos encontradas na região da Serra das Areias, Município de Aparecida de Goiânia com as categorias de ameaça de cada espécie conforme a União Internacional para Conservação da Natureza (IUCN, 2014), a lista vermelha nacional de 2003 e o livro vermelho da fauna ameaçada de extinção do Ministério do Meio Ambiente (MMA, 2008), em que a espécie Myrmecophaga tridactyla é categorizada como vulnerável e, Chrysocyon brachyurus como quase ameaçada. Tabela 16: Espécies encontradas na região de estudo por campanha (Chuva e Seca). Campanha Chuva Seca Classe Mammalia Ordem Carnivora Família Canidae Cetartiodactyla Chiroptera Cervidae Phyllostomidae Didelphimorphia Lagomorpha Pilosa Carnivora Vespertilionidae Didelphidae Leporidae Myrmecophagidae Canidae Chiroptera Vespertilionidae Didelphimorphia Pilosa Didelphidae Myrmecophagidae Plano de Manejo UC Serra das Areias Espécie Cerdocyon thous Chrysocyon brachyurus Mazama gouazoubira Anoura caudifer Artibeus obscurus Carollia perspicillata Desmodus rotundus Glossophaga soricina Eptesicus diminutus Didelphis albiventris Sylvilagus brasiliensis Myrmecophaga tridactyla Cerdocyon thous Chrysocyon brachyurus Eptesicus diminutus Myotis nigricans Didelphis albiventris Myrmecophaga tridactyla Tamandua tetradactyla 91 Tabela 17: Espécies encontradas na região de estudo por campanha (Chuva e Seca). Campanha Redes de Neblina Classe Ordem Família Espécie Mammalia Chiroptera Phyllostomidae Anoura caudifer Artibeus obscurus Carollia perspicillata Desmodus rotundus Glossophaga soricina Eptesicus diminutus Myotis nigricans Vespertilionidae Transecto Diurno/Rastros Mammalia Carnivora Canidae Didelphimorphia Cetartiodactyla Pilosa Didelphidae Cervidae Myrmecophagidae Cerdocyon thous Chrysocyon brachyurus Didelphis albiventris Mazama gouazoubira Myrmecophaga tridactyla Tamandua tetradactyla Transecto Noturno Mammalia Lagomorpha Leporidae Sylvilagus brasiliensis Carnivora Didelphimorphia Pilosa Canidae Didelphidae Myrmecophagidae Cerdocyon thous Didelphis albiventris Myrmecophaga tridactyla Plano de Manejo UC Serra das Areias 92 Tabela 18: Lista de espécies de mamíferos encontradas na região da Serra das Areias - Município de Aparecida de Goiânia. Categorias de ameaça em toda a distribuição da espécie pela União Internacional para Conservação da Natureza (IUCN, 2014) e ameaça na distribuição apenas no território nacional pela lista vermelha nacional de 2003 e livro vermelho da fauna ameaçada de extinção do Ministério do Meio Ambiente (MMA 2008). Classe Mammalia Ordem Família Carnivora Canidae Cetartiodactyla Chiroptera Cervidae Vespertilionidae Phyllostomidae Didelphimorphia Lagomorpha Pilosa Didelphidae Leporidae Myrmecophagidae Cerdocyon thous Chrysocyon brachyurus Mazama gouazoubira Eptesicus diminutus Myotis nigricans Desmodus rotundus Carollia perspicillata Glossophaga soricina Anoura caudifer Artibeus obscurus Didelphis albiventris Sylvilagus brasiliensis Myrmecophaga tridactyla Tamandua tetradactyla Categoria de Ameaça (IUCN) Pouco Preocupante Quase Ameaçada Pouco Preocupante Deficiente de Dados Pouco Preocupante Pouco Preocupante Pouco Preocupante Pouco Preocupante Pouco Preocupante Pouco Preocupante Pouco Preocupante Pouco Preocupante Vulnerável Pouco Preocupante Categoria de Ameaça (MMA) não consta Vulnerável não consta não consta não consta não consta não consta não consta não consta não consta não consta não consta Vulnerável não consta 93 Plano de Manejo UC Serra das Areias Espécie Apesar do comportamento assintótico apresentado pela curva de acumulação de espécies (ou riqueza observada), que representaria suficiência amostral, que é a riqueza de espécies da região foi encontrada durante o período coletado (onze dias), nota-se uma divergência com relação ao estimador Jackknife de primeira ordem. Este estimar (figura 46) prevê que a riqueza que seria esperada na região, baseado na riqueza observada, seria cerca de duas vezes o número de espécies encontradas dentro do período amostrado, e ainda com comportamento não assintótico. Deste modo, seria ideal que houvesse continuidade de monitoramento da fauna da região, a fim de se conhecer a verdadeira representatividade da unidade com relação à mastofauna típica do Cerrado. Figura 46: Riqueza de Espécies estimada pelo método Jackknife de primeira ordem (Jack 1, intervalo de confiança a 95%) e Riqueza Observada (Sobs - curva de acumulação de espécies) da região da Serra das Areias - Município de Aparecida de Goiânia. Fonte: Mattos e Clímaco Ltda, 2014 3.6.1 Unidades Topográficas elevadas Foram encontradas nas Unidades Topográficas elevadas (áreas mais conservadas e com menor restrição de uso e ocupação do solo), treze das quatorze espécies encontradas em toda a região, conforme tabela 19 a seguir. Plano de Manejo UC Serra das Areias 94 Tabela 19: Espécies de mamíferos encontradas na região da Serra das Areias delimitada como unidades topográficas elevadas. Classe Ordem Família Espécie Nome Popular Mammalia Carnivora Canidae Cerdocyon thous Cetartiodactyla Cervidae Chrysocyon brachyurus Mazama gouazoubira Chiroptera Vespertilionidae Phyllostomidae Didelphimorphia Lagomorpha Pilosa Didelphidae Leporidae Myrmecophagidae Cachorro-domato Lobo-Guará Veado Catingueiro Morcego Morcego Morcego Morcego Morcego Morcego Gambá Tapiti TamanduáBandeira TamanduáMirim Eptesicus diminutus Anoura caudifer Artibeus obscurus Desmodus rotundus Carollia perspicillata Glossophaga soricina Didelphis albiventris Sylvilagus brasiliensis Myrmecophaga tridactyla Tamandua tetradactyla Estado de Ameaça (MMA) não consta Quase Ameaçada Pouco Preocupante Vulnerável não consta Deficiente de Dados Pouco Preocupante Pouco Preocupante Pouco Preocupante Pouco Preocupante Pouco Preocupante Pouco Preocupante Pouco Preocupante Vulnerável não consta não consta não consta não consta não consta não consta não consta não consta Vulnerável Pouco Preocupante não consta 95 Plano de Manejo UC Serra das Areias Estado de Ameaça (IUCN) Pouco Preocupante Ordem Carnivora Os carnívoros são importantes para os ecossistemas naturais e para a conservação da biodiversidade em geral. Por serem predadores, regulam as populações de suas presas e estruturam as comunidades naturais com base na predação, sendo por isso consideradas espécies-chave. Como necessitam de grandes áreas para manter populações viáveis, esforços para manter áreas suficientes à conservação de carnívoros acabam por preservar também as outras espécies da comunidade. Nesse caso, os carnívoros estariam exercendo papel de espécies “guarda-chuva”. São também animais carismáticos, o que permite sua utilização como símbolos em projetos de conservação, sendo considerados “espéciesbandeira” (MMA, 2008). Visto que são animais que ocupam o topo da pirâmide alimentar, e por consequência necessitando de grandes áreas para forrageamento/reprodução, a destruição, fragmentação e alteração de habitats representam a principal causa de ameaça para todas as espécies deste grupo. O abate ou retirada de indivíduos da natureza é, atualmente, a segunda principal causa de ameaça para as espécies de carnívoros, seja para animais de estimação, ou em retaliação à predação de animais domésticos. Em décadas anteriores, a caça para o comércio de peles (juntamente com a perda de hábitat) foi o principal fator responsável pela depauperação e consequente ameaça às populações naturais dos carnívoros. Os atropelamentos também afetam populações de várias espécies, em especial as de lobo-guará e cachorro-do-mato. Para mitigar essas ameaças, várias ações específicas podem ser efetivadas, mas as principais dizem respeito à proteção de habitats, com a criação de Unidades de Conservação, além da efetiva proteção daquelas já existentes, procurando sempre promover a conectividade entre habitats protegidos. Dentro da perspectiva de crescente destruição e fragmentação de ambientes naturais e de seus requerimentos de área, a conectividade entre populações é fundamental para a conservação de carnívoros (MMA, 2008). Plano de Manejo UC Serra das Areias 96 Espécies encontradas: Nome Científico: Cerdocyon thous Nome Popular: Cachorro-do-mato Habitat: Ocupa grande variedade de tipos fitofisionômicos, desde matas de galeria e florestas estacionais a áreas de campo sujo. Adapta-se facilmente a regiões desflorestadas e convertidas em plantações. Ameaças: Atropelamentos e doenças disseminadas por canídeos e outros domésticos. Em regiões antropizadas, a espécie também sofre perseguição humana por predar aves domésticas. Nome Científico: Chrysocyon brachyurus Nome Popular: Lobo-Guará Habitat: Habitam, preferencialmente, habitats abertos, como campos, cerrados, veredas e campos úmidos. Embora não existam muitas informações quanto à tolerância a áreas alteradas, o lobo-guará também tem sido visto com maior frequência em terras cultivadas para agricultura e pastagens. Ameaças: Atualmente, o crescimento desordenado de centros urbanos e a consequente perda de hábitat têm resultado em processos negativos à conservação da espécie, mesmo que ela seja mais tolerante a algumas atividades antrópicas, como a agricultura. A drástica redução de ambientes tem sido apontada como o fator principal de redução de populações. Essa ameaça é ainda mais potencializada quando se observa que grande parte da área de ocorrência da espécie já está convertida em campos agricultáveis e em campos destinados à pecuária. Verifica-se, também, grande número de animais vítimas de atropelamentos, na maioria jovens, provavelmente em fase de dispersão. Em algumas populações, estima-se que os atropelamentos sejam responsáveis pela morte de um terço à metade da produção anual de filhotes. Outro impacto é a contaminação epidemiológica de patógenos advindos do contato com animais domésticos, sobretudo onde a zona de contato é grande. Lobos-guará estão sujeitos a várias doenças transmitidas por cães, cujo impacto na natureza pode ser significativo. Além dessas ameaças, a mitificação da espécie como principal responsável pela predação de aves domésticas em comunidades rurais tem sido um motivo significante para a Plano de Manejo UC Serra das Areias 97 perseguição e abate deste animal. Considerada como Vulnerável pela Lista Nacional de espécies Ameaçadas e como Quase Ameaçada pela Lista Mundial da IUCN. Ordem Cetartiodactyla Os representantes da família Cervidae possuem papel funcional nas comunidades ligado à dispersão de sementes, visto que possuem hábito alimentar herbívoro/frugívoro. Na cadeia alimentar, os cervídeos servem de presas para grandes carnívoros e controlam populações de gramíneas, através do pastejo. Espécies encontradas: Nome Científico: Mazama gouazoubira Nome Popular: Veado-Catingueiro Habitat: Ocorre desde regiões úmidas a mais secas, nas quais existem cobertura arbóreo/arbustiva. A espécie evita áreas florestais densas, utilizando apenas suas margens. São encontradas forrageando em áreas abertas e plantações. Ameaças: Apesar de ser a espécie de cervídeo mais abundante no Brasil, apresenta uma tendência de declínio populacional, decorrente em grande parte da perda e fragmentação de hábitats, caça e, em áreas altamente antropizadas, morte por cães domésticos. Ordem Chiroptera Quirópteros são um dos grupos de mamíferos mais diversificados do mundo, com dezoito famílias, 202 gêneros e cerca de 1120 espécies (com tendência crescente a partir de métodos moleculares de classificação). Isso representa aproximadamente 22% das espécies conhecidas de mamíferos. No Brasil é a segunda ordem em riqueza de espécies, sendo superada somente pela ordem Rodentia. Os quirópteros, se por um lado algumas entre suas espécies frugívoras são capazes de provocar danos em pomares, e as hematófagas de disseminar o vírus da raiva, por outro (e a balança pende significativamente a seu favor), são importantíssimos no controle dos insetos, que as formas insetívoras consomem às toneladas em cada noite, na polinização de inúmeras espécies de plantas florestais, que desapareceriam sem o concurso das formas nectarívoras, e na disseminação de sementes pelas frugívoras, Plano de Manejo UC Serra das Areias 98 tanto pelo abandono das sementes maiores após devorarem a polpa, como pela eliminação das menores junto com as suas fezes (Reis et. al, 2007). Além da perseguição e do extermínio constante, tendo em vista sua associação com o vírus da raiva, a alteração de hábitat é uma das principais ameaças aos morcegos. Além disso, biomas como o Cerrado e a Amazônia estão sofrendo rápida substituição de sua vegetação nativa por áreas para pasto e agricultura. Nessas áreas, observa-se um ciclo de extermínio, primeiro pelo desmatamento e depois pela ameaça ao gado. Esses biomas, assim como o Pantanal e a Caatinga, são ainda pouco conhecidos em relação à sua diversidade de espécies, fato este que gera a necessidade de maior número de inventários (MMA, 2008). Espécies Encontradas: Nome Científico: Eptesicus diminutus Nome Popular: Morcego Habitat: De hábito insetívoro, habita áreas abertas, urbanas e sub-urbanas. Ameaças: Perseguição e extermínio, perda e alteração de hábitat (pouco conhecimento a respeito da espécie). Nome Científico: Anoura caudifer Nome Popular: Morcego Habitat: Encontrada em todos os biomas brasileiros, essa espécie tem sido comumente reportada em inventários locais, ocorrendo em áreas de floresta primária e secundária, bananais associados a florestas, pastos e áreas rurais e urbanas. Abriga-se em cavernas, furnas e locas de pedra, cavidades em árvores caídas, e uma variedade de construções humanas, como residências abandonadas e bueiros sob rodovias. Alimenta-se de néctar de plantas de várias famílias, frutos, pólen e ainda de insetos. Desta forma, esta espécie apresenta um importante papel funcional na comunidade como dispersor, polinizador e controlador de populações de insetos, como vetores de doenças. Plano de Manejo UC Serra das Areias 99 Ameaças: Perseguição e extermínio, perda e alteração de hábitat (pouco conhecimento a respeito das ameaças à espécie). Nome Científico: Artibeus obscurus Nome Popular: Morcego Habitat: Endêmica à América do Sul, pouco se sabe sobre a ecologia da espécie. Esta espécie parece estar bem associada a ambientes de floresta primária e a ambientes úmidos, embora possa ser observada também em áreas urbanas. Abriga-se sob folhagem e em saliências de cascas de troncos não totalmente desprendidas das árvores, além de folhas de palmeiras. De hábito frugívoro, alimenta-se de frutos de Ficus e sementes de Cecropia. Ameaças: Perseguição e extermínio, perda e alteração de hábitat (pouco conhecimento a respeito da espécie). Nome Científico: Desmodus rotundus Nome Popular: Morcego vampiro Habitat: Hematófagos, são biogeograficamente limitados a regiões de clima quente. São encontrados em grandes colônias desde regiões áridas a úmidas dos trópicos e subtrópicos. Habitam cavernas, buracos de árvores e construções abandonadas. O fato de ter alimentação exclusivamente de sangue o torna potencial vetor do vírus rábico. Ameaças: Perseguição e extermínio, perda e alteração de hábitat. Nome Científico: Carollia perspicillata Nome Popular: Morcego Habitat: Largamente distribuído por diversos tipos de ambientes ao longo da região Neotropical. Possuem hábito alimentar frugívoro/nectarívoro, consumindo preferencialmente frutos da família Piperaceae (o que o torna um importante dispersor desta família). Porém, sabe-se que esta espécie alimenta-se ainda de frutos de pelo menos outras Plano de Manejo UC Serra das Areias 100 trinta e oito famílias botânicas, de pólen e néctar e ainda de insetos. Desta forma, esta espécie apresenta um importante papel funcional na comunidade como dispersor, polinizador e controlador de populações de insetos, como daqueles vetores de doenças. Ameaças: Perseguição e extermínio, perda e alteração de hábitat. Nome Científico: Glossophaga soricina Nome Popular: Morcego Habitat: Encontrado nos mais diversos tipos de hábitat, incluindo florestas primárias e secundárias, pomares e pequenos fragmentos florestais. Também é comum em meio rural e em áreas urbanas, incluindo grandes cidades onde, não raro, adentra residências. Morcegos dessa espécie têm sido encontrados em cavernas, ocos de árvores, fendas em rochas, túneis, minas, casas abandonadas, interior de cisternas, dutos de ventilação, poço de elevador, sob pontes, telhas e forros. Possuem hábito nectarívoro, alimentando-se de néctar de plantas de diversas famílias botânicas. Ameaças: Perseguição e extermínio, perda e alteração de hábitat. Grande Grupo dos Pequenos Mamíferos (Marsupiais e Roedores) Os pequenos mamíferos têm papel importante nas cadeias alimentares e na dispersão de sementes. Muitos deles estão envolvidos em problemas de saúde pública como hospedeiros de parasitas. Em alguns casos, podem ser capazes de manter a parasitose mesmo sem a presença humana, como a esquistossomose e as leishmanioses. Em geral, suspeita-se que as alterações de hábitat sejam as principais responsáveis ameaças as suas populações. Várias das espécies são florestais, muitas delas arborícolas. Sendo o desflorestamento e a fragmentação um dos principais problemas ambientais do país, essa alteração é considerada a maior ameaça à viabilidade dessas espécies. A expansão das áreas protegidas é a recomendação imediata para manutenção das suas populações (MMA, 2008). Plano de Manejo UC Serra das Areias 101 Ordem Didelphimorphia Espécies Encontradas: Nome Científico: Didelphis albiventris Nome Popular: Gambá Habitat: Encontrada em grande variedade de habitats, desde florestas estacionais e matas de galeria, a regiões desflorestadas, de plantações e zonas urbanas. Frugívora-onívora consome roedores e aves de pequeno porte, herpetos, insetos e frutos, apresentando importante papel funcional no ambiente (dispersor, controle de pragas). É frequentemente associado à predação de aves domésticas. Ameaças: Perseguição e extermínio, perda e alteração de hábitat. Ordem Lagomorpha Espécies Encontradas: Nome Científico: Sylvilagus brasiliensis Nome Popular: Tapiti Habitat: Habitam regiões de mata até campos, sendo típicos de regiões de transição entre bosques e áreas mais abertas ou bordas de cursos d’água, bem como zonas alagadas. Durante o dia permanecem escondidos sob raízes expostas, interior de troncos ou diretamente abaixo da vegetação. Alimentam-se de folhas, frutos, talos, sementes e raízes, possuindo papel funcional de dispersor de sementes. Ameaças: Perda e fragmentação de hábitat e caça. Em áreas antropizadas pode ser predada por cães domésticos, além do próprio homem. Plano de Manejo UC Serra das Areias 102 Ordem Pilosa Espécies Encontradas: Nome Científico: Myrmecophaga tridactyla Nome Popular: Tamanduá-Bandeira Habitat: Encontrado em floresta tropical úmida, matas secas, e vegetação arbóreo/arbustiva. Alimentam-se principalmente de formigas e cupins. Ameaças: Em algumas áreas são caçados para alimentação humana e sua pele é utilizada na produção de artigos de couro, além de aplicações medicinais. Naturalmente é uma espécie rara devido à sua biologia (um filhote por ano e maturidade sexual atingida por volta dos dois anos de idade). Perda e fragmentação de habitats, atropelamentos, caça e fogo tem afetado substancialmente as populações da espécie nos ultimos dez anos, com muitos registro de extirpação da mesma em algumas localidades. Algumas vezes são mortos por cães domésticos, além de humanos (devido ao dito popular referente ao “abraço” dos indivíduos pertencentes a esta espécie). São também caçados para comércio ilegal em algumas regiões da sua distribuição. É considerada como Vulnerável tanto pela lista nacional de espécies ameaçadas quanto pela Lista Mundial da IUCN. Nome Científico: Tamandua tetradactyla Nome Popular: Tamanduá-Mirim Habitat: Encontrada em todos os biomas brasileiros, utilizando tanto ambientes savânicos como ambientes florestais (matas de galeria e florestas estacionais). Alimentam-se geralmente de cupins, formigas, mel e abelhas. Ameaças: Captura para criação como Pet, caça para consumo humano, uso de pele para confecção de artigos de couro e tráfico são algumas das ameaças enfrentadas pela espécie. Além disso, a espécie sofre predação por cães domésticos em regiões antropizadas. Porém as maiores ameaças a espécie são a perda e fragmentação de hábitats, incêndios e Plano de Manejo UC Serra das Areias 103 atropelamentos. Apesar de não constar na Lista Nacional de espécies ameaçadas de extinção e possuir estado Pouco Preocupante pela Lista Mundial da IUCN, a espécie é considerada como Vulnerável em alguns estados Brasileiros. Vale lembrar que Goiás não possui nenhuma lista de espécies ameaçadas. 3.6.2 Unidades Topográficas Planas Foram amostradas nas Unidades Topográficas Planas e mais alteradas do ponto da substituição dos habitas naturais por uso do solo antrópico, seis das quatorze espécies encontradas em toda a área de estudo, conforme tabela 20 a seguir. Ordem Chiroptera Nome Científico: Myotis nigricans Nome Popular: Morcego Habitat: Encontrado em ambientes de mata, capoeiras, plantações, trilhas e também em construções humanas. Classificado como insetívoro aéreo de florestas e clareiras, atua no controle de pragas. Ameaças: Perseguição e extermínio, perda e alteração de hábitat. Plano de Manejo UC Serra das Areias 104 Tabela 20: Espécies de mamíferos encontradas na região da Serra das Areias delimitada como Unidade Topográfica Plana. Classe Mammalia Nome Estado de Ameaça Estado de Ameaça Popular (IUCN) (MMA) Pouco Preocupante não consta Morcego Pouco Preocupante não consta Eptesicus diminutus Morcego Deficiente de Dados não consta Phyllostomidae Desmodus rotundus Morcego Pouco Preocupante não consta Didelphimorphia Didelphidae Didelphis albiventris Gambá Pouco Preocupante não consta Pilosa Myrmecophagidae Myrmecophaga Tamanduá- tridactyla Bandeira Vulnerável Vulnerável Ordem Família Espécie Carnivora Canidae Cerdocyon thous Chiroptera Vespertilionidae Myotis nigricans Cachorro-domato *Para maior descrição das espécies, vide seção anterior. 105 Plano de Manejo UC Serra das Areias 3.6.3 Entorno Na região do entorno da Serra das Areias foi encontrada somente uma espécie, sendo o Cachorro-do-Mato (Cerdocyon thous – vide seções anteriores para mais detalhes sobre a espécie). Portanto, devido a capacidade de locomoção por áreas mais abrangentes, os mamíferos registrados na Serra das Areias podem ocorrer no entorno, especialmente nas áreas com características rurais, em que há conexão através de Matas de Galeria e pequenos remanescentes que servem de suporte para esse grupo. 3.6.4 Heterogeneidade Ao compararmos os resultados encontrados em cada uma das duas categorias de Unidades dentro da Serra das Areias, notamos que a riqueza de espécies encontrada nas Unidades Topográficas Elevadas (UTE) (treze espécies) corresponde a mais do que o dobro daquela encontrada nas Unidades Topográficas Planas (UTP) (seis espécies). Além disso, foi encontrada uma espécie na ultima unidade, e que não foi encontrada na primeira. De forma geral, as espécies encontradas na UTP se apresentaram como uma subamostra daquelas encontradas nas UTE. Apesar dessa observação, e do fato de as UTE possuírem maior quantidade de tipos vegetacionais preservados do que as UTP, não se devem retirar conclusões precipitadas a respeito destes resultados. Mamíferos são animais bastante móveis e com grandes áreas de vida, fato esse que justifica a não restrição das espécies a uma ou outra categoria de unidade de proteção. Além disso, como os esforços de amostragem foram conduzidos de forma extensiva, os tipos de unidades topográficas não foram amostrados de forma equitativa. 3.7 Flora 3.7.1 Fitofisionomias A Serra das Areias apresenta uma grande variedade de fitofisionomias, sendo representadas por formações do tipo campestre (campo sujo), savânica (cerrado sensu stricto e Plano de Manejo UC Serra das Areias 106 vereda) e florestal (cerradão, mata semidecídua e mata de galeria). Para classificação das fitofisionomias foram utilizados os critérios e categorias da EMBRAPA (Ribeiro & Walter 1998). Campo sujo O campo sujo é uma vegetação campestre caracterizada por uma camada herbácea (Figura 47), principalmente constituída por gramíneas, intercalada com arbustos bem esparsos (RIBEIRO & WALTER, 2008). A composição florística do campo sujo, principalmente nas comunidades ou faixas afastadas da vegetação de interflúvio, possui grande similaridade com a dos estratos inferiores das formas de cerrado sensu stricto, sendo muitas as espécies comuns a essas duas fitofisionomias. Essas semelhanças, por vezes, fazem com que o campo sujo seja confundido com o cerrado ralo, entretanto essa última formação apresenta cobertura e densidade arbóreo-arbustiva superior, típica das formações savânicas. Figura 47: Detalhe da fitofisionomia campo sujo. Fonte: Mattos e Clímaco Ltda, 2014 Cerrado sensu stricto O cerrado sensu stricto, também denominado de sentido restrito, é a fitofisionomia savânica predominante do bioma Cerrado (Figura 48), e é a formação vegetal predominante Plano de Manejo UC Serra das Areias 107 na Unidade de Conservação Serra das Areias. Essa formação é caracterizada por vegetação arbóreo-arbustiva aberta, com árvores e arbustos tortuosos e espaçados, de casca grossa, folhas grandes e escleromorfas (Ribeiro & Walter 2008). É constituído por aproximadamente 300 a 450 espécies de plantas vasculares por hectare, atrás apenas das florestas tropicais úmidas (Eiten 1993). Segundo Silva et al. (2002), este tipo de cerrado apresenta um estrato arbóreo-arbustivo variando em torno de 6 a 7m e um estrato rasteiro mais ou menos contínuo. Figura 48: Detalhe da fitofisionomia cerrado sensu stricto. Fonte: Mattos e Clímaco Ltda, 2014 Dependendo de suas características, o cerrado sensu stricto pode ser subdividido em cerrado ralo, quando apresenta baixa densidade de árvores por unidade de área, ou ainda cerrado rupestre, quando apresenta afloramentos rochosos. O cerrado ralo (Figura 49a) é a forma mais baixa e menos densa de cerrado sensu stricto constituída de árvores e arbustos, com cobertura arbórea de 5% a 20% e altura média de dois a três metros (Ribeiro & Walter, 2008). Já o cerrado rupestre é o subtipo de cerrado típico que ocorre sore solos predominantemente rochosos (Figura 49b). Nessa formação vegetal as árvores concentram-se nas fendas entre as rochas, e a densidade arbórea é variável e dependente do volume de solo (Ribeiro & Walter 2008). Plano de Manejo UC Serra das Areias 108 Figura 49: Detalhe dos subtipos de cerrado sensu stricto. A) cerrado ralo e B) cerrado rupestre. Fonte: Mattos e Clímaco Ltda, 2014 Vereda A vereda ou burizital é um tipo de vegetação onde há uma camada arbustivo-herbácea acompanhando o buriti (Mauritia flexuosa), sem a formação de uma cobertura contínua (dossel) e sem um trecho de campo associado (Figura 50). O dossel dessa vegetação possui altura variável de 12 a 20 metros e forma uma cobertura quase homogênea ao longo do ano, variável de 40% a 70% (Ribeiro & Walter, 2008). Por ser geralmente encontrada em locais associados a cursos d’água, como nascentes ou áreas com lençol freático superficial, a vereda é fundamental para a manutenção dos recursos hídricos. Figura 50: Detalhe da fitofisionomia vereda. Fonte: Mattos e Clímaco Ltda, 2014 Plano de Manejo UC Serra das Areias 109 Cerradão O cerradão é a uma formação florestal do bioma Cerrado com características esclerofilas e xeromórficas (Figura 51), caracterizado pela intercalação de espécies que ocorrem no cerrado sensu stricto e também por espécies de florestas, particularmente as de matas secas (Ribeiro & Walter, 2008). Do ponto de vista fisionômico é uma floresta, mas floristicamente se assemelha mais ao cerrado sentido restrito. O cerradão apresenta dossel contínuo e cobertura arbórea que pode oscilar de 50 a 90%, sendo maior na estação chuvosa e menor na seca. A altura média da camada de árvores varia de 8 a 15m, proporcionando condições de luminosidade que favorecem a formação de camadas de arbustivas e herbáceas diferenciadas. Figura 51: Detalhe da fitofisionomia cerradão. Fonte: Mattos e Clímaco Ltda, 2014 Mata Seca Semidecídua Essa é a designação das formações florestais no bioma Cerrado que não possuem associação com cursos de água, caracterizadas por níveis intermediários de queda das folhas durante a estação seca (Figura 52). A queda de folhas contribui para o aumento da matéria orgânica no solo, e por isso esse tipo de mata pode ser encontrada em solos desenvolvidos em rochas básicas de alta fertilidade (terra roxa estruturada ou cambissolos), e de média fertilidade em (latossolos roxo e vermelho-escuro) (Ribeiro & Walter, 2008). A altura média da camada de árvores (estrato arbóreo) varia entre 15 e 25 metros. Plano de Manejo UC Serra das Areias 110 Figura 52: Detalhe da fitofisionomia mata seca semidecídua. Fonte: Mattos e Clímaco Ltda, 2014 Mata de Galeria Esse tipo de vegetação florestal acompanha os rios de pequeno porte e córregos do Cerrado, formando galerias sobre o curso de água (Figura 53). Geralmente localiza-se nos fundos dos vales ou nas cabeceiras de drenagem onde os cursos de água ainda não escavaram um canal definitivo. Essa formação foi encontrada associada ao Córrego da Mata e outros cursos d’água da região. Esse tipo de formação mantém permanentemente as folhas (perenifólia), não apresentando queda significativa das folhas durante a estação seca (Ribeiro & Walter 2008). A altura média do estrato arbóreo varia entre 20 e 30 metros, apresentando uma superposição das copas, que fornecem cobertura arbórea de 70 a 95%. Figura 53: Detalhe da fitofisionomia mata de galeria. Fonte: Mattos e Clímaco Ltda, 2014 Plano de Manejo UC Serra das Areias 111 3.7.2 Diversidade florística Em toda a Serra das Areias foram registradas 290 espécies vegetais pertencentes a 79 famílias botânicas (Tabela 21). As figuras 54, 55 e 56 ilustram algumas dessas espécies em período reprodutivo. As famílias mais representativas em número de espécies foram Fabaceae com 45, Rubiaceae com 18, Asteraceae com 16, Malvaceae com 11, Malpighiaceae e Melastomataceae com 10 espécies cada. Dentre as espécies registradas merecem destaque seis espécies protegidas por lei que foram Anadenanthera peregrina (angico), Astronium fraxinifolium (gonçalo-alves), Caryocar brasiliense (pequi), Handroanthus ochraceus (ipêdo-cerrado), Handroanthus serratifolius (ipê-amarelo-da-mata), Myracroduon urundeuva (aroeira) e Tabebuia alba (ipê-amarelo). A Portaria 113/95 do IBAMA estabelece restrições ao corte do pequi enquanto as demais espécies são protegidas pela Lei Estadual 12.596. Além das espécies protegidas merece destaque a espécie Bromelia goyazensis (bromélia) que é endêmica do estado de Goiás. Das 290 espécies apenas duas são listadas como ameaçadas de extinção de acordo com a lista do Ministério do Meio Ambiente que são Camarea hirsuta (camarea) e Ocotea odorifera (canela). Plano de Manejo UC Serra das Areias 112 Tabela 21: Check list das espécies vegetais registradas na Serra das Areias, tanto nas unidades topográficas elevadas, como nas planas. Família Botânica Nome Científico Autor Origem dos Dados Status de Conservação Importância Habito Coleta ativa * Ornamental Arbusto Coleta ativa * Ornamental Arbusto Coleta ativa * Ornamental Arbusto Acanthaceae Justicia cf. eranthemantha Acanthaceae Justicia lanstyakii Acanthaceae Justicia sp. Acanthaceae Ruellia costata Hiern Coleta ativa * Ornamental Arbusto Acanthaceae Ruellia incomta (Nees) Lindau Coleta ativa * Ornamental Arbusto Acanthaceae Ruellia neesiana (Mart. ex Nees) Lindau Coleta ativa * Ornamental Arbusto Acanthaceae Ruellia nitens (Nees) Wassh Coleta ativa * Ornamental Arbusto Alstroemeriaceae Bomarea edulis (Tussac) Herb. Species link * Ornamental Erva Amaranthaceae Gomphrena sp. Species link * Pirofiticas Erva Coleta ativa * Frutos para fauna Árvore Coleta ativa Frutos para consumo humano Árvore Madeira Árvore Madeira Árvore Rizzini Anacardiaceae Anacardium sp. Anacardiaceae Anacardium humile Anacardiaceae Astronium fraxinifolium. Anacardiaceae Myracrodon urundeuva Allemão Coleta ativa * Protegida pela lei estadual Protegida pela lei estadual Anacardiaceae Tapirira guianensis Aubl. Coleta ativa * Pioneira Árvore Anemiaceae Anemia sp. Coleta ativa * Indicadora Erva Annonaceae Annona crassiflora Mart. Coleta ativa * Frutos para consumo humano Árvore Annonaceae Annona coriacea Mart. Coleta ativa * Frutos para consumo humano Árvore Annonaceae Emmotum nitens (Benth.) Miers. Coleta ativa * Pioneira Árvore Annonaceae Coleta ativa * Pioneira Árvore Annonaceae Xylopia sp. Xylopia aromatica (Lam.) Mart. Coleta ativa * Pioneira Árvore Apiaceae Eryngium sp. Coleta ativa * Pirofiticas Erva Apocynaceae Aspidosperma sp. Coleta ativa * Madeira Árvore Coleta ativa 113 Plano de Manejo UC Serra das Areias A.St.-Hil. Cont. Família Botânica Nome Científico Autor Origem dos Dados Status de Conservação Importância Habito Apocynaceae Aspidosperma macrocarpon Mart. Coleta ativa * Madeira Árvore Apocynaceae Aspidosperma tomentosum Mart. Coleta ativa * Madeira Árvore Apocynaceae Hancornia speciosa Gomes Coleta ativa * Frutos para consumo humano Árvore Apocynaceae Mandevilla cf. hirsuta Coleta ativa * Erva trepadeira Apocynaceae Mandevilla sp. Coleta ativa * Erva trepadeira Apocynaceae Odontadenia lutea (Vell.) Markgr Coleta ativa * Erva trepadeira Apocynaceae Rauwolfia sellowii Species link * Árvore Araliaceae Schefflera macrocarpa Coleta ativa * Pioneira Árvore Araliaceae Schefflera morototoni Müll Arg. (Cham. & Schltdl.) Frodin (Aubl.) Maguire, Steyerm. & Frodin. Coleta ativa * Pioneira Árvore Araliaceae Schefflera sp. Araliaceae Schefflera vinosa (Cham. & Schltdl.) Frodin & Fiaschi Arecaceae Mauritia flexuosa L. Aristolochiaceae - Aristolochiaceae Aristolochia claussenii Asteraceae Aldama sp. Asteraceae Aspilia foliacea Asteraceae Bidens sp. Asteraceae Chromolaena chaseae Asteraceae Cosmos sp. Asteraceae Echinocoryne holosericea (Spreng.) Baker. (B.L.Rob.) R.M.King & H.Rob (Mart. ex Mart.) H.Rob * Pioneira Árvore Coleta ativa * Pioneira Árvore Coleta ativa * Coleta ativa * Borda Erva trepadeira Coleta ativa * Borda Erva trepadeira Coleta ativa * Erva Coleta ativa * Erva Coleta ativa * Erva Species link * Erva Coleta ativa * Erva Species link * Erva Árvore 114 Plano de Manejo UC Serra das Areias Duch. Coleta ativa Cont. Família Botânica Nome Científico Autor Origem dos Dados Status de Conservação Importância Habito Asteraceae Elephantopus hirtiflorus DC. Species link * Arbusto Asteraceae Eremanthus erythropappus (D.C.) MacLeish Coleta ativa * Arbusto Asteraceae Lessigianthus sp.1 Coleta ativa * Arbusto Asteraceae Lessigianthus sp.2 Coleta ativa * Arbusto Asteraceae Lessingianthus bardanoides (Less.) H.Rob. Coleta ativa * Arbusto Asteraceae Lessingianthus onopordioides (Baker) H.Rob Coleta ativa * Arbusto Asteraceae Piptocarpha rotundifolia (Less.) Baker Coleta ativa * Árvore Asteraceae Praxelis sp. Species link * Arbusto Asteraceae Trixis sp. Coleta ativa * Erva Asteraceae Wunderlichia mirabilis Riedel ex Baker Coleta ativa * Árvore Balanophoraceae Langsdorffia hypogaea Mart. Species link * Parasita Erva parasita Begoniaceae Begonia sp. Coleta ativa Ornamental Erva Bignoniaceae Handroanthus ochraceus (Cham.) Mattos Coleta ativa Madeira Árvore Bignoniaceae Handroanthus serratifolius (Vahl) S. O.. Grose Coleta ativa Madeira Árvore Bignoniaceae Tabebuia alba (Cham.) Sandwith Coleta ativa * Protegida pela lei estadual Protegida pela lei estadual Protegida pela lei estadual Madeira Árvore Bignoniaceae Zeyheria montana Mart. Species link * Pioneira Arbusto Bixaceae Cochlospermum regium (Mart. et Schr.) Pilger, Coleta ativa * Pioneira Arbusto Blechnaceae Blechnum sp. Coleta ativa * Indicadora Erva Coleta ativa * Coleta ativa * Boraginaceae Euploca salicoides Boraginaceae Varronia sp. Erva Frutos para fauna Arbusto 115 Plano de Manejo UC Serra das Areias (Cham.) J.I.Melo & Semir Cont. Família Botânica Nome Científico Autor Origem dos Dados Status de Conservação Importância Habito Bromeliaceae Aechmea bromeliifolia (Rudge) Baker Coleta ativa * Ornamental Bromélioide Bromeliaceae Bromelia goyazensis Mez Coleta ativa Endêmica Ornamental Bromélioide Bromeliaceae Dyckia sp.1 Species link * Ornamental Bromélioide Bromeliaceae Dyckia sp.2 Coleta ativa * Ornamental Bromélioide Cactaceae Coleta ativa * Callophylaceae Hueria speciosa Cardiopetalum calophyllum Schltdl. Coleta ativa Cariocaraceae Caryocar brasiliense Cambess Coleta ativa * Protegida pela lei federal Caryophyllaceae Polycarpaea corymbosa (L.) Lam. Species link * Celastraceae Plenckia populnea Reissek Coleta ativa * Celastraceae Salacia crassifolia Salacia sp. (Mart.) Peyr Celastraceae Chrysobalanaceae Cacto Madeira Árvore Frutos para consumo humano Árvore Erva Pioneira Árvore Coleta ativa * Frutos para fauna Árvore Coleta ativa * Frutos para fauna Árvore Hirtella sp. Coleta ativa * Frutos para fauna Árvore Clusiaceae Clusia sp. Coleta ativa * Indicadora Árvore Clusiaceae Kielmeyera coriacea Mart. Coleta ativa * Madeira Árvore Clusiaceae Kielmeyera rubriflora Camb. Coleta ativa * Clusiaceae Coleta ativa * Madeira Árvore Clusiaceae Kielmeyera sp. Kielmeyera speciosa A. St.-Hil. Coleta ativa * Madeira Árvore Combretaceae Terminalia brasiliensis (Cambess.) Eichler Coleta ativa * Madeira Árvore Combretaceae Terminalia sp. Coleta ativa * Madeira Árvore Connaraceae Connarus sp. Coleta ativa * Madeira Árvore Connaraceae Connarus suberosus Coleta ativa * Madeira Árvore 116 Plano de Manejo UC Serra das Areias Planch. Árvore Cont. Família Botânica Nome Científico Autor Origem dos Dados Status de Conservação Importância Habito Coleta ativa * Ornamental Erva trepadeira Convolvulaceae Ipomoea sp. Convolvulaceae Ipomoea squamisepala O'Donell Coleta ativa * Ornamental Erva trepadeira Convolvulaceae Jacquemontia gracillima (Choisy) Hallier f. Species link * Ornamental Erva trepadeira Cucurbitaceae Cayaponia espelina Coleta ativa * Frutos para fauna Erva trepadeira Cucurbitaceae Melothria campestris (Silva Manso) Cogn. (Naudin) H. Schaef. & S.S.Renner Coleta ativa * Frutos para fauna Erva trepadeira Cunoniaceae Lamanonia ternata Vell. Coleta ativa * Pioneira Árvore Cyperaceae Bulbostylis sp. Species link * Pirofiticas Erva Cyperaceae Eleocharis squamata Boeckeler Species link * Indicadora Erva aquática Dilleniaceae Curatella americana L. Coleta ativa * Frutos para fana Árvore Dilleniaceae Davilla flexuosa A.St.-Hil. Species link * Frutos para fauna Arbusto Dilleniaceae Davilla elliptica A.St.-Hil. Coleta ativa * Frutos para fauna Arbusto Dioscoriaceae Dioscorea cf. orthogoneura Coleta ativa * Borda Erva trepadeira Dioscoriaceae Dioscorea sp. Coleta ativa * Borda Erva trepadeira Droseraceae Drosera sp. Coleta ativa * Indicadora Erva Ebenaceae Diospyros sp. Coleta ativa * Frutos para fauna Árvore Eriocaulaceae Paepalanthus chiquitensis Species link * Indicadora Erva Eriocaulaceae Syngonanthus cf. sp. Coleta ativa * Indicadora Erva Erythroxylaceae Erythroxylum campestre Species link * Frutos para fauna Árvore Erythroxylaceae Erythroxylum sp.1 Coleta ativa Frutos para fauna Árvore Erythroxylaceae Erythroxylum suberosum Coleta ativa * * Frutos para fauna Árvore Coleta ativa * Frutos para fauna Árvore Erythroxylaceae Erythroxylum tortuosum A. St.-Hil. A. St.-Hil. Mart. 117 Plano de Manejo UC Serra das Areias Herzog Cont. Família Botânica Euphorbiaceae Euphorbiaceae Euphorbiaceae Euphorbiaceae Euphorbiaceae Euphorbiaceae Euphorbiaceae Euphorbiaceae Fabaceae Fabaceae Fabaceae Fabaceae Nome Científico Chamaesyce sp. Croton chaetocalyx Croton grewioides Euphorbia lycioides Manihot tripartita Maprounea guianensis Microstachys corniculata Microstachys hispida Acosmium dasycarpum Aeschynomene histrix var. histrix Aeschynomene paniculata Aeschynomene sp. Fabaceae Anadenanthera peregrina Fabaceae Andira sp. Andira paniculata Fabaceae Fabaceae Fabaceae Baill. Boiss. Müll. Arg. Aublet (Vahl) Griseb. (Mart.) Govaerts Acosmium sp. Fabaceae Fabaceae Mull.Arg. Pterodon sp. Fabaceae Fabaceae Autor Apuleia leiocarpa (Vogel) Yakovlev Poir Willd. Ex Vogel (L.) Speng Benth. (Vogel) J.F.Macbr. Bauhinia sp. Bionia sp. Calliandra calycina Coleta ativa * Arbusto Species link * Arbusto Species link * Erva Species link * Arbusto Coleta ativa * Coleta ativa * Arbusto Coleta ativa * Arbusto Coleta ativa * Madeira Árvore Coleta ativa * Madeira Árvore Coleta ativa * Madeira Árvore Coleta ativa * Pioneira Arbusto Coleta ativa * Pioneira Arbusto Coleta ativa * Pioneira Arbusto Coleta ativa Madeira Árvore Coleta ativa Protegida pela lei estadual * Madeira Árvore Coleta ativa * Madeira Árvore Coleta ativa * Madeira Árvore Species link * Pioneira Arbusto Coleta ativa * Species link * Importância Habito Arbusto Frutos para fauna Árvore Erva trepadeira Pioneira Arbusto 118 Plano de Manejo UC Serra das Areias Benth Species link Status de Conservação * Origem dos Dados Cont. Família Botânica Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Nome Científico Centrosema angustifolium Chamaecrista blanchetii Chamaecrista diphylla Chamaecrista flexuosa Chamaecrista neesiana Chamaecrista setosa Fabaceae Chamaecrista sp. Fabaceae Copaifera langsdorffii Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Crotalaria retusa Crotalaria sp. Dimorphandra mollis Galactia eriosematoides Galactia lamprophylla Galactia peduncularis Harpalyce brasiliana Hymenaea courbaril. Hymenaea stignocarpa Indigofera bongardiana Inga alata Inga sp. (Kunth) Benth (Benth.) Conc. (L.) Greene (L.) Greene (Mart. ex Benth.) HS Irwin & Barneby (Vogel) H.S. Irwin & Barneby Desf. L. Benth. Harms Harms (Benth.) Taub. Benth L. L. (Kuntze) Burkart Benoist Species link Status de Conservação * Ornamental Arbusto Species link * Pioneira Arbusto Coleta ativa * Pioneira Arbusto Coleta ativa * Pioneira Arbusto Pioneira Arbusto Origem dos Dados Importância Habito * Coleta ativa * Coleta ativa Pioneira Arbusto Coleta ativa * Pioneira Arbusto Coleta ativa * Medicinal Árvore Coleta ativa * Pioneira Arbusto Species link * Pioneira Arbusto Coleta ativa * Medicinal Árvore Species link * Pioneira Arbusto Species link * Pioneira Arbusto Coleta ativa * Pioneira Arbusto Coleta ativa * Pioneira Arbusto Coleta ativa * Frutos para consumo humano Árvore Coleta ativa * Frutos para consumo humano Árvore Coleta ativa * Pioneira Arbusto Coleta ativa * Frutos para consumo humano Árvore Coleta ativa * Frutos para consumo humano Árvore 119 Plano de Manejo UC Serra das Areias Autor Cont. Família Botânica Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Fabaceae Nome Científico Mimosa ursina Periandra coccinea Plathymenia reticulata Plathymenia sp. Pterodon sp. Pterodon emarginatus Senna rugosa Stryphodendron adstringens Autor Mart. (Schrad.) Benth Benth. Vogel (G. Don) H. S. Irwin & Barneby (Mart.) Coville. Species link Status de Conservação * Pioneira Arbusto Coleta ativa * Pioneira Arbusto Coleta ativa * Madeira Árvore Coleta ativa * Madeira Árvore Coleta ativa * Madeira Árvore Coleta ativa * Madeira Árvore Origem dos Dados Importância Habito * Coleta ativa Pioneira Arbusto Coleta ativa * Medicinal Árvore Coleta ativa Madeira Árvore Fabaceae Tachigali sp. Tachigali vulgaris * Gomes da Silva & Lima Coleta ativa * Madeira Árvore Fabaceae Zanthoxylum rhoifolium Lam Coleta ativa * Madeira Árvore Species link * Pioneira Erva Coleta ativa * Pioneira Árvore Coleta ativa * Ornamental Erva Species link * Erva Coleta ativa * Erva Species link * Erva Coleta ativa * Ornamental Erva Coleta ativa * Ornamental Erva Ornamental Erva Fabaceae Fabaceae Flacourtiaceae Gentianaceae Gentianaceae Gentianaceae Gentianaceae Iridaceae Iridaceae Iridaceae Zornia villosa Casearia sylvestris Calolisianthus speciosus Deianira chiquitana (Malme) Herter Sw. Gilg Herzog Deianira sp. Schultesia sp. Cipura paludosa Cipura xanthomelas Trimezia juncifolia Mart. ex Klatt (Klatt.) Benth. & Hook. f. * Coleta ativa 120 Plano de Manejo UC Serra das Areias Aubl. Cont. Família Botânica Iridaceae Lamiaceae Lamiaceae Lamiaceae Lauraceae Lauraceae Lauraceae Lauraceae Loranthaceae Lycopodiaceae Lythraceae Lythraceae Nome Científico Autor Trimezia sp. Hypenia sp. Hyptis lanata Pohl ex Benth Lippia sp. Nectandra cuspidata Nees & Mart. Nectandra sp. Ocotea odorifera Persea willdenovii Psittacanthus dichrous Lycopodiella caroliniana Diplusodon hirsutus Lafoensia pacari (Vell.) Rohwer Kosterm Mart. (L.) Pic. Serm. (Cham. & Schltdl.) DC. A. St.-Hil. Coleta ativa Status de Conservação * Ornamental Erva Coleta ativa * Medicinal Erva Species link * Medicinal Erva Species link * Medicinal Erva Coleta ativa * Madeira Árvore Coleta ativa * Madeira Árvore Species link * Madeira Árvore Species link * Madeira Árvore Species link * Parasita Erva parasita Species link * Indicadora Erva Species link * Ornamental Arbusto Coleta ativa * Madeira Árvore Origem dos Dados Importância Habito Malpighiaceae Banisteriopsis megaphylla (A. Juss.) B. Gates Coleta ativa * Ornamental Erva trepadeira Malpighiaceae Byrsonima coccolobifolia Kunth Coleta ativa * Frutos para consumo humano Árvore Coleta ativa * Frutos para fauna Arbusto Coleta ativa * Frutos para consumo humano Árvore Frutos para consumo humano Árvore Malpighiaceae Malpighiaceae Byrsonima sp. Byrsonima verbascifolia Rich. Ex. Juss. Malpighiaceae Byrsonima pachyphylla A.Juss. Coleta ativa * Malpighiaceae Camarea hirsuta A.St. Hil Coleta ativa Malpighiaceae Heteropterys byrsonimifolia A. Juss Coleta ativa Vulnerável - VU * Erva trepadeira Coleta ativa * Erva trepadeira Species link * Erva trepadeira Malpighiaceae Malpighiaceae Heteropterys campestris Lepidaploa rufogrisea (A. St.-Hil.) H.Rob. 121 Plano de Manejo UC Serra das Areias A.Juss. Árvore Cont. Família Botânica Malpighiaceae Malvaceae Malvaceae Malvaceae Malvaceae Malvaceae Malvaceae Malvaceae Malvaceae Nome Científico Pterandra pyroidea Eriotheca gracilipes Eriotheca pubescens Autor A. Juss (K. Schum.) A. Robyns (Mart. & Zucc.) Schott & Endl Eriotheca sp. Helicteres brevispira Luhea grandiflora A.St.-Hil. Mart. Luhea sp. Pavonia grandiflora A.St.-Hil. Peltaea sp. Species link Status de Conservação * Coleta ativa * Origem dos Dados Coleta ativa Ornamental Arbusto Coleta ativa Madeira Árvore Coleta ativa * Madeira Árvore Coleta ativa * Ornamental Arbusto Species link * Ornamental Arbusto Ornamental Coleta ativa * Malvaceae Triumfetta sp. Coleta ativa * Melastomataceae Melastomataceae Melastomataceae Melastomataceae Melastomataceae Melastomataceae Clidemia hirta (Kunth) DC. (L.) D. Don. Clidemia sp. Miconia albicans Miconia ferruginata Miconia nervosa Microstachys sp. DC. Triana Árvore Arbusto Arbusto Invasora Arbusto * Coleta ativa Ornamental Arbusto Coleta ativa * Ornamental Arbusto Coleta ativa * Indicadora Arbusto Coleta ativa * Indicadora Arbusto Coleta ativa * Indicadora Arbusto Coleta ativa * Indicadora Árvore Species link * Indicadora Arbusto Species link * Arbusto 122 Plano de Manejo UC Serra das Areias (Sw.) Steud. Árvore * Coleta ativa Cambessedesia cf. hilariana Ornamental Coleta ativa Sida sp. Melastomataceae Árvore * Sida linifolia Cambessedesia cf. espora Ornamental Coleta ativa Malvaceae Melastomataceae Arbusto * Malvaceae (A.St.-Hil. ex Bonpl.) DC. Habito * * Juss. ex Cav. Importância Cont. Família Botânica Melastomataceae Melastomataceae Menispermaceae Moraceae Moraceae Myristicaceae Myrtaceae Myrtaceae Myrtaceae Myrtaceae Myrtaceae Nome Científico Pterolepis perpusilla Autor (Naudin) Cogn. Tibouchina sp. Cissampelos ovalifolia Brosimum gaudichaudii DC. Trecul Ficus sp. Virola sebifera Blepharocalyx salicifolius Aubl. (Kunth) O.Berg. Campomanesia sp. Eugenia klotzschiana Psidium myrsinoides Berg, O.Berg Psidium sp. Coleta ativa Status de Conservação * Indicadora Arbusto Coleta ativa * Ornamental Árvore Species link * Frutos para fauna Arbusto Coleta ativa * Frutos para consumo humano Árvore Coleta ativa * Frutos para fauna Árvore Coleta ativa * Pioneira Árvore Coleta ativa * Frutos para fauna Árvore Coleta ativa * Frutos para consumo humano Arbusto Coleta ativa * Frutos para consumo humano Arbusto Coleta ativa * Frutos para fauna Árvore Coleta ativa * Frutos para fauna Árvore Árvore Origem dos Dados Importância Habito Coleta ativa Nyctaginaceae Guapira sp. Guapira noxia * (Netto) Lundell Coleta ativa * Árvore Nyctaginaceae Neea theifera Oerst. Coleta ativa * Árvore Coleta ativa * Árvore Coleta ativa * Árvore Coleta ativa * Árvore Coleta ativa * Árvore Species link * Epifita Species link * Ornamental Epifita Species link * Ornamental Epifita Nyctaginaceae Ochnaceae Ochnaceae Ochnaceae Ochnaceae Orchidaceae Orchidaceae Orchidaceae Ouratea sp. Ouratea spectabilis Ouratea hexasperma Engl. (A. St.-Hil.) Baill. Ouratea sp. Galeandra junceoides Habenaria edwallii Habenaria rodeiensis Cogn Barb. Rodr. 123 Plano de Manejo UC Serra das Areias Barb.Rodr. Cont. Família Botânica Orchidaceae Orchidaceae Orobanchaceae Oxalidaceae Oxalidaceae Phyllanthaceae Piperaceae Poaceae Poaceae Polygalaceae Polygalaceae Polygalaceae Nome Científico Autor Habenaria sp. Koellensteinia tricolor (Lindl.) Rchb. f. Buchnera sp. Oxalis densifolia Mart. Oxalis sp. Phyllanthus orbiculatus Rich. Piper sp. Axonopus sp. Urochloa decumbens Polygala longicaulis Polygala minima Polygala monosperma (Stapf.) Webster Kunth (Chodat) Marques A.W. Benn. Coleta ativa Status de Conservação * Species link * Coleta ativa * Erva Coleta ativa * Arbusto Coleta ativa * Arbusto Species link * Coleta ativa * Arbusto Species link * Erva Coleta ativa * Species link * Erva Species link * Erva Species link * Erva Erva Origem dos Dados Importância Habito Ornamental Epifita Ornamental Epifita Medicinal Invasora Erva Erva Polygalaceae Polygala rhodoptera Mart. ex A.W. Benn Species link * Polygalaceae Polygala tenuis DC. Coleta ativa * Erva Species link * Erva Coleta ativa * Árvore Species link * Árvore Coleta ativa * Species link * Erva Species link * Arbusto Species link * Polygalaceae Proteaceae Rhamnaceae Rubiaceae Rubiaceae Rubiaceae Rubiaceae Polygala violacea Roupala montana Colubrina glandulosa Alibertia edulis Aublet Aubl. Reitzii L. Rich Borreria sp. Chomelia ribesioides Coccocypselum lanceolatum (Ruiz & Pav.) Pers. Frutos para fauna Árvore Erva 124 Plano de Manejo UC Serra das Areias Benth. ex A.Gray Frutos para fauna Cont. Família Botânica Rubiaceae Rubiaceae Rubiaceae Rubiaceae Rubiaceae Rubiaceae Rubiaceae Rubiaceae Rubiaceae Rubiaceae Rubiaceae Rubiaceae Rubiaceae Rubiaceae Sapindaceae Sapindaceae Sapotaceae Sapotaceae Sapotaceae Simaroubaceae Simaroubaceae Nome Científico Autor Coccocypselum sp. Diodella cf. apiculata Galianthe grandifolia Himatanthus obovatus Mitracarpus hirtus Palicourea coriacea Palicourea rigida Psychotria prunifolia (Willd.) Delprete E. L. Cabral (Müll.Arg.) Woodson (Linnaeus) Candolle (Cham.) K. Schum Kunth (Kunth) Steyerm Psychotria sp. Sabicea brasiliensis Wernham Spermacoce sp. Spermacoce tenella Tocoyena formosa Kunth (Cham. & Schltdl.) K. Schum. Tocoyena sp. Cupania sp. Serjania velutina Pouteria ramiflora Cambess Radlk Pouteria sp. Pouteria torta (Mart.) Radlk. Simarouba sp. Simarouba versicolor Coleta ativa * Erva Species link * Arbusto Coleta ativa * Species link * Coleta ativa * Ornamental Arbusto Coleta ativa * Ornamental Árvore Species link * Arbusto Coleta ativa * Arbusto Coleta ativa * Arbusto Coleta ativa * Erva Species link * Erva Importância Habito Frutos para fauna Erva Madeira Árvore Erva * Coleta ativa Frutos para fauna Árvore Coleta ativa * Frutos para fauna Árvore Coleta ativa * Madeira Árvore Species link * Borda Erva trepadeira Coleta ativa * Frutos para fauna Árvore Coleta ativa * Frutos para fauna Árvore Coleta ativa * Frutos para fauna Árvore Coleta ativa * Madeira Árvore Coleta ativa * Madeira Árvore 125 Plano de Manejo UC Serra das Areias A. St.-Hill. Coleta ativa Status de Conservação * Origem dos Dados Cont. Família Botânica Siparunaceae Solanaceae Solanaceae Solanaceae Styracaceae Styracaceae Turneraceae Ulmaceae Velloziaceae Velloziaceae Verbenaceae Vitaceae Nome Científico Siparuna guianensis Solanum grandiflorum Solanum thomasiifolium Styrax ferruginea Styrax pohlii Trema micrantha Cissus erosa Qualea multiflora Xyridaceae A. DC. (L.) Blume Aegiphila sp. Vochysiaceae Vochysiaceae Nees & Mart Vellozia sp. Qualea sp. Vochysiaceae Sendtner Barbacenia sp. Qualea grandiflora Vochysiaceae Ruiz & Pav. Turnera sp. Vochysiaceae Vochysiaceae Aublet Solanum sp. Vochysiaceae Vochysiaceae Autor Qualea parviflora Salvertia convallariodora Vochysia haenkeana Vochysia rufa Vochysia sp. Xyris sp. Mart. Mart. Mart. A. St.-Hi Mart. Mart. Madeira Árvore Coleta ativa * Frutos para fauna Árvore Coleta ativa * Frutos para fauna Arbusto Species link * Frutos para fauna Arbusto Coleta ativa * Árvore Coleta ativa * Árvore Coleta ativa * Erva Coleta ativa * Árvore Species link * Arbusto Coleta ativa * Ornamental Arbusto Coleta ativa * Frutos para fauna Árvore Coleta ativa * Frutos para fauna Erva trepadeiro Coleta ativa * Madeira Árvore Coleta ativa * Madeira Árvore Coleta ativa * Madeira Árvore Coleta ativa * Madeira Árvore Coleta ativa * Árvore Coleta ativa * Árvore Coleta ativa * Árvore Coleta ativa * Arbusto Species link * Importância Habito Indicadora Erva 126 Plano de Manejo UC Serra das Areias Rich Coleta ativa Status de Conservação * Origem dos Dados Figura 54: Exemplares da flora da Unidade de Conservação Serra das Areias: A. Wunderlichia mirabilis; B. Palicourea rígida; C. Palicourea coreacea; D. Mandevilla sp.; E. Indigofera sp.; F. Hirtella sp.; G. Helicteres brevispira; H. Galactia peduncularis; I. Caryocar brasiliense; J. Bromelia goyazense; K. Aldama sp.; L. Agyphylla sp.. Fonte: Mattos e Clímaco Ltda, 2014 Plano de Manejo UC Serra das Areias 127 Figura 55: Exemplares da flora na Unidade de Conservação Serra das Areias: A. Diplusodon sp.; B. Banisteriopsis megaphylla; C. Harpalyce brasiliana; D. Oxalis densifolia; E. Convolvulaceae sp.; F. Chamaecrista neesiana; G. Aspilia foliacea; H. Kielmeyera rubriflora; I. Trimezia juncifolia. Fonte: Mattos e Clímaco Ltda, 2014 Figura 56: Exemplares da flora na Unidade de Conservação Serra das Areias: A. Davilla flexuosa; B. Bionia sp.; Cambessedesia cf. hilariana; D. Pavonia grandiflora; E. Ipomoea squamisepala; F. Dyckia sp.; G. Camarea hirsuta; H. Lessingianthus onopordioides; I. Odontadenia lutea; J. Polygala tenuis. Fonte: Mattos e Clímaco Ltda, 2014 Plano de Manejo UC Serra das Areias 128 A diversidade de espécies registradas na Unidade de Conservação Serra das Areias é bem elevada quando comparada a outras unidades de conservação de Goiás e Distrito Federal (Tabela 22). Uma riqueza maior do que na Unidade de Conservação Serra das Areias só foi registrada no Parque Nacional da Chapada dos Veadeiros (412 spp.), Estação Ecológica de Água Emendadas (351 spp.) e APA de Cafuringa (319 spp.), todas com área total superior a 10 mil hectares. Algumas unidades também bem maiores do que a Serra das Areias, como Parque Nacional de Brasília (46.230 ha), Parque Estadual da Serra de Caldas Novas (12.315 ha) e Parque Estadual de Serra Dourada (30.000 ha) tiveram riqueza de plantas bem inferior com 236, 214 e 94 espécies, respectivamente. Embora o esforço amostral e as metodologias empregadas nos diferentes levantamentos florísticos tenham sido diferentes, esses resultados elucidam que a Serra das Areias é uma importante unidade de conservação da diversidade florística do bioma Cerrado. Tabela 22: Comparação da riqueza de espécies vegetais entre diferentes unidades de conservação municipais, estaduais e federais de Goiás e Distrito Federal. Unidade de Conservação Município Área (ha) Riqueza Referência Unidade de Conservação Serra das Areias Aparecida de Goiânia 2.800 290 Este estudo Parque Estadual da Serra de Caldas Novas Caldas Novas 12.315 214 Junqueira (2011) Floresta Nacional de Silvânia Silvânia 466 244 Francener et al. (2012) Parque Estadual de Serra Dourada Goiás 30.000 94 Miranda et al. (2007) Parque Nacional da Chapada dos Veadeiros Alto Paraíso 65.514 412 Felfili et al. (2007a) Parque Nacional das Emas Mineiros 13.294 95 Jardim Botânico de Brasília Brasília 5.000 223 Batalha & Martins (2002) Chacon et al. (2009) Reserva Ecológica do IBGE Brasília 1.300 288 Pereira et al. (2002) Estação Ecológica de Água Emendadas Brasília 10.000 351 Felfili et al.(2007b) APA de Cafuringa Brasília 46.510 319 SEMAHA (2005) Parque Nacional de Brasília Brasília 46.230 236 Santos (2008) 3.7.3 Estrutura da vegetação Ao longo das 50 parcelas de amostragem fitossociológica foram registrados 841 árvores pertencentes a 112 espécies e 44 famílias (Tabela 23). A família Fabaceae foi a que teve a maior riqueza com 19 espécies e o maior número de indivíduos registrados com 89 Plano de Manejo UC Serra das Areias 129 (Figura 57). A segunda família mais importante foi Vochysiaceae com sete espécies e 89 indivíduos registradas. Em terceiro lugar esteve Malpighiaceae que teve seis espécies e 64 indivíduos registrados. Tabela 23: Parâmetros fitossociológicos das espécies arbóreas registradas na Unidade de Conservação Serra das Areias. Espécie N U AB DA DR FA FR DoA DoR VC VC (%) VI VI (%) Morta 86 37 0,73 172 10,23 74 7,28 1,45 10,45 20,68 10,34 27,96 9,32 Miconia ferruginata 92 22 0,78 184 10,94 44 4,33 1,57 11,29 22,23 11,11 26,56 8,85 Qualea parviflora 50 22 0,42 100 5,95 44 4,33 6,04 5,99 16,32 5,44 0,84 11,99 Byrsonima pachyphylla 47 24 0,18 94 5,59 48 4,72 0,35 2,53 8,12 4,06 12,84 4,28 Psidium myrsinoides 30 21 0,14 60 3,57 42 4,13 0,28 2,04 5,61 2,80 9,74 3,25 Indeterminada 21 12 0,17 42 2,5 24 2,36 0,34 2,44 4,94 2,47 7,30 2,43 Salacia crassifolia 24 11 0,12 48 2,85 22 2,17 0,23 1,68 4,54 2,27 6,70 2,23 Ouratea hexasperma 20 11 0,14 40 2,38 22 2,17 0,28 1,98 4,36 2,18 6,52 2,17 Davilla sp. 20 15 0,06 40 2,38 30 2,95 0,13 0,92 3,30 1,65 6,25 2,08 Miconia albicans 16 11 0,13 32 1,9 22 2,17 0,27 1,93 3,83 1,92 6,00 2,00 Luehea grandiflora 8 4 0,28 16 0,95 8 0,79 0,57 4,08 5,03 2,52 5,82 1,94 Xylopia aromatica 22 8 0,09 44 2,62 16 1,57 0,18 1,27 3,89 1,94 5,46 1,82 Fabaceae 6 6 0,19 12 0,71 12 1,18 0,38 2,74 3,46 1,73 4,64 1,55 Pterodon emarginatus 14 6 0,11 28 1,66 12 1,18 0,22 1,60 3,26 1,63 4,44 1,48 Acosmium sp. 12 10 0,07 24 1,43 20 1,97 0,14 1,00 2,42 1,21 4,39 1,46 Hymenaea stigonocarpa 14 7 0,08 28 1,66 14 1,38 0,17 1,20 2,86 1,43 4,24 1,41 Caryocar brasiliense 8 8 0,11 16 0,95 16 1,57 0,22 1,61 2,56 1,28 4,13 1,38 Anacardium sp. 9 8 0,09 18 1,07 16 1,57 0,18 1,31 2,38 1,19 3,96 1,32 Qualea grandiflora 10 8 0,08 20 1,19 16 1,57 0,17 1,18 2,37 1,19 3,95 1,32 Tachigali vulgaris 7 3 0,17 14 0,83 6 0,59 0,34 2,45 3,28 1,64 3,87 1,29 Copaifera langsdorffii 3 2 0,20 6 0,36 4 0,39 0,41 2,94 3,29 1,65 3,69 1,23 Davilla eliptica 10 7 0,08 20 1,19 14 1,38 0,15 1,08 2,27 1,13 3,65 1,22 Qualea multiflora 10 9 0,04 20 1,19 18 1,77 0,08 0,59 1,78 0,89 3,55 1,18 Piptocarpa rotundifolia 10 8 0,05 20 1,19 16 1,57 0,10 0,75 1,94 0,97 3,51 1,17 Nectandra cuspidata 5 4 0,13 10 0,59 8 0,79 0,27 1,92 2,51 1,25 3,30 1,10 Heteropteryx byrsonimifolia 10 7 0,05 20 1,19 14 1,38 0,10 0,73 1,92 0,96 3,30 1,10 Vochysia rufa 11 6 0,05 22 1,31 12 1,18 0,11 0,76 2,07 1,04 3,25 1,08 Aspidosperma macrocarpum 7 7 0,06 14 0,83 14 1,38 0,13 0,90 1,73 0,87 3,11 1,04 Pterodon sp. 7 7 0,05 14 0,83 14 1,38 0,11 0,78 1,61 0,81 2,99 1,00 Kielmeyera sp. 8 6 0,06 16 0,95 12 1,18 0,11 0,81 1,77 0,88 2,95 0,98 Lafoensia pacari 6 6 0,06 12 0,71 12 1,18 0,12 0,86 1,57 0,79 2,75 0,92 Alibertia edulis 7 6 0,05 14 0,83 12 1,18 0,10 0,73 1,57 0,78 2,75 0,92 Campomonesia sp. 8 5 0,06 16 0,95 10 0,98 0,11 0,81 1,76 0,88 2,74 0,91 Cardiopetalum calophyllum 12 3 0,05 24 1,43 6 0,59 0,10 0,68 2,11 1,05 2,70 0,90 Plano de Manejo UC Serra das Areias 130 Cont. Espécie N U AB DA DR FA FR DoA DoR VC VC (%) VI VI (%) Schefflera macrocarpa 6 4 0,08 12 0,71 8 0,79 0,16 1,17 1,88 0,94 2,67 0,89 Anadenanthera peregrina 1 1 0,15 2 0,12 2 0,20 0,30 2,15 2,27 1,13 2,47 0,82 Kielmeyera coriacea 9 4 0,04 18 1,07 8 0,79 0,08 0,61 1,68 0,84 2,46 0,82 Aspidosperma sp. 6 4 0,07 12 0,71 8 0,79 0,13 0,95 1,66 0,83 2,45 0,82 Annona crassiflora 4 3 0,09 8 0,48 6 0,59 0,18 1,29 1,76 0,88 2,36 0,78 Salvertia convallariodora 5 5 0,05 10 0,59 10 0,98 0,10 0,70 1,30 0,65 2,28 0,76 Pouteria ramiflora 4 2 0,08 8 0,48 4 0,39 0,17 1,19 1,66 0,83 2,06 0,69 Emmotum nitens 5 3 0,04 10 0,59 6 0,59 0,08 0,58 1,18 0,59 1,77 0,59 Ouratea sp. 6 3 0,03 12 0,71 6 0,59 0,06 0,45 1,17 0,58 1,76 0,59 Virola sebifera 5 4 0,02 10 0,59 8 0,79 0,04 0,30 0,89 0,45 1,68 0,56 Rubiaceae 4 4 0,02 8 0,48 8 0,79 0,05 0,33 0,80 0,40 1,59 0,53 Handroanthus ochraceus 5 3 0,03 10 0,59 6 0,59 0,05 0,37 0,96 0,48 1,55 0,52 Tachigali sp. 3 3 0,04 6 0,36 6 0,59 0,08 0,59 0,94 0,47 1,53 0,51 Acosmium dasycarpum 3 3 0,04 6 0,36 6 0,59 0,08 0,59 0,94 0,47 1,53 0,51 Aspidosperma tomentosa 4 4 0,02 8 0,48 8 0,79 0,04 0,25 0,73 0,36 1,51 0,50 Hymenaea courbaril 5 3 0,02 10 0,59 6 0,59 0,04 0,32 0,91 0,46 1,50 0,50 Byrsonima coccolobifolia 4 4 0,02 8 0,48 8 0,79 0,03 0,21 0,69 0,34 1,48 0,49 Anacardium humile 4 3 0,03 8 0,48 6 0,59 0,05 0,39 0,86 0,43 1,46 0,48 Nectandra sp. 4 2 0,04 8 0,48 4 0,39 0,08 0,57 1,05 0,52 1,44 0,48 Guapira sp. 3 3 0,03 6 0,36 6 0,59 0,07 0,47 0,83 0,41 1,42 0,47 Stryphodendron adstringens 3 2 0,04 6 0,36 4 0,39 0,09 0,61 0,97 0,48 1,36 0,45 Maprounea guianensis 4 2 0,03 8 0,48 4 0,39 0,05 0,38 0,86 0,43 1,25 0,42 Alibertia sp. 3 3 0,02 6 0,36 6 0,59 0,04 0,30 0,66 0,33 1,25 0,42 Roupala montana 3 3 0,02 6 0,36 6 0,59 0,04 0,29 0,65 0,32 1,24 0,41 Aspidosperma filamentosa 4 2 0,02 8 0,48 4 0,39 0,05 0,35 0,83 0,41 1,22 0,41 Kielmeyera speciosa 4 3 0,01 8 0,48 6 0,59 0,02 0,15 0,63 0,31 1,22 0,41 Dimorphandra mollis 3 3 0,02 6 0,36 6 0,59 0,03 0,23 0,59 0,30 1,18 0,39 Eriotheca pubescens 2 2 0,04 4 0,24 4 0,39 0,07 0,53 0,77 0,38 1,16 0,39 Styrax ferruginea 3 3 0,01 6 0,36 6 0,59 0,03 0,18 0,54 0,27 1,13 0,38 Ouratea spectabilis 3 3 0,01 6 0,36 6 0,59 0,02 0,15 0,51 0,25 1,10 0,37 Tapirira guianensis 4 2 0,02 8 0,48 4 0,39 0,03 0,22 0,70 0,35 1,09 0,36 Neea theifera 3 2 0,02 6 0,36 4 0,39 0,04 0,32 0,68 0,34 1,07 0,36 Myrtaceae 2 2 0,03 4 0,24 4 0,39 0,06 0,43 0,67 0,34 1,07 0,36 Platymenia reticulata 3 2 0,02 6 0,36 4 0,39 0,04 0,30 0,66 0,33 1,05 0,35 Eriotheca gracilipes 2 2 0,03 4 0,24 4 0,39 0,06 0,40 0,64 0,32 1,03 0,34 Hancornia speciosa 3 2 0,02 6 0,36 4 0,39 0,03 0,21 0,57 0,29 0,96 0,32 Handroanthus serratifolius 3 2 0,02 6 0,36 4 0,39 0,03 0,21 0,57 0,28 0,96 0,32 Apuleia leiocarpa 1 1 0,05 2 0,12 2 0,20 0,09 0,64 0,76 0,38 0,96 0,32 Diospyros sp. 3 2 0,01 6 0,36 4 0,39 0,03 0,20 0,55 0,28 0,95 0,32 Guapira noxia 2 2 0,02 4 0,24 4 0,39 0,04 0,31 0,54 0,27 0,94 0,31 Plano de Manejo UC Serra das Areias 131 Cont. Espécie N U AB DA DR FA FR DoA DoR VC VC (%) VI VI (%) Eremanthus erythropappus 2 2 0,02 4 0,24 4 0,39 0,04 0,29 0,53 0,26 0,92 0,31 Siparuna sp. 2 2 0,02 4 0,24 4 0,39 0,04 0,25 0,49 0,25 0,89 0,29 Curatela americana 2 2 0,02 4 0,24 4 0,39 0,03 0,24 0,48 0,24 0,87 0,29 Schefflera vinosa 2 2 0,02 4 0,24 4 0,39 0,03 0,23 0,47 0,24 0,87 0,29 Terminalia brasiliensis 1 1 0,04 2 0,12 2 0,20 0,07 0,51 0,63 0,32 0,83 0,28 Pouteria torta 2 2 0,01 4 0,24 4 0,39 0,03 0,19 0,42 0,21 0,82 0,27 Vochysia sp. 2 2 0,01 4 0,24 4 0,39 0,02 0,14 0,38 0,19 0,77 0,26 Xylopia sp. 2 2 0,01 4 0,24 4 0,39 0,02 0,12 0,35 0,18 0,75 0,25 Plenckia populnea 2 2 0,01 4 0,24 4 0,39 0,02 0,11 0,35 0,17 0,74 0,25 Tocoyena formosa 2 2 0,01 4 0,24 4 0,39 0,02 0,11 0,35 0,17 0,74 0,25 Erythroxylum sp. 2 2 0,01 4 0,24 4 0,39 0,01 0,10 0,34 0,17 0,73 0,24 Zanthoxylum rhoifolium 2 2 0,01 4 0,24 4 0,39 0,01 0,10 0,33 0,17 0,73 0,24 Vellozia sp. 2 2 0,01 4 0,24 4 0,39 0,01 0,09 0,33 0,16 0,72 0,24 Palicourea rigida 2 2 0,01 4 0,24 4 0,39 0,01 0,07 0,30 0,15 0,70 0,23 Qualea sp. 1 1 0,02 2 0,12 2 0,20 0,05 0,35 0,47 0,23 0,66 0,22 Tabebuia alba 1 1 0,02 2 0,12 2 0,20 0,05 0,33 0,45 0,23 0,65 0,22 Casearia sylvestris 2 1 0,01 4 0,24 2 0,20 0,02 0,13 0,37 0,19 0,57 0,19 Eriotheca cardiophyllum 1 1 0,02 2 0,12 2 0,20 0,03 0,24 0,36 0,18 0,56 0,19 Simarouba sp. 1 1 0,02 2 0,12 2 0,20 0,03 0,22 0,34 0,17 0,54 0,18 Byrsonima sp.1 1 1 0,01 2 0,12 2 0,20 0,03 0,20 0,32 0,16 0,52 0,17 Styrax pohlii 2 1 0,00 4 0,24 2 0,20 0,01 0,06 0,30 0,15 0,49 0,16 Annona coriacea 1 1 0,01 2 0,12 2 0,20 0,02 0,17 0,28 0,14 0,48 0,16 Byrsonima sp.2 1 1 0,01 2 0,12 2 0,20 0,02 0,15 0,27 0,13 0,46 0,15 Pouteria sp. 1 1 0,01 2 0,12 2 0,20 0,02 0,14 0,26 0,13 0,46 0,15 Psidium sp. 1 1 0,01 2 0,12 2 0,20 0,02 0,13 0,25 0,13 0,45 0,15 Meneia sp. 1 1 0,01 2 0,12 2 0,20 0,02 0,12 0,24 0,12 0,43 0,14 Cosmos sp. 1 1 0,01 2 0,12 2 0,20 0,01 0,10 0,22 0,11 0,41 0,14 Inga sp. 1 1 0,01 2 0,12 2 0,20 0,01 0,10 0,22 0,11 0,41 0,14 Terminalia sp. 1 1 0,01 2 0,12 2 0,20 0,01 0,10 0,22 0,11 0,41 0,14 Himatanthus obovatus 1 1 0,01 2 0,12 2 0,20 0,01 0,09 0,21 0,10 0,41 0,14 Clusia sp. 1 1 0,01 2 0,12 2 0,20 0,01 0,08 0,20 0,10 0,40 0,13 Schefflera morototomi 1 1 0,01 2 0,12 2 0,20 0,01 0,08 0,20 0,10 0,39 0,13 Connarus sp. 1 1 0,01 2 0,12 2 0,20 0,01 0,07 0,19 0,09 0,38 0,13 Hueria speciosa 1 1 0,01 2 0,12 2 0,20 0,01 0,07 0,19 0,09 0,38 0,13 Blepharocalyx salicifolius 1 1 0,00 2 0,12 2 0,20 0,01 0,06 0,18 0,09 0,38 0,13 Byrsonima verbascifolia 1 1 0,00 2 0,12 2 0,20 0,01 0,06 0,18 0,09 0,38 0,13 Andira paniculata 1 1 0,00 2 0,12 2 0,20 0,01 0,06 0,17 0,09 0,37 0,12 Connarus suberosos 1 1 0,00 2 0,12 2 0,20 0,01 0,05 0,17 0,08 0,37 0,12 Inga alata 1 1 0,00 2 0,12 2 0,20 0,01 0,05 0,17 0,08 0,37 0,12 Erythroxylum tortuosum 1 1 0,00 2 0,12 2 0,20 0,01 0,04 0,16 0,08 0,36 0,12 Plano de Manejo UC Serra das Areias 132 Cont. Espécie N U AB DA DR FA FR DoA DoR VC VC (%) VI VI (%) Lamanonia ternata 1 1 0,00 2 0,12 2 0,20 0,01 0,04 0,16 0,08 0,35 0,12 Sapindaceae 1 1 0,00 2 0,12 2 0,20 0,01 0,04 0,16 0,08 0,35 0,12 Trema micrantha 1 1 0,00 2 0,12 2 0,20 0,01 0,04 0,16 0,08 0,35 0,12 Andira sp. 1 1 0,00 2 0,12 2 0,20 0,01 0,03 0,15 0,08 0,35 0,12 Ficus sp. 1 1 0,00 2 0,12 2 0,20 0,01 0,03 0,15 0,08 0,35 0,12 Schefflera sp. 1 1 0,00 2 0,12 2 0,20 0,01 0,03 0,15 0,08 0,35 0,12 Astronium sp. 1 1 0,00 2 0,12 2 0,20 0,00 0,03 0,15 0,07 0,34 0,11 1 1 0,00 2 0,12 2 0,20 0,00 0,03 0,15 0,07 0,34 0,11 841 50 6,95 1682 100 1016 100,0 13,9 100,0 200,0 100,0 300,0 100,0 Cupania sp. TOTAL Legenda: N = número de indivíduos; U = número de parcelas; AB = área basal; DA = densidade absoluta; DR = densidade relativa; FA = frequência absoluta; FR = frequência relativa; DoA = dominância absoluta; DoR = dominância relativa; VC = índice de valor de cobertura; VC (%) = índice de valor de cobertura relativo; VI = índice de valor de importância; VI (%) = índice de valor de importância relativo. Figura 57: Riqueza e abundância das 10 famílias mais representativas na Unidade de Conservação Serra das Areias. Fonte: Mattos e Clímaco Ltda, 2014 As espécies mais representativas foram Miconia ferruginata, Qualea parviflora, Byrsonima pachyphylla e Psidium myrsinoides, conforme mostra seus Índices de Valor de Importância (IVI) que foram 8,8%, 5,4%, 4,2% e 3,2%, respectivamente (Tabela 23). Juntas essas quatro espécies somam 21,8% da importância total da comunidade e representam 26% do total de indivíduos registrados. As árvores mortas em pé também foram bastante representativas na área com IVI de 9,3% e 86 indivíduos registrados. Plano de Manejo UC Serra das Areias 133 A densidade total (DA) para área foi de 1682 indivíduos por hectare (Tabela 23). Levantamentos feitos em outras localidades do Cerrado brasileiro encontraram densidades que variam entre 628 e 1396 indivíduos por hectare (Felfili et al. 2004), mostrando que o valor encontrado para a Serra das Areias é alto. A espécie Miconia ferruginata foi a que apresentou a maior densidade (184), seguida por árvores mortas (172) e Qualea parviflora (100). É importante ressaltar que dentre as espécies mais representativas na comunidade vegetal arbórea da Serra das Areias não são encontradas espécies endêmicas, ameaçadas ou protegidas por lei. A partir dos valores de riqueza e abundância registrados, o índice de diversidade de Shannon calculado para a área foi H’ = 3,97. Já o valor do índice de equitabilidade de Pielou foi J’ = 0,83. A Serra das Areias apresenta um elevado valor do índice de diversidade quando comparado a outros estudos do bioma Cerrado. Por exemplo, em uma comparação feita por Felfili et al. (2004) em diferentes comunidades vegetais de Cerrado os valores de Shannon encontrados variaram entre 3,44 e 3,73. Em outro estudo, Silva & Scariot (2003), encontraram um valor de Shannon de 2,99 em um estudo em florestas estacionais no estado de Goiás. Quanto ao valor do índice de equitabilidade Felfili et al. (2004) encontrou valores entre 0,75 e 0,88, mostrando que o valor encontrado no presente estudo é mediano. 3.7.4 Unidades Topográficas Elevadas Por estarem localizadas nas porções de relevo mais movimentado, as unidades topográficas elevadas da Serra das Areias são constituídas predominantemente por vegetação savânica e campestre. Nessas unidades foram estabelecidas 37 das 50 parcelas e foram registrados 609 indivíduos e 100 espécies vegetais. Isso representa uma média de 16,4 indivíduos e 2,7 espécies por parcela. As espécies mais representativas nas Unidades Topográficas Elevadas foram Miconia ferruginata, Qualea parviflora e Byrsonima pachyphylla, com IVI de 7,9%, 5,5% e 4,8%, respectivamente, conforme mostra a Tabela 24. Árvores mortas em pé tiveram IVI de 7,99%. O índice de diversidade de Shannon para essas unidades foi H’=3,91 e o índice de equitabilidade de Pielou foi de J’=0,85. Plano de Manejo UC Serra das Areias 134 Tabela 24: Parâmetros fitossociológicos das 10 espécies arbóreas mais representativas registradas nas Unidades Topográficas Elevadas da Unidade de Conservação Serra das Areias. Espécie N U Morta 51 Miconia ferruginata AB DA DR FA FR DoA DoR VC VC (%) VI VI (%) 27 0,392 137,838 8,37 72,97 6,99 1,06 8,6 16,973 8,49 23,968 7,99 56 18 0,449 151,351 9,2 48,65 4,66 1,214 9,85 19,047 9,52 23,71 7,9 Qualea parviflora 37 18 0,265 100 6,08 48,65 4,66 0,715 5,81 11,881 5,94 16,544 5,51 Byrsonima pachyphylla 38 19 0,147 102,703 6,24 51,35 4,92 0,399 3,24 9,475 4,74 14,397 4,8 Psidium myrsinoides 25 17 0,125 67,568 4,11 45,95 4,4 0,337 2,74 6,842 3,42 11,246 3,75 Ouratea hexasperma 20 11 0,138 54,054 3,28 29,73 2,85 0,372 3,02 6,3 3,15 9,15 3,05 Salacia crassifolia 23 10 0,107 62,162 3,78 27,03 2,59 0,288 2,34 6,118 3,06 8,708 2,9 Davilla sp. 20 15 0,064 54,054 3,28 40,54 3,89 0,173 1,4 4,687 2,34 8,573 2,86 Miconia albicans 16 11 0,134 43,243 2,63 29,73 2,85 0,362 2,94 5,566 2,78 8,416 2,81 Indeterminada 16 8 43,243 2,63 21,62 2,07 0,407 3,3 5,931 2,97 8,003 2,67 TOTAL 609 37 4,559 1645,946 100 1043,24 100 12,322 100 200 100 300 100 0,151 A vegetação das Unidades Topográficas Elevadas apresenta-se relativamente bem conservada, com cobertura vegetal contínua. Entretanto, alguns pontos apresentam solo exposto com início de erosões, principalmente causados por atividades de jeepcross e motocross na região (Figura 58). Além disso, no interior dessas unidades são localizadas algumas cachoeiras, que atraem a visitação que não ocorre de forma planejada, acarretando impactos ambientais facilmente identificados nas áreas, como deposição de lixo (Figura 59), depredação da vegetação e restos de fogueiras. Esses sinais de impactos humanos também são facilmente observados nas áreas da base do morro localizadas próximo aos bairros que circundam a Serra. Figura 58: Atividade de motocross desenvolvida na Serra das Areias. Figura 59: Lixo deixado pelo publico próximo a área de banho. Fonte: Mattos e Clímaco Ltda, 2014 Fonte: Mattos e Clímaco Ltda, 2014 Plano de Manejo UC Serra das Areias 135 A flora da Serra das Areias é constituída por uma série de espécies com grandes potencialidades (Figura 60). Por exemplo, foram registradas 46 espécies usadas para extração de madeira com, por exemplo, aroeira (Myracrodon urundeuva), angico (Anadenanthera peregrina) e garapa (Apuleia leiocarpa). Espécies usadas na ornamentação urbana ou de jardins, também foram bastante abundantes, tais como, as orquídeas (família Orchidaceae). Além disso foram registradas espécies utilizadas na alimentação humana e da fauna nativa, como pequi (Caryocar brasiliense), caju (Anacardium humile) e murici (Byrsonima pachyphylla), bem como outros usos potenciais. Essas espécies merecem atenção especial por ocorrerem tanto na área de proteção integral quanto na área de uso sustentável, inclusive porque algumas dessas espécies são protegidas por legislação específica, com as madeiras de lei anteriormente comentadas. Figura 60: Quantidade de espécies da flora da Serra das Areias de acordo com diferentes tipos potenciais de uso. Fonte: Mattos e Clímaco Ltda, 2014 3.7.5 Unidades Topográficas Planas As unidades topográficas planas e com maior uso do solo antrópico na Serra das Areias foram amostradas através de 13 parcelas. Nelas foram registrados 232 indivíduos e 60 espécies arbóreas, representando uma média de 17,8 indivíduos e 4,6 espécies por parcela. Plano de Manejo UC Serra das Areias 136 Seguindo o padrão, a espécie mais importante nessas unidades foi Miconia ferruginata com IVI de 10,9% (Tabela 25). A principal diferença foi Luehea grandiflora que não apareceu entre as 10 espécies mais representativas nas unidades topográficas elevadas, porém nas unidades topográficas planas ficou em segundo lugar com IVI de 5,7%. Esse resultado se deve ao fato das unidades planas apresentarem boa representatividade de vegetações florestais, como cerradão e mata de galeria, onde essa espécie é comum. Em terceiro lugar esteve Qualea parviflora com IVI de 5,1%. As parcelas dessa unidade apresentaram o maior número de árvores mortas em pé, que somaram 12,4% do IVI da comunidade. O índice de diversidade observado para as unidades planas foi o menor da Serra das Areias (H’=3,34), padrão também observado para o índice de equitabilidade (J’=0,82), mostrando que nessas áreas há uma maior dominância das espécies mais importantes sobre a comunidade. Tabela 25: Parâmetros fitossociológicos das 10 espécies arbóreas mais representativas registradas nas Unidades Topográficas Planas da Unidade de Conservação Serra das Areias. Espécie N U AB DA DR FA FR DoA DoR VC VC (%) VI VI (%) Morta 35 10 0,334 269,231 15,09 76,92 8,2 2,57 13,99 29,07 14,54 37,27 12,42 Miconia ferruginata 36 4 0,335 276,923 15,52 30,77 3,28 2,57 14,03 29,54 14,77 32,82 10,94 Luehea grandiflora 7 3 0,278 53,846 3,02 23,08 2,46 2,14 11,64 14,65 7,33 17,11 5,71 Qualea parviflora 13 4 0,155 100 5,6 30,77 3,28 1,19 6,49 12,09 6,05 15,37 5,12 Xylopia aromática 17 5 0,068 130,769 7,33 38,46 4,1 0,52 2,86 10,18 5,09 14,28 4,76 Tachigali vulgaris 7 3 0,17 53,846 3,02 23,08 2,46 1,31 7,12 10,14 5,07 12,6 4,2 Copaifera langsdorffii 2 1 0,196 15,385 0,86 7,69 0,82 1,511 8,22 9,08 4,54 9,9 3,3 Cardiopetalum calophyllum 12 3 0,047 92,308 5,17 23,08 2,46 0,364 1,98 7,15 3,58 9,61 3,2 Byrsonima pachyphylla 9 5 0,028 69,231 3,88 38,46 4,1 0,216 1,17 5,05 2,53 9,15 3,05 Qualea grandiflora 5 5 0,063 38,462 2,16 38,46 4,1 0,484 2,64 4,79 2,4 8,88 2,96 232 13 2,39 1784,615 100 938,46 100 18,38 100 200 100 300 100 A paisagem das unidades planas é bem heterogênea. Na área são observados, por exemplo, grandes porções destituídas de vegetação natural e predomínio de pastos (Figura 61), intercaladas com fragmentos de vegetação natural (Figura 62). Nessas unidades estão localizas porções importantes de fragmentos de mata, como por exemplo, a mata de galeria que margeia o Córrego da Mata na interfase entre as duas Unidades Topográficas Elevadas (Figura 63). Essa área é de fundamental importância para a manutenção tanto da diversidade florística quanto faunística da Serra, dado que funciona como um corredor ecológico natural que liga as duas unidades de proteção integral, onde estão contidas as maiores porções de Plano de Manejo UC Serra das Areias 137 vegetação natural. Desse modo, essas vegetações de mata devem ser mantidas, inclusive com a necessidade de recuperação em alguns pontos onde não atingirem as especificações previstas em lei. Figura 61: Pastagem fazendo parte da paisagem da Serra das Areias. Figura 62: Fragmento de vegetação natural circundado por pastagem. Fonte: Mattos e Clímaco Ltda, 2014 Fonte: Mattos e Clímaco Ltda, 2014 Figura 63: Corredor de vegetação (seta) formado pela mata de galeria do Córrego da Mata. Fonte: Mattos e Clímaco Ltda, 2014 Na área das unidades mais elevadas são encontradas porções principalmente marginais à Serra, onde a ocupação humana é elevada, com construções e ocupações irregulares (Figura 64). Além disso, na unidade há uma grande incidência de espécies exóticas e invasoras de Plano de Manejo UC Serra das Areias 138 habitats, como o capim-braquiária (Urochloa decumbens), frequentemente usada nas pastagens. Essa espécie pode invadir a vegetação natural e compete com as gramíneas nativas e influenciam na diversidade da flora original, principalmente da flora herbácea que é mais vulnerável às alterações e impactos naturais e antrópicos (Pires et al., 2012). Praticamente todas as unidades de conservação brasileiras (reservas biológicas, parques, etc.) encontram-se atualmente, em maior ou menor grau, invadidas por espécies exóticas (Pivello, 2005). Figura 64: Vista de cima da Serra das Areias, mostrando construções que margeiam a unidade. Fonte: Mattos e Clímaco Ltda, 2014 Como comentado anteriormente a área topográfica plana é constituída por uma série de espécies com potencialidades de uso, que tornam as torna vulnerável à extração e exploração não planejada. Nesse contexto, é importante que nessas zonas onde o contato da população com a Unidade de Conservação é maior haja também um maior esforço para implantação de medidas específicas de manejo da flora, bem como uma maior fiscalização. Um fator importante que deve ser controlado é a questão do fogo. Muitos habitantes têm o habito de colocar fogo em lixos próximos à vegetação, o que pode acarretar riscos para a vegetação, principalmente nos períodos secos. Embora a vegetação do Cerrado esteja historicamente adaptada ao fogo, queimadas muito frequentes e em intervalos muito curtos, podem comprometer seriamente a estrutura da vegetação, principalmente reduzindo a quantidade de árvores e arbustos que é um dos estratos mais importantes da Serra das Areias (Figura 65). Plano de Manejo UC Serra das Areias 139 Figura 65: Quantidade de espécies da flora da Serra das Areias de acordo com diferentes tipos de habitos das plantas. Fonte: Mattos e Clímaco Ltda, 2014 3.7.6 Entorno Por estar inserido em uma zona urbana e semi-urbana, o entorno da Unidade de Conservação Serra das Areias encontra-se altamente fragmentado. A situação é mais crítica na porção norte da Serra, voltada para Aparecida de Goiânia, onde se encontram bairros como Independência Mansões, Colina Azul e Jardim Tiradentes, que tem uma grande densidade populacional. Nessa região há poucos fragmentos de vegetação nativa e a impermeabilidade da matriz urbana dificulta a conexão desses com a Unidade de Conservação. A fragmentação da paisagem causa sérios problemas ecológicos para as espécies decorrentes do isolamento entre as populações. Fragmentos muito pequenos, por exemplo, podem não apresentar disponibilidade de recursos suficientes para a manutenção das populações, principalmente de animais, o que pode levar à significativa redução do tamanho populacional e por consequência, à extinção local das espécies. Além disso, a desconectividade entre os fragmentos pode causar redução da variabilidade genética das populações, tanto de fauna quanto de flora, levando à diminuição da sobrevivência e ao aumento da vulnerabilidade. Plano de Manejo UC Serra das Areias 140 Na porção sul da Unidade de Conservação, voltada para Nova Fátima, a situação é um pouco mais amena tendo em vista que é constituída predominantemente por zona rural. Essa configuração torna menos difícil a conexão das populações da fauna e flora da Serra das Areias com outros fragmentos de vegetação natural. As matas de galeria que margeiam cursos d’água que nascem na Serra e saem da área da UC, bem como fragmentos de Área de Proteção Permanente e Reserva Legal das propriedades rurais do entorno, podem funcionar com corredores ecológicos e áreas de trampolim que conectam as diferentes populações remanescentes. 3.7.7 Heterogeneidade Como comentado anteriormente das 122 espécies registradas, 100 foram registradas na Unidade Topográfica Elevada (UTE) e 60 na Unidade Topografica Plana (UTP), sendo que as duas unidades tiveram 38 espécies compartilhadas (Tabela 26). A primeira unidade apresentou 72,4% do total de árvores amostrados com 609 indivíduos, contra 27,6% (232) da segunda. Na UTE 62% das espécies foram exclusivas, ou seja, não ocorreram no outro tipo de unidade. Na UTP apenas 36% das unidades foram exclusivas. Figura 66: Comparação da diversidade florística entre as Unidades Topográficas Elevadas e Plana. Elevada 100 (81,9) Abundância (%) 609 (72,4) Plana 60 (49,1) 232 (27,6) Unidade Riqueza (%) Espécies compartilhadas (%) 38 (38%) Espécies exclusivas (%) 62 (62%) Índice de diversidade 3,91 38 (64%) 22 (36%) 3,34 A comparação dos índices de diversidade entre os dois tipos de unidade mostra que a UTE é mais diversa (H’=3,91) do que a UTP (H’=3,34). Esses resultados comparativos mostram que os núcleos elevados são bem mais representativos para a conservação da flora da Serra das Areias, inclusive englobando 64% das espécies arbóreas ocorrentes nas áreas de uso sustentável. Consequentemente, reforçam sua importância para dos demais grupos de organismos vivos estudados, devido a grande disponibilidade habitat. Plano de Manejo UC Serra das Areias 141 4. ESTRATÉGIAS PARA CONSERVAÇÃO DO MEIO BIÓTICO Atualmente o aumento da perda de vegetação natural através da fragmentação e supressão de habitats naturais tem sido considerado como as maiores ameaças para a biodiversidade (Tabarelli e Gascon, 2005). Como o Bioma Cerrado apresenta um alto índice de espécies endêmicas submetidas a um elevado nível de degradação ambiental é considerado um dos 34 hotspots de biodiversidade (Mittermeier et al. 2004). Admite-se que devido a degradação elevada do Cerrado, este bioma esteja perdendo espécies ainda não conhecidas pela ciência (Diniz-Filho et al. 2005). Portanto, é necessário o estabelecimento de ações prioritárias relacionadas à conservação, preservação e recuperação da cobertura vegetal, especialmente em unidades territoriais já protegidas. Essas ações conservacionistas, de preservação e até de recuperação ambiental só são alcançadas quando demandamos um esforço em conhecer a realidade ambiental do local, suas principais potencialidades, mas também as principais ameaças à biodiversidade em escala local. Feito este diagnóstico, torna-se viável propor as medidas necessárias para alcançar as metas vinculadas às funções legais de Unidades de Conservação. Tais medidas podem ainda, alcançar as diversas zonas da Unidade de Conservação de maneiras distintas, podendo existir desde zonas voltadas à recuperação ambiental da área degradada, até zonas de visitação pública vinculadas à atividades de educação ambiental. Portanto, cabe a cada grupo de organismo estudado apontar as principais medidas de conservação e manutenção da diversidade encontrada na Serra das Areias. 4.1 Avifauna As medidas mais eficazes na preservação de ecossistemas naturais geralmente vão no sentido oposto ao entendimento da grande maioria das pessoas. Limitar ao máximo a presença de intrusos por um certo tempo seria uma das medidas que possibilitaria uma recomposição das comunidades de aves no local. Outra medida necessária é o inventário ambiental mais apurado tanto nas serras quanto nas suas imediações, pois sem o conhecimento da riqueza real de espécies de aves que existe no local, torna subjetivo pensar em preservação. Isso porque Plano de Manejo UC Serra das Areias 142 determinadas espécies requerem cuidados específicos, pois apresentam desde hábito alimentares até locais de nidificação que podem estar ameaçados pelas atividades antrópicas que vem degradando a Unidade de Conservação. 4.2 Entomofauna Apesar dos impactos que o uso antrópico da região tem gerado sobre a fauna de insetos, a Unidade de Conservação Serra das Areias apresenta um grande potencial de conservação, servindo de refúgio para uma grande diversidade de espécies. A principal recomendação para a manutenção destas comunidades é a preservação dos remanescentes das Unidades Topográficas Planas, permitindo a conexão e fluxo de organismos entre as unidades topográficas elevadas e entre estas e o entorno da Unidade de Conservação. Além disso, uma vez que mesmo áreas abertas como pastagens com pouco uso contribuem para a manutenção das populações de insetos, práticas de manejo que permitam uma regeneração periódica da vegetação herbácea como pastejo rotativo podem ser benéficos para esse grupo. 4.3 Herpetofauna A região da Serra das Areias está sob forte pressão antrópica, principalmente pelo alto número de visitantes nas belezas naturais e pelos proprietários que exploram a área de forma inconsciente. Dessa forma, a região pode ser considerada uma área de vulnerabilidade, principalmente por estar localizada na região periférica de um grande centro urbano. Outros proprietários, com uma visão mais ambientalista, visam à proteção da área e o uso sustentável da terra. No entanto, estas práticas sustentáveis devem ser revistas e devem funcionar de forma efetiva, buscando a integridade e conservação dos diferentes representantes da fauna e da flora na região. Para tanto, a educação ambiental, sustentada por treinamentos e cursos aos moradores, pode ser uma forma de inserir a população na realidade e nas atividades atribuídas à reserva e que vai abranger, de forma direta e indireta, a conservação de todos os grupos estudados. Neste mesmo sentido, faz-se necessário uma Plano de Manejo UC Serra das Areias 143 política de gestão e coleta do lixo deixado na região, principalmente às margens dos corpos d’água. Esta estratégia pode gerar resultados efetivos com a participação ativa dos proprietários da região. As características vegetais, a abundância de corpos d’água temporários e o relevo acidentado da região, têm potencial para abrigar uma riqueza de espécies da herpetofauna maior do que esta foi registrada. Outro fator contribuinte é o pouco tempo de amostragem e a realização de apenas duas campanhas (uma na estação seca e outra na chuvosa). Neste caso, para o real conhecimento da herpetofauna da região, especialmente dos répteis, recomendamos o aumento do tempo de amostragem e o uso de métodos mais eficientes de captura, como as armadilhas de interceptação e queda (Pitfall traps). No interior das unidades topográfica elevadas é comum o predomínio ou a presença de pastagem. Controlar o avanço do pasto em remanescentes de Cerrado é uma tarefa difícil e custosa. Para tanto, limitar o avanço e pisoteio do gado às áreas topográficas planas e já modificadas contribuirá para a manutenção da vegetação nativa rasteira no interior das áreas de proteção integral, além de reduzir o custo de um posterior manejo. Somado à contenção do avanço bovino, a criação de uma zona de amortecimento no entorno das unidades topográficas elevadas podem auxiliar neste processo. Por fim, o ponto mais delicado e que aparenta ser de grande importância para a movimentação dos representantes da herpetofauna entre as áreas elevadas e mais conservadas se localiza em uma área de intensa atividade antrópica. A preservação deste corredor ecológico (Ponto P10) é importante para manter uma comunicação entre as áreas. Uma alternativa inicial seria a conscientização do proprietário do clube para que realize a limpeza do local e limite a frequência e número de visitantes. Em longo prazo, a ampliação e/ou criação de outro corredor adjacente (Figura 7) poderia fortalecer a conectividade entre as áreas topográficas elevadas. Além disso, faz-se necessário o reflorestamento de áreas com solo exposto e nas margens de corpos d’água, especialmente nas áreas próximas às Veredas (Pontos P3 e P15), facilitando o deslocamento das espécies e restaurando a barreira natural de proteção dos recursos hídricos. Plano de Manejo UC Serra das Areias 144 Figura 67: Área com potencial para a criação de um corredor ecológico (em amarelo) para ligação entre as duas áreas topográficas elevadas e mais conservadas Fonte: Google Earth, 2014 4.4 Ictiofauna Para a preservação das espécies de peixes dos cursos d’água da Serra das Areias, é de extrema importância que se faça a educação ambiental dos residentes da Serra das Areias. Este programa educacional deve abordar aspectos como a importância da mata ciliar para os cursos d’água (e toda a comunidade aquática), consequências de introdução de espécies exóticas (e até mesmo do “peixamento”), utilização de agrotóxicos e destinação adequada de resíduos sólidos. Também é necessário a implantação de projetos de recuperação de mata ciliar também será necessária para a manutenção da biodiversidade aquática. Apesar de os pontos amostrados não apresentarem séria degradação da vegetação marginal, vários outros pontos apresentaram ausência da mata ciliar, inclusive com fortes erosões. Portanto, uma das prioridades é a restauração desses sistemas. Recomenda-se também que a área mais conservada (hoje restrita as unidades topográficas elevadas) seja expandida através do zoneamento, afim de alcançar as principais Plano de Manejo UC Serra das Areias 145 nascentes do córrego da Mata (próximo ao ponto P2). Essa região mostrou-se com grande diversidade de espécies e de grupos tróficos. Além disso, expandindo a área destinada à conservação integral, ela envolverá os diferentes pontos dos cursos d’água, contribuindo para a conservação da biodiversidade como um todo, tendo em vista que os pontos possuem bastante complementariedade. Por último, também é importante aprimorar o sistema de fiscalização na Serra das Areias para que todas as medidas tomadas sejam realizadas efetivamente e permanentemente, sem que degradações de meios aquáticos ocorram ao longo do tempo. 4.5 Macroinvertebrados Aquáticos Os riachos analisados nascem na região da Unidade de Conservação Serra das Areias e continuam seu curso até desaguarem no rio Meia Ponte. As nascentes e cursos d’água de pequenas ordens, como é o caso dos riachos amostrados, merecem especial atenção, pois qualquer impacto nas cabeceiras pode refletir à jusante. Nas áreas delimitadas como topograficamente planas e mais antropizadas recomenda-se que atividades recreativas realizadas dentro e no entorno nos corpos d’água sejam realizadas de forma consciente, acompanhadas de Educação Ambiental e com número de visitantes limitado. A presença humana por si só já pode ser considerada um fator de impacto sobre a biota, no entanto, o principal impacto sobre a diversidade de invertebrados bentônicos nas áreas de uso sustentável pode ser a poluição e destruição das matas no entorno. Além disso, recomenda-se que as áreas no entorno dos riachos sejam restauradas quando necessário e que as áreas de proteção integral incluam as nascentes dos riachos, principalmente do córrego da Mata, que se encontra mais preservado. O monitoramento da fauna de invertebrados aquáticos deve ser realizado periodicamente mesmo após a implantação do plano de manejo, para acompanhar se os métodos adotados estão sendo eficientes para preservar a biodiversidade da região. 4.6 Mastofauna A ocorrência de determinados mamíferos em um ambiente, muitas vezes, constitui-se como excelentes indicadores de qualidade ambiental, e a presença de espécies-bandeiras (i.e. Plano de Manejo UC Serra das Areias 146 Myrmecophaga tridactyla, Chrysocyon brachyurus) e espécies do ápice da pirâmide ecológica numa determinada área (i.e grandes felídeos) já a caracteriza como prioritária para a conservação da diversidade (Jorge et al, 2001). Desta forma, seria necessária e justificada uma maior rigorosidade na preservação de todos os remanescentes da região, focando na preservação de diversos tipos vegetacionais, e com especial cuidado com relação às matas ciliares e corredores de dispersão para as espécies. É válido ressaltar que corredores de dispersão de espécies (corredores ecológicos) não são sempre formados por formações florestais e de matas de galeria, visto que algumas espécies são relacionadas a áreas abertas. Observou-se também que algumas espécies presentes na região possuem histórico de conflitos com o homem, como pela predação de animais domésticos (galinhas, gado). Alguns moradores relataram a presença de onças na região, e mesmo que não tenhamos encontrado confirmações maiores, observamos alguns indicativos da presença desses grandes felinos. Desta forma, há muito vem se observado a crescente perseguição e matança desses animais silvestres por parte de moradores de regiões rurais. Esse fato se torna um indicativo e um alerta a respeito da manutenção da diversidade de mamíferos na região da Serra das Areias, indicando que esforços (campanhas de educação ambiental, controle e fiscalização da caça) devem ser empenhados em mitigar tais impactos. Observamos também a presença recorrente de lixo e entulhos por toda a região de estudo e que são deixados por moradores ou por turistas/trilheiros. Esse lixo pode causar danos de diversas formas, como pela contaminação de cursos d’agua, ingestão pelos animais e até início de incêndio (latas e vidros). Desta forma, faz-se necessário um maior controle do acesso dentro das Unidades. 4.7 Flora A partir da integração dos dados obtidos nos levantamentos realizados concluiu-se que a Unidade de Conservação Serra das Areias é uma unidade de conservação fundamental para a manutenção da diversidade florística da região. Contudo, o diagnóstico evidencia a necessita da adoção de medidas que assegurem a efetividade da unidade na manutenção da flora. Medidas que viabilizem a recomposição das APPs e permitam a sua expansão, destacam-se nesse contexto, uma vez que, as atividades humanas (e.g. pastagens, moradias, etc.) são Plano de Manejo UC Serra das Areias 147 frequentes na Unidade de Conservação, inclusive por vezes muito próximas aos limites das áreas de proteção integral, ameaçando a flora nativa. Desse modo, recomenda-se que o acesso do público às áreas mais conservadas e topograficamente elevadas seja diminuído, por exemplo, através da criação de um plano de visitação que estabeleça os locais e períodos que a visitação possa ocorrer sem prejuízos a diversidade local. Além disso, é necessário que as áreas que não estão de acordo com os preceitos da legislação ambiental sejam recompostas. As áreas prioritárias para a recomposição são as APPs, principalmente ao longo do Córrego da Mata já nas unidades topográficas planas, de modo a criar corredores ecológicos que permitam conectar os dois núcleos de proteção integral, bem como a Serra das Areias os demais fragmentos de vegetação natural da região. Plano de Manejo UC Serra das Areias 148 CONSIDERAÇÕES FINAIS As análises ambientais referentes ao meio biótico apontaram algumas percepções em comum dentre os principais grupos estudados (avifauna, entomofauna, ictiofauna, herpetofauna, macroinvertebrados aquáticos, mastofauna e flora), sendo a principal delas a elevada diversidade para cada grupo. Adiconalmente observou-se ainda outros aspectos em comum aos grupos da biota, sendo eles: (1) Existem duas unidades topográficas no Parque da Serra das Areias do ponto de vista da preservação ambiental, sendo uma unidade mais conservada e elevada; outra, mais antropizadas e baixa; (2) A diversidade de espécies foi maior nas unidades elevadas e mais conservadas, porém nas unidades baixas e mais antropizadas existem habitats naturais com características ambientais relevantes e que não estão presente nas unidades elevadas; (3) As unidades baixas e antropizadas apresentam remanescentes fundamentais para a manutenção e fluxo gênico da diversidade entre as unidades mais conservadas e, entre estas e as áreas adjacentes, especialmente através das Matas de Galeria dos cursos d’água; (4) As unidades elevadas e mais conservadas também apresentam impactos antrópicos como o uso dos recursos naturais para lazer sem planejamento e sem consciência ambiental, a presença de animais domésticos, a deposição de lixo doméstico, a pratica de esportes impactantes como enduro, motocross, jeep cross e mountain bike em trilhas clandestinas e sem manejo adequado, dentre outros; (5) As unidades baixas e mais antropizadas apresentam os mesmos impactos ambientais que as unidades elevadas, porém somados a outros impactos ainda mais intensos como a fragmentação de habitas, o avanço da pastagem sobre áreas nativas, extrações de solo e cascalho, atropelamentos de animais, deposição de lixo doméstico e da construção civil, ocupações sem planejamento, dentre outros; (6) O entorno da UC apresenta duas feições distintas. Uma delas é bastante urbanizada, com bairros populosos em sua maior parte, infraestrutura urbana e poucos habitats naturais, estando estes restritos, em sua maior parte, às matas de galerias dos cursos Plano de Manejo UC Serra das Areias 149 d’água. Já o entorno que é limítrofe à zona rural apresenta maiores remanescentes de habitat natural que o entorno urbano e, os habitats alterados desse entorno rural permitem que grande parte da biota conviva com algumas atividades antrópicas de pastagem e cultivos (avifauna, entomofauna, herpetofauna, mastofauna). Em síntese, as análises do meio biótico revelam áreas mais conservadas que outras e que coincidem com as unidades topográficas elevadas. Porém, ressalta a importância de ambas as áreas para a conservação da diversidade biológica da Unidade de Conservação Serra das Areias, deixando clara a existência de áreas que precisam ser recuperadas em ambas as unidades topográficas. Destaca-se que a maior parte da UC está preservada, porém apresentando carência de atividades de fiscalização, educação e controle ambiental. Assim, ao passo que as atividades necessárias ao equilíbrio ambiental da área forem implementadas, será possível atingir os anseios de uma Unidade de Conservação previstos no Sistema Nacional de Unidades de Conservação. Assim faz-se necessário a sobreposição da situação do meio biótico em relação ao meio físico e socioeconômico, promovendo a projeção do zoneamento ambiental da Unidade de Conservação, que estão dispostos em volume próprio neste Plano de Manejo. O produto dessa compilação de dados e o zoneamento ambiental irá possibilitar a definição da categoria mais adequada da Unidade de Conservação, assim como os programas ambientais necessários para a melhor efetivação das atividades de fiscalização, educação e controle ambiental. Também serão necessários e a capacidade de carga ou restrições ambientais de determinadas áreas que são necessários. Aparecida de Goiânia, 25 de janeiro de 2015 MATTOS & CLÍMACO LTDA CREA 6098/RF DIVINO BRANDÃO Biólogo, Doutor em Ecologia CFB 00466/04-D Plano de Manejo UC Serra das Areias MARIANA NASCIMENTO Bióloga, Doutoranda em C. Ambientais CRBio -044524/04-D 150 REFERÊNCIAS BIBLIOGRÁFICAS AB’SABER, A. N. (2003). Os domínios de Natureza no Brasil: potencialidades paisagísticas. São Paulo. Ateliê Editorial, 159 p. AGUIAR, F.C., FERREIRA, M.T. & PINTO, P. (2002) Relative influence of environmental variables on macroinvertebrate assemblages from an Iberian basin. Journal of North American Benthological Society, 21(1): 43-53. AGUIAR, L.M.S., MACHADO, R.B. & MARINHO-FILHO, J. A. (2004) Diversidade Biológica do Cerrado. Embrapa Cerrados, Planaltina, p.17-40. AIZEN, M.A; MORALES, C.L; VÁZQUEZ, D.P; GARIBALDI, L.A; SÁEZ, A; HARDER, LD. (2014). When mutualism goes bad: density-depent impacts of introduced bees on plant reproduction. New Phytologist. doi: 10.1111/nph.12924 ALBA-TERCEDOR, J. & SANCHEZ-ORTEGA, A. (1988) Un método rápido y simples para evaluar la calidad biológica de las aguas corrientes basado en el de Hellawell (1988). Limnetica, 4: 51-56. ALBA-TERCEDOR, J. (1996) Macroinvertebrados acuaticos y calidad de las aguas de los rios. IV Simposio del agua em Andaluzia (SIAGA), Almeria, 2: 203-213. ALHO, C.J. R. (1981) Small mammals populations of Brazilian Cerrado: the dependence of abundance and diversity on habitat complexity. Rev. Bras. Biol., v. 41, p.223-2230. BAILLIE et al. 2004. 2004 IUCN Red List of Threatened Species™. A Global Species Assessment. IUCN, Gland, Switzerland and Cambridge, UK. Disponviel em: http://www.iucnredlist.org/technical-documents/references, BASTOS, R. P., MOTTA, J. A. O., LIMA, L. P. & GUIMARÃES, L. D. (2003). Anfíbios da Floresta Nacional de Silvânia, Estado de Goiás. R. P. Bastos, Goiânia. BATALHA, M.A. & MARTINS, F.R. (2002) The vascular flora of the cerrado in Emas National Park (Goiás, Central Brazil). SIDA - Contributions to botany. v. 20, p.295-314. BAXTER, C.B., FAUSCH, K.D., MURAKAMI, M. & CHAPMAN, P.L. (2004) Fish invasion restructures stream and forest food webs by interrupting reciprocal prey subsidies. Ecology, 85 (10): 2656-2662. BECKER, C. G., FONSECA, C. R., HADDAD, C. F. B., BATISTA, R. F. & PRADO, P. I. (2007). Habitat split and the global decline of amphibians. Science 318: 1775-1777. BECKER, M. & DALPONTE, J. C. (1991) Rastros de mamíferos silvestres brasileiros – um guia de campo. Editora Universidade de Brasília, Brasília, Brasil. Plano de Manejo UC Serra das Areias 151 BECKER, M. & DALPONTE, J. C. (2013) Rastros de mamíferos silvestres brasileiros – um guia de campo. Editora Universidade de Brasília, Brasília, Brasil. BEIER, P. & LOWE, S. (1992). A checklist for evaluating impacts to wildlife movement corridors. Wildl. Soc. Bull. 20: 434 – 440. BERLIN, O.G.W.; BELKIN, JN. (1980). Mosquito studies (Diptera, Culicidae) XXXVI. Subgenera Aedinus, Tinolestes and Anoedioporpa of Culex. Contributions of the American Entomological Institute, 17:1- 104. BIBY, C. J.; BURGUESS, N. D.; HILL D. A.; MUSTOE, S. H. (2000) Bird Census Techniques. Second Ed. London, Academic Press, 302 p. BISPO, P.C. & OLIVEIRA, L.G. (1998) Distribuição espacial de insetos aquáticos (Ephemeroptera, Plecoptera e Trichoptera) em córregos de Cerrado do Parque Ecológico de Goiânia. Estado de Goiás. Oeocologia Brasiliensis, 5: 19-33. BLAMIRES, D.; A. B. VALGAS & P. Da D. BISPO. (2001) Estrutura dacomunidade de aves da Fazenda Bonsucesso, município de Caldazinha, Goiás, Brasil. Tangara, Belo Horizonte, 1 (3): 101-113. BLAUSTEIN, A. R. & WAKE, D. B. (1995). The puzzle of declining amphibian populations. Scientific American 272: 52–57. BRANDON, K., FONSECA, G.A.B., RYLANDS, A.B., SILVA, J.M.C. (2005) Conservação brasileira: desafios e oportunidades. Megadiversidade, 1, 7-13. BRASIL. 2000. Lei n. 9.985, de 18 de julho de 2000. Lei do Sistema Nacional de Unidades de Conservação da Natureza (SNUC) BRASIL. 2002. Decreto 4.340, de 23 de agosto de 2002. Regulamenta artigos da Lei no 9.985, de 18 de julho de 2000 BRASIL. Constituição da República Federativa do Brasil de 1988. Art.° 225 – Meio Ambiente. BRITO, D. (2004) Lack of adequate taxonomic knowledge may hinder endemic mammal conservation in the Brazilian Atlantic Forest. Biodiversity and Conservation, 13, 21352144. BRITSKI, H.A., SATO, Y. & ROSA, A.B.S. (1988) Manual de identificação de peixes da região de Três Marias: com chaves de identificação para os peixes da bacia do São Francisco. 3a ed. Brasília, Câmara dos Deputados/Codevasf, 115p. BUCHMANN, SL. (1987). The ecology of oil flowers and their bees. Annual Review of Eoclogy and Systematics, 18:343- 369 Plano de Manejo UC Serra das Areias 152 BUSS, D.F., D.F. BAPTISTA, J.L. NESSIMIAN & M. EGLER. (2004) Substrate specificity, environmental degradation and disturbance structuring macroinvertebrate assemblages in neotropical streams. Hydrobiologia, 518: 179-188. CALLISTO, M., MORENO, P. & BARBOSA, F.A.R. 2001. Habitat diversity and benthic trophic functional groups at Serra do Cipó, southeast Brazil. Braz. J. Biol., 61(2): 259266. CALLISTO, M; GOULART, M.; MEDEIROS, A.O.; ORENO, P.; ROSA, C.A. (2004) Diversity assessment of benthic macroinvertebrates, yeasts and microbiological indicators along a longitudinal gradient in Serra do Cipó, Brazil. Braz. J. Biol., 61 (2): 259-266. CARVALHO Jr., O. & LUZ, N.C. (2008) Pegadas: Série Boas Práticas, v.3. EDUFPA, Belém. CARVALHO-ZILSE, G.A; NUNES-SILVA, CG. (2012). Threats to the stingless bees in the brazilian Amazon: how to deal with scarce biological data and an increasing rate of destruction. In: Bees. FLORIO, RM ed. Nova Science Publishers, New York. CEBALLOS, G. & EHRLICH, P.R. (2002) Mammal population losses and the extinction crisis. Science, 296, 904-907. CHACON, R.G.; MARTINS, R.C.; AZEVEDO, I.N.C.; OLIVEIRA, M.S.; PAIVA, V.F. (2009) Florística da Estação Ecológica do Jardim Botânico de Brasília e do Jardim Botânico de Brasília. Heringeriana 3:11-78. CHIARELLO, A. G., AGUIAR, L. M. S., CERQUEIRA, R., MELO, F. R., RODRIGUES, F. H. G., SILVA, V. M. F. (2008) Mamíferos Ameaçados de Extinção no Brasil. In Livro Vermelho da Fauna Brasileira Ameaçada de Extinção. Ministério do Meio Ambiente. CLAVERO, M; GARCÍA-BERTHOU, E. (2005). Invasive species are a leading cause of animal extinctions. TRENDS in Ecology and Evolution, 20: 110. COLLI, G. R., BASTOS, R. P. & ARAÚJO, A. F. B. (2002). The character and dynamics of the Cerrado herpetofauna. The Cerrados of Brazil: ecology and natural history of a neotropical savanna (ed. by P. S. Oliveira,, R. J. Marquis). pp. 223-241. Columbia Univ. Press. New York. COMITÊ BRASILEIRO DE REGISTROS ORNITOLÓGICOS – CBRO. (2014). Disponível em: <http:/www.cbro.org.br/CBRO/indexhtm>. (acesso em 26/08/2014). CONSOLI, RAGB; OLIVEIRA, RL. (1994). Principais mosquitos de importância sanitária no Brasil. Rio de Janeiro: Editora FIOCRUZ. 228 p. CONTRERA, FAL; MENEZES, C; VENTURIERI, GC. (2011) New horizons on stingless beekeeping (Apidae, Meliponini). Revista Brasileira de Zootecnia, 40: 48-51 Plano de Manejo UC Serra das Areias 153 COSTA, L.P., LEITE, Y.L.R., MENDES, S.L. & DITCHFIELD, A.B. (2005) Conservação de mamíferos no Brasil. Megadiversidade 1(1):103-112. CRUMP, M. L. & SCOTT Jr., N. J. (1994). Visual encounter surveys. In: Heyer, W. R., Donnelly, M. A., McDiarmid, R. W., Hayek, L. A. C., Foster, M. S. (Eds). Measuring and Monitoring Biological Diversity - Standard Methods for Amphibians. Smithsonian Institution Press. Washington D. C., 84-92. CULLEN, Jr., L., BODMER, R. E. & VALLADARES-PADUA, C.V. (2000) Effects of hunting in habitat fragments of the Atlantic forest, Brazil. Biological Conservation. 95:49-56. CUNHA, H.F.; FERREIRA, A.A. & BRANDÃO, D. (2007) Composição e fragmentação do Cerrado em Goiás usando Sistema de Informação Geográfica (SIG). Boletim Goiano de Geografia 27: 139-152. DIAS, B. F. S. (1992). Cerrados: uma caracterização. In: DIAS, B. F. S. (Coord.). Alternativa de desenvolvimento dos cerrados: manejo e conservação dos recursos naturais renováveis. Brasília, IBAMA, p. 11-25. DINIZ-FILHO, J.A.F., BASTOS, R.P., RANGEL,T.F.L.V.B., BINI, L.M., CARVALHO, P. & SILVA, R.J. (2005) Macroecological correlates and spatial patterns of anuran description dates in the Brazilian Cerrado. Global Ecol Biogeogr. 14: 469–477 DINIZ-FILHO, J.A.F., L.G. OLIVEIRA & M.M. SILVA. (1998) Explaining the beta diversity of aquatic insects in Cerrado streams from central Brazil using multiple Matel Test. Revista Brasileira de Biologia 58: 223-231. DUELLMAN, W. E. & TRUEB, L. (1994) Biology of amphibians. Baltimore, London. The Johns Hopkins University Press. 696p. EITEN, G. (1993). Vegetação do Cerrado. In: NOVAES PINTO, M (org.). Cerrado: caracterização, ocupação e perspectivas. Brasília. Editora Universidade de Brasília. pp. 1773. EITHEN, G. (1977) Delimitação do conceito de Cerrado. Arquivos do Jardim Botânico, Rio de Janeiro, v.21, p125-134. FAVRETTO, Mario Arthur. (2009) Sobre a origem das aves. (Theropoda: Aves). Atualidades Ornitológicas On-line Nº 150 - Julho/Agosto 2009 - www.ao.com.br FELFILI, J.M., REZENDE, A.V.; SILVA-JUNIOR, M.C.; SILVA, P.E.N.; WALTER, B.M.T.; ENCINAS, J.I.; SILVA, M.A. (2007a). Fitossociologia Da Vegetação Arbórea. In: FELFILI, J.M., REZENDE, A.V.; SILVA-JUNIOR, M.C. Biogeografia do Bioma Cerrado – Vegetação e Solos da Chapada dos Veadeiros. Editora UnB. P. 47-96. Plano de Manejo UC Serra das Areias 154 FELFILI, J.M., SILVA-JUNIOR, M.C.; MENDONÇA, R.C.; FAGG, C.W.; FILGUEIRAS, T.S.; MECENAS, V. (2007b). Composição florística da Estação Ecológica de Águas Emendadas no Distrito Federal. Heringeriana 1:28-85. FELFILI, J.M.; SILVA-JÚNIOR, M.C.; SEVILHA, A.C.; FAGG, C.W.; WALTER, B.M.T.; NOGUEIRA, P.E.; REZENDE, A.V. (2004) Diversity, floristic and structural patterns of cerrado vegetation in Central Brazil. Plant Ecology, v.175, p.37-46. FERREIRA, A.A.; BASTOS, R.P.; FERREIRA, M.E. 2008. Estado da arte sobre a biodiversidade de vertebrados em Goiás. In: FERREIRA, L. G. (Ed). A encruzilhada socioambiental. Editora UFG, p. 67 – 90. FRANCENER, A.; HALL, C.F.; PORFÍRIO-JUNIOR, E.D., ARAÚJO, W.S. (2012) Flora fanerogâmica da Floresta Nacional de Silvânia, Goiás, Brasil. Enciclopédia Biosfera 8:1263-1277. FROESE, R. and D. PAULY. Editors. (2014) FishBase. World Wide Web electronic publication. www.fishbase.org, version (08/2014). FROST, D.R. (2014). Amphibian Species of the World: an Online Reference. Version 5.6. Electronic Database accessible at <http://research.amnh.org/vz/herpetology/amphibia/index.html> American Museum of Natural History, New York, USA. Acessed on 30/07/2014. GALDEAN, N., CALLISTO, M. & BARBOSA, F.A.R. (2000) Lotic ecosystems of Serra do Cipó, southeast Brazil: water quality and a tentative classification based on the benthic macroinvertebrate community. Aquatic Ecosystem Health and Management, 3: 545-552. GALINDO, P; BLANTON, FS; PEYTON, EL. (1954). A revision of the Uranotaenia of Panama with notes on other American species of the Genus (Diptera, Culicidae). Annals of the Entomological Society of America, 47:107- 177. GARDNER, A. L. (2007) Mammals of South America: Marsupials, Xenarthrans, Shrews, and Bats. Chicago and London: University of Chicago Press. GIBBONS, J. W., SCOTT, D. E., RYAN, T. J., BUHLMANN, K. A., TUBERVILLE, T. D., METTS, B.S., GREENE, J. L. MILLS, T., LEIDEN, Y. POPPY, S. & WINNE, C.T. (2000). The global decline of reptiles, déjà vu amphibians. Bioscience 50: 553 – 556. GOIÁS, Estado de. Secretaria de Meio Ambiente e dos Recursos Hídricos do Estado de Goiás (SEMARH), Agência Ambiental de Goiás, Programa das Nações Unidas Para o Meio Ambiente (PNUMA) e Fundação Centro Brasileiro de Referência e Apoio Cultural (CEBRAC).GeoGoiás (2002) - Estado Ambiental de Goiás. Goiânia, CD-ROM. 2002. GRAÇA, W. J.; PAVANELLI, C. S. (2007) Peixes da planície de inundação do alto rio Paraná e áreas adjacentes. Maringá: EDUEM, 308 p. Plano de Manejo UC Serra das Areias 155 GRATZ, NG. (1999) Emerging and resurging vector-borne diseases. Annual Review of Entomology, 44: 51-75. GUERESCHI, R. M. (2004) Macroinvertebrados bentônicos em córregos da estação ecológica de Jataí, Luiz Antônio, SP: subsídios para monitoramento ambiental. Tese (Doutorado) Universidade Federal de São Carlos. HADDAD, C. F. B. & PRADO, C. P. A. (2005). Reproductive Modes in Frogs and Their Unexpected Diversity in the Atlantic Forest of Brazil. Bioscience, 55: 207-217. HARRISON, R. L. (1992). Toward a theory of inter-refuge corridor design. Conservation Biology 6: 293-295. HUNTLY, N. (1991) Herbivores and the dynamics of communities and ecosystems. Annual Review of Ecology and Systematics, 22: 477-503 IMAÑA-ENCINAS, J.; REZENDE, A.V.; IMAÑA, C.R. & SANTANA, O.A. (2009). Contribuição dendrométrica nos levantamentos fitossociológicos. Universidade de Brasília, 46 p. IUCN. Red List of Threatened Species. < http://www.redlist.org>. Acessado em agosto de 2014. _________. (2014). The IUCN Red List of Threatened Species. Version 2014.2. Accessible at <http://www.iucnredlist.org> . Downloaded on 30 July 2014. JORGE, M.A.L, PIVELLO, V.R., MEIRELLES, S.T., VIVO, M. (2001) Riqueza e abundância de pequenos mamíferos em ambientes de cerrado e floresta, na Reserva Cerrado Pé-de-Gigante, Parque Estadual de Vassununga. Naturalia, v.26, p287-302. JUNQUEIRA, D.I. (2011). Flora arbórea do Parque Estadual da Serra de Caldas Novas, GO, Brasil - Similaridade florística entre unidades de conservação do Cerrado em Goiás e Distrito Federal. Dissertação de Mestrado, Universidade de Brasília. KEVAN, PG; Baker, HG. (1983) Insects as flower visitors and pollinators. Annual Review of Entomology, 28: 407-453. KLINK, C.A. & MACHADO, R.B. (2005). Conservation of Brazilian Cerrado. Conservation Biology 19: 707-713. KLINK, C.A., MACHADO, R.B. (2005) A conservação do Cerrado brasileiro. Megadiversidade, v.1, p.147-155. LAPOLA, D. M., MARTINELLI, L. A., PERES, C. A., OMETTO, J. P., FERREIRA, M. E., NOBRE, C. A. & VIEIRA, I. C. (2014). Pervasive transition of the Brazilian land-use system. Nature Climate Change, 4(1), 27-35. Plano de Manejo UC Serra das Areias 156 LEWINSOHN, T.M. & PRADO, P.I. (2005) How many species are there in Brazil? Conservation Biology. 19: 619-624. MARINHO-FILHO, J. F.; RODRIGUES, H. G.; JUAREZ, K. M. (2002) The Cerrado mammals: diversity, ecology and natural history. Em: The Cerrados of Brazil: Ecology and Natural History of a Neotropical Savanna. Columbia University Press, New York, p. 266-284. MARINI, M.A.; GARCIA, F.I. (2005) Conservação de aves no Brasil. Departamento de Zoologia, Instituto de Biologia, Universidade de Brasília. MARQUES, O.A.V., ETEROVIC, A. & SAZIMA, I. (2004). Snakes of the Brazilian Atlantic Forest: an Illustrated Field Guide for the Serra do Mar Range. Ribeirão Preto: Holos. MARQUES, O.A.V., NOGUEIRA, C., MARTINS, M. & SAWAYA, R.J. (2010). Potential impacts of changes in the Brazilian Forest Code on reptiles. Biota Neotropica 10(4): 39-41. MARTINS, M. & MOLINA, F. B. (2008). Panorama geral dos répteis ameaçados do Brasil. In: Livro Vermelho da Fauna Brasileira Ameaçada de Extinção (Machado, A. B. M., Drummond, G. M., Paglia, A. P., eds). MMA, Brasília, Fundação Biodiversitas, Belo Horizonte, p. 327-334. MARZLUFF, J.M., EWING, K. (2001) Restoration of fragmented landscapes for the conservation of birds: a general framework and specific recommendations for urbanizing landscapes. Restoration Ecol 9:280–292. MELO T. L. D., TEJERINA-GARRO F. L., MELO C. E. d. (2007). Diversidade biológica da comunidade de peixes no baixo rio das Mortes, Mato Grosso, Brasil. Revista Brasileira de Zoologia 24: 657-665, setembro, 2007. MENDES, H.F.; PINHO, L.C. (2014) Brazilian chironomid home page. Disponível em: https://sites.google.com/site/brazilianchironomids/home. Acesso em 20 de julho de 2014. MMA. Ministério do Meio Ambiente. Conselho Nacional do Meio Ambiente. (2005) Disponível em: <http://www.mma.gov.br/port/conama/res/res05/res35705.pdf> Acesso em 17 jan. 2014. MIRANDA, S.C.; SILVA JUNIOR, M.C.; SALLES, L.A. (2007) A comunidade lenhosa de cerrado rupestre na Serra Dourada, Goiás. Heringeriana 1:43-53. MITTERMEIER, R. A., MYERS, N., ROBLES-GIL, P., & MITTERMEIER, C. (1999) Hotspots: Earth’s Biologically Richest and Most Endangered Terrestrial Ecosystems. Agrupación Sierra Madre. México: CEMEX and Conservation International. MITTERMEIER, R.A., P. ROBLES GIL & C.G. MITTERMEIER. (1997) Megadiversity: earth’s biologically wealthiest nations. CEMEX, Conservation International, Agrupación Sierra Madre, Cidade do México. Plano de Manejo UC Serra das Areias 157 MITTERMEIER, R.A.; Gil, P.R.; HOFFMANN, M.; PILGRIM, J.; BROOKS, J.; MITTERMEIER, C.G.; LAMOURUX, J. & FONSECA, G.A.B. (2004) Hotspots revisited: earth’s biologically richest and most endangered terrestrial ecoregions. Cemex, Washington, DC. MONTEIRO, T.R., OLIVEIRA, L.G., GODOY, B.S. (2008) Macroinvertebrados bentônicos: Adaptação do índice biótico BMWP à Bacia do rio Meia Ponte, GO. Oecologia Bras. 12 (3): 553-563. MOORE, JC; WALTER, DE; HUNT, HW. (1988) Arthropod regulation of micro- and mesobiota in below-ground detrital food webs. Annual review of Entomology, 33: 419-435. MYERS, N.; MITTERMEIER, R.A.; MITTERMEIER, C.G.; FONSECA, G.A.B. & KENT, J. (2000) Biodiversity hotspots for conservation priorities. Nature 403: 853-858. NOGUEIRA, C., RIBEIRO, S., COSTA, G. C. & COLLI, G. R. (2011). Vicariance and endemism in a Neotropical savanna hotspot: distribution patterns of Cerrado squamate reptiles. Journal of Biogeography 38: 1907 - 1922. OLIVEIRA, L.G., BISPO, P.C. & SÁ, N.C. (1997). Ecologia de assembléias de insetos bentônicos (Ephemeroptera, Plecoptera e Trichoptera), em córregos do parque ecológico de Goiânia, Goiás, Brasil. Rev. Bras. Zool., 14(4): 867-876. OLIVEIRA-FILHO, A.T. & RATTER, J.A. (2002). Vegetation physionomies and wood flora of the Cerrado Biome, p. 91-120. In: OLIVEIRA, P.S. & MARQUIS, R.J. (Eds.). The Cerrados of Brazil: ecology and natural history of a neotropical savanna. New York, Columbia University Press. OLMOS, F. Aves ameaçadas, prioridades e políticas de conservação no Brasil. Natureza & Conservação - vol. 3 - nº1 - Abril 2005 - pp. 21-42. OODEGARD, F. (2008). How many species of arthropods? Erwin's estimate revised. Biological Journal of the Linnean Society, 71: 583-597. PAGLIA, A.P.; PAESE, A.; BEDÊ, L.; FONSECA, M.; PINTO, L.P.; MACHADO, R.B. (2004) Lacunas de conservação e áreas insubstituíveis para vertebrados ameaçados da Mata Atlântica. Pp. 39-50. Anais do IV Congresso Brasileiro de Unidades de Conservação. Volume II - Seminários. Fundação o Boticário de Proteção à Natureza e Rede Nacional Pró Unidades de Conservação. Curitiba, PR. PAINI, DR. (2004) Impact of the introduced honey bee (Apis mellifera) (Hymenoptera: Apidae) on native bees: A review. Austral Ecology, 29: 399-407. PARDINI, R.; DITT, E. H.; CULLEN Jr, L.; BASSI, C.; RUDRAN, R. (2003) Levantamento rápido de mamíferos de médio e grande porte. Métodos de Estudos em Biologia da Conservação e Manejo da Vida Silvestre. Editora UFPR; Fundação O Boticário de Proteção à Natureza.Cap. 8, p. 181-201. Plano de Manejo UC Serra das Areias 158 PIRES, A.C.V.; PEREIRA, S.R.; FERNANDES, G.W. And OKI, Y. (2012) Efeito de Brachiaria decumbens na herbivoria e no desenvolvimento de duas leguminosas nativas de cerrado. Planta daninha 30:737-746. PIROVANI, D. B.; SILVA, A. G.; SANTOS, A. R.; CECÍLIO, R. A.; GLERIANI, J. M.; MARTINS, S. V. (2014) Análise espacial de fragmentos florestais na Bacia do Rio Itapemirim, ES. Revista Árvore, v. 38, n. 2, p. 271-281. PIVELLO, V. R. (2005). Invasões Biológicas no Cerrado Brasileiro: Efeitos da Introdução de Espécies Exóticas sobre a Biodiversidade. Ecologia_Info 33. POUGH, H.; JANIS, C. M.; HEISER, J. B. (2008) A vida dos vertebrados. São Paulo: Atheneu. RATTER, J. A. (1991). The conservation situation of the Brasilian cerrado vegetation. Report for World Wildlife Found (WWF). Edinburgh, Royal Botanical Garden, 19p REDFORD, KH. (1984). The Termitaria of Cornitermes cumulans (Isoptera, Termitidae) and Their Role in Determining a Potential Keystone Species. Biotropica 16: 112 -119. REIS, N.R., PERACCHI, A.L., PEDRO, W.A. & LIMA, I.P. (2007) Morcegos do Brasil. Londrina. REIS, R. E., KULLANDER, S. O., FERRARIS, C. J. (2003) Check list of the freshwater fishes of south and central America. Porto Alegre: EDIPUCRS, 742 p. RIBEIRO, J.F. & WALTER, B.M.T. (2008). Fitofisionomias do bioma Cerrado. In: S.M. Sano, S.P. Almeida & J.F. Ribeiro. Cerrado: ecologia e flora. EMBRAPA-CPAC, Planaltina, p.151-212. RICHARDS, O.W. (1971). The biology of the social wasps (Hymenoptera, Vespidae). Biological Reviews 46: 483-528. RODRIGUES, M. T. (2005). Conservação dos répteis brasileiros: os desafios para um país megadiverso. Megadiversidade, 1 (1), 87-94. RUBIO, V.C.; SÁNCHEZ, E.; CERDÁ-REVERTER, J.M. (2010) Compensatory feeding in the sea bass after fasting and physical stress. Aquaculture 298: 332-337. SANTANA JR, P.A.; GONRING, A.H.R.; PICANCO, M.C.; RAMOS, R.S.; MARTINS, J.C; de OLIVEIRA FERREIRA, D. (2012). Natural Biological Control of Diaphania spp.(Lepidoptera: Crambidae) by Social Wasps. Sociobiology 59:2. SBH (2012). Lista de espécies de anfíbios do Brasil. Sociedade Brasileira de Herpetologia (SBH). Disponível em: <http://www.sbherpetologia.org.br/checklist/anfibios.htm>, Acesso em: fev. 2014. Plano de Manejo UC Serra das Areias 159 SCHAEFER, S. A. (1998). Conflit and resolutions impacts of new taxa on phylogenetics studies of the neotropical, p. 364-400. ln: L. R. Malabarba, Reis ,R. E., Vari, R. P., Lucena, Z. M. S. M., Lucena, C. A. S. Phylogeny and Classification of Neotropical Fishes. Porto Alegre: Edipucrs, X + 603p. SCHÜEPP, C; RITTINER, S; ENTLING, M.H. (2012). High bee and wasp diversity in a heterogeneous tropical farming system compared to protected forest. PLOS one, 7: 1-8. SCOSS, L. M.; MARCO JUNIOR, P.; SILVA, E. & MARTINS, S.V. (2004) Uso de parcelas de areia para o monitoramento de impacto de estradas sobre a riqueza de espécies de mamíferos. Revista Árvore. Viçosa, v 28 nº1. SICK, H. (1997). Ornitologia Brasileira. Ed. Nova Fronteira. SIGRIST, T. (2009). Iconografia Das Aves do Brasil. Volume 1 – Bioma Cerrado. Vinhedo, SP: Avisbrasilis. SILVA, L.A. & SCARIOT, A. (2003). Composição florística e estrutura da comunidade arbórea em uma floresta estacional decidual em afloramento calcário (Fazenda São José, São Domingos, GO, Bacia do Rio Paranã). Acta Botanica Brasílica, v. 17, n. 2, pp. 305-313. SILVA, L.O.; COSTA, D.A.; ESPÍRITO-SANTO FILHO, K.; FERREIRA, H.D.; BRANDÃO, D. (2002). Levantamento florístico e fitossociológico em duas áreas de cerrado sensu stricto no Parque Estadual da Serra de Caldas Novas, Goiás. Acta Botanica Brasilica, v. 16, n. 1. SILVANO, D. L., & SEGALLA, M. V. (2004). Conservation of Brazilian Amphibians. Conservation Biology 19(3): 653 – 658. SOTO, N.T.; ANJOS, L. (2009). Frugivoria por aves em Alchornea triplinervia (Euphorbiaceae) e Ocotea elegans (Lauraceae) no parque estadual Mata dos Godoy, Londrina-Paraná. Resumo não publicado. STORER, T. I., USINGER, R. L., STEBBINS, R. C., NYBAKKEN, J. W. (1998) Zoologia Geral. 6. ed. São Paulo: Companhia Editora Nacional. STORER, T.I.; USINGER, R.L.; STEBBINS, R.C.; NYBAKKEN, J.W. (2003) Zoologia Geral. Ed. Nacional, São Paulo, STRAHLER, A. N. (1957) Quantitative analyses of watershed geomorphology. Trans. American Geuph Union. 38: 913-920. SUDIA, W.D.; CHAMBERLAIN, R.W. (1962). Battery operated light trap, an improved model. Mosquito News, 22: 126-129. Plano de Manejo UC Serra das Areias 160 TABARELLI, M. & GASCON, C. (2005) Lições da pesquisa sobre fragmentação: aperfeiçoando políticas e diretrizes de manejo para a conservação da biodiversidade. Megadiversidade 1(1): 181-188 TRIVINHO-STRIXINO, S. (2014). Ordem Diptera Família Chironomidae: Guia de Identificação de larvas. In: Ed. Hamada, N., Nessimian, J.L., Querino, R.B. Insetos Aquáticos na Amazônia brasileira: taxonomia, biologia e ecologia. Manaus: Editora do INPA, 457-660. VALDUJO, P. H; SILVANO, D.L.; COLLI, G. & MARTINS, M. (2012). Anuran Species Composition and Distribribution Patterns in Brazzilian Cerrado, a Neotropical Hotpost. South American Journal of Herpetology, 7(2):63-78. VANNOTE, R.L.; MINSHALL, G.W.; CUMMINS, K.W.; SEDELL, J.R. & CUSHING, C.E. (1980). The river continuum concept. Canadian Journal of Fisheries and Aquatic Sciences 37: 130-137. WELLS, K. D. (2007). The Ecology and Behavior of Amphibians. Chicago: The University of Chicago Press. 1148pp. WILSON, D. E., & REEDER, D. M. (2005) Mammal species of the world: A taxonomic and geographic reference. Third Edition. The Johns Hopkins University Press, Baltimore. WINEMILLER, K.O., AGOSTINHO, A.A. & CARAMASCHI, E.P. (2007) Fish Ecology in tropical streams . In: DUDGEON, D. & CRESSA, C. (eds.). Tropical stream ecology. Amsterdam: Elsevier Science p. 107-146. ZIMMERMAN, B.L. (1994). Audio strip transects. In: W.R. Heyer, M.A. Donnelly, R.W. McDiarmid, L.A.C. Hayek & M.S. Foster (eds.). Measuring and monitoring biological diversity: standard methods for amphibians. Smithsonian Institution Press, p.92-96. Plano de Manejo UC Serra das Areias 161
Baixar