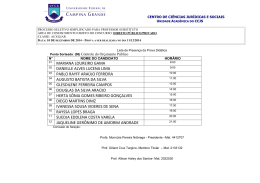
Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Um “ efeit o c oligat ivo” é um a m odific aç ão em c ert as propriedades de um solvent e quando nele adic ionados um s o l u t o n ã o -v o l á t i l , o q u a l s ó depende do núm ero de p a r t íc u l a s ( m o l é c u l a s o u ío n s ) dissolvidas e não de sua n a t u r e za ! n ã o -v o l á t i l : p o n t o d e e b u l i ç ã o s u p e r i o r a o d o s o l v e n t e . Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS As propriedades do solvent e m odific adas são: • Pr e s s ã o d e v a p o r à e f e i t o t o n o m é t r i c o • Po n t o d e e b u l i ç ã o à e f e i t o e b u l i o m é t r i c o • Po n t o d e f u s ã o à e f e i t o c r i o m é t r i c o • Pr e s s ã o o s m ó t i c a à e f e i t o o s m o m é t r i c o Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Ef e i t o T o n o m é t r i c o Co n s i s t e n a d i m i n u i ç ã o d a p r e s s ã o d e v a p o r d o s o l v e n t e q u a n d o a d i c i o n a -s e u m s o l u t o n ã o -v o l á t i l ! Pr e s s ã o d e vapor é aquela ex erc ida pelas m o l é c u l a s (d e m aior energia) do solvent e, c ont ra a int erfac e para passar ao est ado de vapor. interface líquido/vapor Prof . Mat eus Andrade Pvapor EFEI T OS COL I GA T I V OS Co m a a d i ç ã o d e p a r t íc u l a s d e s o l u t o (ío n s o u m oléc ulas) i n t e n s i f i c a m -s e as forç as at rat ivas m olec ulares e dim inui a pressão de vapor do solvent e. Um t ec ido úm ido c om água do m ar dem ora m ais a sec ar do que c om água da t orneira ! Prof . Mat eus Andrade Pvapor Pvapor soluto EFEI T OS COL I GA T I V OS A variaç ão na pressão de vapor pode ser obt ida do seguint e m odo: Po = p r e s s ã o d e v a p o r d o s o l v e n t e p u r o Pv = p r e s s ã o d e v a p o r d o s o l v e n t e , n a s o l u ç ã o DP = d i m i n u i ç ã o a b s o l u t a d a p r e s s ã o d e v a p o r DP / P o = d i m i n u i ç ã o r e l a t i v a d a p r e s s ã o d e v a p o r D P = .C K P v T molar KT = constante tonométrica Cmolar = concentração molar o Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Re p r e s e n t a ç ã o g r á f i c a A p r e ss ã o d e v a p o r d a so l u ç ã o é m enor do que a do s o l ve n t e p u r o . P ro f. Ma te u s A n d ra d e EFEI T OS COL I GA T I V OS Ex e m p l o Um a soluç ão aquosa de glic ose a p r e s e n t a c o n c e n t r a ç ã o m o l a r 2 ,0 M . Sa b e n d o q u e a c o n s t a n t e t o n o m é t r i c a p a r a a á g u a v a l e 1 ,8 .1 0 -2 , q u a l o a b a i x a m e n t o relat ivo da pressão de vapor ? So l u ç ã o C m o l a r = 2 ,0 m o l /L ; K t (á g u a ) DP/P o = K t . C m o l a r = 2 ,0 x = 1 ,8 .1 0 -2 1 ,8 .1 0 -2 = 3 ,6 .1 0 -2 Re s p o s t a : DP/P o = 3 ,6 .1 0 -2 Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Ef e i t o Eb u l i o m é t r i c o Co n s i s t e n o a u m e n t o d a t e m p e r a t u r a d e e b u l i ç ã o d o s o l v e n t e q u a n d o a d i c i o n a -s e u m s o l u t o n ã o -v o l á t i l , e x p l i c a d a p e l o a u m e n t o da int ensidade das forç as int erat ivas, pela p r e s e n ç a d a s p a r t íc u l a s d o s o l u t o . To = solvente puro DTebulição Prof . Mat eus Andrade Te = solução EFEI T OS COL I GA T I V OS A variaç ão na t em perat ura de ebuliç ão pode ser obt ida do seguint e m odo: To = pont o de ebuliç ão do solvent e puro Te ou T = pont o de ebuliç ão do solvent e, na soluç ão DT e = a u m e n t o n a t e m p e r a t u r a d e e b u l i ç ã o DT = K .C E E molar KE = constante ebuliométrica Cmolar = concentração molar A “ água da sopa” ferve a um a t em perat ura superior àquela da água t orneira ! Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Ex e m p l o Qu a l o a u m e n t o p r o v o c a d o n o p o n t o de ebuliç ão da água pela dissoluç ão de 3 ,0 m o l s d e g l i c o s e , n u m v o l u m e d e 5 0 0 m L de soluç ão, sendo a c onst ant e e b u l i o m é t r i c a d a á g u a K e = 0 ,5 2 o C/m o l ? So l u ç ã o n 1 = 3 ,0 m o l s ; V = 0 ,5 L ; K e = 0 ,5 2 o C/m o l DT e = K e . C m o l a r = 0 ,5 2 . 3 ,0 / 0 ,5 = 3 ,1 2 o C * A s o l u ç ã o i r á f e r v e r n a t e m p e r a t u r a d e 1 0 3 ,1 2 o C. Re s p o s t a : DT = 3 ,1 2 o C e T e = 1 0 3 ,1 2 o C Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Ef e i t o Cr i o m é t r i c o Co n s i s t e n a d i m i n u i ç ã o d a t e m p e r a t u r a d e c ongelam ent o ou fusão do solvent e quando a d i c i o n a -s e u m s o l u t o n ã o -v o l á t i l . To = solvente puro Tf = solução DTfusão Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS A variaç ão na t em perat ura de c ongelam ent o ou fusão pode ser obt ida do seguint e m odo: To = pont o de fusão do solvent e puro Tc ou T = pont o de fusão do solvent e, na soluç ão DT c = d i m i n u i ç ã o n a t e m p e r a t u r a d e f u s ã o DTC = KC . Cmolar KE = constante criométrica Cmolar = concentração molar A c erveja c ongela a um a t em perat ura inferior à da água pura ! Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Ex e m p l o Qu a l a d i m i n u i ç ã o p r o v o c a d a n o pont o de c ongelam ent o da água pela d i s s o l u ç ã o d e 1 ,5 m o l s d e u r é i a , n u m volum e de 200 m L de soluç ão, sabendo que a c onst ant e c riom ét ric a da água vale K c = 0 ,1 ,8 6 o C/m o l ? So l u ç ã o n 1 = 1 ,5 m o l s ; V = 0 ,2 L ; K c = 1 ,8 6 o C/m o l DT c = K c . C m o l a r = 1 ,8 6 . 1 ,5 / 0 ,2 = 1 3 ,9 5 o C * A s o l u ç ã o i r á c o n g e l a r n a t e m p e r a t u r a d e – 1 3 ,9 5 o C . Re s p o s t a : DT = 1 3 ,9 5 o C e T c = - 1 3 ,9 5 o C Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Ef e i t o Os m o m é t r i c o Co n s i s t e n a m e d i d a d a p r e s s ã o o s m ó t i c a ent re duas soluç ões separadas ent re sí por u m a m e m b r a n a s e m i -p e r m e á v e l (m .s .p .) o u de um a soluç ão c om o solvent e puro. OB SERV A ÇÕES A ) M e m b r a n a s e m i -p e r m e á v e l = s ó p e r m i t e a p a s s a g e m d e s o l v e n t e ( e x .: c i t o p l a s m a , p a p e l c e l o f a n e ,... ); B ) Os m o s e = p a s s a g e m d e s o l v e n t e a t r a v é s d e u m a m .s .p ., a t é q u e a s s o l u ç õ e s t o r n e m -s e i s o t ô n i c a s , i s t o é , q u e ex erç am a m esm a pressão osm ót ic a; C) Pr e s s ã o o s m ó t i c a = p r e s s ã o e x e r c i d a p e l o s o l v e n t e c o n t r a a m .s .p . p a r a q u e o c o r r a a o s m o s e . Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Pr e s s ã o Os m ó t i c a soluto solvente OSMOSE d i l u íd a m esm a c onc ent raç ão c onc ent rada APÓS CERTO TEMPO m .s .p m .s .p Po b r e l e s m a q u a n d o a d i c i o n a m o s s a l ! Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS A p r e s s ã o o s m ó t i c a (P) p o d e s e r o b t i d a do seguint e m odo: - a pressão ex erc ida por um gás, em dada t em perat ura, é c alc ulada pela ex pressão PV=nRT -p o r a n a l o g i a , a p r e s s ã o o s m ó t i c a s e r á P V = n RT nRT mRT P= = = Cmolar RT V MV R = c o n s t a n t e u n i v e r s a l d o s g a s e s (0 ,0 8 2 a t m .L /m o l .K T = t e m p e r a t u r a a b s o l u t a (K e l v i n ) Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Ex e m p l o Qu a l a p r e s s ã o o s m ó t i c a e x e r c i d a p o r u m a s o l u ç ã o a q u o s a d e s a c a r o s e 1 ,8 M , n a t e m p e r a t u r a d e 2 7 o C? • Da d o : R = 0 ,0 8 2 a t m .L / m o l .K So l u ç ã o C m o l a r = 1 ,8 ; T = 2 7 o C = 3 0 0 K P = C m o l a r R T = 1 ,8 x 0 ,0 8 2 x 3 0 0 = 4 4 ,2 8 a t m Re s p o s t a : P = 4 4 ,2 8 a t m Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Re s u m o d o s e f e i t o s c o l i g a t i v o s T ON OM ET RI A (P V D P = .C K P ) v T molar o EB U L I OM ET RI A (T E CRI OM ET RI A (T C OSM OM ET RI A (P) DT = K .C ) E E molar DT = K . C ) C P= C molar nRT mRT = = Cmolar RT V MV Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Ef e i t o s c o l i g a t i v o s d e s o l u t o s i ô n i c o s Em v i r t u d e d o s e f e i t o s c o l i g a t i v o s d e p e n d e r e m d o n o d e p a r t íc u l a s p r e s e n t e s e n ã o d a n a t u r e za d a s m e s m a s ( u m m o l d e ío n s e x e r c e o m e s m o e f e i t o que um m ol de m oléc ulas) p a r a s o l u t o s iônic os as ex pressões deverão ser m ult iplic adas por um fat or de c orreç ão “ i ” q u e c o r r e p o n d e a o n o d e ío n s p r o d u zi d o s p o r f ó r m u l a d e s u b s t â n c i a iônic a. Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Ex e m p l o s : N a Cl à N a + + Cl - i = 2 (2 ío n s ) i = 3 (3 ío n s ) + 3 Cl - i = 4 (4 ío n s ) Sn +4 + 4 Cl - i = 5 (5 ío n s ) A l 2 (SO 4 ) 3 à 2 A l +3 + 3 SO 4 -2 i = 5 (5 ío n s ) Ca Cl 2 à Ca +2 + 2 Cl Fe Cl 3 à Fe +3 Sn Cl 4 à Prof . Mat eus Andrade EFEI T OS COL I GA T I V OS Po r t a n t o , a s e x p r e s s õ e s (f ó r m u l a s ) c orrigidas para os efeit os c oligat ivos iônic os são Tonom ét ric o DP = . K C P t molar o Eb u l i o m é t r i c o .i DT = K . C e c c molar molar .i Os m o m é t r i c o Cr i o m é t r i c o DT = K . C e .i p =C Prof . Mat eus Andrade molar . R . T .i EFEI T OS COL I GA T I V OS Prof . Mat eus Andrade
Download