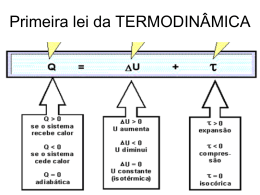
Este recurso é ideal para que você conheça ou aprofunde seu conhecimento nos estudos acerca das Leis da Termodinâmica. TERMODINÂMICA LEIS DA TERMODINÂMICA Antes de explicar a segunda Lei da termodinâmica, vamos recapitular a 1ª Lei e a Lei zero da termodinâmica. A PRIMEIRA LEI DA TERMODINÂMICA Há cerca de duzentos anos, o calor era encarado como um fluido invisível denominado calórico, que fluía como água de objetos quentes para objetos frios. O calórico parecia ser conservado – ou seja, parecia fluir de um lugar para outro sem ser criado ou destruído. Essa ideia foi a precursora da lei da conservação da energia. Pela metade do século 19 tornou-se claro que o não é uma substância localizada no interior da matéria, tornou-se claro que o fluxo de calor não era mais do que um mero fluxo de energia. A teoria do calórico para calor foi sendo gradualmente. Hoje encaramos calor como energia sendo transferida de um lugar para o outro. Calor é energia em trânsito. Quando a lei da conservação da energia é estendida para incluir o calor, passamos a chamar de primeira lei da termodinâmica. O enunciado de uma forma geral o seguinte: Quando flui calor para um sistema ou para fora dele, o sistema ganha ou perde uma quantidade de energia igual à quantidade de calor transferido. Por sistema, queremos nos referir a um grupo bem definido de átomos, moléculas, partículas ou corpos. O sistema pode ser pode ser o vapor quente dentro de uma máquina térmica, ou pode ser a atmosfera inteira da Terra. Pode até mesmo ser o corpo de um ser vivo. O ponto importante é que devemos é que devemos ser capazes de definir claramente o que está contido no sistema e o que está fora dele. Se adicionarmos calor ao vapor de uma máquina a vapor, à atmosfera da terra ou ao corpo de um ser vivo, estaremos adicionando energia ao sistema. O sistema pode usar essa energia para aumentar a sua própria energia interna, ou para realizar trabalho sobre sua vizinhança. De modo que se adicionarmos calor ao sistema, ocorrerá uma de duas coisas: (1) um aumento da energia, se a energia permanece nele, ou (2) a realização de trabalho pelo sistema sobre coisas que lhe são externas, caso a energia adicionada deixe o sistema. Mais especificamente, a primeira lei estabelece que: Calor adicionado ao sistema = aumento da energia interna + trabalho externo realizado pelo sistema A primeira lei é um princípio geral que não diz respeito ao funcionamento interno do próprio sistema. Sejam quais forem os detalhes do comportamento molecular do sistema, o calor adicionado fará aumentar a energia interna do sistema ou possibilitará que o sistema realize trabalho externo (ou ambos). Considere uma certa quantidade de energia fornecida a uma máquina a vapor, seja ela uma usina ou um navio com propulsão nuclear. Essa quantidade será evidenciada por meio da energia interna do vapor e do trabalho realizado. A soma do aumento da energia interna com o trabalho realizado é igual à energia que entra. A primeira lei da termodinâmica é simplesmente a versão “térmica” da lei da conservação da energia. Adicionar calor a um sistema, de modo que ele possa realizar trabalho mecânico é apenas uma das aplicações da primeira lei da termodinâmica. Se em vez de adicionar calor, nós realizarmos trabalho sobre o sistema mecânico, a primeira lei nos diz o que esperar: um crescimento da energia interna. Esfregue suas mãos uma na outra e certamente elas se tornarão mais quentes. Ou encha um pneu de uma bicicleta com uma bomba manual, e a bomba terá se aquecido. Por quê? Porque basicamente estamos realizando trabalho mecânico sobre o sistema e elevando sua energia interna. Se o processo for realizado tão rapidamente, de modo que muito pouco calor seja transferido para fora do sistema por condução, então a maior parte do trabalho realizado sobre o sistema vai aumentar sua energia interna, e o sistema se tornará mais quente. A SEGUNDA LEI DA TERMODINÂMICA Suponha que você coloque um tijolo quente sobre um tijolo frio, no interior de uma região termicamente isolada. Você sabe que o tijolo quente esfriará e cederá calor ao tijolo frio, o qual se aquecerá. Eles acabarão atingindo uma temperatura comum: o equilíbrio térmico. Nenhuma energia se perderá, de acordo com a primeira lei da termodinâmica. Mas imagine que o tijolo quente extraísse calor do tijolo frio, tornando-se mais quente ainda. Isso violaria a primeira lei da termodinâmica? Não, se o tijolo frio tornar-se correspondentemente mais frio, de maneira que a energia combinada de ambos permaneça constante. Se isso acontecesse, não haveria violação da primeira lei da termodinâmica. Mas violaria a segunda lei da termodinâmica. Essa lei identifica o sentido da transformação de energia em processos naturais. A segunda lei pode ser enunciada de muitas maneiras, mas a mais simples de todas é esta: O calor por si mesmo jamais flui de um objeto frio para um objeto quente. No inverno, o calor flui do interior aquecido de uma casa para o exterior frio. No verão o calor flui do ar quente no exterior da casa para seu interior mais frio. Pode-se fazer o calor fluir no outro sentido, mas se apenas realizarmos trabalho sobre o sistema ou adicionarmos energia de alguma outra fonte – como ocorre nas bombas térmicas e nos condicionadores de ar. A enorme quantidade de energia interna do oceano não pode ser usada para alimentar uma única lâmpada sem haver esforço externo. A energia por si mesma não fluirá do oceano a uma temperatura mais baixa para o filamento da lâmpada a uma temperatura mais alta. Sem esforço externo, o sentido do fluxo de calor é do quente para o frio. A LEI ZERO DA TERMODINÂMICA Existe também a lei (o nome se deve ao fato de que essa lei foi formulada após a primeira e a segunda leis da termodinâmica) estabelecendo que dois sistemas que estão em equilíbrio térmico com um terceiro sistema estão necessariamente em equilíbrio térmico entre si. MÁQUINAS TÉRMICAS As máquinas constituíram o ponto focal d revolução Industrial durante o final do século 19 e início do século 20. Sem esperanças de construir máquinas do tipo moto-perpétuo*, os cientistas e industriais concentraram-se em aumentar o rendimento das máquinas reais e dos motores que a fazem funcionar. *Um moto-contínuo, ou máquina de movimento perpétuo são classes de máquinas hipotéticas as quais reutilizariam indefinidamente a energia gerada por seu próprio movimento. A existência de um dispositivo moto-contínuo é geralmente aceita como sendo impossível, de acordo com o nosso atual conhecimento das leis da física. Uma máquina térmica é qualquer dispositivo que converta energia interna em trabalho mecânico. A Idea básica por trás de qualquer máquina térmica, seja ela uma máquina a vapor, a combustão interna ou um motor a jato, é que trabalho mecânico pode ser obtido somente quando o calor flui de uma temperatura alta para uma temperatura baixa. Em toda máquina térmica, somente uma parte do calor é convertido é convertido em trabalho. Ao considerar as máquinas térmicas, falamos em reservatórios. O calor sai de um reservatório de que se encontra alta para uma temperatura baixa. Toda máquina térmica: 1 – recebe calor de uma temperatura alta, aumentando assim sua energia interna; 2 – converte parte dessa energia em trabalho mecânico; 3 – rejeita a energia restante, como calor, para outro reservatório a uma temperatura baixa, o qual chamaremos de escoadouro (ver figura). Temperatura alta Temperatura baixa A segunda lei nos garante que nenhuma máquina térmica pode converter todo o calor que lhe é fornecido em energia mecânica. Apenas parte do calor pode ser transformada em trabalho, com o restante sendo expelido durante o processo. Aplicada às máquinas térmicas, a segunda lei pode ser enunciada como: Quando trabalho é realizado por uma máquina térmica que opera entre duas temperaturas Tquente e Tfria, somente uma parte do calor que ingressa na máquina a Tquente pode ser convertida em trabalho, e o restante é rejeitado a Tfrio. Toda máquina térmica rejeita algum calor, o que pode ser desejável ou indesejável. O ar quente expelido em uma lavanderia automática é inteiramente desejável em um dia frio de inverno, enquanto será inteiramente indesejável em um dia quente de verão. Quando o calor é indesejável, nós o chamamos de poluição térmica. Antes dos cientistas compreenderem a segunda lei, muitas pessoas achavam que uma máquina térmica que envolvesse em sua operação muito pouco atrito poderia converter quase toda sua energia térmica em trabalho útil. Mas isso não é verdade. Em 1824, o engenheiro francês Nicolau Léonard Sadi Carnot (1796 – 1832) analisou o funcionamento de uma máquina térmica e fez uma descoberta fundamental. Ele mostrou que a máxima fração de energia fornecida que pode ser convertida em trabalho útil, mesmo sob condições ideais, depende da diferença de temperatura entre o reservatório quente e o escoadouro frio. Sua equação é: 1 Tf Tq Em que η é o rendimento ideal, Tq é a temperatura do reservatório quente e Tf a do escoadouro frio. O rendimento ideal depende apenas da temperatura entre a entrada e saída. Sempre que estão envolvidas temperaturas, a escala absoluta de temperatura deve ser utilizada de modo que Tq e Tf devem ser expressos em kelvins. A equação de Carnot estabelece o limite superior de eficiência para todas as máquinas térmicas, seja ela um automóvel, um navio movido a energia nuclear ou um avião a jato. Na prática, o atrito está sempre presente em todas as máquinas e o rendimento será sempre menor que o ideal*. Apesar do atrito ser o principal responsável pela ineficiência de muitos dispositivos, no caso das máquinas térmicas o conceito dominante é a segunda lei da termodinâmica: apenas parte do calor pode ser convertido em trabalho – mesmo que não houvesse atrito nenhum. * O rendimento ideal do motor de um automóvel a combustão interna é maior que 50%, mas, na prática, o rendimento acaba sendo cerca de 25%. Motores que operassem a temperatura mais elevadas (em comparação com a do reservatório frio) seriam mais eficientes, mas o ponto de fusão dos materiais do motor impõe limites superiores de temperatura em que eles podem operar. Rendimentos mais altos, portanto, aguardam por motores feitos de materiais com pontos de fusão mais elevados. Fique de olho nos motores de cerâmica. A ORDEM TENDE PARA A DESORDEM A primeira lei da termodinâmica estabelece que a energia não pode ser criada nem destruída. Ela refere-se à quantidade de energia. A segunda lei qualifica isso, acrescentando que a forma que a energia assume nas diversas transformações de que participa acaba se “deteriorando” em formas menos úteis de energia. Ela refere-se à qualidade da energia, quando a energia torna-se mais difusa e finalmente acaba degenerando em dissipação. Outra forma de dizer isso é dizer que a energia “organizada” (concentrada e, portanto, energia de alta utilidade ou qualidade) acaba degenerando em energia “desorganizada” (com baixa utilidade ou qualidade). A gasolina, onde a energia organizada se degrada quando queima dentro do motor de um carro. Energia útil degenera em formas não úteis, e é incapaz de realizar trabalho novamente. O calor, esparso no meio ambiente como energia térmica, é um túmulo para a energia útil. A perda de qualidade da energia ocorre a cada transformação que ela sofre, quando a energia de uma forma organizada tende para formas desorganizadas. Com essa perspectiva mais ampla, a segunda lei pode ser enunciada de uma outra maneira: Em processos naturais, a energia de alta qualidade tende a transforma-se em energia de qualidade mais baixa – a ordem tende para a desordem. ENTROPIA E AS LEIS DA TERMODINÂMICA A idéia de um rebaixamento de energia na “qualidade” da energia está embutida na idéia de entropia, uma medida da quantidade de desordem em um sistema. A segunda lei estabelece que a entropia, afinal de contas, sempre aumenta. As moléculas de um gás que escapam de um vidro de perfume movem-se de um estado relativamente ordenado para um estado desordenado. A desordem aumenta; a entropia cresce. Sempre que um sistema pode distribuir livremente sua energia, ele sempre o faz de modo que a entropia cresce, enquanto diminui a energia do sistema que permanece disponível para a realização de trabalho. As leis da termodinâmica frequentemente são expressas dessa maneira: você não pode ganhar o jogo (pois não pode retirar do sistema mais energia do que foi posta nele), não pode empatar (pois não pode conseguir tanta energia útil do sistema quanto a que lhe é fornecida), e não pode sair do jogo ( a entropia do universo está sempre aumentando). Referências Bibliográficas Física Conceitual, Paul G. Hewitt,- 11ed.- Porto Alegre: Bookman, 2002 Física Conceitual, Paul G. Hewitt,- 11ed.- Porto Alegre: Bookman, 2011 Próprio autor
Download