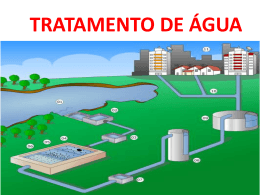
QUÍMICA Vestibular UFU 2ª Fase 17 de Janeiro de 2011 PRIMEIRA QUESTÃO Um dos problemas do crescimento das cidades é a distribuição de água tratada para todos os seus moradores. Para o tratamento da água, pode-se utilizar o gás cloro borbulhado diretamente nos tanques d’água em tratamento. Na produção desse gás em laboratório, promove-se uma reação do ácido clorídrico aquoso (HCl) com dióxido de manganês sólido (MnO2), formando o cloro gasoso (Cl2), o óxido de manganês (MnO) e água, de acordo com o esquema abaixo. A partir das informações extraídas do texto e de seus conhecimentos em Química, responda o que se pode. A) Escreva a equação balanceada de formação do gás cloro a partir do dióxido de manganês e de ácido clorídrico. B) Identifique o agente oxidante e o agente redutor e justifique sua resposta. C) Indique o tipo de ligação química presente no gás cloro e explique o que caracteriza essa ligação. Resolução: A) 2HCl ( AQ) + MnO 2 (s) → Cl2 (g) + MnO(s) + H2O( A ) 2+ 4+ 1‐ B) O O agente oxidante é o MnO2, pois o Nox do manganês variou de 4+ para 2+, indicando sua redução. Portanto, a oxidação do cloro foi provocada pelo MnO2, em que o agente redutor é o ácido clorídrico, pois o Nox do cloro variou de 1- para zero, indicando sua oxidação, assim, a redução manganês foi provocada pelo HCl (AQ). C) Na substância cloro gasoso observamos uma ligação intermolecular do tipo dipolo instantâneo-dipolo induzido ou dispersões de London ou Forças de Vander Waals. Tal ligação é caracterizada pela ausência de pólos permanentes nas moléculas de cloro (Cl2), porém devido à movimentação dos elétrons que hora se encontram mais de um lado da molécula que fica negativo deixando o outro extremo positivamente carregado devido a existência dos prótons do núcleo dos átomos de cloro. OBS: Considerando apenas a molécula de gás cloro (Cl2) a ligação entre os átomos na molécula é do tipo covalente normal, caracterizada pelo compartilhamento de pares eletrônicos entre os átomos de Cloro QUÍMICA Vestibular UFU 2ª Fase 17 de Janeiro de 2011 SEGUNDA QUESTÃO O gás cloro, além de sua importância no tratamento de água para o abastecimento das cidades, é utilizado como matéria prima na fabricação de clorofórmio (CHCl3), um solvente orgânico e anestésico externo. A reação ocorre a partir do gás metano (CH4) e do gás cloro, em presença de luz solar, formando clorofórmio (CHCl3) e gás clorídrico (HCl). Porém, por ser uma substância muito tóxica, o clorofórmio, mesmo em pequenas quantidades – em contato com a água – é um grande poluente. A legislação brasileira permite a presença de até 0,1 mg de clorofórmio por litro de água, acima disso, a água é considerada como não potável. Faça o que se pede. A) Escreva o nome do clorofórmio CHCl3 segundo a IUPAC. B) Escreva a equação química balanceada entre o gás cloro e gás metano, identificando o tipo de reação orgânica. C) Explique, a partir de cálculos, o que ocorre com a potabilidade de 500L de água contidos em um tanque doméstico em que, acidentalmente, fora adicionado clorofórmio produzido a partir de 106,5 mg de gás cloro e quantidade suficiente de metano. Resolução: A) O nome do clorofórmio segundo a IUPAC é triclorometano. λ B) 3Cl 2(g) + CH4(g) →CHCl3(l) + 3HCl(g) Δ C) * Cálculo da massa de clorofórmio contida em106,5 mg de gás cloro: De acordo com a proporção dada na equação balanceada temos: 3 mols CA 2 ____1mol CHCA 3 3x71g CA 2 ____1x119,5g CHCA 3 106,5mg CA 2 __ x x= 106,5 mg CA 2 x 119,5g CHCA 3 213g CA 2 x = 59,75mg de CHCA 3 Tem-se então: 59, 75mg CHCA 3 ___ 500L H 2 O (tan que) m m= ___ 1L H 2 O 59, 75mg CHCA3.1LH 2 O 500LH 2 O M = 0,1195mg CHCA 3 / LH 2 O Sabendo que a legislação permite apenas 01,mg CHCA 3 / LH 2 O Tem-se que a água do tanque com o acréscimo de 106,5mg de CA 2 não é potável. QUÍMICA Vestibular UFU 2ª Fase 17 de Janeiro de 2011 TERCEIRA QUESTÃO De modo a diminuir a poluição e a concentração de gases nocivos à saúde e ao meio ambiente nos grandes centros urbanos, a indústria automobilística americana, em meados dos anos 1970, começou a fabricar os primeiros carros equipados com catalisadores como itens de série (no Brasil, os primeiros carros equipados com catalisadores surgiram em 1992 e, somente a partir de 1997, o equipamento foi adotado em todos os veículos produzidos no país). O catalisador também impulsionou a utilização da gasolina sem chumbo (chumbo chumbo tetraetila), visto que a gasolina com chumbo contamina o agente catalisador usado no conjunto, destruindo sua utilidade e levando-o a entupir, além dos danos que o chumbo provoca à saúde humana. Em catalisador automotivo, ocorrem várias reações químicas, sendo uma das mais importantes: Dados: CO(g) + 1 02 (g) → CO2 (g) 2 C(grafite) + 02 (g) → CO2(g) C(grafite) 1 02 (g) → CO(g) 2 ΔH = − 94,1kcal ΔH = − 26,4kcal Baseado no texto e na reação acima, responda: A) Identifique se a reação é endotérmica ou exotérmica a partir do calculo da variação de sua entalpia. B) Explique qual a função do catalisador automotivo no desenvolvimento da reação (velocidade) , na energia de ativação e na variação da entalpia da reação de decomposição do monóxido de carbono. C) Cite e explique um impacto ambiental da liberação do gás carbônico pelos automóveis, apontando duas maneiras de minimizar tal impacto. Resolução: A) C (grafite) + 02(g) →CO2 (g) ΔH = − 94,1kcal CO(g) →C (grafite) + 1 02 2 (g) ΔH = + 26,4kcal CO(g) + 1 O2 (g) →CO2(g) 2 ΔH = − 67,7kcal A reação acima é exotérmica, pois a partir dos cálculos encontra-se ΔH negativo, característico de reações exotérmicas. B) O catalisador atua no sentido de diminuir a energia de ativação, dessa forma aumentando a velocidade da reação facilitando portanto a combustão do CO. Por outro lado o catalisador não influenciará na variação da entalpia da reação. C) A liberação de grande quantidade de CO2, poderá intensificar o efeito estufa, aumentando a temperatura média do planeta ocorrendo mudanças climáticas e provável derretimento das calotas polares. Uma forma de minimizar, seria a realização de rodízios automobilístico diminuindo portanto o fluxo de veículos automotivos e consequentemente a emissão de CO2; uso de combustíveis de fontes renováveis (não fosseis). Outra maneira ocorre através de uma maior arborização contribuindo assim para uma maior absorção de gás carbônico. QUÍMICA Vestibular UFU 2ª Fase 17 de Janeiro de 2011 QUARTA QUESTÃO Um dos desafios de uma cidade em expansão é conciliar o desenvolvimento econômico e social com a preservação do ambiente. [...] O acesso universal aos serviços de água tratada, luz, saneamento básico e coleta de esgoto é imprescindível. A mineira Uberlândia exibe um histórico de missões cumpridas. A cidade tem o quarto melhor serviço de coleta e tratamento de esgoto do país, de acordo com um levantamento do Instituto Trata Brasil. Cerca de 99% da população urbana é atendida e 100% dos dejetos são tratados. A coleta e o tratamento de lixo são apontados como os melhores de Minas Gerais. Todas as casas do município são servidas de água tratada – nas Estações de Tratamento (ETA) – e energia elétrica. Apesar disso, as autoridades já planejam um novo sistema de captação de água capaz de atender uma população de 3 milhões de pessoas – cinco vezes a atual. A rede de saúde local, a melhor do próspero Triângulo Mineiro, conta com nove hospitais e, obviamente, atrai pacientes de toda a região. Para reduzir a pressão sobre o serviço de saúde, a cidade está investindo na construção de mais um hospital, com 258 leitos. Todos os 384 ônibus que circulam pelo município dispõem de elevadores para o acesso de deficientes físicos. Nenhuma capital brasileira atingiu padrão semelhante. Revista Veja, 1° de setembro de 2010, p. 124-125. Reportagem “5 exemplos a serem seguidos” de Igor Paulin, Leonardo Coutinho e Marcelo Sperandio. (Texto modificado). A partir do texto e de seus conhecimentos em Química, responda o que se pede: A) Explique um processo que ocorre no tratamento da água em Estações de Tratamento (ETA). B) Aponte um benefício do tratamento do lixo e justifique sua resposta. C) Destaque e explique uma vantagem ambiental para os rios e lagos do Triângulo Mineiro em decorrência do tratamento do esgoto da cidade de Uberlândia. Resolução: A) Nas E.T.A.s, ocorrem vários processos físicos e químicos. Dentre os processos físicos podemos citar a filtração que separa os resíduos sólidos (terra, areia, argila, folhas, galhos, etc) da água e a decantação que separa as partículas solidas em suspensão que não foram separadas da água pela filtração comum. Na decantação a água fica em repouso e as partículas solidas mais densas que a água sedimentam-se. Dois processo químicos mais importantes são a floculação que consististe na mistura de 2 substâncias (Al2(SO4)3 e CaO) para obtenção do agente floculante o Al(OH)3 ; o Al(OH)3 aglutina as partículas sólidas menores e pouco densas provocando sua precipitação. Outro processo químico importante é a cloração que consiste na adição de substâncias como o Cl2(g) ou hipoclorito de sódio (NaClO) que são agentes bactericidas. B) O tratamento do lixo evita que seja jogado de forma inadequada no ambiente causando poluição e contaminação. Os resíduos sólidos do lixo podem ser reciclados evitando a exploração exagerada de recursos minerais e diminuindo o consumo de energia para a obtenção de algumas matérias primas como o alumínio, os diferentes polímeros plasmáticos, o papel entre outros. O lixo orgânico pode ser usado na fabricação de adubos fertilizantes para a agricultura. O gás metano que é produzido pela decomposição anaeróbica do lixo pode ser usado como fonte alternativa de energia para uso em diversos segmentos da indústria. Com o tratamento do lixo diminui a quantidade de sólidos queimados evitando o aumento o CO2(g) agente causador do efeito estufa. C) *Preservação do meio ambiente aquático: o tratamento prévio do esgoto evita a contaminação das águas dos rios e lagos preservando sua fauna e flora. *O tratamento do esgoto evita a contaminação da água que é utilizada na agropecuária e nas cidades. *A água livre de esgotos exige uma menor utilização de processos físicos e químicos para seu tratamento. *O tratamento do esgoto torna a água livre de agentes causadores de doenças na população.
Download