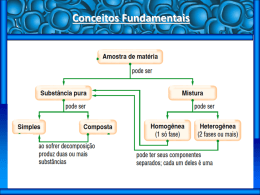
Data: o /08/2014 Bimestre: 2. a Nome: 1. Disciplina: Química Valor da Prova / Atividade: Objetivo/Instruções: Série Nº Professor: Laércio 0 a 2,0 (20 % da média) Nota: LISTA DE EXERCÍCIOS – RECUPERAÇÃO 2º. BIMESTRE/2014 Separação de Misturas; Ligações Iônicas e Covalentes; Fórmulas Estruturais; Geometria e Polaridade (Ligações e Moléculas); Grandezas Químicas (mol, massas atômicas, moleculares e molares); Transformações Gasosas (RESPONDA TODOS OS TESTES A CANETA NA PRÓPRIA FOLHA COM AS PERGUNTAS!) (0,2) Q.1-) Em visita a uma usina sucroalcooleira, um grupo de alunos pôde observar a série de processos de beneficiamento da cana-de-açúcar, entre os quais se destacam: I. A cana chega cortada da lavoura por meio de caminhões e é despejada em mesas alimentadoras que a conduzem para as moendas. Antes de ser esmagada para a retirada do caldo açucarado, toda a cana é transportada por esteiras e passada por um eletroímã para a retirada de materiais metálicos. II. Após se esmagar a cana, o caldo primário, resultante do esmagamento, é passado por filtros e sofre tratamento para transformar-se em açúcar refinado e etanol. III. O etanol é separado posteriormente em grande parte da água por aquecimento adequado. Com base nos destaques da observação dos alunos, quais operações físicas de separação de materiais foram realizadas nas respectivas etapas de beneficiamento da cana-de-açúcar, I, II e III? a) Separação mecânica, flotação, decantação. b) Separação magnética, combustão, filtração. c) Separação magnética, filtração, destilação fracionada. d) Imantação, combustão, peneiração. e) Imantação, destilação, filtração. (0,2) Q.2-) De uma mistura heterogênea de dois líquidos imiscíveis (que não se misturam) e de densidades diferentes, podem-se obter os líquidos puros através de: I. sublimação; II. decantação; III. filtração. Dessas afirmações, são corretas apenas: a) I. b) II. c) III. d) I e II. e) II e III. (0,2) Q.3-) Um aluno encontrou em um laboratório três frascos contendo três misturas binárias, conforme descrito a seguir. 1ª mistura: heterogênea, formada por um sólido e um líquido; 2ª mistura: heterogênea, formada por dois líquidos; 3ª mistura: homogênea, formada por dois líquidos cujos pontos de ebulição diferem em 20 °C. Marque a alternativa que indica os processos de separação mais adequados para recuperar as substâncias a a a originais na 1 , 2 e 3 misturas, respectivamente. a) filtração, decantação e destilação fracionada. b) evaporação, destilação simples e decantação. c) decantação, destilação simples e dissolução fracionada. d) sublimação, decantação e destilação simples. e) flotação, decantação e destilação fracionada. (0,2) Q.4-) Átomos do elemento A, com 2 elétrons na camada de valência, combinaram-se com átomos do elemento B que possui 5 elétrons na camada de valência. A fórmula do composto iônico formado é: a) AB b) A2B3 c) A3B2 d) AB2 e) A3B (0,2) Q.5-) Em relação às estruturas químicas apresentadas a seguir, qual apresenta geometria linear plana e ao mesmo tempo todas as ligações covalentes polares ? (0,2) Q.6-) O uso dos combustíveis fósseis, gasolina e diesel, para fins veiculares resulta em emissão de gases para a atmosfera, que geram os seguintes prejuízos ambientais: aquecimento global e chuva ácida. Como resultado da combustão, detecta-se na atmosfera aumento da concentração dos gases CO2 e SO2. Sobre as moléculas desses gases, é correto afirmar que: (Dados: elétrons na camada de valência: C = 4 ; O = 6 ; S = 6) a) CO2 tem ligações polares e é linear; SO2 tem ligações polares e é angular. b) ambas tem ligações polares e são angulares. c) CO2 tem ligações polares e é linear; SO2 tem ligações apolares e é angular. d) CO2 tem ligações polares e é angular; SO2 tem ligações apolares e é linear. e) ambas tem ligações apolares e são lineares. (0,1) Q.7-) Na figura ao lado, são apresentados os desenhos de algumas geometrias moleculares. Com base nesse modelo, qual a alternativa que mostra corretamente as geometrias das moléculas de ácido cianídrico (HCN), fosfina (PH3), trióxido de enxofre (SO3) e de gás sulfídrico (H2S) ? (Dados: elétrons na camada de valência: H = 1 ;C = 4 ; N = 5 ; P = 5 ; O = 6 ; S = 6) a) I = H2S; II = HCN; III = PH3; IV = SO3. b) I = HCN; II = H2S; III = SO3; IV = PH3. c) I = SO3; II = H2S; III = PH3; IV = HCN. d) I = HCN; II = H2S; III = PH3; IV = SO3. e) I = PH3; II = H2S; III = HCN; IV = SO3. (0,1) Q.8-) A massa atômica de um elemento químico é dada pela média ponderada dos diferentes números de massa (A) dos isótopos. Calculando a massa atômica de um elemento Y, constituído de três isótopos, cujas ocorrências e respectivas massas atômicas são dadas a seguir, encontramos o valor de: A = 80 A = 84 A = 88 Y (60%) Y (20%) Y (20%) a) 82,4 u b) 80,0 u c) 84,8 u d) 85,0 u e) 87,2 u (0,1) Q.9-) As massas moleculares do álcool etílico (C2H6O), empregado como combustível de automóveis atualmente, e do ácido acético (C2H4O2), substância encontrada no vinagre, são, respectivamente: (Dados: Massas atômicas (u): H = 1; C = 12; O = 16) a) 60 u e 46 u b) 66 u e 40 u c) 46 u e 66 u d) 40 u e 66 u e) 46 u e 60 u (0,1) Q.10-) Quanto “pesa”, ou melhor, qual é a massa, em gramas, de uma única molécula de açúcar comum, a sacarose cuja fórmula molecular pode ser representada por C12H22O11 ? o 23 (Dados: massas molares (g/mol) H = 1 ; C = 12 ; O = 16. N. de Avogadro = 6,0 x 10 ) – 22 23 24 – 22 – 21 a) 5,7 x 10 b) 6,0 x 10 c) 5,7 x 10 d) 3,0 x 10 e) 5,0 x 10 24 (0,1) Q.11-) A quantidade de mols existentes em 1,5 x 10 o 23 (Dado: N. de Avogadro = 6,0 x 10 ) a) 0,5 b) 1,0 c) 1,5 moléculas de ácido fosfórico (H3PO4) é igual a: d) 2,0 e) 2,5 (0,1) Q.12-) Uma amostra gasosa se encontra em um recipiente de 9 L a 25 °C e 1,6 atm. Se todo esse gás for transferido para outro recipiente de 12 L, qual será a nova pressão, também a 25 °C (transformação isotérmica)? a) 0,9 atm b) 1,2 atm c) 2,1 atm d) 2,4 atm e) 3,2 atm (0,1) Q.13-) Uma amostra de gás ideal encontra-se num recipiente fechado e indeformável, a – 73 °C e 600 mmHg. Se a temperatura for elevada até + 77 °C, calcule qual deverá ser o valor da nova pressão (em mmHg) nessa transformação isocórica. (Dado: T(K) = T(°C) + 273) a) 1050 b) 1000 c) 950 d) 900 e) 760 (0,1) Q.14-) Certa massa gasosa ideal ocupa um volume de 10,0 L a – 23 °C e 1140 mmHg. Qual será o volume aproximado (em L) dessa mesma massa gasosa a 227 °C e 760 mmHg de pressão? (Dado: PI.VI/TI = Po.Vo/To) a) 100 b) 90 c) 70 d) 50 e) 30 Bom Trabalho ! Prof. £aércio
Download