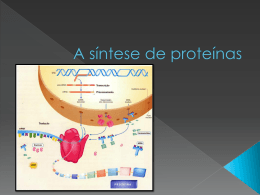
TRADUÇÃO / SÍNTESE DE PROTEÍNAS CÓDIGO GENÉTICO “Dicionário” → correspondência da seqüência de nucleotídeos levando à seqüência de aminoácidos; Códon → 3 bases nucleotídicas no RNAm que codificam cada aminoácido (“palavra”); Códon: RNAm → A, G, C e U; “escrita” da direção 5’ para 3’; 64 combinações diferentes de bases; CÓDIGO GENÉTICO 1 códon 3 nucleotídeos no RNAm 7 códons 21 nucleotídeos CÓDIGO GENÉTICO 61 dos 64 códons possíveis codificam os 20 aminoácidos padrão UAG / UGA / UAA Códons de terminação ou de parada ou sem sentido; não codificam AA. COMPONENTES DO RIBOSSOMOS DE EUCARIONTES 80 S Tipo de rRNA Número aproximado de nucleotídeos Localização da subunidade 18s 1900 40s 5s 120 60s 5,8s 156 60s 28s 4700 60s CÓDIGO GENÉTICO Características: Especificidade – um determinado códon sempre codifica o mesmo AA; Universalidade – é conservado em todas as espécies; Redundância ou Degeneração – um AA pode ter mais de 1 trinca que o codifica; Contínuo – sempre lido de 3 em 3 bases. Degeneração do código MUTAÇÕES NO CÓDIGO GENÉTICO Mutação silenciosa: Mutação com perda de sentido: Códon com 1 base alterada ainda codifica o mesmo AA; Códon com 1 base alterada codifica um AA diferente; Mutação sem sentido: Códon com 1 base alterada se torna um dos códons de terminação; OUTRAS MUTAÇÕES Inserções de várias repetições de 1 códon. Ex: doença de Huntington; Mutações em sítios de corte-junção: CÓDIGO GENÉTICO Expansão de repetições trinucleotídicas: NO Alteração de íntrons removidos; Mutações com alteração de módulo de leitura: 1 ou 2 nucleotídeos perdidos ou adicionados → seqüência de AAs altera radicalmente. AAs: COMPONENTES DA TRADUÇÃO Dieta → AAs essenciais; RNAt ou moléculas adaptadoras: Em humanos existem em torno de 50 espécies de RNAt, enquanto bactérias possuem em torno de 3040 espécies; Anticódon → seqüência de 3 nucleotídeos que reconhece o códon específico do RNAm; Componentes da Tradução •RNAT: 50 tipos de RNAt para 20 aa: alguns aas possuem mais de um RNAt específico O pareamento códon-anticódon é complementar e antiparalelo Estrutura secundária: folha de trevo 1 anticódon pode reconhecer mais de um códon COMPONENTES DA Aminoacil-RNAt sintetase: Família de enzimas que ligam AA aos seus RNAt → ↑ especificidade que aumenta a fidelidade da tradução da mensagem genética; TRADUÇÃO COMPONENTES DA RNAm (molde); Ribossomos: Ribossomos: proteínas. grandes complexos de RNAr e São as estruturas responsáveis pela síntese protéica (local da síntese). Livres ou no RER. RNAr: responsáveis pela estabilização do complexo de iniciação e dos demais participantes da tradução TRADUÇÃO COMPONENTES DA TRADUÇÃO Ribossomos: • Sítio P: neste sítio, o códon de iniciação é posicionado para seu pareamento com o anticódon do RNAt que transposta metionina – primeiro aa da tradução. • Sítio A: neste sítio, o códon adjacente é posicionado para seu pareamento com o anticódon do RNAt que transposta o próximo aa da cadeia polipeptídica. • Sítio E: depois de ser traduzido, o códon é posicionado no sítio E (ou sítio de saída) para seu desligamento com o RNAt, agora descarregado. Fatores protéicos: Fatores de liberação. ATP e GTP. iniciação, alongamento e terminação ou RECONHECIMENTO DOS CÓDONS PELO RNAT A ligação entre códon do RNAm e anticódon do RNAt é antiparalela; O códon é lido de 5’ para 3’; o anticódon também deve ser lido de 5’ para 3’. Portanto a primeira base do códon pareia com a última base do anticódon; Etapa 1 ETAPAS DA SÍNTESE PROTÉICA Ativação dos AAs: Ligação dos AAs aos seus RNAt ocorre no citosol pelas aminoacil-RNAt sintetases. Duas lig. de alta energia Aminoacilação do RNAt Requer: • 20 aas • 20 aminoacil-tRNA sintetases •Energia – ATP • RNAt Etapa 2 ETAPAS DA SÍNTESE PROTÉICA Iniciação: O aminoacil-RNAt de iniciação pareia com o códon AUG, que é o códon que sinaliza o início da proteína a ser sintetizada; Em bactérias e na mitocôndria, esse RNAt de iniciação carrega uma metionina N-formilada (grupo formila é adicionado pela enzima transformilase). Nos eucariotos, a metionina não está formilada; Etapa 2 INICIAÇÃO Requer: • RNAm • aminoacil-tRNA de iniciação – • Fatores de iniciação • GTP metionina • códon de iniciação - AUG Formação do complexo de iniciação em eucariotos ETAPAS DA SÍNTESE PROTÉICA Etapa 3 Alongamento: Fatores de alongamento são necessários (EF-Tu, EF-Ts, EF-G); Peptidiltransferase (ribozima) → liga o peptídeo em formação e o AA a ser adicionado; Após a ligação peptídica se formar, o ribossomo avança 3 nucleotídeos na direção 3’→Translocação (requer energia, GTP) . O RNAt não-carregado vai para o sítio E antes de ser liberado e o RNAt carregando o peptídeo vai para o sítio P . Etapa 3 ALONGAMENTO Requer: • Complexo de iniciação • aminoacil-tRNA especificados pelos códons • Fatores de alongamento • Peptidiltransferase • GTP Etapa 3 ALONGAMENTO TANSLOCAÇÃO O ribossomo se move em direção à extremidade 3´do mRNA, o peptidil-tRNA está, agora, no sítio P deixando o sítio A aberto para o terceiro aminoacil-tRNA. O tRNA nãocarregado é deslocado para o sítio E, desligando-se imediatamente do ribossomo. A translocação envolve o complexo fator de elongação EF-G-GTP. ETAPA 4 Terminação: Ocorre quando 1 dos 3 códons (UAA, UAG, UGA) de terminação é “colocado” no sítio A; Na E. coli, os fatores de terminação ou liberação reconhecem esses códons e ocorre a liberação do complexo ribossomal. Etapa 4 TERMINAÇÃO -Ocorre quando 1 dos 3 códons (UAA, UAG, UGA) de terminação é “colocado” no sítio A; - Hidrólise da lig. peptidil-RNAt terminal; -Liberação do peptídeo livre e do RNAt; -Dissociação do ribossomo Requer: • Códons de terminação • Fatores de liberação ETAPAS DA SÍNTESE PROTÉICA Polissomos ou Polirribossomos: Complexo de 1 RNAm e vários ribossomos. e a Estrutura Etapa 5:Modificações Pós-translacionais Tridimensional Após a tradução, algumas proteínas, antes de assumirem a sua conformação nativa, têm a sua estrutura primária alterada por modificações póstranslacionais, como por exemplo: Fosforilação Etapa 5: Modificações Pós-translacionais e a Estrutura Tridimensional Metilação Etapa 5: Modificações Pós-translacionais e a Estrutura Tridimensional As proteínas assumem a sua conformação nativa com o auxílio das chaperonas ou proteínas do estresse ou proteínas do choque térmico (heat shock proteins). Ajudam as proteínas a se moldar, associar a outras proteínas de maneira estável e tornarem-se estruturas ativas, evitando a associação de proteínas ainda não dobradas corretamente Conformação Desnaturada Conformação Nativa
Baixar