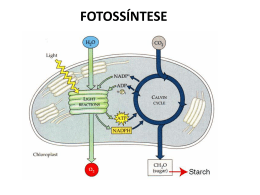
EIXO BIOLÓGICO Unidade 12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese Autora: Professora Consuelo Medeiros Rodrigues de Lima I. Introdução II. Fotossíntese III. Quimiossíntese IV. Referências #M2U12 I. Introdução V ocê, prezado(a) aluno(a), que está adquirindo conhecimentos na área biológica, já pensou na definição de vida? Será que já existe uma definição exata desse fenômeno? O estudo da vida, na verdade, da manutenção de um “estado” que nós chamamos de vida, sempre foi e sempre será foco natural do interesse dos cientistas. Murphy e O’Neill fazem uma abordagem interessante desse tema no livro O que é vida?, o qual menciono como importante sugestão de leitura. Além disso, o estudo do conteúdo do Módulo 1 e a leitura do texto-base deste módulo, certamente, estimularam-no a refletir sobre as questões relativas à vida e endereçaram-no à busca de informações sobre tal tema. Essa atividade enriquecerá, e muito, sua capacidade de compreensão de cada uma das unidades deste módulo. Atividade complementar 1 1. Reflita sobre a seguinte frase: “O conhecimento adquirido por meio das investigações na área biológica permite a identificação de características comuns à matéria animada, aos seres vivos.” Aproveite essa questão para pesquisar e elaborar uma lista das características dos seres vivos. 2. Com as características listadas por você, vamos fazer um outro exercício reflexivo. Carl Sagan foi um dos cientistas que ajudou na elaboração das mensagens sobre a vida no planeta Terra, as quais foram lançadas no espaço por meio da Pioneer 10 e 11 (em 1972 e 1973, respectivamente). Se você precisasse explicar “o que é vida” para alguém que não conhecesse a Terra, como você faria? Redija uma carta de, no mínimo, uma lauda com essa explicação. Após essa atividade, discuta quais foram as facilidades e dificuldades que sentiu para cumprir a tarefa. Para manter a vida, realizando as diversas funções biológicas, um organismo (ou mesmo uma célula) necessita de matéria e energia. Assim, antes de passar à leitura desta unidade, seria interessante reler o conteúdo da unidade 5 deste módulo, que trata das “estratégias de captura e obtenção de matéria pelos organismos”. O conteúdo desta unidade pretende apresentar os processos básicos de síntese de biomoléculas utilizados pelos organismos, considerando a fonte de energia que dirige tal 430 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC processo. Para tanto, é importante que consideremos primeiro a classificação dos organismos de acordo com as fontes de matéria e de energia. Em função da fonte de carbono, os organismos podem ser heterotróficos (do grego heteros, “outro”, e trophos, “alimentador”, isto é, “alimentados por outros”), os quais obtêm seus carbonos a partir de compostos orgânicos (mais reduzidos que o CO2), produzidos por fontes externas ou autotróficos (que se “auto-alimentam ou nutrem”). Esses utilizam o CO2 como fonte única de carbono para a biossíntese celular. Animais, fungos e muitos organismos unicelulares, como a maioria das bactérias e protistas, são heterotróficos, enquanto plantas, algas, cianobactérias e algumas bactérias são autotróficas. Quanto à obtenção de energia os organismos podem ser fototróficos, se a fonte de energia para o metabolismo for a luz solar, ou quimiotróficos, se a energia é obtida a partir da oxidação de substâncias químicas. Se a substância química usada como fonte de energia for um composto orgânico (glicose, acetato, etc.), o organismo é denominado quimiorganotrófico e se for inorgânica (como o íon amônio (NH4+), o H2S, o ferro ferroso (Fe2+), etc.), é quimiolitotrófico. Os organismos quimiorganotróficos são, invariavelmente, heterotróficos. Por outro lado, muitos quimiolitotróficos e, praticamente, todos os fototróficos são autotróficos (Figura 1). ORGANISMOS AUTOTRÓFICOS ORGANISMOS HETEROTRÓFICOS ORGANISMOS FOTOTRÓFICOS ORGANISMOS QUIMIOTRÓFICOS Figura 1: Organismos autotróficos, heterotróficos, quimiotróficos e fototróficos. A maioria dos organismos autotrótroficos obtém energia para suas funções metabólicas a partir da luz e são denominados fotoautotróficos ou fotossintetizantes. Outros autótrofos obtêm energia a partir da oxidação de compostos inorgânicos e são denominados quimioautotróficos ou quimiolitotróficos. Ambos os grupos são capazes de crescer em meio totalmente inorgânico. Os fotoautotróficos compreendem um grupo bastante diverso, que inclui eucariotos (plantas superiores e algas) e procariotos (cianobactérias e outras bactérias), enquanto os quimioautotróficos compreendem apenas algumas espécies de bactérias e nenhum eucarioto. Atividade complementar 2 Agora, que tal tentar classificar os seres humanos, a bactéria Escherichia coli e as cianobactérias utilizando as definições acima? Consórcio Setentrional de Ensino a Distância 431 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese Ao realizar essa tarefa você poderá observar o compartilhamento de fontes de energia e de carbono mesmo entre organismos tão diversos quanto o homem e uma bactéria. Nós, humanos, por exemplo, somos classificados como quimioheterotróficos, mais especificamente, quimiorganotróficos, visto que utilizamos a energia conservada a partir da oxidação de compostos orgânicos. De fato, no caso da fonte de energia ser um composto químico, ocorre a oxidação (remoção de elétrons) de tal composto e a conservação de parte da energia liberada na forma de coenzimas reduzidas (potencial redutor) e de adenosina trifosfato (ATP), um composto rico em energia (Figura 2). Quando a fonte de energia é a luz solar, primeiro ocorre a conversão da energia dos fótons na energia química do ATP (e, muitas vezes, também em potencial redutor). A energia do ATP e também o potencial redutor são utilizados em processos que requerem energia, como por exemplo, a geração de biomassa por meio da fixação dos carbonos do CO2 em compostos orgânicos (como veremos posteriormente). Figura 2: Molécula do ATP (Adenosina Trifosfato). Dessa forma, podemos dizer que todos os organismos vivos compartilham a necessidade de energia química na forma da molécula de ATP para realizar suas funções e que o processo de obtenção dessa forma de energia é a base para a classificação dos organismos nos dois grandes grupos mencionados acima, quimiotróficos e fototróficos. Entretanto, apesar das diferenças na fonte de energia, há uma característica comum na evolução de todos os sistemas viáveis: o ATP, gerado a partir de ADP e Pi, é um meio universal de troca de energia bioquímica; energia que pode ser usada para realizar o trabalho celular. Neste ponto, caberia a análise da estrutura da molécula de ATP para ajudá-lo(a) a compreender sua função nos processos metabólicos. Atividade complementar 3 Pesquise e responda: que características tem a molécula de ATP que a habilita a exercer a função de “moeda metabólica”? Existem outras moléculas capazes de exercer tal função? Essa diversidade nas fontes de energia e carbono envolve aspectos evolutivos interessantes, inclusive os relacionados à competição por determinados nutrientes. Por exemplo, os organismos que usam como fonte de energia compostos químicos inorgânicos, ao invés de compostos orgânicos, reduzem a questão da competição com organismos organotróficos com os quais convive. Além disso, podem aproveitar muitos compostos 432 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC inorgânicos, como o H2S, gerados pelo metabolismo de organismos quimiorganotróficos e excretados para o meio. Tal estratégia, desenvolvida por determinados organismos quimiolitotróficos, reflete uma forma de manutenção da vida que envolve a exploração de recursos não utilizáveis por outros organismos. No caso dos organismos fototróficos, há a grande vantagem da disponibilidade da fonte de energia que utilizam (luz solar), além de não haver competição com os organismos quimiotróficos. Em uma terminologia mais ecológica, os organismos autotróficos recebem também a denominação de produtores primários, visto que têm a capacidade de sintetizar matéria orgânica a partir de CO2, propiciando matéria e energia para os quimiorganotróficos e, também, para si mesmos. A tabela 1 resume as informações referentes a tais classificações, considerando a natureza da fonte de energia e da fonte de carbono. Tabela 1: Classificação de autótrofos e heterótrofos conforme a fonte de energia Fonte de Energia Substâncias Químicas Luz Saiba mais Há, entretanto, certa versatilidade quanto às fontes de matéria e energia, permitindo que alguns organismos aproveitem o que estiver mais prontamente disponível em seu ambiente. Essa versatilidade reflete uma “competência metabólica” que resulta em aumento das chances de sobrevivência frente a mudanças em seu ambiente. Fonte de Carbono Fonte de Carbono Dióxido de carbono (CO2) (autotróficos) Compostos orgânicos (heterotróficos) Quimioautotróficos Quimioheterotróficos Bactéria do hidrogênio, bactéria sulfurosa incolor, bactéria nitrificante, bactéria do ferro. Animais, maiorias das bactérias, fungos, protozoários. Fotoautotróficos Fotoheterotróficos Plantas verdes, maioria das algas, bactéria sulfurosa púrpura, bactéria sulfurosa verde. Poucas algas e a bactéria não sulfurosa púrpura. Como já mencionado, a energia química e a energia luminosa podem ser conservadas nas células na forma de ATP e é esta forma de energia que dirige as reações biossintéticas e outros processos celulares que requerem energia (processos ativos). Vamos iniciar nossa empreitada conhecendo os mecanismos envolvidos no processo geral em que a fonte de energia é a luz, denominado fotossíntese. #M2U12 II. Fotossíntese É bem provável que você já tenha ouvido, inúmeras vezes, a palavra fotossíntese. Entretanto, talvez não tenha pensado no por que desse nome, na sua importância, quais organismos podem realizá-la, etc. Ou será que pensou? Afinal, esse é um dos temas mais instigantes da área biológica. De qualquer forma, boa parte do conteúdo desta unidade deverá ajudá-lo(a) a responder tais questionamentos e, é claro, a formular novas questões. O desenvolvimento de organismos mais complexos na terra ocorreu atrelado à capacidade de realizar a biossíntese; especialmente quando houve a aquisição da capacidade de absorver e aproveitar a energia luminosa (em princípio, fonte inesgotável de energia). Esse foi um evento evolutivo crucial, visto que permitiu o surgimento de sistemas vivos sustentáveis. Assim, um bom ponto de partida para entender a importância do processo fotossintético é a leitura de textos que apresentem uma perspectiva histórica desse tema (disponíveis na maioria dos livros-texto de bioquímica). Consórcio Setentrional de Ensino a Distância 433 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese Fotossíntese, de forma geral e bem resumida, é a síntese de compostos orgânicos a partir de CO2, utilizando a energia luminosa absorvida por pigmentos, especialmente as clorofilas. Esse processo envolve a redução do CO2 e requer um doador de elétrons. Se esse doador for a H2O, resultará na liberação de O2 e o processo será designado fotossíntese oxigênica. Plantas, cianobactérias e algas, por exemplo, realizam a fotossíntese oxigênica; desta forma, além de serem fonte de alimento e biomassa para os demais níveis tróficos, também liberam oxigênio (O2), que fica disponível para organismos aeróbios. Caso o doador de elétrons seja outro composto, não haverá liberação de O2, caracterizando a fotossíntese anoxigênica. Isso ocorre, por exemplo, no caso da bactéria púrpura, que utiliza H2S como doador de elétrons, liberando enxofre elementar. Relembrando, os organismos que realizam a fotossíntese são denominados fotossintetizantes ou fotoautotróficos, visto que utilizam a luz como fonte de energia e podem crescer tendo o CO2 como fonte única de carbonos. Plantas, algas (eucariotos unicelulares) e muitas bactérias (procariotos) são seres fotossintetizantes e realizam a fotossíntese através de mecanismos básicos essencialmente iguais, diferindo apenas em alguns detalhes. Em função da complexidade do processo e da relação mais direta que temos com as plantas, daremos ênfase à fotossíntese que ocorre nas células fotossintéticas de vegetais. A energia luminosa é, efetivamente, a força que impulsiona a ciclagem de elementos químicos essenciais aos organismos vivos, como o carbono e o oxigênio. A figura 3 ilustra a ciclagem de CO2 e O2 entre seres fotossintetizantes e heterotróficos e a luz solar como fonte primária de energia. Esse processo garante a manutenção da maioria dos organismos autotróficos (produtores de material orgânico), como também a dos consumidores heterotróficos. Os organismos fotossintetizantes convertem a energia dos fótons de luz em ATP e potencial redutor (nicotinamida adenina dinucleotídeo fosfato na forma reduzida – NADPH) e usam essa energia para sintetizar compostos orgânicos, a partir de CO2 e H2O, liberando O2 para a atmosfera. Os organismos heterotróficos com metabolismo aeróbio (que inclui o homem e as próprias plantas) obtêm energia na forma de ATP, utilizando o O2 atmosférico para oxidar os produtos ricos em energia, também oriundos do processo fotossintético. Em resumo, na maioria dos sistemas biológicos, a síntese de moléculas orgânicas é dirigida, direta ou indiretamente, pela energia luminosa; um dos aspectos que reflete a sua importância para os seres vivos. (CO2) (H2O) (O2) (Carboidato) fotoautotrófico heterotrófico Figura 3: Relação entre energia solar, os fototróficos e os heterotróficos. 434 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC Fotossíntese em plantas O processo fotossintético em vegetais ocorre em duas fases. A primeira envolve a absorção da energia luminosa e é denominada fase ou reações dependentes de luz, também conhecida como fase clara. A segunda é denominada fase ou reações de assimilação de carbono, também conhecida pela denominação equivocada (embora amplamente difundida) de fase escura. A primeira fase depende diretamente da incidência de energia luminosa, que é absorvida pelas clorofilas e outros pigmentos e conservada nas moléculas de ATP e NADPH, com liberação de O2. A energia química do ATP e do NADPH é utilizada na segunda fase para dirigir a redução de CO2, gerando inicialmente trioses fosfato que poderão tomar diversos caminhos metabólicos, principalmente a síntese de amido e sacarose, como também outros compostos orgânicos. O processo geral de fotossíntese oxigênica pode ser representado pela equação abaixo, que descreve uma reação de oxido-redução, em que a H2O doa potencial redutor (elétrons) para a redução do CO2 a carboidratos: Equação F1 CO2 + H2O + Energia Luminosa → O2 + (CH2O) Em células eucarióticas fotossintéticas, tanto as reações de absorção de energia luminosa quanto a redução do CO2 acontecem em organelas especializadas denominadas cloroplastos. A figura 4 apresenta um esquema da estrutura básica de um cloroplasto. Sua estrutura compreende duas membranas, uma externa (menos seletiva) e uma interna (mais seletiva), que delimita a fase aquosa interna do cloroplasto, o estroma. Esse compartimento interno contém os tilacóides, vesículas membranosas achatadas, geralmente arranjadas em pilhas (grana). As membranas tilacóides (também chamadas lamelas) contêm toda a maquinaria (pigmentos, complexos enzimáticos, etc.) envolvida na absorção e conversão de energia luminosa em energia química, enquanto o estroma contém a maior parte das enzimas requeridas para a assimilação do CO2. Lamela Espaço Intermembranas Grana (Pila de Tilacóides) Membrana externa Membrana interna Tilacóide Estroma Figura 4: Esquema da estrutura de um cloroplasto. Consórcio Setentrional de Ensino a Distância 435 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese Atividade complementar 4 1. Pesquise e discuta a inadequação da terminologia “fase escura” usada para denominar a fase de assimilação de carbono. 2. Pesquise e compare as estruturas de mitocôndrias e cloroplastos. Primeira fase: reações dependentes da luz A compreensão da absorção da energia luminosa requer conhecimento sobre o espectro eletromagnético disponível no conteúdo da unidade 10, do Módulo I, deste curso. A radiação eletromagnética absorvida pelos pigmentos de organismos fotossintetizantes corresponde à luz visível (pequena faixa do espectro eletromagnético que corresponde aos comprimentos de onda (λ) ente 400 e 700 nm, que varia do violeta ao vermelho). Considerando que quanto menor o λ maior a quantidade de energia dos fótons de luz, a energia dos fótons da região do violeta do espectro é maior do que na região do vermelho. Afinal o que acontece quando a energia luminosa é absorvida? A absorção de um fóton de luz visível por uma molécula implica a promoção de um elétron desta molécula para um orbital de maior energia. A quantidade de energia associada a esse fóton (um quantum de energia) precisa ser exatamente igual à necessária para a transição eletrônica para que o evento ocorra. Ao absorver um fóton, a molécula passa a um estado excitado, instável. O elétron tende a retornar rapidamente para o seu orbital normal de menor energia, tornando-se mais estável. O decaimento ou retorno da molécula para o estado basal é acompanhado de liberação da energia absorvida como luz (fluorescência), calor ou, em determinadas condições, pode ser conservada para realizar o trabalho químico. O decaimento também pode envolver a transferência direta de energia de excitação (exciton) de uma molécula excitada para uma próxima, caracterizando um processo denominado transferência de exciton, que também ocorre durante a fotossíntese. No caso da fotossíntese, esses fotopigmentos estão arranjados de uma forma tal que permite que parte da energia absorvida seja conservada na forma de ATP e NADPH. Os fotopigmentos são essenciais para que ocorra a absorção de energia luminosa. Entre estes, as clorofilas são os mais importantes, pois são pigmentos verdes, que apresentam estrutura característica constituída por uma longa cadeia lateral fitol e um sistema heterocíclico de anéis, como mostrado na figura 5: CHO na clorofila b CH 3 C CH 2 na bacterioclorofila CH 2 O CH 3 Ligação saturada na bacterioclorofila CH N CH 2 CH 3 N Mg cadeia lateral do fitol CH 3 CH 3 CH 3 CH 2 C CH 3 O CH 3 H O CH 3 N N CH 3 CH 2 H H CH 3O C O O Clorofila α CH 3 CH 3 CH 3 CH 3 CH 3 CHda 436 Módulo II — Processos biológicos na captação e na transformação matéria e da energia 3 CH 3 CH 3 CH 3 CH 3 Saiba mais Um mol de fótons (6 x 1023 fótons) de luz visível contém entre 170 a 300kJ; quantidade de energia, mais que suficiente para a síntese de 1 mol de ATP, a partir de adenosina difosfato (ADP) e fosfato inorgânico (Pi), que requer entre 30 e 50kJ. cadeia lateral do fitol CH 3 CH 3 CH 3 CH 3 O H CH 2 C CH 3 CH 3 H O CH 2 H C CH 3O O P O Clorofila α BSC Biológico B CH 3 CH 3 CH 3 CH 3 CH 3 CH 3 CH 3 CH 3 CH 3 CH 3 β-caroteno COO CH 3 CH 3 O N H CH CH 3 - COO CH 2 CH 2 CH 2 CH 2 N H - CH 3 CH 3 CH 2 CH 3 CH CH 2 N H N na ficocianina O Ligação insaturada na ficocianina Ficoeritrina Figura 5: Estrutura da molécula de clorofila a e b. Atividade complementar 5 A estrutura das clorofilas confere a elas uma grande habilidade em absorver energia na região visível do espectro. Pesquise e justifique essa afirmativa. Atividade complementar 6 Luz solar que atinge a Terra Cl b Ficoeritrina ß-caroteno Ficocianina Absorção As clorofilas a e b, embora sejam verdes, apresentam diferenças significativas no espectro de absorção de luz. Os cloroplastos contêm ambos os tipos de clorofila, as quais atuam de forma complementar na absorção de energia do espectro visível, aumentando a eficiência do processo. A figura 6 mostra o espectro de absorção de luz visível pelos fotopigmentos. Os pigmentos acessórios, denominados carotenóides, também estão embebidos na membrana tilacóide. Os principais são o β caroteno e a luteína. Cl 300 400 500 600 700 a 800 Comprimento de onda (nm) Pesquise e avalie a estrutura e o espectro de absorção dos carotenóides. Após, justifique a presença dos carotenóides nas membranas tilacóides. Qual é o papel desses pigmentos? Temos então a seguinte situação: a luz visível é absorvida por fotopigmentos (especialmente as clorofilas) que estão embebidos na membrana dos tilacóides, os quais são estruturas vesiculares que estão no interior dos cloroplastos de células fotossintetizantes das plantas. Mas, isso é só o começo. Os fotopigmentos não estão inseridos ao acaso nas membranas tilacóides. Ao contrário, estão organizados em arranjos funcionais denominados fotossistemas (PS). Consórcio Setentrional de Ensino a Distância 437 # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese Os PS (Figura 7) estão embebidos nas membranas tilacóides e são constituídos por moléculas-antena ou coletoras de luz (clorofilas, carotenóides e outros pigmentos acessórios ligados a proteínas) e um centro de reação fotoquímica (CRF). As moléculasantena absorvem a energia luminosa e transmitem rapidamente a excitação (transferência de exciton) até o centro de reação fotoquímica, onde, efetivamente, ocorre a transdução de energia luminosa em energia química. Moléculas antenas Luz Clorofila do centro de reação A luz excita uma molécula antena (clorofila ou pigmento acessório), elevando um elétron a um nível de energia maior. * A molécula antena excitada passa energia a uma molécula de clorofila vizinha, excitando-a (transferência de energia ressonante). * Esta energia é transferida a uma clorofila do centro de reação,excitando-a. Receptor de elétrons * A clorofila do centro de reação excitada passa um elétron a um receptor de elétrons. A cavidade do elétron no centro da reação é preenchida por um elétron de um doador de elétrons. + + Doador de elétrons - - + + A absorção de um fóton provoca a separação de cargas no centro de reação. Centro de reação excitado perde epara um receptor de elétrons... Ph (a) PSII P680* Z (b) PSI Ao e o substitui com e- retirado de um doador de um doador de elétrons. Ph- - PhP680 P680 Z Z+ + Ao Ao P700* P700+ P700 PC PC PC+ + + Figura 7: Esquema da organização de um fotossistema. 438 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC Pode-se observar, experimentalmente, como já mencionado, que uma molécula de fotopigmento, como a clorofila, excitada pela luz visível, pode liberar a energia absorvida como fluorescência e calor. Contudo, quando tais pigmentos estão arranjados em estruturas como as dos complexos coletores de luz dos PS, apenas uma quantidade insignificante de energia é liberada nestas formas. Ao invés disso, a energia de excitação é transferida até o CRF, onde é desencadeado um processo de transferência de elétrons, que culmina na geração de potencial redutor e ATP. Assim, a incidência de luz visível no PS dispara uma seqüência de eventos, que podem ser descritos como se segue: uma molécula-antena absorve luz e passa a um estado excitado (um elétron é promovido para um orbital de maior energia); a energia dessa molécula excitada é transferida (transferência de exciton) para uma molécula vizinha, que passa ao estado excitado, enquanto a primeira retorna ao seu estado basal; essa transferência de energia de ressonância ocorre sucessivamente entre moléculas vizinhas até alcançar a molécula especial de clorofila do CRF, promovendo um elétron dessa clorofila para um orbital de maior energia; a clorofila excitada transfere seu elétron para um aceptor de elétrons próximo, que adquire carga negativa, enquanto a clorofila do CRF fica “vacante” de um elétron; a vacância da clorofila do CRF é preenchida por um doador de elétrons próximo, o qual se torna positivamente carregado. Resumindo: a excitação promovida pela absorção de energia luminosa nos PS é canalizada para o CRF, gerando um forte agente redutor e um forte agente oxidante, criando condições para iniciar um conjunto de reações de oxido-redução. Atividade complementar 7 Saiba mais Os números indicados como índices dos CRF (P680 e P700) referem-se aos comprimentos de onda (λ) em que ocorre o “descoramento” máximo dos pigmentos dos PSII e I, respectivamente. Esse “descoramento” é resultante da impossibilidade temporária dos pigmentos de absorver energia luminosa nestes λ específicos (680 e 700nm), devido à perda de um elétron do CRF. Vamos lá, caro estudante. Exercite sua imaginação esquematizando o processo de transferência de energia em um PS: a transferência de exciton entre moléculasantena vizinhas, a transferência de energia para o CRF e a geração de um forte aceptor e de um forte doador de elétrons. O nosso conhecimento atual sobre a fotossíntese em plantas resulta de estudos conduzidos em cloroplastos, como também em algas e bactérias. O evento central do processo fotossintético é o fluxo de elétrons dirigido pela luz e este é realizado por sistemas multienzimáticos, embebidos na membrana tilacoideana. Certamente, as plantas, as cianobactérias e as algas contam com um aparato fotossintético mais complexo que aquele de bactérias, que geralmente têm apenas um PS. As membranas tilacóides dos cloroplastos de células vegetais apresentam dois tipos de PS (I e II), que parecem ter evoluído a partir da combinação de sistemas bacterianos mais simples. Cada um desses PS tem seu próprio CRF e suas moléculas-antena, e exercem funções distintas e complementares. No fotossistema II (PSII) a razão clorofila a/clorofila b é igual a 1 e o seu CRF é denominado P680. O fotossistema I (PSI) contém mais clorofila “a” do que “b” e seu CRF denomina-se P700. Consórcio Setentrional de Ensino a Distância 439 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese O PSI e o PSII estão dispostos em grande número nas membranas tilacóides dos cloroplastos e seus CRF agem em seqüência para viabilizar a transferência de elétrons, a qual é dirigida pela luz da H2O até o NADP+. O esquema “Z”, apresentado na figura 8, ilustra esse movimento unidirecional de elétrons e as relações de energia nas reações dependentes de luz. -1,6 Fotossistema I -1,4 P700* Fotossistema II Ao -1,2 A1 -1,0 Fe-S Fd P680* Cí c lic a -0,8 QA QB -0,4 -0,2 NADPH Complexo Cit bf Luz [ Luz FP NADP+ Vi -0,6 a Ph 0 PC 0,2 P700 0,4 0,6 H2O 0,8 1,0 Complexo Mn que cinde a H2O P680 O2 + 2H+ ] Translocação de prótons Figura 8: esquema Z, PSI e PSII. A excitação de P680 no PSII gera P680*, um excelente agente redutor que, em picossegundos (10-12 s.), transfere elétrons para a feofitina (Pheo), que adquire uma carga negativa (Pheo-). Essa transferência de elétrons converte P680* em um radical catiônico (P680+). A Pheo- transfere seu elétron sobressalente para plastoquinona A (PQA), que o repassa para a plastoquinona B (PQB). PQB recebe dois elétrons e, quando isso ocorre a partir de duas transferências de PQA, ao retirar dois prótons do estroma do cloroplasto, fica na forma totalmente reduzida (PQBH2). Similarmente, a excitação de P700 no PSI gera P700*, que pela perda de um elétron para A0 (provavelmente uma forma especial de clorofila), gerando A0- e P700+. A0- é um excelente doador de elétrons e inicia a transferência de elétrons por uma cadeia de transportadores (filoquinona – proteína Ferro-enxofre – ferrodoxina e ferrodoxina NADP+ oxido-redutase) até o NADP+ que é reduzido a NADPH. 440 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC Finalmente, os elétrons que geraram a PQBH2, a partir da excitação de P680, são conduzidos até PSI, onde a excitação gerou P700+, um forte agente oxidante. Os elétrons de PQBH2 passam, um a um, do complexo citocromo b6f para a plastocianina e terminam preenchendo a vacância do PSI. O complexo citocromo b6f, similarmente ao que ocorre para o complexo III na mitocôndria, transfere elétrons de um carreador de dois elétrons (PQBH2) para um carreador de um elétron (plastocianina), utilizando um mecanismo complexo que envolve proteína, ferro, enxofre, grupos heme, etc., forma o ciclo Q. Esse ciclo Q resulta em um bombeamento de prótons (até 4H+/par de elétrons) do estroma do cloroplasto para o lúmen do tilacóide, gerando um gradiente de H+ através da membrana tilacoideana durante o fluxo de elétrons do PSII para o PSI. A força prótonmotriz resultante desse gradiente dirige a síntese de ATP, denominada fotofosforilação (que será discutida posteriormente). A excitação do PSII resultou em vacância de elétrons no seu centro de reação fotoquímica (CRF). Assim, P680+ precisa adquirir um elétron para retornar ao seu estado basal e estar pronto para uma nova excitação. Para tanto, o PSII contém um complexo de cisão da água, o qual catalisa a clivagem fotolítica de duas moléculas de H2O em quatro prótons (liberados no lúmen do tilacóide), quatro elétrons e uma molécula de oxigênio. Essa clivagem fotolítica (processo de “quebra” da molécula de H2O mediado pela energia luminosa) requer a absorção de quatro fótons. Os quatro elétrons retirados da H2O não passam diretamente para P680+, que só pode receber um elétron por vez. Na verdade, um resíduo de tirosina (Tyr) de uma proteína do PSII doa um elétron para P680+ e perde também um próton para o meio, resultando no radical livre Tyr (∙ Tyr). O elétron e o próton doados são repostos quando ocorre a oxidação de um agregado de quatro íons de manganês (Mn) do complexo de cisão da água. O grau de oxidação do Mn pode variar de +2 a +7. Dessa forma, o agregado de quatro íons Mn pode perfeitamente aceitar quatro elétrons da H2O e transferir, um a um, para o resíduo de Tyr oxidado. Assim, na fotossíntese oxigênica, a fonte última de elétrons que resulta na redução de NADP+ a NADPH é a água. Esse fluxo de elétrons descrito pelo “Esquema Z” pode ser traduzido pela equação abaixo: Equação F2 2 H2O + 2 NADP+ + 8 fótons → O2 + 2 NADPH + 2 H+ Para cada quatro fótons absorvidos (dois por PS) dois elétrons são transferidos da H2O para o NADP+. Para haver liberação de oxigênio molecular são necessárias duas moléculas de H2O, a absorção de oito fótons (4 por PS), gerando assim quatro elétrons que se reduzirão a duas moléculas de NADP+. Fotofosforilação A síntese ATP por fotofosforilação (figura 9), da mesma forma que a fosforilação oxidativa mitocondrial, é também explicada pela teoria quimiosmótica de Peter Mitchell (ano). Os elétrons fluem da água até o PSII; deste para o PSI através de uma cadeia transportadora de elétrons e do PSI para o NADP+. Durante o fluxo de elétrons do PSII para o PSI, parte da energia liberada é usada para bombear prótons do estroma do cloroplasto para o lúmen do tilacóide, gerando um gradiente de prótons. A membrana tilacoideana, além de conter os PS, carreadores de elétrons, etc., contém uma enzima muito similar à FoF1 ATP sintase mitocondrial: a CFoCF1ATPsintase. Consórcio Setentrional de Ensino a Distância 441 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese Saiba mais A teoria Quimiosmótica propõe que a energia potencial do gradiente eletroquímico gerado pelo movimento de prótons através de membranas (por exemplo, através da membrana mitocondrial interna, que compartimentaliza a matriz mitocondrial e o espaço entre a membrana mitocondrial interna e externa) é, em parte, conservada na forma de ATP. Figura 9: Fluxo de elétron, bombeamento de prótons e fotofosforilação no tilacóide. Essa enzima viabiliza o retorno dos prótons ao estroma do cloroplasto e catalisa a síntese de ATP utilizando a energia do gradiente de prótons gerado pela transferência de elétrons dirigida pela luz. Esse mecanismo de síntese de ATP é denominado fotofosforilação. Atividade complementar 8 Pesquise sobre a fotofosforilação que ocorre nos cloroplastos e compare com a fosforilação oxidativa mitocondrial. De acordo com estimativas para a estequiometria da fotofosforilação, para cada O2 formado durante o fluxo de elétrons fotossintético, 12 prótons são conduzidos para o lúmen do tilacóide: quatro bombeados pelo complexo de cisão da H2O e oito pelo complexo citocromo b6f. A força próton-motriz, associada ao gradiente gerado, é de -17 kJ/mol. Considerando 12 moles, teríamos, em princípio, aproximadamente, 200 kJ de energia disponíveis para a síntese de ATP (ou seja, cerca de 6 mols de ATP). Resultados experimentais têm estimado 3 ATP´s por O2 produzido. Assim, a equação geral para a fotofosforilação (não cíclica) pode ser escrita como se segue: Equação F3 2 H2O + 2 NADP+ + ~3 ADP + ~3 Pi + 8 fótons → O2 + ~3 ATP + 2 NADPH + 2 H+ 442 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC Fotofosforilação cíclica Até agora consideramos o fluxo não cíclico de elétrons da H2O até o NADP+, que resulta em síntese de ATP e de NADPH e liberação de O2. Alternativamente pode ocorrer o fluxo cíclico de elétrons, que envolve apenas o PSI e resulta em síntese de ATP (denominada fotofosforilação cíclica), mas não de NADPH. Nesse processo também não há liberação de O2. A excitação de P700 no PSI resulta em P700*, que transfere seu elétron como já descrito. Porém a ferrodoxina da cadeia de transportadores associada ao PSI não continua até o NADP+, mas conduz o elétron de volta ao PSI através do complexo citocromo b6f e da plastocianina. A equação abaixo descreve a fotofosforilação cíclica: Equação F4 ADP + Pi + energia luminosa → ATP Atividade complementar 9 Procure mais informações sobre o fluxo cíclico de elétrons. O que justificaria esse fluxo alternativo de elétrons? Considerações importantes O processo de transferência de elétrons dirigido pela luz é, realmente, muito complexo e precisa ser muito bem regulado. No caso de organismos que realizam a fotossíntese oxigênica, que envolve dois PS diferentes, há necessidade de uma integração perfeita entre os dois CRF, o que requer uma organização espacial bem definida dos integrantes do processo fotossintético na membrana do tilacóide. Se os dois PS estivessem dispostos de forma contígua, a energia absorvida pelos complexos-antena do PSII poderia ser desviada para o CRF do PSI, comprometendo seriamente a excitação do PSII e a atuação seqüencial dos dois PS. Esse tipo de problema é contornado pela separação espacial de PSI e PSII na membrana tilacoideana. PSI localiza-se principalmente nas regiões da lamela estromal (regiões em que não há membranas tilacoideanas adjacentes e comprimidas), onde também se encontra a CFoCF 1ATP sintase. Essa disposição facilita o acesso a ADP e NADP + do estroma do cloroplasto. Por outro lado, PSII localiza-se quase que exclusivamente nas regiões da lamela granal, onde há justaposição de membranas. Os complexos coletores de luz (LHCII), associados à PSII, também ficam nessa região. Alterações nessa associação interferem, como veremos, no grau de associação de membranas adjacentes do grana. Considerando que a energia associada a comprimentos de onda aumenta na medida em que este diminui, podemos afirmar que a quantidade de energia requerida para excitar o PSII (P680) é maior do que a necessária para excitar o PSI (P700). Quando há luz intensa (sol brilhante), há maior incidência do componente de luz azul e PSII absorve mais luz que PSI; se a luminosidade é menos intensa há um maior componente de luz vermelha e PSI é mais excitado que PSII. Esse descompasso poderia inviabilizar a integração entre os dois PS se não houvesse um ajuste proporcionado por alterações na associação de LHCII ao PSII induzidas pela intensidade e comprimento de onda da luz. Se PSII for mais excitado que PSI (o que ocorre quando a luminosidade é intensa) haverá acúmulo de PQH2, pois este é produzido mais rápido do que o PSI pode oxidar. PQH2 ativa uma enzima (proteína cinase), a qual Consórcio Setentrional de Ensino a Distância 443 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese catalisa a fosforilação de um resíduo de treonina (Thr), no LHCII, enfraquecendo sua interação com PSII. Isso facilita a dissociação de LHCII, que então pode mover-se para a lamela estromal, onde se localiza PSI. Essa nova disposição facilita a transferência da energia dos fótons absorvida por LHCII para PSI excitando-o e aumentando a velocidade de oxidação de PQH2. Se PSI absorver mais luz que PSII (quando há menor intensidade luminosa), PSI terá capacidade de oxidação maior do que a quantidade de PQH2 produzida por PSII, resultando em acúmulo de PQ (plastoquinona oxidada), que ativa uma enzima (proteína fosfatase) que catalisa a defosforilação de LHCII, revertendo a situação promovida pela fosforilação. Certamente, esse é apenas um, entre os muitos mecanismos de regulação que ajustam o trabalho dos “atores biológicos” para garantir sua atuação seqüencial e a integração adequada com outros processos. Segunda fase: reações de assimilação de CO2 Precisamos agora compreender como a energia conservada na forma de ATP e de NADPH, produtos da primeira fase da fotossíntese, é utilizada para “fixar” e reduzir carbonos sintetizando compostos orgânicos simples. Ou seja, como ocorre a síntese fotossintética de carboidratos. O carbono é disponibilizado para as plantas na forma de CO2 e este tem acesso às células fotossintetizantes por meio de aberturas especiais, denominadas estômatos. Essa fase ocorre no estroma dos cloroplastos e, em muitas espécies vegetais, se dá, diretamente, por meio de um conjunto de reações denominado ciclo de Calvin (ou ciclo de redução fotossintética do carbono). Nesse ciclo, da mesma forma que em outras vias metabólicas cíclicas, (como o ciclo do ácido cítrico mitocondrial), ao fim de cada volta, o composto inicial precisa ser regenerado. No caso do ciclo de Calvin, esse composto é a ribulose 1,5-bifosfato (RuBP), uma pentose bifosforilada. Estudos, utilizando carbono marcado (14CO2), desenvolvidos na década de 1940 por Melvin Calvin e colaboradores, forneceram fortes indícios de que o primeiro composto detectável contendo carbono radiativo era o 3-fosfoglicerato (PGA), um composto contendo três átomos de carbono. Dessa forma, o ciclo de Calvin (Figura 10) também recebe a designação de Via C3. Essa terminologia é utilizada também para diferenciar plantas em que esse composto de três carbonos é o primeiro intermediário desse processo, plantas C3, daquelas denominadas plantas C4, que serão discutidas mais adiante. ADP (3) Estágio 3: regeneração do receptor CH2O CO2 (3) CHOH (3) CHOH Estágio 1: fixação CH2O Liberação de energia na via glicolítica; síntese de amido ou açucar P C O ATP P Ribulose-1,5bifosfato (3) (5) CHO (1) COO- CHO CH2O CHOH P CH2O P 3-fosfoglicerato (6) Gliceraldeído-3-fosfato (6) Estágio 2: redução Pi (6) ATP NADP (6) (6) + NADPH + H+ (6) ADP (6) Figura 10: ciclo de Calvin e os seus três estágios. 444 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC O ciclo de Calvin pode ser dividido três estágios: fixação, redução e regeneração do aceptor. No primeiro estágio (Figura 11), o CO2 é, enzimaticamente, condensado ao aceptor de cinco carbonos, a RuBP, formando um intermediário instável de seis carbonos (que permanece ligado à enzima); este é, imediatamente, hidrolisado em duas moléculas de 3fosfoglicerato (PGA), uma delas contendo a molécula de CO2 incorporada. A enzima que catalisa essa conversão é a ribulose 1,5-bifosfato carboxilase/oxigenase, abreviadamente, RUBISCO. A atividade carboxilase da RUBISCO é evidenciada pela reação do estágio de fixação do ciclo de Calvin. As características da RUBISCO, sua regulação e sua atividade oxigenase serão descritas posteriormente. O P CH2O O C H C H C O C OH H C O OH H C OH - P CH2O C H P Intermediário enediol H+ P CH2O C O CH2O Ribulose-1,5-bifosfato HO P CH2O COO- P CH2O HO C - COO- Carbanion H 3-fosfoglicerato + COOH C OH CH2O P 3-fosfoglicerato P CH2O HO H O H C COO- C OH C OH P CH2O H 2`-carboxi-3-cetoD-arabinitol-1.5-bifosfato (intermediário α - cetoácido) H+ P CH2O HO C COO- HO C O- H C OH CH2O Intermediário hidratado P Intermediário da reação com seis carbonos ligados à ribulose-1,5-bifosfato carboxilase (rubisco) Figura 11: Primeiro estágio do ciclo de Calvin. Consórcio Setentrional de Ensino a Distância 445 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese Atividade complementar 10 Se você é daqueles que têm interesse especial nos mecanismos químicos envolvidos nos processos biológicos, a análise da reação de carboxilação catalisada pela RUBISCO é um bom modelo para você explorar. Aproveite e discuta com colegas que tenham o mesmo tipo de interesse. No segundo estágio (Figura 12), que ocorre em dois passos, a primeira reação é a fosforilação do PGA em 1,3-bifosfoglicerato, à custa de ATP. Esse intermediário é, então, reduzido a gliceraldeído 3-fosfato (uma triose-fosfato), utilizando o potencial redutor do NADPH. A enzima que catalisa o primeiro passo é uma cinase (3-fosfoglicerato cinase) e a do segundo passo uma desidrogenase (gliceraldeído 3-fosfato desidrogenase). Esse estágio é, essencialmente, o reverso das reações correspondentes na glicólise (via do catabolismo de carboidratos descrita na unidade que trata da respiração celular) e as reações são catalisadas por isoenzimas daquelas citossólicas. O gliceraldeído 3-fosfato pode ser convertido em seu isômero, diidroxiacetona fosfato, pela ação de uma isomerase. Figura 12: Segundo estágio do ciclo de Calvin. O terceiro estágio (Figura 13) é constituído por um conjunto de reações, envolvendo o rearranjo do esqueleto carbônico de trioses-fosfato geradas no segundo estágio, que permite a regeneração da ribulose 1,5-bifosfato, utilizada no estágio de fixação do CO2. Essa regeneração é essencial para garantir a continuidade da incorporação de CO2 em um composto orgânico de três carbonos, o 3-fosfoglicerato (primeiro estágio do ciclo de Calvin), garantindo assim a síntese de carboidratos e outras biomoléculas. Essa conversão de trioses-fosfatos em pentoses bifosfato requer a participação de inúmeras enzimas, como transcetolases e transaldolases, e o gasto de um ATP por pentose-bifosfato regenerada. 446 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia Saiba mais As cinases e as desidrogenase são duas “famílias” de enzimas que desempenham um papel metabólico estratégico, catalisando reações de transferência de grupo fosfato e de transferência potencial redutor, respectivamente. P BSC Biológico H O OH C CH CH2O P B Gliceraldeído-3fosfato (a) Diidroxiacetonafosfato OH Gliceraldeído-3fosfato 6 Trioses fosfato O CH2 C CH2O H P O OH C CH CH2O P 6Pi 6NADP+ 6NADPH 6ADP 6ATP 3CO2 Diidroxiacetonafosfato Diidroxiacetonafosfato OH OH O CH2 C CH2O O CH2 C P Gliceraldeído-3fosfato CH2O H P O OH C CH CH2O Gliceraldeído-3fosfato H P O OH C CH CH2O Gliceraldeído-3fosfato P H O OH C CH CH2O P Pi Reações de fixação do CO2 P CH2O O H C OH H C OH H P 8 C O HO C H H C OH H C OH H C OH 3ATP O CH2O Frutose-1,6-bifosfato OH CH2OH H HO Frutose-6-fosfato OH H P CH2O P H HO P CH2O H HO OH2C H Rebulose-1.5bifosfato (3) 3ADP O OH2C HO C CH2O P TPP 1 Eritrose-4fosfato O TPP-2C H C H 2 H C C CH2O P TPP O O C H H C OH H C OH H C OH CH2O C OH H C OH H C OH CH2O Ribulose-5fosfato Ribulose-5fosfato CH2OH C O C OH H C OH CH2O Ribose-5fosfato P 6 CH2OH C O HO C H H C OH CH2O P Xilulose-5fosfato P 7 CH2OH C O H C OH H C OH CH2O P 5 7 P H TPP-2C H H CH2OH O CH2O C 3 C 4 P Sedoeptulose-7bifosfato Sedoeptulose-1,7bifosfato C HO OH OH CH2OH Xilulose-5fosfato Ribulose-5fosfato P Pi (b) 3C 3C 3C 3C 5C 4C 3C 7C 6C 5C 5C Figura 13: Terceiro estágio do ciclo de Calvin. Para que se tenha como resultado líquido a síntese de uma triose-fosfato, são necessárias três moléculas de CO2 e uma de fosfato inorgânico (Pi) e, é claro, três voltas no ciclo de Calvin, o que significa o consumo de nove moléculas de ATP e seis de NADPH. A figura 14 ilustra a estequiometria do ciclo de Calvin para a síntese de uma triose fosfato; processo que pode ser resumido pela equação geral apresentada abaixo: Consórcio Setentrional de Ensino a Distância 447 # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese Equação F5 3 CO2 + 3 H2O + 9 ATP + 6 NADPH + 6 H+ → Gliceraldeído 3-P + 6 NADP+ + 9 ADP + 8 Pi Figura 14: Estequiometria de assimilação de três moléculas de CO2 no ciclo de Calvin. Considerações importantes A maior parte das trioses-fosfato geradas (considerando o resultado líquido) pelo ciclo de Calvin é convertida em amido, no cloroplasto, e estocada ou exportada para o citossol da célula, onde é convertida em sacarose para ser transportada para outros tecidos vegetais (não fotossintéticos ou regiões em crescimento). No caso de folhas em desenvolvimento, uma parte significativa dessas trioses será oxidada no citossol, pela via glicolítica, gerando ATP para atender a demanda do tecido. Então, boa parte das trioses geradas precisa ser exportada para o citossol. Nas reações da primeira fase da fotossíntese, ATP e NADPH são sintetizados na mesma proporção (3/2) que são consumidos no ciclo de Calvin. A cada três voltas no ciclo, nove moléculas de ATP são hidrolisadas liberando nove moléculas de ADP e 8 de Pi, considerando que uma molécula de Pi foi incorporada na geração de uma triose-fosfato. Assim sendo, é necessário que a célula disponha de mecanismos para garantir a demanda de Pi livre no estroma; caso contrário a síntese fotossintética de ATP ficaria comprometida e, conseqüentemente, a assimilação de CO2. Outro ponto importante é que a alta seletividade da membrana interna do cloroplasto impede, inclusive, a passagem livre de compostos fosforilados, como os produtos da fotossíntese. Entretanto, a membrana interna do cloroplasto contém um sistema de transporte específico, denominado antiporte fosfato inorgânico – triose-fosfato, que mede a troca, um para um, de Pi e triose-fosfato. Isso viabiliza o movimento simultâneo de Pi citossólico para o estroma do cloroplasto e de triose-fosfato do estroma para o citossol da célula. Dessa forma, esse sistema de co-transporte contorna os problemas que poderiam advir da depleção de Pi no estroma ou do fato dos produtos da fotossíntese não serem exportados 448 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC para o citossol, evitando desencadar uma cascata de conseqüências danosas para os vegetais e para os organismos que deles dependem. É importante ressaltar que a regulação do metabolismo de carboidratos em plantas é muito complexa e o destino metabólico das trioses-fosfato sintetizadas por meio da fotosíntese requer uma regulação muito fina. Um regulador importante é a frutose 2,6-bifosfato. A concentração desse intermediário metabólico na planta é regulada pelos produtos da assimilação de carbonos, dirigida pela luz. Quando a taxa fotossintética está alta (como ocorre na presença de luz), há uma diminuição da concentração de frutose 2,6bifosfato por mecanismos que envolvem a regulação da atividade de cinases e fosfatases, ocorrendo o inverso em ausência de luz. Assim, a concentração de frutose 2,6-bifosfato na planta reflete sua taxa fotossintética. Atividade complementar 11 A regulação é um ponto fundamental para o entendimento do metabolismo. Assim, caro estudante, seria interessante procurar saber mais sobre a regulação do metabolismo de carboidratos em plantas, especialmente os mecanismos que envolvem a frutose 2,6 bifosfato. Ribulose 1,5-Bifosfato Carboxilase/Oxigenase – RUBISCO Saiba mais O termo turnover referese ao número de moléculas de substrato convertidas em produto, por uma única molécula de enzima, em uma unidade de tempo definida, considerando a condição de saturação da enzima pelo substrato. A RUBISCO é uma enzima realmente especial. É uma das principais responsáveis por uma atividade fundamental para todos os organismos heterotróficos (como nós) e é uma das enzimas mais abundantes da biosfera. A RUBISCO de plantas tem uma estrutura complexa de dezesseis subunidades, sendo oito subunidades grandes idênticas e oito subunidades pequenas, também idênticas. A função catalítica é exercida pelas subunidades grandes (cada subunidade contém um sítio catalítico), enquanto a função das subunidades pequenas ainda permanece incerta. A atividade carboxilase da RUBISCO está diretamente relacionada à produção de biomassa pelos vegetais. Cada molécula de RUBISCO pode fixar apenas três moléculas de CO2 por segundo, a 25°C, evidenciando um baixo número de turn over. Assim, para garantir altas taxas de fixação de CO2, a célula requer uma grande quantidade dessa enzima, a qual constitui quase 50% das proteínas solúveis do cloroplasto de vegetais. A RUBISCO inicia o processo de assimilação de CO2 e está sujeita à regulação por diversos mecanismos. Vamos, então, conhecer alguns deles. A conversão da RUBISCO na sua forma ativa requer a carbamilação de um resíduo específico de lisina (201Lys) e a ligação de um íon Mg+2. Esse íon é fundamental para a aproximação e orientação dos reagentes no sítio ativo. Contudo, a ribulose 1,5-bifosfato (um dos substratos da RUBISCO) inibe a carbamilação ao ligar-se ao sítio ativo da RUBISCO, alterando a conformação da enzima e impedindo o acesso ao resíduo de 201Lys (Figura 15). A enzima RUBISCO ativase contorna essa inibição, deslocando a ribulose 1,5-bifosfato ligada, à custa da hidrólise de uma molécula de ATP, deixando assim o resíduo de 201Lys acessível para a carbamilação não enzimática por CO2, seguida pela ligação do íon Mg+2. Algumas plantas, em ausência de luz, sintetizam um composto (2-carboxi-arabinitol 1-fosfato) muito similar ao β-cetoácido intermediário, formado na reação de carboxilação, catalisada pela RUBISCO. Esse composto, denominado “inibidor noturno”, é um potente inibidor da forma ativa da RUBISCO. Ele sofre hidrólise induzida pela luz ou é expulso do sítio ativo da enzima pela RUBISCO ativase, deixando a RUBISCO ativa. Atividade complementar 12 Pesquise sobre outros fatores que interferem na atividade da RUBISCO e também de outras enzimas que participam do ciclo de Calvin. Consórcio Setentrional de Ensino a Distância 449 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese + 3 i - As plantas realizam a fotossíntese, a respiração (mitocôndrial) e, também, a fotorrespiração, que consiste em uma reação dispendiosa, colateral ao processo fotossintético, e que ocorre em função da incapacidade da RUBISCO de discernir CO2 de O2. Além da atividade carboxilase, a ribulose 1,5-bifosfato carboxilase/oxigenase (RUBISCO), como o nome indica, apresenta também atividade oxigenase (Figura 16). Isso significa que a RUBISCO não tem especificidade absoluta para o CO2, podendo usar o O2 como substrato; mais ainda, como o sítio ativo é o mesmo para CO2 e O2, esses dois substratos competem para ocupar o sítio ativo da enzima. Se o O2, ao invés de CO2, ocupar o sítio ativo da RUBISCO, os produtos serão, ao invés de duas moléculas de 3-fosfoglicerato, uma molécula de 3-fosfoglicerato (três carbonos) e uma molécula de 2-fosfoglicolato (dois carbonos), um composto metabolicamente inútil. Conseqüentemente, a atividade oxigenase da RUBISCO compromete a fixação de CO2 e gera uma perda líquida para a célula. [ ] - 450 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC Atividade complementar 13 Pesquise e responda: considerando que a reação com o O2 (atividade oxigenase da RUBISCO) compromete significativamente o organismo, como se explica que a evolução tenha gerado uma enzima com sítio ativo que reconhece tal molécula como substrato? Ter gerado uma enzima sem especificidade absoluta para o CO2? A célula desenvolveu um mecanismo que minimiza a perda resultante da atividade oxigenase da RUBISCO, porém envolve um alto custo energético. Essa via é denominada via do Glicolato (Figura 17) e envolve três compartimentos celulares (cloroplasto, peroxissomo e mitocôndria) na conversão de duas moléculas de fosfoglicolato em uma molécula de serina (três carbonos) e uma de CO2. A serina é convertida em hidroxipiruvato, que é reduzido a glicerato e este, finalmente, é fosforilado (à custa de ATP) a 3-fosfoglicerato. - - + + Glicina descarboxilase CO2 liberado na fotorrespiração Consórcio Setentrional de Ensino a Distância 451 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese A ocorrência combinada da atividade oxigenase da RUBISCO com a via do glicolato consome O2 adicional e produz CO2 (da mesma forma que a respiração mitocondrial) e é dirigido pela luz (como a fotossíntese). Por isso, recebeu a denominação de fotorrespiração. Essa via termina gastando ATP e NADPH produzidos pela fotossíntese e pode comprometer a formação de biomassa em até 50%. Considerações importantes O CO2 corresponde a 0,04% da atmosfera atual, enquanto o O2 corresponde a aproximadamente 20%. Sabe-se que o O2 compete com o CO2 pelo sítio ativo da RUBISCO e que a relação condensação de CO2/condensação de O2 é de aproximadamente 3/1, ou seja, há uma taxa significativa de fotorrespiração. A solubilidade de CO2 e de O2 depende da temperatura e, em temperaturas mais altas, a razão O2/CO2 em solução aumenta. Além disso, com o aumento da temperatura ocorre uma diminuição da afinidade da RUBISCO por CO2, favorecendo a reação com O2. Algumas adaptações evolutivas surgiram (especialmente em plantas de climas mais quentes) minimizando a ineficiência no processo de assimilação de CO2. Muitas plantas que crescem nos trópicos desenvolveram um mecanismo, no qual o CO2 é “pré-fixado” temporariamente em um composto de quatro carbonos (malato), antes da fixação definitiva por meio do ciclo de Calvin. O malato é, a seguir, descarboxilado, liberando CO2 para a RUBISCO. A enzima que “pré-fixa” o CO2 (na forma de HCO3-), a fosfoenolpiruvato carboxilase, tem alta afinidade por CO2 e não usa O2 como substrato. Essa adaptação resulta em aumento da concentração local de CO2, favorecendo a atividade carboxilase da RUBISCO. Essas plantas receberam a denominação de plantas C4 e o processo de assimilação de carbono que desenvolveram, de via C4. Por outro lado, as plantas cujo primeiro passo para a assimilação do CO2 é a reação de condensação do CO2 à ribulose 1,5-bifosfato para formar 3-fosfoglicerato, um composto de três carbonos, recebem a denominação de plantas C3. As plantas C4 (por exemplo, milho, sorgo, cana-de-açúcar, capim da roça, etc.) crescem em regiões de altas temperaturas e alta intensidade luminosa; têm altas taxas fotossintéticas e de crescimento; baixas taxas de fotorrespiração e de perda de água e, além disso, têm estruturas especializadas nas folhas (células mesofílicas e células do envoltório do feixe). A figura 18 apresenta a via de assimilação de carbono das plantas C4. Outro ponto fundamental a ser considerado é o gasto energético. As plantas C4 utilizam cinco moléculas de ATP por molécula de CO2 assimilada, enquanto as plantas C3 utilizam três. A análise simples do gasto de energia pode induzir-nos a pensar que as plantas C4 desenvolveram uma adaptação desvantajosa. Entretanto, se considerarmos que a afinidade da RUBISCO por CO2 diminui com o aumento da temperatura, em determinadas temperaturas (entre 28 e 30°C), esse custo energético para contornar a fotorrespiração será muito vantajoso para a planta C4. Figura 18: Reações da via C4. 452 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC Atividade complementar 14 Existem, certamente, outras adaptações para contornar um possível aumento da fotorrespiração, como, por exemplo, a desenvolvida pelas chamadas plantas CAM. Pesquise e avalie a adaptação desenvolvida pelas plantas CAM e compare com a das plantas C4. Fotossíntese em bactérias O estudo da fotossíntese bacteriana agregou conhecimentos, especialmente no entendimento dos eventos moleculares, essenciais para a compreensão do processo fotossintético. O mecanismo de absorção da energia luminosa em bactérias envolve apenas um fotossistema, com um de dois tipos básicos de centro de reação fotoquímica (CRF). O CRF tipo I (feofitina-quinona) envolve a transferência de elétrons da feofitina (Pheo) para uma quinona e o tipo II (Fe-S), em que ocorre o fluxo de elétrons para um centro ferro-enxofre através de uma quinona. A bactéria púrpura, por exemplo, apresenta CRF tipo II e a excitação do fotossistema pela luz promove um fluxo cíclico de elétrons. A absorção dos fótons de luz dirige os elétrons do CRF, P870, através de uma cadeia de carreadores de elétrons passando por um complexo citocromo bc1 e pelo citocromo c2, retornando ao CRF. Durante o fluxo de elétrons pelo citocromo bc1, há um bombeamento de prótons, gerando um gradiente quimiosmótico e uma força próton-motriz, que promoverá a síntese de ATP (fotofosforilação). A maquinaria fotossintética da bactéria sulfurosa verde envolve um CRF do tipo I e a excitação do CRF, P840, pela luz pode gerar um fluxo cíclico de elétrons (como na bactéria púrpura) ou gerar um fluxo não-cíclico de elétrons. Nesse caso, a excitação causa o fluxo de elétrons do CRF, P840, para o NAD(P)+, através de uma proteína ferro-enxofre (ferrodoxina), reduzindo-o a NAD(P)H. A reposição dos elétrons do CRF, geralmente, é feita através da oxidação de compostos sulfurosos reduzidos, como o sulfeto de hidrogênio (H2S). Essa oxidação do H2S é análoga à oxidação da H2O, que ocorre na fotossíntese oxigênica. Dessa forma, há síntese de ATP (fotofosforilação) e também geração de potencial redutor. As cianobactérias formam um grupo com morfologia e fisiologia diversa, que surgiu na Terra há bilhões de anos e são os únicos procariotos que realizam fotossíntese oxigênica. A maquinaria fotoquímica, geradora de oxigênio de cianobactérias, provavelmente foi essencial para gerar uma atmosfera que propiciasse o desenvolvimento da respiração aeróbia. As cianobactérias foram originalmente classificadas como algas (algas azul-esverdeadas) porque continham clorofila “a” e realizavam fotossíntese oxigênica. Depois, a microscopia eletrônica revelou sua estrutura celular procariótica e elas passaram a ser classificadas como bactérias (bactérias verde-azuladas). Contudo, hoje persiste uma nomenclatura dual para as cianobactérias. Esses organismos, apesar de não apresentarem nem cloroplasto nem mitocôndria, são capazes de gerar ATP tanto por fotofosforilação, quanto por fosforilação oxidativa (mecanismo apresentado na unidade referente à respiração celular). A membrana plasmática das cianobactérias apresenta uma estrutura contendo muitos dobramentos, onde está inserida a maquinaria para ambos os processos. A capacidade das cianobactérias de realizar a síntese de ATP utilizando esses dois mecanismos (fotofosforilação e fosforilação oxidativa) deve estar atrelada a características morfológicas e metabólicas peculiares. Seria interessante conhecê-las em mais detalhes, você não acha? Consórcio Setentrional de Ensino a Distância 453 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese Atividade complementar 15 Pesquise sobre as cianobactérias, especialmente sua estrutura e formas de obtenção de energia; compare-a com outros procariotos e, também, com eucariotos. Para finalizar esta parte, gostaria de indicar o site: http://www.splammo.net/bact102/102pnsb.html No qual você terá acesso a um artigo sobre a fantástica bactéria fotossintética nãosulfurosa púrpura. Certamente, você também vai ficar impressionado com a versatilidade desses microorganismos; com a capacidade que essas bactérias têm para usar uma diversidade de fontes de matéria e energia. Conhecer esses organismos e suas estratégias de sobrevivência estimula-nos a buscar mais conhecimento para entender a vida. #M2U12 III. Quimiossíntese O termo “quimiolitotrofia” foi proposto pelo microbiologista russo Sergei Winogradsky, quando do desenvolvimento de estudos em bactérias oxidantes de enxofre, referindo-se à liberação de energia associada à oxidação de compostos inorgânicos. Além das contribuições relativas às bactérias oxidantes de enxofre, ele demonstrou que o processo de nitrificação (oxidação de amônia a nitrato) era resultado de atividade bacteriana. Winogradsky foi um microbiologista excepcional e agregou conhecimentos essenciais ao desenvolvimento da bioquímica de microorganismos. A capacidade de utilizar a energia armazenada em compostos inorgânicos é, praticamente, exclusiva de organismos procariotos e tal processo bacteriano é considerado essencial para a manutenção dos ciclos biogeoquímicos da natureza. A observação de atividade quimioautotrófica em organismos superiores, como no caso da nitrificação em certos fungos, é rara e não afeta o ambiente de forma significativa. “Quimiossíntese” é o termo geral usado para indicar a síntese de moléculas orgânicas, a partir de CO2 e H2O, utilizando a energia química de compostos inorgânicos, como NH4+, H2, H2S e Fe2+ (lembre-se que, analogamente, quando a energia usada provém da luz, a designação é fotossíntese). Nesse processo, o doador de elétrons também é um composto inorgânico. A quimiossíntese é, geralmente, realizada por bactérias quimiossintetizantes, as quais são também designadas quimioautotróficas, quimiolitotróficas ou quimiolitoautotróficas. Os diferentes grupos de bactérias quimiolitotróficas que existem podem ser diferenciados em função do composto inorgânico que oxidam para obter energia. Assim, temos: bactérias nitrificantes oxidam compostos reduzidos contendo nitrogênio; bactérias oxidantes de enxofre oxidam compostos reduzidos contendo enxofre; bactérias oxidantes de ferro oxidam ferro reduzido e, por fim, as bactérias de hidrogênio oxidam o gás hidrogênio. Existem ainda as bactérias acetogênicas, que produzem ácido acético a partir de CO2, e as carboxidobactérias, que oxidam monóxido de carbono além de H2, as quais 454 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC fazem parte do grupo das bactérias oxidantes de hidrogênio. Vamos, então, considerar alguns desses grupos. Bactérias nitrificantes As bactérias nitrificantes (Figura 19) estão presentes tanto no solo como na água, especialmente em ambientes de pH alcalino ou neutro, onde a amônia é mais abundante que o íon amônio e mais carbonato está disponível para a fixação de CO2. A maioria das espécies é quimiolitotrófica facultativa, pois pode crescer em meio completamente inorgânico, mas pode também utilizar fontes orgânicas de carbono, tal como o acetato, para seu crescimento. Acredita-se que os sistemas de citocromos, responsáveis pela oxidação de amônia, nitrito e também pela geração de potencial redutor (NAD(P)H) da maioria dessas bactérias, está contido em um complexo sistema citoplasmático de membranas. As bactérias nitrificantes obtêm a energia para crescer a partir de compostos inorgânicos nitrogenados reduzidos, principalmente amônia (NH3) e nitrito (NO2-). Um grupo de nitrificadores, denominado “oxidante da amônia” ou nitrosificantes, oxida a amônia a nitrito. Um outro grupo, os “oxidantes de nitrito”, também conhecido como as bactérias nitrificantes verdadeiras (produtoras de nitrato), oxidam nitrito a nitrato. As equações abaixo evidenciam a estequiometria geral desses processos: Equação Q1 2 NH3 + 3 ½ O2 → 2 NO2- + 3 H2O Equação Q2 NO2- + ½ O2 → NO3Para realizar a oxidação completa da amônia a nitrato é necessária a atividade seqüencial dos dois grupos de bactérias acima citados, visto que nenhuma bactéria nitrificante sozinha tem a capacidade de realizar esses dois passos seqüenciais. Assim, para garantir a oxidação efetiva da amônia a nitrato, é necessário que esses dois grupos de bactérias nitrificantes cresçam em estreita associação e que esses dois passos estejam perfeitamente acoplados. Em geral, a denominação de gênero iniciada por “nitroso” é dada às bactérias nitrosificantes e a denominação iniciada por “nitro” é dada às bactérias nitrificantes verdadeiras (que produzem nitrato). As nitrosificantes são geralmente do gênero Nitrosomonas e as nitrificantes verdadeiras são geralmente do gênero Nitrobacter. Grupo oxidante da amônia – nitrosificantes A oxidação da amônia a ácido nitroso ocorre em dois passos, como mostrado nas equações abaixo, tendo como intermediário a hidroxilamina (NH2OH): Consórcio Setentrional de Ensino a Distância 455 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese Equação Q3 NH3 + O2 + XH2 → NH2OH + H2O + X A reação acima é catalisada pela enzima amônia mono-oxigenase (AMO). Equação Q4a NH2OH + X → HNO + XH2 X é um carreador de hidrogênio, como o NAD+. Equação Q4b HNO + H2O → HNO2 + 2 H+ + 2eA enzima que catalisa as reações Q4a e b acima é a hidroxilamina oxido-redutase (HAO) e a variação de energia livre padrão (ΔG°’) da oxidação de amônia a ácido nitroso é -275 kJ/mol. É importante notar que o potencial redutor gerado na equação Q4a “alimenta” a reação Q3 e os elétrons da equação Q4b são transportados por um amplo sistema de citocromos ligado à membrana bacteriana. Esse fluxo de elétrons gera energia livre suficiente para a síntese de ATP. Como? Bem, se você se recorda do mecanismo de fotofosforilação, fica mais fácil entender o que ocorre neste caso. Os ácidos gerados pela oxidação de compostos inorgânicos nitrogenados resultam na liberação de prótons (H+) que são transportados através da membrana, gerando uma força próton-motriz e viabilizando a síntese de ATP pela ATPase (ATP sintase) da membrana celular. O poder redutor gerado durante os processos de oxidação é utilizado nas reações de fixação de CO2 que ocorrem no ciclo de Calvin. Grupo oxidante de nitrito – nitrificantes verdadeiras A oxidação do nitrito a nitrato ocorre em apenas um passo, como apresentado na equação abaixo, catalisado pela enzima nitrito oxido-redutase (NOR) e o ΔG°’ é -76 kJ/mol: Equação Q6 NO2- + H2O → NO3- + 2 e- + 2 H+ Os elétrons provenientes da água fluem por uma cadeia de citocromos até o oxigênio, reduzindo a água no citoplasma da célula bacteriana. O gradiente resultante do acúmulo de prótons no espaço periplasmático gera uma força próton-motriz através da membrana celular, que é utilizada para a síntese de ATP, por mecanismos quimiosmóticos. O potencial redutor (NAD(P)H) é gerado por transferência reversa de elétrons, um processo que requer energia. Nesse processo, a enzima ATP sintase da membrana, ao invés de sintetizar ATP (como geralmente faz), hidrolisa-o liberando energia para reduzir NADP+ a NADPH que será utilizado na redução de CO2 em carboidratos no ciclo de Calvin. O sistema gerador de energia das bactérias nitrificantes tem um rendimento relativamente baixo. Isso implica restrições energéticas para esses organismos, especialmente para as oxidantes de nitrito. Talvez, para contornar, em parte, essa forte restrição energética, a maioria dos oxidantes de nitrito é também quimiorganotrófica, podendo usar glicose e outros substratos orgânicos como fonte de energia. Atividade complementar 16 O metabolismo das bactérias nitrificantes é, em geral, estritamente aeróbio. Entretanto a amônia também pode ser oxidada em condições anóxicas, por meio de um processo denominado “anamox”. Pesquise sobre esse processo e compare-o com o descrito acima. 456 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia Saiba mais A enzima AMO (amônia monooxigenase) é uma proteína integral de membrana, cuja atividade enzimática é essencial para esse processo. Apresenta uma ampla especificidade, podendo também oxidar metano, o que a torna semelhante à bactéria oxidante de metano. Esta enzima é inibida por várias substâncias, incluindo o acetileno (muito utilizado em investigações na área ecológica). Saiba mais A enzima HAO (hidroxilamina oxido-redutase) é uma enzima periplasmática que catalisa a reação de oxidação da hidroxilanina a HNO e subsequentemente a ácido nitroso, gerando energia. O HNO pode ser degradado, espontaneamente, a N2O, óxido nitroso (conhecido como “gás hilariante” e que, se você procurar saber mais sobre ele, verá que já foi utilizado como anestésico). P Biológico BSC Considerações importantes Os organismos nitrificantes têm o metabolismo muito ativo, o que compensa suas concentrações relativamente baixas no ambiente. O nitrito, agente mutagênico para plantas e animais, não se acumula porque é rapidamente oxidado a nitrato, em função da associação entre oxidantes de amônia e oxidantes de nitrito. No solo, a atividade das bactérias nitrificantes é fundamental para a ciclagem do nitrogênio. A alta solubilidade do nitrato permite que ele seja rapidamente carreado pela água de superfície. Além disso, organismos denitrificadores podem converter o nitrato em nitrogênio gasoso, facilitando sua eliminação do solo. Outro ponto relevante em termos ambientais é o óxido nitroso (N2O), substância intermediária formada nos processos realizados pelos organismos nitrificadores e denitrificadores, a qual pode reagir fotoquimicamente com o ozônio atmosférico, o que poderia comprometer a camada de ozônio. Todavia, a atividade bacteriana existe há bilhões de anos e não inviabilizou o estabelecimento e a manutenção dessa camada. O problema vigente da destruição da camada de ozônio é, quase certamente, decorrente do avanço tecnológico da civilização humana, especialmente a liberação de CFC (cloro-fluor-carbono) na atmosfera. Atividade complementar 17 A liberação de CFC tem sido alvo de discussão no mundo todo. Pesquise sobre esse tema e discuta com seus pares sobre os fatores que contribuem para o comprometimento da camada de ozônio. Seria interessante também refletir sobre possíveis alterações nas atividades humanas que poderiam evitar o avanço da destruição da camada de ozônio. Oxidantes de enxofre A oxidação de compostos inorgânicos reduzidos, contendo enxofre é a fonte de energia para muitos grupos de bactérias litotróficas. Dois desses grupos, os “oxidantes de enxofre unicelulares” e os “oxidantes de enxofre filamentosas”, fazem parte do domínio Eubactéria. Outros oxidantes de enxofre, como a família Sulfolobaceae, fazem parte do domínio Archaea. Algumas bactérias, como a Thiobacillus ferrooxidans, podem oxidar também pirita (FeS2), formando óxido e sulfato férrico e podem obter energia tanto da oxidação do ferro quanto do enxofre. Trataremos aqui do metabolismo energético de alguns grupos de Eubactérias. Figura 20: Thiobacillus thiooxidans. Consórcio Setentrional de Ensino a Distância 457 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese Os principais gêneros do grupo de Eubactérias oxidantes de enxofre unicelulares são o Thiobacillus, que habita o solo e a água; o Thiomicrospira, comum em habitats marinhos; e o Thermothrix, que cresce em temperaturas entre 40 e 80°C em condições de pequena disponibilidade de oxigênio. Os oxidantes de enxofre filamentosos são comuns em ambientes aeróbicos que têm disponibilidade de sulfeto. Esse tipo de habitat, que favorece um ciclo ativo de enxofre, é denominado “sulfureta”. Os gêneros mais estudados são o Beggiatoa e o Thioploca. Algumas eubactérias oxidantes de enxofre usam como fonte de energia o enxofre elementar (S0), outras usam tiossulfato (S2O32-). O sulfeto também é utilizado e pode ser fornecido como sulfeto de hidrogênio ou como sulfeto metálico (como sulfeto de ferro ou de cobre). Algumas espécies que usam o sulfeto de hidrogênio (H2S) como fonte de energia podem depositar o enxofre elementar, resultante da oxidação inicial do H2S, em seu interior. Essa reserva de energia pode atender à demanda energética em situações emergenciais, através da oxidação do enxofre em sulfato. Cabe salientar que o enxofre elementar tem baixíssima solubilidade, o que poderia comprometer sua absorção quando é fornecido a partir de fonte exógena. Se for este o caso, é necessário que o organismo cresça aderido à partícula de enxofre, para que possa obtê-lo. Esse processo de aderência é, provavelmente, mediado por proteínas de membrana ou periplasmáticas, que solubilizam o enxofre, por meio da redução de S0 a HS-, que, a seguir, pode ser internalizado e utilizado no metabolismo quimiolitotrófico. Há, ainda, bactérias que têm versatilidade para oxidar três fontes diferentes de enxofre. Entretanto, independentemente da forma de enxofre oxidada, o produto final será o ácido sulfúrico, como ilustrado pelas equações apresentadas abaixo: Equação Q7 S2- + 4 O2 → 2 SO42Equação Q8 2 S0 + 3 O2 + 2 H2O → 2 H2SO4 Equação Q9 S2O32- + 2 O2 + H2O → 2 SO42- + 2 H+ Um exemplo interessante é o caso do Thiobacillus spp., em que o sulfeto, o enxofre elementar e o tiossulfato podem ser os substratos reduzidos a serem oxidados pela enzima sulfeto oxidase para formar sulfito, o qual pode seguir dois diferentes caminhos metabólicos. O caminho mais comum envolve a oxidação do sulfito (SO32-) a sulfato pela enzima sulfito oxidase, que transfere elétrons para o citocromo c, gerando o bombeamento de prótons e a síntese de ATP. Alternativamente, o sulfito é oxidado a sulfato, que é transferido para AMP (adenosina monofosfato) para formar adenosina fosfosulfato (APS). A enzima que catalisa essa reação é a adenosina fosfosulfato redutase, atuando de forma reversa. O ATP é formado a partir do gradiente de prótons e o ADP por fosforilação ao nível do substrato. Esses dois caminhos metabólicos são ilustrados pelas equações que se seguem: Equação Q10.1 SO32- → SO42- + 2 eEquação Q10.2a SO32- + AMP → APS + 2 eEquação Q10.2b APS + Pi → ADP + SO42- 458 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia Saiba mais Durante o crescimento das bactérias sulfurosas há uma diminuição do pH resultante da produção de ácido sulfúrico, podendo chegar a pH 1,0, como no caso da bactéria acidofílica Thiobacillus thiooxidans. Mesmo em tal condição extrema de pH, o organismo mantém a viabilidade. P Biológico BSC De uma forma geral, todos os elétrons obtidos a partir de compostos sulfurados reduzidos são transportados até o O2 através de um sistema de carreadores de elétrons, gerando uma força próton-motriz que viabiliza a síntese de ATP. O potencial redutor requerido para a fixação autotrófica de CO2 pelo ciclo de Calvin é obtido, como no caso das bactérias oxidantes de nitrito, a partir do fluxo reverso de elétrons; o que implica gasto extra de ATP. O grupo dos quimiolitotróficos do enxofre é, em sua maioria, aeróbio, mas algumas espécies, como a Thiobacillus denitricans, podem crescer anaerobicamente, usando nitrato como aceptor de elétrons. Oxidantes de ferro A crosta terrestre tem ferro em abundância, sendo encontrado na natureza, principalmente nas formas férrica (Fe3+) e ferrosa (Fe2+). Além da redução de natureza química, o Fe3+ pode ser reduzido através dos mecanismos da respiração anaeróbia e o Fe2+ pode ser reduzido, como apresentado, por meio do metabolismo quimiolitotrófico. As bactérias oxidantes de ferro apresentam um metabolismo muito interessante envolvendo essas formas de ferro. Além disso, estão relacionadas a importantes processos ecológicos, especialmente em ambientes poluídos por ácidos. São poucas as espécies de bactérias capazes de obter energia a partir da oxidação do ferro ferroso (Fe2+) ao ferro férrico (Fe3+) e os oxidantes conhecidos requerem oxigênio para realizar esse processo. Para viabilizar o crescimento dessas bactérias é necessário que grande quantidade de ferro seja oxidada, pois a quantidade de energia disponibilizada por meio desse processo de oxidação é pequena. Em meio aquoso, o ferro férrico (Fe3+) produzido tende a precipitar como hidróxido férrico [Fe(OH)3]. Ferro ferroso (Fe2+) é instável em condições aeróbias e pH fisiológico (próximo à neutralidade), visto que sua oxidação ocorre espontaneamente. Contudo, em pH ácido, mesmo em condições óxicas (presença de O2), o Fe2+ é estável. Assim, as bactérias que realizam esse processo ou vivem em condições de pH muito ácido (são acidófilas obrigatórias) ou em ambientes com baixíssima disponibilidade de O2. As espécies de bactérias oxidantes do ferro (Figura 21) mais conhecidas são a Thiobacillus ferrooxidans, a Leptospirillum ferrooxidans, a Gallionella ferruginea e a Sphaerotilus natans. Figura 21: a) Thiobacillus ferrooxidans; b) Leptospirillum ferrooxidans; c) Gallionella ferruginea; d) Sphaerotilus natans, espécies de bactérias oxidantes de ferro. Consórcio Setentrional de Ensino a Distância 459 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese As espécies de oxidantes de ferro Thiobacillus ferrooxidans e Leptospirillum ferrooxidans crescem caracteristicamente em meio ácido (como os escoadouros de minas de carvão), utilizando Fe2+ como doador de elétrons. Essas bactérias crescem em associação com bactérias oxidantes de enxofre e têm um papel importante na poluição de minas ácidas e na oxidação mineral. Algumas espécies oxidantes de ferro vivem em pH neutro, apesar do Fe2+ ser instável em tais condições, a partir da utilização do Fe2+ mobilizado de condições anóxicas para condições óxicas. As regiões de interface entre águas subterrâneas anóxicas (ricas em Fe2+) e o ar (como, por exemplo, “bolsões de ar”) viabilizam esse processo. Espécies como Gallionella ferruginea e Sphaerotilus natans crescem em tais interfaces e oxidam o Fe2+, gerado em ausência de O2, antes que a oxidação espontânea se processe. A bactéria aeróbica Thiobacillus ferrooxidans obtém energia oxidando Fe2+ por um processo muito interessante, na medida em que consegue tirar vantagens energéticas a partir das características de seu ambiente. Ela utiliza o ferro como fonte de energia em um ambiente em que o pH externo é dois. O pH citoplasmático sob essas condições é cerca de seis. Em pH dois o ferro está principalmente na forma solúvel (Fe2+) e há uma grande disponibilidade de H+ nas proximidades da superfície da membrana externa. A cadeia de transporte de elétrons dessas bactérias contém citocromos dos tipos c e a1 e rusticianina, uma proteína periplasmática que contém cobre. A rota de fluxo de elétrons até o oxigênio (O2/H2O, E0’, potencial padrão de redução igual a +0,82) tende a ser muito curta, especialmente devido ao elevado E0’ do par Fe3+/Fe2+ (+0,77V, em pH 2). A oxidação inicia-se no periplasma, onde a rusticianina remove os elétrons do Fe2+ produzindo Fe3+ insolúvel. A rusticianina reduzida transfere elétrons para o citocromo c e este, então, reduz o citocromo a1 na superfície interna da membrana citoplasmática. Os elétrons, então, são transferidos para o oxigênio (1/2O2) com a concomitante captação de prótons (H+) do citoplasma, reduzindo-o a H2O. Uma série dessas reações pode resultar em diminuição da concentração de H+ no interior da célula e, conseqüentemente, em um gradiente de H+ através da membrana (maior concentração de H+ externamente). Os H+ tendem a dirigir-se do ambiente externo para o ambiente interno (a favor do gradiente de concentração), liberando energia para a síntese de ATP pela ATPase da membrana. Assim, podemos dizer que a função da cadeia de transporte de elétrons na Thiobacillus ferrooxidans é bombear elétrons de fora para o citoplasma, onde por sua vez os H+ são removidos (durante a formação de H2O), promovendo a síntese de ATP. Dessa forma, havendo disponibilidade de Fe2+ para T. ferroxidans, a síntese de ATP pode ocorrer devido à força próton-motriz resultante do gradiente natural existente através da membrana citoplasmática. A equação abaixo ilustra o processo de oxidação do Fe2+ a Fe3+, com redução do oxigênio a H2O: Equação Q11 2 Fe2+ + O2 + 2 H+ → 2 Fe3+ + H2O As bactérias T. ferroxidans utilizam como fonte de carbonos o CO2 e requerem ATP e potencial redutor para reduzi-lo a compostos orgânicos através do ciclo de Calvin. O potencial redutor é obtido por meio do fluxo reverso de elétrons (já mencionado), com gasto extra de ATP. 460 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC Oxidantes de hidrogênio A capacidade de utilizar o gás hidrogênio (H2) como doador de elétrons é compartilhada por um grande número de organismos quimiolitotróficos, tanto do domínio Bacteria quanto do Archaea. Os principais gêneros são Ralstonia e Alcaligenes. Consideraremos aqui, especialmente, as bactérias oxidantes de H2 que desenvolvem metabolismo aeróbio, embora muitos destes oxidantes realizem o metabolismo anaeróbio para crescer, utilizando diferentes aceptores de elétrons, como o nitrato e o sulfato. Figura 22: Alcaligenes eutrophus, bactéria oxidante de hidrogênio. O hidrogênio gasoso (H2) é uma excelente fonte de energia e sua oxidação é realizada por diferentes grupos de Eubacterias. Um grupo, denominado mesofílico, é quimiolitotrófico facultativo e pode usar também fonte orgânica de carbono para crescer. Um segundo grupo é o constituído por Eubactérias termofílicas e há ainda dois outros grupos, as carboxidobactérias, que oxidam monóxido de carbono (CO) e hidrogênio, e as bactérias acetogênicas, que produzem ácido acético a partir de CO2. Os organismos oxidantes de hidrogênio típicos conservam energia na forma de ATP, a partir da força próton-motriz gerada na reação de oxidação do H2 pelo O2. A reação geral, apresentada abaixo, envolve a liberação de grande quantidade de energia (ΔG°’= -237 kJ/mol) e é catalisada pela hidrogenase, uma enzima ligada à membrana. Equação Q12 H 2 + ½ O 2 → H 2O Os elétrons do H2 são transferidos para o O2 através de uma cadeia de transportadores constituída por uma quinona e uma série de citocromos. O metabolismo de algumas espécies oxidantes de H2 envolve duas hidrogenases, uma associada à membrana envolvida com a energética de síntese de ATP e uma hidrogenase solúvel que oxida o H2 e transfere os elétrons, diretamente, para NAD+, reduzindo-o a NADH. Como o potencial redutor do H2 (-0,42) é muito baixo viabiliza essa transferên- Consórcio Setentrional de Ensino a Distância 461 B # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese cia direta de elétrons, evitando o gasto de ATP para gerar poder redutor através do fluxo reverso de elétrons. As bactérias oxidantes de H2 quimiolitotróficas podem usar CO2 como fonte única de carbono e, assim, realizam a redução do carbono através do ciclo de Calvin. A equação abaixo apresenta a estequiometria geral desse processo. A fórmula (CH2O) está representando compostos celulares: Equação Q13 6 H2 + 2 O2 + CO2 → (CH2O) + 5 H20 Como já mencionado, a maioria das bactérias oxidantes de H2 típicas é quimiolitotrófica facultativa, ou seja, é também quimiorganotrófica (isto é, capaz de crescer utilizando compostos orgânicos como fonte de energia). Essa é uma das principais diferenças entre os quimiolitotróficos do hidrogênio e as diversas bactérias quimiolitotróficas de enxofre e nitrificantes, cujos membros são, em sua maioria, quimiolitotróficos obrigatórios. As bactérias oxidantes de H2 típicas, quando em condições de grande disponibilidade de compostos orgânicos como a glicose, têm a síntese das enzimas hidrogenases e a repressão das do ciclo de Calvin. Assim, tais bactérias, para tirar proveito de tal versatilidade, precisam dispor de um mecanismo de regulação muito sensível para alterar a atividade das suas enzimas, em função da disponibilidade de material, aos metabolismos quimiolitotrófico e quimiorganotrófico. Um aspecto importante a ser ressaltado é que a maioria das bactérias do hidrogênio tem o crescimento favorecido por condições microaeróbias. Nestas condições, elas utilizam o metabolismo quimiolitotrófico a partir do H2, pois a hidrogenases são sensíveis ao oxigênio. Concentrações de oxigênio entre 5% e 10% e a presença de níquel (Ni2+ é cofator das hidrogenases) favorecem o crescimento das bactérias oxidantes de H2. Assim sendo, considerando que na natureza a disponibilidade de H2 em ambientes óxicos é muito baixa e inconstante, é provável que as interfaces entre ambientes óxicos e anóxicos tenham as condições mais adequadas para o crescimento desses microorganismos, visto que nessas regiões o H2 resultante do metabolismo fermentativo de alguns organismos ficaria disponível em maior quantidade e maior constância, favorecendo o metabolismo quimiolitotrófico de H2 nessas bactérias. Carboxidobactérias Antes de abordarmos as carboxidobactérias, é importante ressaltar alguns aspectos do monóxido de carbono (CO). O CO é gerado pela combustão incompleta de madeira, carvão e óleo, sendo, portanto, comum no ambiente. CO é um composto letal para os seres humanos e para outros animais, pois se liga irreversivelmente à hemoglobina, comprometendo o transporte de oxigênio aos tecidos e, conseqüentemente, o metabolismo aeróbio. Contudo, os níveis de CO na atmosfera não têm sofrido alteração significativa por muitos anos. Provavelmente, o fator mais importante na manutenção dos níveis de CO atmosféricos seja o consumo microbiano de CO. Felizmente, para todos nós, as carboxidobactérias estão amplamente distribuídas no solo e em ambientes aquáticos e são muito eficientes na degradação do CO. A presença de bactérias carboxidotróficas nas camadas superficiais do solo é fundamental para retirar o CO liberado em ambientes óxicos, que ocorre principalmente pela combustão incompleta de combustíveis fósseis, pelos escapamentos de carros e pelo catabolismo da lignina. 462 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico As espécies de bactérias carboxidotróficas (Figura 23) mais conhecidas são a Pseudomonas carboxydovorans, Bacillus schlegelii e Alcaligenes carboxydus. Certamente, a atividade das carboxidobactérias é o principal escoadouro de CO na natureza, representando assim um processo ecológico essencial. As carboxidobactérias obtêm energia oxidando H2 e monóxido de carbono (CO) formando dióxido de carbono (CO2) e constituem um grupo especial de bactéria do hidrogênio. Essa reação é catalisada pela desidrogenase de monóxido de carbono, uma enzima que contém molibdênio. A equação geral abaixo representa esse processo: Equação Q14 CO + H2 + ½ O2 → CO2 + 2 H+ + 2 e- BSC B Figura 23: Carboxidobactéria. Os elétrons provenientes da oxidação de CO em CO2 são transferidos para uma cadeia transportadora de elétrons, promovendo a conservação de energia na forma de ATP. Essas bactérias oxidantes de CO, também denominadas carboxidotróficas, são autotróficas, ou seja, geram seus compostos orgânicos a partir da fixação de CO2 pelo ciclo de Calvin. Bactérias do hidrogênio termofílicas O grupo das bactérias do hidrogênio termofílicas compreende a ordem Aquificales e contém os gêneros termofílicos Hydrogenobacter e Aquifex, que crescem em fontes termais. Algumas espécies do gênero Hydrogenobacter crescem em temperaturas ótimas entre 70 e 75°C e algumas do gênero Aquifex podem crescer em temperaturas tão altas quanto 95°C. Nenhuma espécie desse grupo pode crescer utilizando fonte de carbono orgânica. Dessa forma, seus componentes podem ser considerados, de fato, quimiolitotróficos do hidrogênio obrigatórios. Todas as espécies conhecidas requerem oxigênio, porém em concentrações extremamente baixas. O CO2 não é fixado através das reações do ciclo de Calvin, mas utilizando o ciclo do ácido cítrico redutivo (ou reverso). O ciclo do ácido cítrico reverso é um mecanismo de carboxilação redutiva para fixação do CO2 que é, essencialmente, o reverso do ciclo do ácido cítrico. O acetato é o principal intermediário e uma volta completa tem como resultado líquido a produção de uma molécula de acetil-CoA. Esse componente pode, prontamente, entrar no ciclo do ácido cítrico sintético, disponibilizando precursores metabólicos essenciais. Bactérias acetogênicas O grupo das bactérias acetogênicas compreende bactérias anaeróbias que podem usar hidrogênio como fonte de energia e dióxido de carbono como aceptor final de elé- Consórcio Setentrional de Ensino a Distância 463 # M2U12 Processos Biológicos na Captação e Transformação de Matéria e Energia – Metabolismo energético I: Fotossíntese e Quimiossíntese trons, gerando ácido acético como produto final, de acordo com a equação geral apresentada a seguir: Equação Q15 4 H2 + 2 CO2 → CH3COOH + 2 H2O Essas bactérias quimiolitotróficas acetogênicas utilizam a via do Acetil Coenzima A (CoA) para realizar a redução do CO2. Parte do acetato produzido pelo crescimento autotrófico é, então, usado como fonte de carbono para a síntese de componentes celulares. Esses organismos são considerados autotróficos porque sintetizam seu próprio material celular a partir de CO2. A via do Acetil-CoA, também denominada via de Ljungdahl-Wood em homenagem aos seus descobridores, gera uma molécula de acetato a partir de duas moléculas de CO2. Não é uma via cíclica como o ciclo de Calvin. De fato, envolve a redução do CO2 utilizando duas vias lineares. Uma molécula de CO2 é reduzida ao grupo metil do acetato e a outra é reduzida ao grupo carbonil. O processo é finalizado pela geração de acetil-CoA. Uma enzima-chave, a monóxido de carbono desidrogenase, catalisa a reação de redução do CO2 a CO, usando uma molécula de H2, como mostrado na equação abaixo: Equação Q16 CO2 + H2 → CO + H2O O CO produzido é incorporado ao acetato na posição carbonil (-COO-). O grupo metil resulta da redução do CO2 através de uma série de reações envolvendo a coenzima tetraidrofolato. Esse grupo metil é, então, transferido para uma enzima contendo vitamina B12 como cofator. No mecanismo de reação da etapa final, o grupo CH3, que está ligado a um átomo de níquel da enzima, é condensado ao CO, que está ligado a um átomo de ferro da enzima, juntamente com a coenzima A, para gerar acetil-CoA como produto final. Há requerimento de ATP no início desse processo. Essas bactérias conservam energia na forma de uma molécula de ATP durante a conversão de acetil-CoA em acetato (via acetil-fosfato), pelo mecanismo de fosforilação ao nível do substrato, entretanto a maior parte da energia é conservada devido ao estabelecimento de um gradiente de Na+ através da membrana, gerando uma força sódio-motriz (análoga à força próton-motriz, que envolve H+) que dirige a síntese de ATP catalisada pela ATPase de membrana. Finalmente, cabe ressaltar que o conhecimento sobre quimiossíntese conduziu-nos ao mundo versátil, surpreendente e maravilhoso dos microrganismos. Contudo, o conjunto de informações acima representa apenas uma “pincelada” deste amplo, e ainda misterioso, quadro da vida bacteriana. Certamente, você, caro aluno, terá novas oportunidades para conhecer e apreciar com mais cuidado o fantástico mundo bacteriano. #M2U12 IV. Referências Nelson, David L.; Cox, Michael M. Lehninger Principles of Biochemistry. 4. ed. Freeman, 2004. M. Berg, Jeremy; Tymoczko, John L.; Stryer, Lubert. Biochemistry. 5. ed. Freeman, 2002. Metzler, David E. Chemical Reactions of Living Cells. 2. ed. Academic Press, 2003. 464 Módulo II — Processos biológicos na captação e na transformação da matéria e da energia P Biológico BSC Voet, Donald; Voet, Judith G. Biochemistry. 3. ed. Wiley, 2004. Perry, Jerome; Staley, James. Microbiology: dinamycs and diversity. 1. ed. Saunders College Publishing, 1997. Madigan, Michael; Martinko, John; Parker, Jack. Microbiologia de Brock. 10. ed. Tradução: NOME DO TRADUTOR. CIDADE: Pearson Prentice Hall, 2004. Consórcio Setentrional de Ensino a Distância 465 B
Download