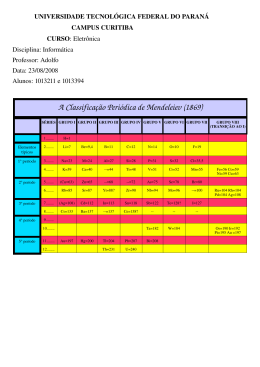
UNIVERSIDADE DO GRANDE RIO UNIGRANRIO WANDERLEY CARREIRA DE SOUZA JUNIOR “QUÍMICA EM GERAL” A PARTIR DE UMA TABELA PERIÓDICA NO MICROSOFT EXCEL: UMA ESTRATÉGIA DE ENSINO DE QUÍMICA NA EDUCAÇÃO BÁSICA Duque de Caxias 2010 WANDERLEY CARREIRA DE SOUZA JUNIOR UNIVERSIDADE DO GRANDE RIO “QUÍMICA EM GERAL” A PARTIR DE UMA TABELA PERIÓDICA NO MICROSOFT EXCEL: UMA ESTRATÉGIA DE ENSINO DE QUÍMICA NA EDUCAÇÃO BÁSICA Dissertação apresentada à Universidade do Grande Rio “Prof. José de Souza Herdy”, como parte dos requisitos parciais para obtenção do grau de mestre em Ensino das Ciências na Educação Básica. Área de concentração: Ensino de Química. Orientador: Professora Doutora Wilma Clemente de Lima Co-Orientador: Professora Doutora Cristina Novikoff . Duque de Caxias - RJ 2010 . CATALOGAÇÃO NA FONTE/BIBLIOTECA – UNIGRANRIO C314 Carreira, Wanderley. “Química em geral” a partir de uma tabela periódica no microsoft excel: uma estratégia de ensino de química na educação básica./ Wanderley Carreira. – 2010. 142 f. : il. ; 30 cm. Dissertação (mestrado em Ensino de Ciências na Educação Básica) – Universidade do Grande Rio “Prof. José de Souza Herdy”, Escola de Educação, Ciências, Letras, Artes e Humanidades, 2010. “Orientadora: Profª. Wilma Clemente de Lima.” “Co-Orientadora: Prof.ª Cristina Novikoff.” Bibliografia: p. 99-100 1. Educação. 2. Educação básica. 3. Química– estudo e ensino. Química - Tabela periódica. I. Lima, Wilma Clemente. II. Novikoff, Cristina. III. Universidade do grande Rio “Prof. José de Souza Herdy”. IV. Título. CDD –370 DEDICATÓRIA Aos meus pais, Wanderley Carreira e Darcy Vitoria, que sempre acreditaram na educação como um caminho para ascensão social e que me deram incondicional apoio durante a minha formação. A minha primeira professora, Maria Helena (1977), que me ensinou os primeiros passos e me fez superar o medo do “Quadro de Giz”. A dois primos: Sandra Assumpção e Fernando Assumpção que preencheram a lacuna de dois irmãos e serviram de modelo para minha formação. A minha esposa, Dayse Brum, por toda paciência, compreensão incondicional e apoio nesses últimos dois anos tão conturbados. Aos meus amigos da “Velha Guarda” do Laboratório: Francisco Alves, Lúcio Cunha, Hélio Thomaz, José Fernando, Paulo Silva e Rosangela Henriques que foram responsáveis pela minha formação profissional. Aos professores do Programa de PósGraduação em Ensino das Ciências da Unigranrio pelo carinho, parceria, dedicação e profissionalismo demonstrando ao longo desses dois anos. AGRADECIMENTOS Quando criança, embora não fosse fã de Roberto Carlos, eu queria ter um milhão de amigos. Obviamente, não cheguei a esse expressivo número. Não obstante, a sinergia proporcionada pelos poucos amigos que possuo é suficiente o bastante para ultrapassar a milhão deles. Hoje, um antigo sonho se realiza. Contudo, cabe lembrar que nada é feito sozinho. Tolos são aqueles que pensam dessa forma. Destarte, preciso dividir o mérito dessa conquista, agradecer e reconhecer aqueles que direta ou indiretamente me auxiliaram na concepção desse trabalho. A começar pelos meus companheiros de turma: Alex Coelho, Sérgio Trindade e em especial Andrea Lima e Valessa Lessa, pois sem eles não haveria a excelente turma, da qual fiz parte. Aos amigos Wagner Bahia, Ricardo Gomes, Andre Alves, Charles Bessa, Paulo Silva e Helio Thomaz que fizeram parte da “Família Laboratório”. Aos amigos do Dream Team: Wellington Santos, Clara Simões, Amanda Assis, José Fernando, Sabrina Silva, Renan Rosário, Andre Primo, Felipe Batista, Ana Carolina Abrahão, Lidiane Nascimento, Natália Borba, Jailton Deveza e Bruno Quintanilha pela torcida e apoio e, em especial, ao Fábio Felisberto pelas revisões ortográficas. A fraternal amiga Rosangela Henriques pelas exaustivas revisões sugestões na composição desse texto e a escudeira Claudia Sampaio pela captura e tratamento das imagens utilizadas durante muitas madrugadas. Aos demais amigos da Fábrica de Lubrificantes Fernando Mackert, Tiago Silva e Gilson Rocha pelas palavras de apoio e ânimo, não se esquecendo dos amigos Renato Chalub e Roberto Biato pelo incontestável apoio nas semanas que antecederam a defesa da dissertação. Ao fraterno amigo, professor Sergio Henrique, por se fazer presente nos momentos em que eu mais precisei. Ao amigo Alex Beringuy pelas primeiras lições de informática. Ao amigo Alexandre Mendes pelo incentivo e parceria a Marta Mendes pela indicação das referências bibliográficas. Ao amigo e coordenador do Curso de Tecnologia em Gestão da Produção Industrial (IFRJ) Marcelo Lacerda por conciliar meu horário de trabalho no IFRJ, para que eu pudesse atingir o meu objetivo. Ao Leonardo Pardal pela vital ajuda no Congresso realizado na Espanha. Aos professores Herbert Martins; Haydea Reis, Jacqueline Lima, Frederico Allan, Luiz Eduardo por compartilharem suas experiências e fundamentar essa pesquisa e, em especial, aos professores Marcelo Pedrosa, Zenildo Morais, Wilma Pinto e a professora Cristina Novikoff por suas valorosas contribuições no delineamento metodológico dessa pesquisa. Aos professores que fizeram parte da equipe de avaliação da T Wanc®©. Aos meus pais pela torcida para que tudo desse certo e a minha esposa, Dayse Brum, pela compreensão, presença e incondicional apoio nos finais de semana, Natal, Ano Novo, Carnaval, Páscoa, etc. Finalmente, ao Grande Escritor dessa história: Deus, o qual me concedeu a força e perseverança, como também me regalou com grandes seres humanos que foram vitais na encenação de mais esse capítulo da minha vida e mais uma vez fez-me acreditar que um somente evolui a partir de outros homens.. Jamais considere seus estudos como uma obrigação, mas como uma oportunidade invejável para aprender a conhecer a influência libertadora da beleza do reino do espírito, para o seu próprio prazer pessoal e, para o proveito da comunidade à qual o seu futuro trabalho pertencer. Albert Einstein RESUMO O produto desse trabalho é o resultado de uma pesquisa mista (qualitativa/quantitativa) aplicada que teve por principal objetivo desenvolver um recurso didático para o ensino de Química, a partir de uma Tabela Periódica desenvolvida no Microsoft Excel – T Wanc®©. A metodologia empregada no desenvolvimento desse recurso implicou na análise interpretativa de diferentes instrumentos sob os quais o ensino da química está alicerçado, tais como: Lei de Diretrizes e Bases da Educação Nacional (LDBEN), Parâmetros Curriculares Nacionais para o Ensino Médio (PCNEM), Orientações Curriculares para o Ensino Médio, livros de química constantes do Programa Nacional do Livro para o Ensino Médio (PNLEM) e sites dedicados a Tabela Periódica. Posteriormente, foram discutidas as limitações desses livros e sites sob o prisma da contextualização e interdisciplinaridade e se estabeleceu um diálogo entre a Tabela Periódica e temas, tais como a toxicologia, geologia, ecologia, nutrição, fisiologia, dentre outros, culminando-se em uma proposta didática, com uma abordagem diferenciada daquela comumente praticada pelos manuais didáticos. A avaliação da T Wanc®©, por seis professores que já ministram ou ministraram o tema em questão, tabela periódica, sinalizou para possibilidade de sua utilização como um recurso didático nas aulas de Química na educação básica. Palavras-chave: Tabela Periódica. Ensino de química. Livro didático. ABSTRACT The product of this work is the result of a qualitative and quantitative research applied that was aimed to develop a resource for the teaching of chemistry, from a periodic table developed in Microsoft Excel - T Wanc®©. The methodology used in developing this action resulted in an interpretative analysis of different instruments under which the teaching of chemistry is founded, such as the Brazilian Law of Directives and Bases of National Education (LDBEN), the Brazilian National Curriculum Parameters for Secondary Education (PCNEM) Curriculum Guidelines for High School, chemistry books in the National Textbook Program for high school (PNLEM) and websites dedicated to the Periodic Table. Later, participants discussed the limitations of books and selected sites in the light of context and interdisciplinarity has established a dialogue between the Periodic Table and issues such as toxicology, geology, ecology, nutrition, physiology, among others, culminating in a didactic proposal with a different approach from that commonly practiced by the textbooks. The evaluation of the proposed application (T Wanc®©) by six teachers, who have ministers or the content in question, signaled the possibility of its use as a teaching tool in chemistry class in basic education. Keywords: Periodic Table. Chemistry education. Textbook. SUMÁRIO 1 INTRODUÇÃO ................................................................................................................ 13 2 REVISÃO DA LITERATURA ........................................................................................ 16 2.1 Conceitos Caros ao Ensino ........................................................................................... 16 2.1.1 Racionalidade, Ensino-aprendizagem, Interdisciplinaridade, Contextualização.......... 16 2.1.2 O Papel da Química na Educação ................................................................................ 20 2.2 A raiz da ciência Química: Tabela Periódica ............................................................... 23 2.3 Tabela Periódica: de Tales à IUPAC ............................................................................ 24 2.3.1 As Perguntas Movem o Mundo .................................................................................... 25 2.3.2 Alquimia e Iatroquímica ............................................................................................... 32 2.3.3 O “Re-Nascimento” de uma Ciência ............................................................................ 35 2.3.4 A Química do Século XVIII ......................................................................................... 37 2.3.5 A Química No Século XIX........................................................................................... 42 2.3.6 A Evolução da Tabela Periódica .................................................................................. 46 2.3.7 IUPAC Como Entidade Normalizadora ....................................................................... 63 3 METODOLOGIA ............................................................................................................. 67 3.1 Tipo de Estudo .............................................................................................................. 67 3.2 Questões de Pesquisa .................................................................................................... 68 3.3 Fases da Pesquisa ......................................................................................................... 69 3.3.1 Fase 1: Levantamento no Portal CAPES e artigos correlatos ...................................... 69 3.3.2 Fase 2: Revisão de Documentos Normativos ............................................................... 69 3.3.3 Fase 3: Levantamento de Livros Didáticos .................................................................. 70 3.3.4 Fase 4: Levantamento de Sites Dedicados ao Tema ..................................................... 70 3.3.5 Fase 5: Análise Interpretativa dos Livros e Sites .......................................................... 70 3.3.6 Fase 6: Fundamentação Teórica e Desenvolvimento da T Wanc®© no Excel.............. 72 3.3.7 Fase 7 - Experimentação da T Wanc®© ........................................................................ 75 3.4 4 Tratamento dos Dados .................................................................................................. 77 APRESENTAÇÃO E DISCUSSÃO DOS RESULTADOS ............................................ 80 4.1 A Avaliação dos Livros Didáticos ................................................................................ 80 4.2 A avaliação dos sites..................................................................................................... 84 4.3 Experimentação Laboratorial da Versão Beta da T Wanc®© ....................................... 87 4.3.1 Análise do discurso docente: Perfil do Professor e Aulas sobre Tabela Periódica ...... 87 4.3.2 Análise do discurso docente: Avaliação da T Wanc®© pelos professores.................... 90 4.4 5 Apresentação da T Wanc®© .......................................................................................... 92 CONCLUSÕES .............................................................................................................. 108 REFERÊNCIAS BIBLIOGRÁFICAS ................................................................................... 110 Apêndice A: Tabela Periódica dos elementos segundo a IUPAC .......................................... 122 Apêndice B: Linha do Tempo - elementos químicos e a Tabela Periódica ............................ 123 Apêndice C: Os seis livros didáticos selecionados para avaliação do conteúdo Tabela Periódica ................................................................................................................................. 125 Apêndice D: Matriz com os resultados da avaliação do capítulo Tabela Periódica dos seis livros didáticos........................................................................................................................ 126 Apêndice E: Relação dos trinta sites selecionados para avaliação ......................................... 127 Apêndice F: Matriz com o resultado da avaliação dos sites selecionados ............................. 130 Apêndice G: Imagem de abertura dos sites avaliados ............................................................ 131 Apêndice H: Referências bibliográficas utilizadas na concepção da T Wanc®© ................... 132 Apêndice I: T Wanc®© – Tela de abertura ampliada .............................................................. 138 LISTA DE ILUSTRAÇÕES Figura 2.1: Tabela Periódica como raiz da ciência Química .................................................... 24 Figura 2.2: Os cinco sólidos platônicos: o tetraedro (fogo), o hexaedro (terra),o octaedro (ar), icosaedro (água) e o dodecaedro (universo). ............................................................................ 28 Figura 2.3: Os cinco elementos na visão de Aristóteles com suas respectivas propriedades associados aos sólidos platônicos. ............................................................................................ 30 Figura 2.4: Lista original das substâncias simples (“elementos”) segundo Lavoisier em 1789 .................................................................................................................................................. 40 Figura 2.5: Notação (pictogramas) usada por Dalton para representação dos átomos, publicadas em seu livro Um Novo sistema filosófico da química. .......................................... 43 Figura 2.6: Comparação entre algumas massas atômicas de Dalton e os valores já conhecidos em 1872 .................................................................................................................................... 45 Figura 2.7: Analogia entre as Tríades propostas de Döbreiner e a Tabela Periódica atual ...... 47 Figura 2.8: Sistema em “V” proposto por Leopold Gmelin para ordenação dos elementos em 1843. ......................................................................................................................................... 48 Figura 2.9: Deslocamento da extremidade direita do sistema de Gmelin para baixo. ............. 49 Figura 2.10: Analogia entre o sistema proposto por Leopold Gmelin e a Tabela Periódica atual .................................................................................................................................................. 49 Figura 2.11: Parafuso de Alexandre De Chancourtois ............................................................. 50 Figura 2.12: Tabela de William Odling publicada em 1864 .................................................... 52 Figura 2.13: Tabela de Newlands ilustrando a lei das oitavas apresentada à Chemical Society em 1866 .................................................................................................................................... 53 Figura 2.14: Primeira Tabela de Lothar Meyer, 1864 .............................................................. 55 Figura 2.15: Sistema ortogonal desenvolvido por Lothar Meyer em 1870 .............................. 55 Figura 2.16: Tabela Periódica refletindo o periodismo de Lothar Meyer, 1872. ..................... 56 Figura 2.17: Primeira Tabela desenvolvida por Mendeleev, em 1869. a) versão manuscrita; b) versão impressa ........................................................................................................................ 57 Figura 2.18: Segunda versão da Tabela Periódica de Mendeleev, publicada em 1871. ........... 58 Figura 2.19: Tabela Periódica organizada por Mendeleeev em 1879. ..................................... 59 Figura 2.20: Tabela mais moderna organizada por Mendeleev................................................ 59 Figura 2.21: Relação linear observada por Henry Moseley em 1913 ...................................... 61 Figura 2.22: Tabela Periódica antes e depois da intervenção de Glenn Seaborg. .................... 63 Figura 3.1: Categorias utilizadas para avaliação dos livros e sites ........................................... 71 Figura 3.2: Estrutura da T Wanc®© .......................................................................................... 74 Figura 4.1: Tela de abertura contendo o detalhamento dos temas que são tratados na T Wanc®©. .................................................................................................................................... 93 Figura 4.2: Axioma genérico considerando a interação de um átomo genérico e as suas interrelações ..................................................................................................................................... 94 Figura 4.3: T Wanc®© Classificação geral dos elementos químicos ........................................ 95 Figura 4.4: T Wanc®© Classificação geral dos elementos químicos – Expansão dos lantanídeos e actinídeos ............................................................................................................ 95 Figura 4.5: T Wanc®© Tabela e a linguagem padronizada da química – Número Atômico .... 96 Figura 4.6 T Wanc®© Tabela e a linguagem padronizada da química – Símbolo .................... 97 Figura 4.7: Informações obtidas para o elemento cálcio (Ca) a partir do site NIST Webbok. 97 Figura 4.8: T Wanc®© Elementos Químicos e Nutrição........................................................... 98 Figura 4.9: Ampliação de parte da tela Elementos Químicos e Nutrição................................. 99 Figura 4.10: T Wanc®© Elementos Químicos e Nutrição – Fontes naturais .......................... 100 Figura 4.11: T Wanc®© Elementos Químicos e Nutrição – Simulação de dietas................... 101 Figura 4.12: T Wanc®© Elementos Químicos e Nutrição – Resultado da simulação de uma dieta ........................................................................................................................................ 102 Figura 4.13: Detalhe da legenda usada identificação dos tipos de alimentos usados na dieta102 Figura 4.14: Propaganda em favor do uso de medicamentos à base de cálcio para tratamento sintomático contra a osteoporose, uma doença que atinge mais de vinte e cinco milhões de pessoas no mundo. .................................................................................................................. 103 Figura 4.15: T Wanc®© Elementos e Agricultura ................................................................... 104 Figura 4.16: T Wanc®© Tabela periódica e os ciclos biogeoquímicos ................................... 105 Figura 4.17: T Wanc®© Tabela Periódica e ciclo biogeoquímico do cálcio ........................... 106 LISTA DE QUADROS Quadro 3.1: Questões para análise do discurso docente: perfil do professor ........................... 75 Quadro 3.2: Questões para análise do discurso docente: aulas sobre tabela periódica ............ 76 Quadro 3.3: Questões para análise do discurso docente: Avaliação da T Wanc®© .................. 77 Quadro 3.4: Detalhamento das categorias utilizadas na análise dos livros didáticos, sites e discurso docente. ...................................................................................................................... 78 Quadro 3.5: Classificação das variáveis sob estudo: VCD e VCO .......................................... 79 LISTA DE GRÁFICOS Gráfico 4.1: Resultado da avaliação dos livros por categoria .................................................. 81 Gráfico 4.2: Resultado da avaliação do eixo contextualizador e interdisciplinar dos livros .... 82 Gráfico 4.3: Resultado da avaliação dos sites por categoria .................................................... 85 Gráfico 4.4: Resultado da avaliação eixo contextualizador e interdisciplinar dos sites ........... 86 Gráfico 4.5: Análise do Discurso Docente: Perfil do professor ............................................... 88 Gráfico 4.6: Análise do Discurso Docente: Aulas sobre Tabela Periódica .............................. 89 Gráfico 4.7: Análise do Discurso Docente: Avaliação da versão beta da T Wanc®© .............. 91 LISTA DE SÍMBOLOS ®: Marca registrada ©: Direitos autorais (Copyright) LISTA DE ABREVIATURAS ACS: American Chemical Society BDP: Base de Dados Principal BDS: Base de Dados Secundária CAS: Chemical Abstract Service CEB: Coordenadoria de Educação Básica C&I: Contextualizador e Interdisciplinar CTSA: Ciência, Tecnologia, Sociedade e Meio Ambiente DCN: Diretrizes Curriculares Nacionais ENEM: Exame Nacional do Ensino Médio IFRJ: Instituto Federal de Ciência e Tecnologia do Rio de Janeiro INEP: Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira IACS: International Association of Chemical Societies IUPAC: International Union of Pure and Applied Chemistry LDBEN: Lei de Diretrizes e Bases da Educação Nacional NASA: National Aeronautics and Space Administration NIST: National Institute of Standards and Technology PCNEM: Parâmetros Curriculares Nacionais para o Ensino Médio OIT: Organização Internacional do Trabalho PCN+: Orientações Educacionais Complementares aos Parâmetros Curriculares Nacionais PNLEM: Programa Nacional do Livro Didático para o Ensino Médio T-Wanc: Tabela professor Wanderley Carreira VBA: Visual Basic for Applications VCD: Variável categórica dicotômica VCO: Variável categórica ordinal 13 1 INTRODUÇÃO Certamente, um dos maiores desafios enfrentados hoje no ambiente escolar é como utilizar a contextualização e a interdisciplinaridade na prática pedagógica. Tanto que essa questão vem sendo debatida por diversos pesquisadores há algum tempo (FRANSCISCHETT, 2005; ZANON, 2008; CARLOS, 2007), como também permeia a legislação de ensino vigente (BRASIL, 1996; 2002; 2006). Críticas não faltam ao ensino da Química, em especial no Ensino Médio (BELTRAN et al., 1991; CHASSOT, 2008; ZANON, 2008), por se priorizar o tratamento dos conceitos dessa disciplina de modo fragmentado e descontextualizado, o que para muitos autores se constitui em um dos responsáveis pelo elevado nível de rejeição por parte dos alunos a essa disciplina (FERNANDES, 2007; NARCISO JR et al., 2000). Sob essa ótica, ao tratar do ensino de Química fez-se o corte epistemológico sobre a classificação periódica dos elementos. Isso porque a Tabela Periódica é o símbolo mais conhecido da linguagem química e se constitui em um valioso instrumento didático para o ensino dessa ciência (TOLENTINO et al., 1997; TROMBLEY, 2000), embora muitos estudantes a reconheçam como um verdadeiro amontoado de informações que precisam ser essencialmente memorizadas (CHRISPINO, 1994; DALLACOSTA et al., 1998; NARCISO JR et al., 2000). Por outro lado, os trabalhos dedicados ao ensino da Tabela Periódica não têm se apresentado alinhados à legislação vigente (BRASIL, 1996) e apontam para a necessidade de se desenvolver novas abordagens para o seu ensino (BELTRAN et al., 1991; NARCISO JR et al., 2000). Sob esse prisma, a “Química em Geral” a partir de uma Tabela Periódica no Microsoft Excel: T Wanc®© (CARREIRA; PINTO, 2009) visa a preencher parte dessa lacuna, uma vez que o eixo norteador dessa dissertação de mestrado está fundamentado na contextualização e interdisciplinaridade (BRASIL, 1996; 2002; 2006); necessidades básicas da educação para o século XXI. Como motivadores para a concepção dessa pesquisa elencamse a vivência do autor como professor de cursos pré-vestibulares e da rede pública de ensino, sua experiência no uso do Microsoft Excel voltado para o desenvolvimento de aplicações 14 industriais e, principalmente, por se acreditar que a Tabela Periódica não é algo absoluto, fora do espaço, fora do tempo e tampouco uma simples base de dados de onde se extraem apenas “números”, pois sódio, potássio, rubídio, césio e frâncio, podem ser mais que um conjunto de nomes e símbolos. Por que “Química em Geral” [...]? Realmente, o título da dissertação pode causar estranheza ou inquietação, mas seu objetivo é realmente esse. Chamar a atenção acerca do potencial didático que a Tabela Periódica pode oferecer ao ensino da Química como ciência do cotidiano, entendendo-se que os elementos químicos constituintes das substâncias hoje conhecidas, encontram-se primariamente ordenados na Tabela Periódica. Dessa forma, acredita-se que ela sirva de base para se discutir/aprender a “Química em Geral”, ou seja, uma aproximação entre a Química e a sociedade a partir da classificação periódica dos elementos. Nessa linha, os principais objetivos dessa pesquisa constituem-se em apresentar à comunidade de professores um recurso paradidático para o ensino da Química e por meio dele, divulgar o potencial didático do Microsoft Excel (MORAN et al., 2007) na perspectiva crítica (progressista), como também ofertar um meio para que os elementos químicos sejam trabalhados a partir de suas múltiplas relações com a sociedade, mediante um diálogo entre a Tabela Periódica e diferentes temas, voltados para ciência, tecnologia, sociedade e meio ambiente (CTSA) (CHAGAS, 1992; CHASSOT, 2001; CHRISPINO, 1994). A partir desses dois objetivos, emergiram os seguintes objetivos específicos, a saber: i) Contribuir para novas propostas de aplicações voltadas para o ensino por meio do uso eficiente dos laptops dos professores; ii) Interpretar o capítulo Tabela Periódica presente nos livros didáticos a luz do PCNEM, PCN+ e das Orientações Curriculares para o Ensino Médio; iii) Resgatar a evolução da Tabela Periódica ao longo da história da Química e iv) Observar o que pensam os professores a respeito do ensino do conteúdo Tabela Periódica e da T Wanc®©. Obviamente, para se desenvolver esse projeto, fundamentado na contextualização e interdisciplinaridade (BRASIL, 1996; 2002; 2006), foi preciso reunir diferentes subsídios, o que envolveu à consulta a legislação vigente, estudo pormenorizado do capítulo “Tabela Periódica dos livros didáticos de química, avaliação de sites dedicados ao assunto, levantamento de bibliografias específicas, correlatas ao ensino de Química, dentre outros. Dessa forma, o relato desse estudo é feito em cinco capítulos. No primeiro, que se refere a introdução é apresentado um panorama de como a pesquisa foi concebida, a motivação para sua realização, seus objetivos principais e secundários, justificativas bem como a estrutura básica da dissertação. O segundo capítulo, fundamental em toda dissertação, destina-se à revisão da literatura, o qual se encontra dividido em duas partes. Na primeira delas, discorre- 15 se acerca dos conceitos caros ao ensino: racionalidade, ensino-aprendizagem, interdisciplinaridade, contextualização, bem como o problema do ensino da Química e a importância da Química como disciplina do ensino médio. Na segunda parte, resgata-se a evolução da Tabela Periódica no decurso da história da química; partindo-se das primeiras indagações a cerca da constituição da matéria até a Tabela Periódica atualmente recomendada pela IUPAC. O terceiro capítulo é dedicado à metodologia, onde se classifica o tipo de estudo realizado, reafirmam-se os objetivos, elencam-se as questões da pesquisa e detalham-se as sete etapas envolvidas na concepção desse estudo, bem como a forma de tratamento dos dados levantados. No quarto capítulo são apresentados e discutidos os resultados das avaliações dos livros didáticos constantes do PNLEM (Programa Nacional do Livro do Ensino Médio), sites dedicados a Tabela Periódica, a avaliação T Wanc®© pelo grupo de professores envolvidos na pesquisa, como também é apresentada a versão final do recurso paradidático proposto. Finalmente, no último capítulo são feitas as considerações finais e reflexões sobre a pesquisa como um todo, bem como as sugestões para continuidade desse estudo. 16 2 REVISÃO DA LITERATURA 2.1 Conceitos Caros ao Ensino 2.1.1 Racionalidade, Contextualização Ensino-aprendizagem, Interdisciplinaridade, Os Parâmetros Curriculares Nacionais para o Ensino Médio (PCNEM) (BRASIL, 1999) são guias para instituições de ensino médio e docentes implementarem o modelo de ensino estabelecido pela LDBEN (BRASIL, 1996). Esses documentos orientam para uma organização curricular que, dentre outras questões, aborde os conteúdos de ensino de modo contextualizado, aproveitando sempre as relações entre conteúdos e contexto para dar significado ao aprendido, estimular o protagonismo e a autonomia intelectual do discente (MENEZES et al., 2002). A interdisciplinaridade também é uma orientação da LDBEN (BRASIL, 1996) por meio dos PCNEM (BRASIL, 1999), cujo principal objetivo é fazer da sala de aula mais do que um espaço para simples absorção e memorização de informações. Por isso, a interdisciplinaridade se utiliza dos conhecimentos de várias áreas do saber na compreensão de um problema, na busca de soluções, ou entendimento de um fenômeno sob vários pontos de vista (MENEZES et al., 2002). Dessa forma, de acordo com a LDBEN (BRASIL, 1996) e os PCNEM (BRASIL, 1999) é preciso aproveitar sempre as relações entre conteúdos e contexto para dar significado ao aprendido (BRASIL, 2006). Por sua vez, os temas transversais estão voltados para a compreensão e para a construção da realidade social e dos direitos e responsabilidades relacionados com a vida pessoal e coletiva e com a afirmação do princípio da participação política. Isso significa que devem ser trabalhados, de forma transversal, nas áreas e nas disciplinas já existentes. Destarte esses temas correspondem a questões de 17 interesse da sociedade moderna, como por exemplo: saúde, meio ambiente, trabalho, dentre outros (MENEZES et al., 2002). A contextualização ganhou força a partir da reforma do ensino médio, quando da promulgação da Lei de Diretrizes e Bases da Educação (BRASIL, 1996), que orienta para a compreensão dos conhecimentos para uso cotidiano. Possui sua origem nas diretrizes que estão definidas nos Parâmetros Curriculares Nacionais para o Ensino Médio (BRASIL, 1999), que são orientações para os professores na aplicação desse modelo. É fácil perceber que da perspectiva da contextualização deriva a interdisciplinaridade, princípios organizadores de focos de desenvolvimento de uma multiplicidade de relações entre pensamentos conceituais específicos a componentes curriculares integrantes da área de Ciências Naturais (ZANON, 2008), cujos conceitos1 vêm sendo introduzidos na literatura educacional há quase quarenta anos. E hoje, a LDBEN (BRASIL, 1996) e os Parâmetros Curriculares Nacionais para o Ensino Médio (BRASIL, 1999) advogam explicitamente em seu favor. Não obstante, Carlos (2007), em sua dissertação apontou a dificuldade em se identificar no PCNEM uma clara definição do conceito de interdisciplinaridade, de modo a se orientar a ação pedagógica dos professores de química, o que enreda a sua aplicação, pois, sem saber “o que é” “como fazer” e “quando fazer”, fica mais difícil para o professor se apropriar desse conceito e colocá-lo em prática apenas pela consulta a esses documentos. Chassot (2008), também identificou um viés, ainda, muito “disciplinar” no PCNEM, pois o documento apenas cita, mas não discute essa questão com o devido aprofundamento. O que diferencia a disciplinaridade da interdisciplinaridade é que a primeira “significa a exploração científica especializada de determinado domínio homogêneo de estudo, isto é, um conjunto sistemático e organizado de conhecimentos que apresentam características próprias nos planos do ensino, da formação, dos métodos e das matérias; esta exploração consiste em fazer surgir novos conhecimentos que se substituem aos antigos” (JAPIASSU, 1976 apud FRANSCISCHETT, 2005), enquanto a interdisciplinaridade caracteriza-se pela intensidade das trocas entre os especialistas e pelo grau de integração real das disciplinas no interior de um determinado campo (CARLOS, 2007; FRANSCISCHETT, 1 Segundo Carlos (2007) e Francischett (2005) a interdisciplinaridade surgiu na França e Itália, em meados da década de sessenta do século XX, como uma tentativa de elucidação e classificação temática das propostas educacionais. No final desse mesmo ano, seus conceitos não só chegaram ao Brasil, como também influenciaram a Lei de Diretrizes e Bases Nº 5.692/71. Desde então, entre erros e acertos, sua presença no cenário educacional brasileiro tem se intensificado; principalmente após a sanção da LDBEN Nº 9.394 (BRASIL, 1996) e redação dos PCN (BRASIL, 1999), PCN+ (BRASIL, 2002) e as Orientações Curriculares para o Ensino Médio (BRASIL, 2006). 18 2005), ou seja, a interdisciplinaridade é uma relação simbiótica entre áreas do saber. Todavia, essa inter-relação acontece em maior ou menor extensão. Por tal razão, para distinguir esses níveis de relacionamento foram criadas quatro classes de interação, a saber: i) multidisciplinaridade; ii) pluridisciplinaridade; iii) interdisciplinaridade; e iv) transdisciplinaridade (CARLOS, 2007; FRANSCISCHETT, 2005), que denotam o grau de interação entre as disciplinas. Nessa linha, tanto Francischett (2005) quanto Carlos (2007), fundamentados em Japiassú, definem a multidisciplinaridade como o primeiro nível de integração entre os conhecimentos disciplinares, a qual predomina nas atividades e práticas de ensino das escolas. Contudo, essa prática é marcadamente fracionada, visto que ainda não se explora a relação entre os conhecimentos disciplinares, de modo a fomentar a cooperação entre as disciplinas. Já pluridisciplinaridade, carrega em si algum tipo de interação entre os conhecimentos, embora eles ainda se situem num mesmo nível hierárquico, não havendo ainda a coordenação proveniente de um nível hierarquicamente superior. Por seu turno, a interdisciplinaridade representa a terceira classe de interação entre as disciplinas, sistematizada pela presença de uma axiomática comum a um grupo de disciplinas conexas e definidas no nível hierárquico imediatamente superior, o que introduz a noção de finalidade. Finalmente, a transdisciplinaridade representa um nível de integração disciplinar além da interdisciplinaridade, uma espécie de coordenação de todas as disciplinas e interdisciplinas, sobre a base de uma axiomática geral, em um contexto mais abrangente, gerando uma interpretação mais holística dos fatos e fenômenos. Felizmente, ao se examinar as Orientações Educacionais Complementares aos Parâmetros Curriculares Nacionais – Ciências da Natureza, Matemática e suas Tecnologias (PCN+) (BRASIL, 2002), já se observa uma maior preocupação, embora tênue, em se reconhecer que a interdisciplinaridade muitas vezes alinhada ao contexto no aprendizado permeia a transdisciplinaridade: A natural relação entre interdisciplinaridade e contexto pode levar à conclusão apressada de que seria mais difícil a presença do contexto no aprendizado de uma única disciplina. O fato de o contexto ser usualmente transdisciplinar não dificulta seu tratamento em cada disciplina. Isso deveria ser objeto de atenção na preparação para o ensino, por exemplo, ao se sistematizarem e organizarem os temas, em torno dos quais se conduz o aprendizado disciplinar que chamamos de temas estruturadores do ensino. [...] em cada uma das disciplinas da área [Ciências da Natureza, matemática e suas tecnologias, por exemplo:] o universo de investigação da Biologia, a Biosfera, dará contexto a um dos temas estruturadores da Química, ao passo que Qualidade de vida, que é um tema da Biologia, trará em seu contexto elementos da Física e da Química do ambiente humano. A Física, por sua vez, em seu tema estruturador Terra, Universo e vida humana, porá em discussão as condições físicas para o surgimento da vida, e, portanto, da biosfera, aqui na Terra ou em outras partes, num contexto maior, que é o da evolução cósmica. A Matemática, linguagem onipresente, distribuirá transversalmente às demais ciências 19 seus temas estruturadores, relacionados respectivamente aos números, às formas e à análise de dados (BRASIL, 2002, p. 32, grifo nosso). Assim como as Orientações Curriculares para o Ensino Médio apontam para a interdisciplinaridade, a partir de uma [...] abordagem simultânea de um mesmo assunto por diferentes disciplinas. Isso exige um acerto de planos de aula e de cronogramas entre os professores, respeitando-se as especificidades de cada disciplina. Nessa ação, professores de diferentes disciplinas e áreas podem descobrir conteúdos que permitam um trabalho conjunto. Podem, também, verificar como um mesmo conceito, processo ou fenômeno, é abordado nas diferentes disciplinas e investigar pontos em comum que podem ser explorados nas aulas. A idéia não é uniformizar, mas expor o aluno à multiplicidade de enfoques, informações e conhecimentos de forma que perceba que os conhecimentos de cada disciplina apresentam múltiplas interfaces, sendo capaz de inter-relacionar fenômenos, conceitos e processos, e de construir um pensamento orgânico. É importante observar que a interdisciplinaridade não acontece somente por força da lei ou pela vontade do professor, do diretor ou do coordenador pedagógico (BRASIL, 2006 p. 37). Nessa perspectiva, tanto contextualização como a interdisciplinaridade não podem ser interpretadas de maneira simplista. Por tal razão, a interdisciplinaridade é um processo pelo qual os professores mediam conhecimentos e linguagens de outras áreas do saber para a compreensão de um problema e busca de soluções. Nessa linha, Chassot (2008) afirma que é mais complexo lecionar ciências no ensino básico, do que, por exemplo, no ensino superior e convida aos céticos a refletir acerca de como seria, por exemplo, uma abordagem do tema energia na sexta série do ensino fundamental e na disciplina de Físico-Química, no final de um curso de graduação. O autor defende um ensino menos disciplinar, menos especializado, por meio do seguinte exemplo: O “Fantástico” de domingo parece determinar muito do que se ensina na escola na segunda-feira. “Professor, o senhor viu...?”. “Vi sim, mas sou professor de Física, isso é química”. Procurando o professor de Química, “sou inorgânico, esse assunto é de orgânica”. Encontrado um professor de Química Orgânica, este tem uma boa desculpa: “trata-se de compostos cíclicos, minha pesquisa é com acíclicos”. Achado aquele especialista em química cíclica, desculpar-se-á dizendo “isso é uma situação de anéis pentagonais, trabalho com anéis hexagonais”. O experto em anéis pentagonais dirá que se trata de um caso de anéis heterocíclicos, e ele trabalha como homocíclicos. A situação poderia se estender por mais meia dúzia de especializações. Quem dá a explicação ao ensino fundamental? A professora ou o professor de ciência. A situação não é diferente para nós, leigos em medicina, quando temos que procurar um médico. Quando elegemos um especialista, corremos o risco de ouvir: “seu problema é no ouvido direito!...Vou lhe encaminhar a um colega, pois minha especialidade é o ouvido esquerdo” (CHASSOT, 2008, p. 228). A citação acima não denota uma oposição a especialização, pois essa também continua sendo uma necessidade dos dias atuais, visto que as disciplinas e suas subdivisões são resultados da evolução filosófica, científica e cultural do ser humano em resposta as necessidades demandadas pela sociedade. Contudo, o diálogo interdisciplinar necessita 20 avançar, pois não é função da escola anterior à universidade formar especialistas e tampouco cientistas, mas sim cidadãos que saibam ler a linguagem da natureza e da sociedade. Assim sendo, a riqueza da diversidade de perspectivas dinamizadoras dos conhecimentos cotidianos, científicos e escolares reside na essencialidade das relações passíveis de serem estabelecidas deles entre si. Sua relevância está na produção de diálogos mutuamente enriquecidos/enriquecedores de abordagens plurais e dinâmicas, capazes de transformar o mundo para melhor (ZANON, 2008 p. 259). A interdisciplinaridade como perspectiva de articulação interativa entre as diversas disciplinas no sentido de enriquecê-las através de relações dialógicas entre os métodos e conteúdos que as constituem não pretende eliminar disciplinas, mas utilizá-las na compreensão de um problema, na busca de soluções ou entendimento de um fenômeno sob diferentes pontos de vista, que dessa forma abrem o caminho para a contextualização. Como a Química possui peculiaridades que lhe permitem conexões com outras disciplinas, acredita-se que a Tabela Periódica tanto pode, como deve ser explorada de um modo mais concreto, de maneira a se permitir uma apresentação e organização de diversos elementos essenciais à vida e à evolução da sociedade. 2.1.2 O Papel da Química na Educação Atualmente, tem-se um considerável número de alunos nas classes de ensino médio2 e ao mesmo tempo, há uma grande preocupação a respeito da qualidade do ensino ofertado a esses jovens em todo o país (BRASIL, 2006; 2002, 1996). Paralelamente, existe uma importante demanda pela renovação dos métodos de ensino, de forma a despertar o interesse desses estudantes pela educação e realmente proporcioná-los uma sólida formação que os permita: I - a consolidação e o aprofundamento dos conhecimentos adquiridos no ensino fundamental, possibilitando o prosseguimento de estudos; II - a preparação básica para o trabalho e cidadania [....], para continuar aprendendo, de modo a ser capaz de se adaptar com flexibilidade a novas condições de ocupação ou aperfeiçoamento posteriores; III - o aprimoramento [....] como pessoa humana, incluindo a formação ética e o desenvolvimento da autonomia intelectual e do pensamento crítico; IV - a compreensão dos fundamentos científico-tecnológicos dos processos produtivos, relacionando a teoria com a prática, no ensino de cada disciplina (BRASIL, 1996, grifo nosso). 2 Dados do Educacenso (INEP, 2009) sinalizam para 634 520 alunos matriculados somente nas escolas de Ensino Médio do Rio de Janeiro. 21 Nota-se, que as propostas do ensino médio fundamentadas no desenvolvimento de competências e habilidades cognitivas requerem posturas diferenciadas dos professores (BRASIL, 1999; 2002; 2006). Indubitavelmente a educação através da química significa um esforço em colocar essa ciência a serviço da humanidade, dessa forma entende-se que o foco nos conteúdos em si e por si mesmos precisa ser substituído pela ênfase no processo da educação, no qual o conhecimento químico sirva como um instrumento para o crescimento da sociedade como um todo (CHASSOT, 2008; 2001; 1990), visto que a química participa do desenvolvimento científico-tecnológico com importantes contribuições, cujas decorrências têm alcance econômico, social e político (BRASIL, 1999). Todavia, a memorização excessiva, programas extensos, falta de atividades experimentais, desconexão entre fatos, teorias, leis e modelos têm sido apontados há muito tempo como uma das principais barreiras para o ensino dessa ciência em toda a sua extensão (BRASIL, 2006, 1999). É sabido que necessariamente o ensino da química passa pela utilização de fórmulas, equações, símbolos, enfim, toda uma série de representações que muitas vezes por serem abstratas são de difícil compreensão. Contudo, a desmistificação de tais representações pode ser feita de diferentes maneiras e distintos meios, principalmente quando se adota uma abordagem contextualizada e interdisciplinar da química (MAGALHÃES, 2002; MATEUS, 2001). Nessa linha, os docentes deixam de ser os detentores de todo o conhecimento e passam a exercer o papel organizador, mediador e orientador do processo de ensino aprendizagem. Segundo Sprenger (2008), os profissionais que efetivamente cumprem essa missão são aqueles que utilizam estratégias de ensino mais eficientes3 e que possuem mais recursos de ensino à sua disposição, pois somente assim será possível vencer a racionalidade instrumental (NOVIKOFF et al., 2009) enfatizada no ensino voltado para o vestibular. Por sua vez, o livro didático tem sido um importante instrumento cultural para a educação em Química (ENCHEVERRIA et al., 2008), mas infelizmente, a racionalidade instrumental também tem sido observada em alguns livros de química, com algumas exceções (GARRITZ et al., 1994; NARCISO JR et al., 2000; TROMBLEY, 2000), e também na mídia, conforme pode ser verificado em duas vídeo-aulas sobre “regras” e “macetes” para o ensino da Tabela Periódica com foco no vestibular, disponíveis no portal de uma grande emissora de televisão: 3 A título de informação, no livro Memória: como ensinar para o aluno lembrar, Marille Sprenger sugere sete passos (atingir, refletir, recodificar, reforçar, treinar, rever e recuperar) para dinamizar o processo de ensino-aprendizagem. 22 x http://video.globo.com/Videos/Player/Noticias/0,,GIM1076936-7823CONHECA+OS+ELEMENTOS+QUE+COMPOEM+A+TABELA+ PERIODICA,00.html. x http://video.globo.com/Videos/Player/Noticias/0,,GIM1150175-7823SAIBA+MAIS+SOBRE+A+ESTRUTURA+DA+TABELA+PERIOD ICA,00.html. Situações totalmente contraditórias ao que preconiza a Lei de Diretrizes e Bases da Educação Nacional (LDBEN) nº 9.394 (BRASIL, 1996) e a Resolução da Coordenadoria de Educação Básica número 3 (BRASIL, 1998) que referenciam por inúmeras vezes a interdisciplinaridade e a contextualização. Alinhado a esse requisito legal e pensando na Química, como disciplina do ensino médio, acredita-se que por meio da integração dos conhecimentos, muitas vezes esparsos dessa ciência, em uma visão holística, é possível fazer da sala de aula mais que um espaço de simples absorção e acúmulo de informações. De fato, se no mundo contemporâneo até as ciências rompem fronteiras com a criação das chamadas ciências híbridas, os estudantes também precisam ampliar suas percepções além dos enfoques precisos de um conhecimento acabado. Um indicador dessa necessidade está particularizado nos Parâmetros Curriculares Nacionais do Ensino Médio, no qual está explícita a contribuição da Química para a formação da cidadania, a qual deve permitir o desenvolvimento de conhecimentos e valores que possam servir de instrumentos mediadores da interação do indivíduo com o mundo. Contudo, consegue-se isso mais efetivamente ao se contextualizar o aprendizado, o que pode ser feito com exemplos mais gerais, universais, ou com exemplos de relevância mais local, regional (BRASIL, 1999). É notória a necessidade de reorientação do ensino de química, de modo a promover a interação do ser humano com o mundo. Porém, em uma simples observação do processo educativo, tal como se verifica hoje, percebe-se que ainda ocorre uma prática fragmentada, resumida a uma justaposição de atividades, experiências, unidades e conteúdos que se unem, mas não se somam e tampouco se integram (LÜCK, 2007), uma vez que prevalece a idéia de que a melhor escola é aquela que mais aprova nos exames vestibulares (BRASIL, 2006). Nessa perspectiva, cada “especialista” preocupa-se essencialmente com a sua disciplina, esquecendo-se das demais áreas do conhecimento (BRASIL, 2002). Pesquisadores da área apontam: O atrelamento do [...] [ensino médio] ao vestibular é mais um fator a complicar o ensino de Química; a pressão para “dar matéria” e “terminar o programa” tem como resultado, entre outros, a superficialidade da análise dos fenômenos, a má construção 23 dos conceitos e a ausência do relacionamento do assunto com o saber todo da Química. Nessas condições, o estudo da Química desliza para o seu grau mais baixo e mais inútil: a simples memorização dos conceitos e de “regrinhas” para resolver problemas e testes visando passar no vestibular (BELTRAN et al., 1991, p. 17). O [ensino de Química] vem sendo historicamente marcado por desafios aos educadores. Voltado a preparação para exames vestibulares, em detrimento das finalidades atribuídas pela LDBEN à Educação Básica [...], em que pesem as novas perspectivas em discussão prevalecem as formas lineares e fragmentadas de organização do conhecimento escolar, aliadas a repetição de conteúdos de cunho apenas propedêutico, limitados à preparação para concursos e seleções, o que está expresso no próprio perfil das escolas consideradas melhores, cujo ensino assemelha-se ao modelo de cursinhos pré-vestibular (ZANON, 2008, p. 258). A problemática apontada por Beltran (1991) é a mesma discutida nas Orientações Curriculares para o Ensino Médio (BRASIL, 2006) e recentemente debatidas por Zanon (2008), ou seja, aprendizados escolares superficiais e estanques, que carecem de relações entre si e com contextos de vivência fora da sala de aula, e que na verdade não contribuem para o desenvolvimento das potencialidades humanas, uma vez que o atrelamento ao vestibular se resume na racionalidade instrumental retratada por Novikoff (2009). Contudo, a extrema complexidade do mundo atual não mais permite que o ensino médio seja apenas preparatório para um exame de seleção, em que o estudante é perito, porque [está] treinado em resolver questões que exigem sempre a mesma resposta padrão. [O dinamismo da sociedade] exige que o estudante se posicione, julgue e tome decisões, e seja responsabilizado por isso. Essas são capacidades mentais construídas nas interações sociais vivenciadas na escola, em situações complexas que exigem novas formas de participação (BRASIL, 2006, p. 106). Sob essa ótica, uma boa aula de Química não deveria ser avaliada pelo número de exercícios de adestramento, mas sim pela qualidade das situações propostas, em que os estudantes e os professores, em interação, teriam meios de produzir conhecimentos contextualizados. Obviamente, essa produção exige do professor e do aluno conhecimentos que possibilitem mais que um padrão de adestramento, mas sim uma discussão entre pares para garantir estratégias de ensino mais eficientes, ou seja, uma verdadeira superação das fronteiras disciplinares. 2.2 A raiz da ciência Química: Tabela Periódica Hoje uma infinidade de substâncias simples e compostas é conhecida. Todas elas formadas por um ou mais elementos químicos. Pode-se imaginar que o número de elementos atualmente disponível justifica a variedade de substâncias que nos cercam. Ao contrário, a quantidade de substâncias existentes para a sociedade, não é o resultado do número de 24 elementos, mas sim pelo modo como tais elementos se combinam entre si por meio de reações químicas (Figura 2.1). Figura 2.1: Tabela Periódica como raiz da ciência Química Fonte: The Chemogenesis Web Book (LEACH, 2009)4 Entendendo-se que os elementos químicos constituintes de todas as substâncias hoje conhecidas, encontram-se coerentemente ordenados em sistema periódico (Apêndice A) segundo as suas propriedades físicas e químicas, a Tabela Periódica só pode ser considerada a raiz da ciência Química, como também pode oferecer grandes contribuições ao seu ensino da Química como ciência do cotidiano, quando considerada como um axioma para se discutir/aprender a “Química em Geral”, ou seja, uma aproximação entre a Química e a sociedade a partir da classificação periódica dos elementos. 2.3 Tabela Periódica: de Tales à IUPAC A classificação periódica foi inicialmente idealizada com base apenas na semelhança do comportamento químico dos elementos, mas à medida que outros elementos foram descobertos (Apêndice B: Linha do Tempo - elementos químicos e a Tabela Periódica) e a 4 A Figura 2.1 foi gentilmente cedida pelo Dr Mark R. Leach (UK). 25 estrutura atômica foi elucidada, os cientistas propuseram ordenações mais coerentes e complexas entre eles (PAULING, 1967), visto que tais avanços reduziram paulatinamente as lacunas observadas entre as propriedades dos elementos químicos, fazendo com que a periodicidade se tornasse cada vez mais latente. Contudo para se chegar a esse estágio, um longo caminho foi percorrido, iniciando-se na Grécia Antiga até a constituição da Tabela Periódica atualmente recomendada pela IUPAC (International Union of Pure and Applied Chemistry) que se encontra disponível para consulta no Apêndice A: Tabela Periódica dos elementos segundo a IUPAC. 2.3.1 As Perguntas Movem o Mundo Na antiguidade, o ouro, a prata, o cobre, o ferro, o carbono (carvão), o chumbo, o estanho, o mercúrio, o enxofre e o antimônio já eram bastante conhecidos pelos seus diferentes usos e aplicações na produção de jóias, moedas, armas, cosméticos, ferramentas, mas não como elementos químicos (BABOR et al., 1974; NEVES et al., 2008; PAULING, 1967; VANIN, 2005). Dentre esses elementos, o primeiro metal usado pelo homem, segundo Gleiser (2008, p. 36) foi o cobre, uma vez que arqueólogos encontraram objetos em cobre produzidos há mais de 10.000 anos, não muito após o surgimento das primeiras comunidades agrárias. Com exceção do mercúrio, todos os elementos citados também aparecem em textos religiosos, seja em sentido figurado ou concreto evidenciando as suas propriedades: E Zilá também deu à luz a Tubal-Caim, fabricante de todo instrumento cortante de cobre e ferro; e a irmã de Tubal-Caim foi Noema (Gênesis 4:22). E era Abrão muito rico em gado, em prata e em ouro (Gênesis 13:2). Então o Senhor fez chover enxofre e fogo, do Senhor desde os céus, sobre Sodoma e Gomorra (Gênesis 19:24). Sopraste com o teu vento, e o mar os cobriu; afundaram-se como chumbo em veementes águas (Êxodo 15:10). Contudo o ouro, e a prata, o cobre, o ferro, o estanho, e o chumbo (Números 31:22). Como o carvão para as brasas, e a lenha para o fogo, assim é o homem contencioso para acender rixas (Provérbios 26:21) (BÍBLIA, 1990, p. 8, 14, 24, 65, 154, 566). Dentre as civilizações antigas, sem dúvidas, a que mais se destacou na utilização empírica dos processos químicos, foi a egípcia (BABOR et al., 1974). Os egípcios sabiam trabalhar muito bem o ouro, como pode ser constatado na máscara mortuária do faraó Tutankamon (VANIN, 2005), produziam vidros e esmaltes, imitavam com perfeição os metais nobres, assim como o rubi, a safira e a esmeralda, utilizavam amplamente o couro dos animais, a lã, o algodão, o linho e sabiam tingi-los com índigo e púrpura, preparavam sabões 26 perfumes e produtos de beleza (BABOR et al., 1974); Cleópatra, por exemplo, pintava o contorno dos olhos com um preparado à base de sulfeto de antimônio (VANIN, 2005). Percebe-se que antes mesmo de qualquer definição ou conceituação, os elementos químicos já faziam parte do cotidiano humano, seja do ponto de vista prático, que envolvia a produção de moedas, armas e utensílios, como também do ponto de vista filosófico e religioso. O conceito de elemento químico evoluiu paulatinamente, como também a compreensão da estrutura e transformações da matéria. Durante muito tempo filósofos e cientistas buscaram meios para explicar como e porque os elementos reagiam para formar novas substâncias. Acredita-se que tenha sido na Grécia antiga, cerca de cinco séculos antes da era Cristã, onde surgiram as primeiras indagações acerca da constituição do mundo material. Os antigos gregos propuseram diferentes interpretações e desenvolveram várias correntes filosóficas no intuito de prover explicações para o comportamento da natureza (COTTON et al., 1968; MAIA et al., 2007). Dentre os principais filósofos gregos que se preocuparam em definir a constituição da matéria e explicar o seu comportamento podem ser destacados: Tales, Anaximandro, Anaxímenes, Heráclito, Empédocles, Platão, Aristóteles, Leucipo, Demócrito e Epicuro (GLEISER, 2008; MARTINS, 2001; QUADBECK-SEEGER, 2007; STRATHERN, 2002). Atribui-se a Tales de Mileto (625 a. C. - 547 a. C), os primeiros questionamentos a respeito da constituição da matéria. Segundo ele, o elemento precursor do mundo material seria a água, que ao ser resfriada, tornava-se densa e dava origem à terra, que ao ser aquecida transformava-se em vapor e ar, que precipitavam sob a forma de chuva quando eram novamente resfriados (GLEISER, 2008). Por meio desse ciclo contínuo nasciam as diversas formas de vida vegetal e animal. Embora empírica, percebe-se que a concepção de Tales já identificava a importância da água para a natureza em toda a sua abrangência. Por sua vez, Anaximandro de Mileto (611 a. C – 546 a. C), um dos seguidores de Tales, postulou a existência de uma entidade totalmente abstrata, dinâmica e universal, dotada de vida e imortalidade, o ilimitado; de onde tudo nascia e fluía, não se restringindo apenas à Terra (BALCHIN, 2009). Uma visão um tanto abstrata e inspiradora da natureza em constante transformação. Já Anaxímenes de Mileto (585 a. C. 525 a. C.), discípulo de Anaximandro, retomou o materialismo de Tales e postulou que o ar seria o elemento fundamental da matéria e não a água, ou seja, um elemento não tão abstrato como o ilimitado de Anaximandro, porém menos perceptível que a água proposta por Tales. Tudo sobrevinha do ar, por meio de seus movimentos. À medida que o ar fosse comprimido, ele se materializaria em água. Quando a água fosse comprimida, ela se transformaria em terra; que se ainda mais comprimida fosse, se 27 transformaria em rocha, ou seja, tudo se resumiria em ar, em um estado mais ou menos aproximado (GLEISER, 2008; QUADBECK-SEEGER, 2007; STRATHERN, 2002). Enquanto isso para Heráclito de Éfeso (540 a.C. - 470 a.C.) as argumentações de Anaxímenes eram insuficientes para explicar a diversidade do mundo. Segundo ele existia por trás de todas as coisas um princípio organizador, o logos. Tudo fazia parte de uma unidade, na qual o agente transformador seria o fogo. O determinante do comportamento de todas as coisas, ou seja, a encarnação de logos. Heráclito afirmava que o mundo era, e sempre seria um eterno fogo, que se inflamava e apagava continuamente, orientado por um fluxo contínuo (GLEISER, 2008). Pode-se dizer que: O fogo cambiante de Heráclito assemelha-se à idéia de energia na física moderna. [...] Na relatividade a massa é equivalente à energia, segundo a fórmula de Einstein, E = m.c2. Assim a energia pode teoricamente transformar-se em matéria, exatamente como o fluxo ou o fogo de Heráclito [...] (STRATHERN, 2002, p. 21). Nota-se que os filósofos gregos, ao refletirem acerca da constituição da matéria, terminavam por concluir que o universo era formado por um único constituinte. Contudo, não havia um consenso entre eles, pois o componente defendido como fundamental variava bastante. Embora essas asserções, deduzidas a partir de observações subjetivas, pudessem ter um grande número de defensores, nenhuma delas mostrava-se suficientemente satisfatória para explicar as transformações ocorridas na natureza. 2.3.1.1 As Quatro Raízes de Empédocles Empédocles de Agrigento (490 a. C. – 435 a. C) idealizou um sistema filosófico “conciliador” a respeito da constituição da matéria, no qual combinava as concepções filosóficas de Tales, Anaximandro e Heráclito. Ele substitui a filosofia de um único princípio pela combinação da água, ar, fogo com mais um quarto constituinte, a Terra. As concepções de Empédocles eram bastante razoáveis para época, pois o mundo material era percebido sob quatro formas: sólida (terra); gasosa (ar), líquida (água) ou energia (fogo) (GLEISER, 2008; STRATHERN, 2002). Esses componentes foram nomeados raízes; e segundo Empédocles, formavam a base de todas as coisas quando combinados em distintas proporções. Por sua vez, as quatro raízes eram indestrutíveis e estavam em harmônico equilíbrio, regidos por dois princípios opostos: o amor; responsável pela união das raízes para formar outras substâncias e o ódio; para explicar a separação ou a decomposição (CHASSOT, 2004; GLEISER, 2008). Observa-se que a filosofia de Empédocles possuía uma descrição filosófica do 28 comportamento bastante semelhante àquele regido pelas forças dualísticas de atração e repulsão (GLEISER, 2008). 2.3.1.2 Os Sólidos Platônicos Platão (427 a. C. – 374 a. C.) forneceu um tratamento geométrico para a filosofia de Empédocles ao associá-la a cinco poliedros regulares (Figura 2.2). Na visão de Platão, o tetraedro corresponderia ao fogo; por ter o menor volume para sua superfície, o que analogamente representaria a aridez. O hexaedro, por ser constituído por seis quadrados, que lhe conferem estabilidade, reproduziria a terra. O octaedro estaria associado ao ar, pois quando fixado por dois vértices opostos, poderia ser girado livremente. O icosaedro representaria a água, por possuir o maior volume para a sua área superficial e o dodecaedro, com doze pentágonos iguais seria uma analogia ao zodíaco, que por sua vez representaria o universo como um todo (OBSERVATÓRIO NACIONAL, 2009). Figura 2.2: Os cinco sólidos platônicos: o tetraedro (fogo), o hexaedro (terra),o octaedro (ar), icosaedro (água) e o dodecaedro (universo). Fonte: elaborado pelo o autor. Platão explicava a partir das faces dos poliedros ilustrados na Figura 2.2 as transformações mútuas das raízes de Empédocles, com exceção da terra, representada pelo cubo, raiz estável (SCIENTIFIC AMERICAN, [200?]). De fato, o tetraedro, octaedro e o icosaedro por serem formados por triângulos equiláteros, prestavam-se muito bem a essa explicação, que em parte 29 [...] aproximava-se, do ponto de vista da estequiometria, da moderna noção de reatividade utilizada pela química. [...] O princípio da conservação da matéria, base do cálculo estequiométrico em química, evidencia-se na possibilidade de transmutação estabelecida por Platão para os seus elementos, sendo possível a transformação: 1 Ar → 2 fogo, uma vez que o ar está associado ao octaedro (oito triângulos eqüiláteros) e o fogo ao tetraedro (quatro triângulos eqüiláteros), de forma que, na transformação exemplificada, tem-se nos “reagentes” e “produtos”, oito triângulos eqüiláteros (Faria et al , 2005 apud NEVES et al 2008). As explicações sustentadas pelos sólidos platônicos assemelham-se bastante a Lei da Conservação da Massa enunciada por Antoine Lavoisier no século XVII, após sucessivos experimentos quantitativos. 2.3.1.3 Das Quatro Raízes ao Éter de Aristóteles Aristóteles (384 a. C. – 322 a. C.), discípulo de Platão e adepto da filosofia das quatro raízes, associou a cada uma das raízes de Empédocles quatro qualidades primárias e fundamentais, formando pares opostos quente e frio, úmido e seco; e denominou as quatro raízes de “elementos”, conforme descrito a seguir (CHASSOT, 2004; TRINDADE et al., 1989): x Terra: propriedade fria e seca; x Água: propriedade fria e úmida; x Ar: propriedade quente e úmido; x Fogo: propriedade quente e seco. Aristóteles defendia que a matéria era contínua e infinitamente divisível e cada um dos quatro elementos tinha um lugar específico (GLEISER, 2008). A terra estaria abaixo dos demais elementos. Em seguida viria a água; sobre a superfície da terra, pois ela precipitava sob a forma de chuva através do ar. O ar estaria acima da água, e o fogo por seu turno estaria posicionado em local mais elevado. A Lua seria o divisor entre duas realidades. Abaixo dela, tudo seria formado pelos quatro elementos e os demais astros, inclusive a lua, seriam formados pela quintessência; o éter, que era totalmente diferente dos demais elementos (CHASSOT, 2004; STRATHERN, 2002; TRINDADE et al., 1989). Segundo Aristóteles, os quatro elementos ilustrados na Figura 2.2 eram imutáveis e poderiam ser convertidos entre si; e uma ou ambas, de suas propriedades poderiam ser transformadas opostamente (TRINDADE et al., 1989). No caso das 30 propriedades antagônicas, a transformação ocorreria mais facilmente entre aqueles elementos que tivessem uma característica em comum. Figura 2.3: Os cinco elementos na visão de Aristóteles com suas respectivas propriedades associados aos sólidos platônicos. Fonte: Traduzido de QUADBECK-SEEGER (2007, p. 18). O modelo de Aristóteles "explicava" facilmente uma série de fenômenos observados na natureza. A queima de um arbusto, por exemplo, poderia ser interpretada pelo madeira ser constituída por terra e água, se transformar em fogo e ar, por meio da conversão das características seco-frio-úmido em seco-quente-úmido. Nesse caso, a única propriedade realmente modificada seria a qualidade de frio para quente, que explicava, na época, satisfatoriamente o fenômeno químico, hoje conhecido por combustão (STRATHERN, 2002). 2.3.1.4 O Atomismo Dentre as várias concepções sobre a constituição da matéria que compõe o Universo, a mais relevante foi a proposta atômica de Leucipo de Mileto (500 a. C - ?) e Demócrito de Abdera (470 a.C – 380 a.C), que foi capaz de explicar a estrutura da matéria sem recorrer a entidades divinas ou misteriosas (GLEISER, 2008). Segundo esses filósofos, o universo era constituído por duas coisas; um vazio total (vácuo) e agregados de matéria, que independentemente da sua forma, poderiam ser subdivididos em unidades cada vez menores até um limite, além do qual nenhuma divisão seria mais possível (átomos) (MARTINS, 2001). Cerca de um século mais tarde, Epicuro (341 a.C. - 270 a.C.), não só retomou as concepções 31 atômicas, como também nomeou por átomos as partículas indivisíveis de Leucipo e Demócrito e concebeu sua própria filosofia: Nada vem do nada ou do que não existe, pois se assim não fosse, tudo nasceria de tudo sem necessitar de sementes. Se o que se destrói não passasse a ser outra coisa, passando a não existência, tudo já teria se acabado. Mas o Universo foi sempre tal como é hoje, e como tal será sempre e nada existe em que possa converter-se; pois fora do próprio Universo nada existe em que ele possa vir a se transformar ou com o qual ele possa ser trocado. Há o vácuo, pois se ele não existisse, criando o espaço e a extensão, não teriam os corpos um local para estar, nem onde se movimentar como na verdade se movem. Os corpos uns são compostos e outros são simples, porém estes podem também (...) vir a formar corpos compostos. São estes corpos simples indivisíveis e imutáveis, que não podem passar a não existência, de tal maneira que permanecem eternamente estáveis, mesmo quando se dissolvem os corpos compostos. Deste modo, precisamente os princípios fundamentais de todas as coisas, constituem as naturezas intrínsecas destes pequenos corpos, átomos, ou seja, indivisíveis. O Universo é infinito pela grandeza do vácuo e pela quantidade destes átomos. Os átomos se movem continuamente. Devem ter igual velocidade quando se deslocam no vácuo, sem se tocar em nada, pois supondo que nada encontrem que os detenha, nem os mais pesados correm mais que os mais leves, nem os menores que os maiores. Os átomos não têm princípio já que eles e o vácuo são a causa de tudo. Não têm nenhuma qualidade a não ser a configuração, a grandeza e o peso (MARTINS, 2001 p. 5). Na filosofia de Epicuro destacam-se asserções, embora incipientes, acerca da conservação da matéria, a inércia e até mesmo a suposição da existência de distintas massas (“pesos”) atômicas. Conjeturas que mais tarde, de uma forma ou outra, foram retomadas por cientistas tais como Isaac Newton (1687), Antoine Lavoisier (1789), Amedeo Avogadro (1811), Stanislao Cannizzarro (1860), dentre outros. O epicurismo foi bastante difundido pelo filósofo romano, Lito Lucrécio, (95 a.C. 52 a.C), por meio do livro De rerum natura5. Além da divulgação do atomismo, Lucrécio também possuía suas próprias concepções acerca dos átomos, como por exemplo, atribuiulhes formas geométricas distintas para justificar as propriedades das substâncias (MARTINS, 2001). Graças a Lucrécio, as idéias de Epicuro assumiram um lugar de destaque em Roma (TRINDADE et al., 1989). Todavia, com o advento do cristianismo, a austeridade e a contrição tornaram-se a ordem do dia, levando os primeiros cristãos a identificar Epicuro como o anticristo. A principal acusação era que as concepções atômicas se resumiam em uma doutrina ateísta-materialista, que pressupunha explicar os fenômenos da natureza em termos de matéria e movimento (MARTINS, 2001). Dessa forma, átomos invisíveis movimentando-se no vácuo, sem planos ou desígnios pré-estabelecidos, pareciam concorrer com os valores espirituais, o que consistia em um agravo inconcebível para as antigas religiões (QUADBECK-SEEGER, 2007; TRINDADE et al., 1989). Sendo assim, até a primeira 5 Tradução: Da natureza das coisas. 32 metade do século XVII, o atomismo não teve grandes repercussões, até que os experimentos de Evangelista Torricelli (1608 - 1647) em 1640 e Otto von Guericke (1602 -1682) comprovoram a existência do vácuo6 (MARTINS, 2001). Por outro lado, as concepções de Aristóteles foram tão sólidas, que malograram o atomismo por muito tempo por distintas razões. A principal delas, afora a questão religiosa, era que as proposições do filósofo fundamentavam-se em propriedades muito mais palpáveis; dessa forma, não era necessária a utilização de entidades tão abstratas, como o átomo e o vácuo para explicar as transformações da natureza. Além disso, a filosofia dos quatro elementos subsidiava a presciência das transformações das substâncias em outras, como por exemplo: Ao queimarmos um pedaço de madeira, podemos observar o desprendimento de gotículas de água, a formação do fogo, e a liberação de substâncias gasosas (na interpretação Aristotélica, ar), restando ao final, apenas o material não calcinado, cinzas (terra). (NEVES et al., 2008, p. 35). Percebe-se que os “produtos” obtidos a partir da combustão da madeira encontravam-se em plena concordância com as idéias de Aristóteles. Sob esse aspecto, o modelo dos quatro elementos era muito mais elucidativo do que aquele proposto por Epicuro, e conseqüentemente exerceu maior influência no desenvolvimento do pensamento científico (BALCHIN, 2009). A hipótese de qualquer forma da matéria ser obtida a partir da variação das proporções de quatro elementos-base obteve uma grande aceitabilidade e tornou-se posteriormente a base da alquimia. A quimera aristotélica não pôde ser provada por meio de observações experimentais e dessa forma a alquimia mostrou-se não efetiva. Não obstante, a autoridade e o brilhantismo de Aristóteles eram tamanhos que suas idéias foram praticamente irrefutáveis por quase dois mil anos (STRATHERN, 2002). 2.3.2 Alquimia e Iatroquímica É impossível afirmar com exatidão quando surgiu a alquimia, pois suas origens se perdem e se confundem com a existência do próprio homem. É sabido que a extração de alguns metais comuns e de seus minérios era praticada há muito tempo, assim como a 6 Em 1656, Guericke obteve a primeira prova experimental da existência do vácuo. Com uma bomba de ar modificada que ele mesmo havia inventado, Guericke retirou o ar de dois hemisférios de metal que tinham sido postos em união somente com graxa. A seguir ele atrelou um grupo de oito cavalos a cada um dos hemisférios e fez com que eles tentassem separar o conjunto. Apesar de todo o esforço, os cavalos foram incapazes de separá-los. O que impedia a separação era a pressão exercida pelo ar sobre a superfície externa dos hemisférios. Esta experiência foi feita na cidade alemã de Magdeburg e os hemisférios passaram a ser conhecidos como hemisférios de Magdeburg (OBSERVATÓRIO NACIONAL, 2010). 33 preparação de princípios ativos derivados das plantas, para aplicações medicinais, envolvendo uma prática involuntária da química, foi um aspecto importante para as civilizações primitivas (VANIN, 2005). Segundo Farias (2007), a hipótese mais provável acerca da origem da palavra alquimia está no vocábulo árabe el-kimyâ que, por sua vez tem ascendência grega, cujo significado é “a terra negra”; uma provável alusão as antigas e férteis margens do rio Nilo. Dessa forma, a progênie da palavra alquimia sugere sua prática no Egito (MELLOR, 1955). Por outro lado, alguns historiadores defendem a idéia que a palavra kimia, deriva do grego chymia, que significa fundir um metal. Hipótese essa que remonta a uma prática alquímica nos primórdios da civilização humana (FARIAS, 2007), uma vez que existem evidências que ouro, ferro, cobre, prata, chumbo e estanho eram conhecidos antes do ano 3000 a. C (PAULING, 1967). Independente de como, onde e quando a alquimia tenha surgido, é notório que sua gênese está no conhecimento prático existente e acumulado ao longo da existência do homem, que foi fortemente influenciado pelo misticismo envolvido nas transformações químicas até então desconhecidas. Os alquimistas ganharam notoriedade em parte da história da química ao buscar a “Pedra Filosofal” e o “Elixir da Longa Vida”; substâncias essas que conseguiriam respectivamente feitos notáveis, como a transmutação de metais em ouro e o princípio responsável pela juventude eterna (imortalidade). Apesar desses sonhos inatingíveis, o trabalho desenvolvido por eles foi de suma importância para humanidade, pois graças a seus experimentos rudimentares, muitas substâncias foram descobertas, equipamentos foram aperfeiçoados e novas técnicas laboratoriais foram desenvolvidas (BABOR et al., 1974; VANIN, 2005). A filosofia de Aristóteles fundiu-se com o conhecimento egípcio e posteriormente foi ampliada pelos árabes após a conquista dos egípcios no ano 640 d. C. (BABOR et al., 1974; MELLOR, 1955). O mais importante alquimista árabe foi Abu Moussah Diafar al Sofi Geber, conhecido por Geber. Responsável por adicionar o mercúrio e o enxofre aos quatro elementos de Aristóteles (CHASSOT, 2004; MELLOR, 1955). Sem dúvidas, o conhecimento adquirido a partir das fontes Greco-egípcias, aliados a prática inerente aos árabes difundiu-se paulatinamente por toda Europa (MELLOR, 1955). Nos séculos XII e XIII, surgiram as primeiras traduções dos trabalhos árabes, especialmente na Espanha, e dessa forma, o alquimismo elevou-se a uma posição de considerável importância. Dentre os principais nomes desse período, destacam-se San Alberto Magno (1206 – 1280), considerado o Aristóteles da Idade Média (BABOR et al., 1974), que preparou a potassa cáustica e descreveu o método 34 para se obter arsênico puro, cujo mérito do descobrimento lhe é concedido; Roger Bacon (1214 – 1292), opositor de Aristóteles, considerado o difusor da pólvora no Ocidente, Raymond Lully (1235 – 1315), descobridor do método de fabricação do álcool puro e Arnold Vilanova (1232 – 1316), médico alquimista (BABOR et al., 1974), ao qual se atribuiu o descobrimento das propriedades anti-sépticas e conservantes do álcool (aquavitae), bem como publicação do texto De conservanda invetute et retardanda senectte7 (CHASSOT, 2004; MELLOR, 1955; STRATHERN, 2002). Após Magno, Bacon, Lully e Vilanova, a alquimia vivenciou um período, no qual parte dos alquimistas concentrou suas atenções para o desenvolvimento do Elixir da Longa Vida. Dentre os alquimistas dessa época, destaca-se a Figura de Paracelso8, cujo verdadeiro nome era Theophrastus Bombastus von Hohenheim (1490 - 1541); principal ícone desse segmento da alquimia, conhecido por iatroquímica (STRATHERN, 2002 ;TRINDADE et al., 1989; VANIN, 2005). Entre erros e acertos, Paracelso não somente aplicou a alquimia à medicina, como também demonstrou o efeito curativo de várias substâncias, afora direcionar o pensamento alquimista para fins mais concretos, muito além da Pedra Filosofal (MELLOR, 1955; VANIN, 2005). Partidário da doutrina dos quatro elementos, Paracelso acreditava que eles se manifestavam no corpo humano regidos pelos dois princípios anteriormente citados (enxofre e mercúrio) conjugados a um terceiro princípio, o sal. A esses três princípios filosóficos, denominou-se tria prima, cujo enxofre representava a cor e combustibilidade; o sal significava a resistência ou incombustibilidade, enquanto o mercúrio (caráter metálico) era o responsável pelo brilho e dureza da matéria. Por sua vez, as doenças eram o produto dos desequilíbrios da tria prima no corpo humano (NEVES et al., 2008; TRINDADE et al., 1989). Paracelso foi pioneiro no emprego de medicamentos a base de ópio e substâncias a base de ferro, enxofre, arsênico e cobre na cura de várias enfermidades, além de ter empregado a mercúrioterapia no tratamento da sífilis9 (GLEISER, 2008; MELLOR, 1955). Antes da iatroquímica, os remédios restringiam-se apenas às substâncias extraídas de plantas e animais, pois não se concebia até então que ferro, enxofre e zinco pudessem debelar doenças. Várias substâncias empregadas por Paracelso, ainda fazem parte do receituário médico de nosso cotidiano, como por exemplo, o ferro; como antianêmico e o enxofre; como 7 Tradução: Sobre a conservação da juventude e o retardar da velhice. Paracelso significa “além de” ou “maior que” Celso. Enciclopedista romano cujos escritos, do primeiro século da era cristã, formavam a base da medicina da época, mesmo passados quinze séculos (GLEISER, 2008). 9 Na época dos grandes descobrimentos, a sífilis atingiu proporções devastadoras na Europa. Porém, não se sabe se ela foi proveniente das Américas, do Oriente ou se somente então foi reconhecida como doença (GLEISER, 2008 p. 73). 8 35 antimicótico (VANIN, 2005). Foi também o autor da primeira monografia10 sobre as doenças ocupacionais que acometiam os mineiros e operários das fundições, a qual foi publicada postumamente, em 1567 (LING et al., 2005). Muitas das concepções de Paracelso traziam em si as superstições e os misticismos da alquimia, contudo seus sucessores discerniram em parte o misticismo do experimentalismo, com destaque especial para Andreas Libavius (1540 – 1616), que em 1597 publicou o primeiro livro-texto de “química”, intitulado Alchemia (NEVES et al., 2008) e Johann Baptista van Helmont (1577 – 1644), que fundamentado em experimentos quantitativos com um pé de salgueiro11, não somente abandonou os princípios de Paracelso, como também rejeitou os quatro elementos de Aristóteles e resgatou o pensamento de Tales (STRATHERN, 2002). Van Helmont foi o primeiro alquimista a inteirar-se que muitas reações químicas geravam gases e seus estudos nessa área influenciaram os trabalhos de Robert Boyle (TRINDADE et al., 1989). Helmont, por exemplo, descobriu que o spiritus sylvester12 (dióxido de carbono – CO2), substância formada durante a combustão dos vegetais possuía as mesmas propriedades daquela originada no processo de fermentação do vinho, e atribui-lhe o termo “gás”, a partir da pronúncia flamenga da palavra grega – chaos (BALCHIN, 2009; MELLOR, 1955; TRINDADE et al., 1989). 2.3.3 O “Re-Nascimento” de uma Ciência Pierre Gassend (1592 – 1655) é considerado um dos maiores divulgadores da obra de Lito Lucrécio13 no século XVII (STRATHERN, 2002). Na verdade, Gassend foi um opositor aos quatro elementos de Aristóteles, e o responsável por conciliar a teoria atômica ao cristianismo (MARTINS, 2001). Acredita-se que o trabalho desenvolvido por Gassend na França tenha sido tão importante que Isaac Newton14 e Robert Boyle, praticantes da alquimia, 10 Título original: On the miner’s sickness and other diseases of miners. Segundo Balchin (2009), Helmont cultivou um pé de salgueiro que ficou protegido contra poeira e foi regado diariamente, por cinco anos. Após esse período, ele retirou a planta do vaso e mediu sua massa, comparou-a com a massa inicial do vegetal e chegou a conclusão de que toda a folhagem da árvore consistia inteiramente de água, e que esta fora espontaneamente convertida pela árvore em sua própria substância. 12 Tradução: espírito da mata. 13 De rerum natura. 14 Newton estendeu às reações químicas as idéias desenvolvidas na mecânica e na ótica. Admitiu que as forças de atração ou afinidades, que existem entre as partículas microscópicas de matéria como entre os planetas e os astros, são causa do referido comportamento. A intensidade maior ou menor da força de atração entre duas categorias de partículas depende da propensão maior ou menor que essas partículas têm de se unir entre si. A versão newtoniana da teoria das afinidades foi desenvolvida por Geoffroy que idealizou uma tabela de afinidades para diferentes substâncias até então conhecidas (ROSMORDUC, 1988). 11 36 foram influenciados por ele (ROSMORDUC, 1988). Na verdade, o curso da história européia durante o século XVII foi marcado pelo nascimento de um espírito investigatório, associado ao Renascimento, que deu início da ciência moderna. Nessa perspectiva, em 1620, Francis Bacon (1561-1626), publicou o livro Novum Organum Scientarum, no qual definiu claramente uma metodologia para abordagem dos problemas científicos. O método de Bacon primava pela observação cuidadosa, acúmulo de fatos, imparcialidade e ausência de preconceitos na correlação e coordenação das observações (MELLOR, 1955; STRATHERN, 2002). A Francis Bacon é atribuída a fundação da ciência experimental (CHASSOT, 2004). Por sua vez, Robert Boyle (1627 – 1691) é considerado por muitos autores o fundador da química. Semelhante a van Helmont, Boyle questionou os quatro elementos de Aristóteles e a tria prima de Paracelso em seu livro Sceptical Chymist 15 , publicado em 1661 (BRYSON, 2005; MELLOR, 1955; NEVES et al., 2008; STRATHERN, 2002). Segundo Boyle: [Os verdadeiros] elementos são certos corpos perfeitamente puros, primitivos e simples e não feitos de nenhum corpo, nem um do outro: são os ingredientes dos quais são feitos diretamente todos os corpos chamados combinados, e nos quais esses corpos por fim se decomporão (NEVES et al., 2008, p. 43). Os pensamentos de Robert Boyle diferiam das concepções aristotélicas e marcaram o início de uma paulatina ruptura entre o alquimismo e uma ciência emergente – a Química. Por não acreditar que o fogo era capaz de decompor uma substância em seus constituintes básicos, Boyle, demonstrou experimentalmente que o sabão, produzido a partir de gordura e álcali ao ser submetido ao fogo, não produzia seus componentes. Ao contrário, formava produtos distintos que não reproduziam o sabão ao serem combinados; ou seja, o fogo não decompunha as substâncias em seus elementos, apenas rearranjava suas partículas componentes para formar outros compostos (TRINDADE et al., 1989). Com base nesses experimentos, Boyle defendeu que o número de elementos produzidos dependeria do modo pelo qual se processava o aquecimento. Por exemplo, a combustão da madeira em um sistema aberto produzia cinzas e carvão, mas, quando queimada em uma retorta, gerava óleo, água, carvão, vinagre e alcoóis. Uma evidência, segundo ele, que distintas formas de aquecimento, ditavam o número de elementos constitutivos da madeira (TRINDADE et al., 1989). Boyle ao verificar, experimentalmente, que o gás contido em um recipiente dotado por um êmbolo, por meio do qual se podia variar o volume do sistema, por intermédio de uma força aplicada sobre o recipiente em função da pressão exercida, acendeu a hipótese de que os 15 Tradução: O Químico Cético. 37 gases seriam dotados por diminutas partículas envolvidas por um enorme espaço vazio, razão pela qual poderiam ser reduzidas a volumes menores (HAVEN, 2008). Destarte, com uma visão experimental privilegiada, Robert Boyle acreditava que a natureza não se resumia nos quatro elementos de Aristóteles e na tria prima de Paracelso, e a melhor forma de identificar tais elementos era por meio da experimentação (VANIN, 2005). [...] Segundo a definição de Boyle, um elemento era uma substância que não podia ser decomposta em substâncias ainda mais primárias. Isso significa que, quando se constatava que uma substância era um elemento, essa podia ser apenas uma situação provisória. Era sempre possível que alguma outra pessoa encontrasse uma maneira de decompor ainda mais a substância. Isso deixou Boyle em uma situação anômala. Embora tivesse definido elemento, não sabia de fato o que era um. Ironicamente, era perfeitamente possível que, com o aperfeiçoamento das técnicas químicas, todas as substâncias até aquele ponto consideradas indivisíveis acabassem por ser decompostas em apenas quatro elementos – muito semelhantes a terra, ar, fogo e água [de Aristóteles]! (STRATHERN, 2002, p. 155). Notadamente, Boyle introduziu na química a necessidade de métodos experimentais, para a comprovação das teorias e a verificação da exatidão dos fatos, ao questionar as doutrinas de Aristóteles e Paracelso. Além disso, ele reconheceu a perenidade e a necessidade de evolução do conhecimento, ao restringir a definição de elemento como uma substância incapaz de ulterior decomposição por qualquer meio disponível, mas que poderia mais tarde, com a introdução de novos métodos de investigação, não o ser. Porém, até que isso não se verificasse deveria permanecer como tal. Obviamente, os elementos definidos por Boyle não são os elementos químicos que hoje são conhecidos. Contudo, suas concepções foram suficientes o bastante para o estabelecimento de uma química moderna com uma sólida base experimental nos séculos seguintes, principalmente após Lavoisier (1789). 2.3.4 A Química do Século XVIII O fogo sempre exerceu fascínio sobre o homem e a combustão sempre foi alvo da especulação humana. Basta recordar que Heráclito, afirmara que o fogo era o princípio subjacente a todas as substâncias e mudanças da matéria (GLEISER, 2008). Filósofos anteriores acreditavam que o fogo estava presente em todas as substâncias inflamáveis, visto que ele era um dos quatro elementos de Aristóteles (STRATHERN, 2002). Nessa linha de raciocínio surgiu a teoria do flogisto que perdurou por boa parte do século XVIII. Essa teoria teve suas origens nos ensinamentos do alquimista Johann Joachim Becher (1635-1682) em oposição aos pensamentos de Paracelso, o qual 38 acreditava que apenas as substâncias que continham o princípio da inflamabilidade (enxofre) queimavam. De outro modo, Becher ao observar que muitos materiais, embora combustíveis, não apresentavam enxofre em sua composição (MELLOR, 1955; NEVES, et al., 2008), postulou em seu livro Physica subterranea, publicado em 1667, que as substâncias eram formadas por três tipos de terras16, a saber: terra fluida, terra lapida e a terra pinguis. A primeira terra era responsável pela fluidez e volatilidade das substâncias, a segunda era o elemento aglutinador e a terceira, terra pinguis, era a responsável pelas características oleosas e combustíveis, ou seja, esse seria o verdadeiro princípio da inflamabilidade (STRATHERN, 2002). A terra pinguis de Becher foi retomada em 1703 por George Ernst Stahl (1660 - 1734), no intuito de explicar os processos de fundição dos metais (PAULING, 1967), uma vez que: A técnica da fundição fora conhecida desde os tempos pré-históricos, mas o que realmente acontecia no curso desse processo permanecia um tanto misterioso. Stahl reconheceu que a fundição estava agora madura para ser analisada de um ponto de vista químico, o que poderia de fato levar a avanços na técnica de mineração. Foi a noção de terra pinguis de Becher que inspirou nele a compreensão de que a fundição era simplesmente o processo oposto à combustão. Na combustão, uma substância como a madeira liberava terra pinguis para se converter em cinza. Na fundição, o minério absorvia terra pinguis do carvão para se tornar metal. Essa intuição foi confirmada por Stahl pelo fato de que ela explicava também o enferrujamento em metais. No enferrujamento, o metal liberava sua terra pinguis ígnea e era reduzido a uma ferrugem semelhante a cinzas. Portanto o enferrujamento era simplesmente a combustão ocorrendo numa velocidade mais lenta (STRATHERN, 2002 pp. 179180). Calcado em Becher, Stahl supôs a existência de uma substância denominada flogisto (do grego phlogizein, incendiar, queimar), constituinte do fogo e assumiu que os metais seriam formados por resíduos minerais, chamados cal (do latim calx) combinados com o flogisto, pois: metal + flogisto = cal. Segundo George Stahl, cada metal era dotado por uma cal característica; por sua vez, outras substâncias não metálicas, como por exemplo, o carvão eram quase exclusivamente flogisto; que era dissipado sob a forma de luz e calor durante a combustão. Com base nessa teoria, Stahl explicava facilmente porque um óxido metálico ao ser aquecido com o carvão, em ausência de ar, transformava-se em metal; pois, o resíduo metálico, cal, combinava-se com o flogisto do carvão e transformava-se em metal, ou seja, o metal para ser regenerado deveria ter sua cal tratada por uma substância rica em flogisto, tal como o carvão (MELLOR, 1955; PAULING, 1967). Nessa linha, a teoria de Stahl não somente fornecia uma explicação geral para os processos oxidação (perda de flogisto) e redução (combinação com flogisto), como 16 Do ponto de vista mineralógico as terras eram na verdade os nossos óxidos (TOLENTINO et al., 1997). 39 também justificava outros fenômenos químicos, como por exemplo, o processo de digestão (PAULING, 1967). A combustão de substâncias como a madeira e papel era satisfatoriamente explicada pela teoria do flogisto, pois ao serem queimados, parte desses materiais era convertida em fuligem e cinzas. Todavia, o mesmo não era válido para justificar a oxidação do ferro e outros metais, pois os produtos advindos desses processos possuíam massa superior ao metal de origem, ou seja, a teoria era falha, pois não conseguia explicar por que os metais aumentavam de massa, em vez de diminuir ao serem oxidados ou calcinados17. Para contornar essa anomalia, os partidários de Stahl propuseram dois tipos de flogisto. O primeiro deles, existente em materiais como a madeira e o papel eram dotados de massa, por sua vez, o segundo, presente nos metais possuía massa negativa, (NEVES et al., 2008; STRATHERN, 2002). Não obstante, mesmo falha a teoria continuou válida por quase cem anos, até que no século XVIII Antoine Lavoisier procurou outra explicação, [...] que encontrou em diversas etapas: análise do ar atmosférico e experiências programadas sobre a combustão de substâncias conhecidas (metais, enxofre, fósforo, carbono, etc.), pesando com precisão o material antes e depois da reação. Lavoisier persuadiu-se de que em toda a combustão há união da substância com o ar vital. Daí deduziu que a hipótese flogística era inútil e, portanto, rejeitável. Entre 1775 e 1777, Lavoisier estudou os ácidos, num trabalho que lhe permitiu coletar mais dados para sua batalha contra o flogístico. Mostrou que a transformação dos metais em seus óxidos básicos e a dos não metais em seus ácidos ocorre por efeito de uma combinação do corpo queimado com o oxigênio, e não como explicavam os flogicistas, dizendo que os metais perdiam o flogisto para se converter em derivados dos metais (CHASSOT, 2004, p. 177-118). A principal razão para permanência do flogisto como teoria deve-se a interpretação dos fenômenos químicos sob um prisma qualitativo. A mudança aconteceu somente quando Lavoisier não só aplicou um enfoque quantitativo como também esclareceu o processo de combustão, finalizando assim a teoria de Becher e Stahl. 2.3.4.1 Antoine Lavoisier Cerca de 100 anos após Boyle desenvolver a definição de “elemento”, Antoine Lavoisier (1743 – 1794) aperfeiçou esse conceito, definindo-o como uma substância que não poderia ser decomposta em substâncias mais simples por qualquer meio conhecido 17 Trindade e Pugliesi (1989 p. 251) relatam que Robert Boyle e John Mayow (1641 – 1679) já haviam observado que os metais quando calcinados ganhavam massa. Boyle atribuiu isso a incorporação de partículas de fogo pelos metais e por sua vez Mayow denfendia que na calcinação os metais absorviam partículas nitro-aéreas. 40 (FILGUEIRAS, 1995). A Figura 2.4 apresenta a relação dos elementos de Lavoisier, publicada em 1789. Figura 2.4: Lista original das substâncias simples (“elementos”) segundo Lavoisier em 1789 Fonte: Trindade et al. (1989, p. 254). Em 1789, Lavoisier publicou um dos livros mais influentes na Química, o Traité Élémentaire de Chimie18, uma das maiores contribuições para a Química moderna, que marcou a transição entre as interpretações qualitativas não metodotizadas, provenientes da alquimia e o saber químico metódico, característico da ciência moderna (TOLENTINO et al., 1997). Nessa obra ele não só elucidou como também corrigiu interpretações equivocadas 18 Tradução: Tratado Elementar de Química. 41 acerca dos processos de combustão, e dessa forma contribui efetivamente para a derrocada da teoria do flogisto (BALCHIN, 2009; NEVES et al., 2008). Além disso, Antoine Lavoisier desenvolveu um sistema de nomenclatura química, como também apresentou uma lista de substâncias que não poderiam ser subdivididas em frações menores (Figura 2.4), ordenadas em quatro categorias distintas, a saber: a) substâncias simples que pertenciam aos três reinos e que eram consideradas como elementos dos corpos: calórico, luz, oxigênio, azoto e hidrogênio; b) substâncias simples não-metálicas oxidáveis e acidificáveis: enxofre, fósforo, carbono, radical muriático, radical fluórico e radical borácico; c) substâncias simples metálicas oxidáveis e acidificáveis; antimônio, arsênio, prata, bismuto, cobalto, cobre, estanho, ferro, manganês, mercúrio, molibdênio, níquel, ouro, platina, chumbo, tungstênio; d) substâncias simples salificáveis e terrosas: cal, magnésia, barita, alumina e sílica (SCERRI, 2007; TOLENTINO et al., 1997; TRINDADE et al., 1989). Algumas substâncias listadas na Figura 2.4 foram posteriormente classificadas como elementos químicos, outras como, por exemplo, a luz e o calórico, obviamente, foram desconsiderados como tal. O rápido desenvolvimento de técnicas de separação e caracterização das substâncias químicas permitiu a revisão da tabela proposta por Lavoisier. Um bom exemplo dessa evolução foram os resultados obtidos por Humphry Davy (1778 – 1829) que descobriu em 1807, os elementos potássio e sódio ao aplicar eletricidade à potassa e à soda (HAVEN, 2008). Substâncias que na época possuíam grande importância comercial, na produção de vidro, sabão e pólvora e haviam resistido a todas as tentativas de decomposição anteriores (TRINDADE et al., 1989; STRATHERN, 2002) e que foram consideradas ainda como átomos por John Dalton até o início do século XIX (BRYSON, 2005; HAVEN, 2008; STRATHERN, 2002), conforme será visto mais adiante. As teorias de Antoine Lavoisier eram suportadas por medições experimentais e seus resultados eram facilmente reproduzidos por outros cientistas. Nos experimentos de aquecimento19 e combustão, ele deu especial atenção à massa dos reagentes nas reações químicas e nos produtos resultantes, ao constatar que a massa do produto da combustão era sempre igual à massa dos reagentes: “porque nada se cria, nem nas operações da arte nem nas da natureza e pode-se estabelecer, em princípio que, em toda operação há uma quantidade igual de matéria antes e depois da operação [...]” (NEVES et al., 2008, p. 55), o que se resume no princípio de conservação da matéria. 19 Antoine Lavoisier atingiu temperaturas próximas a 1700 ºC usando a luz solar. Temperaturas mais altas do que as obtidas por qualquer um naquela época. Hoje, por exemplo, uma das fornalhas solares mais potentes em uso atualmente se encontra em Sandia, Novo México, onde temperaturas próximas a 1700 ºC são obtidas (HINRICHS et al., 2003). 42 2.3.5 A Química No Século XIX O atomismo científico propriamente começou no início do século XIX com os trabalhos de John Dalton (1766-1844), Joseph-Louis Gay-Lussac (1778-1850), Lorenzo Amedeo Avogadro (1776-1856) (BALCHIN, 2009). A John Dalton se atribui o mérito da aplicação bem sucedida das idéias atomistas, pois mesmo não dispondo de evidências convincentes da realidade atômica, ele conseguiu sistematizar, em 1803, parte dos conhecimentos até então existentes, por meio de um conjunto de postulados (POLO, 2000), nos quais segundo ele: 1) [A] matéria, embora extremamente divisível, não é, todavia, infinitamente divisível. Deve haver algum ponto além do qual não possamos continuar a divisão da matéria. Dificilmente pode-se duvidar da existência dessas partículas últimas da matéria, embora elas sejam, provavelmente pequenas demais para que as possamos ver, mesmo com futuros melhoramentos dos microscópios. Escolhi a palavra átomo para designar essas partículas últimas; 2) Cada elemento é constituído por átomos idênticos de um tipo característico. Logo, existem tantos tipos de átomos quantos são os elementos. Os átomos de um elemento são perfeitamente iguais em peso, forma, etc; 3) Os átomos são imutáveis; 4) Ao ocorrer a combinação de elementos diferentes para a formação de um composto, a menor porção do composto é constituída por um número definido de átomos de cada elemento; 5) Os átomos não são criados nem destruídos, mas apenas reagrupados nas reações químicas (TRINDADE et al., 1989, p. 254-255) Mais que uma releitura do epicurismo, Dalton fez importantes asserções, que possibilitaram o entendimento do que então era conhecido sobre a estequiometria das reações químicas (NEVES et al., 2008). Embora não tenha sido um grande experimentador, as contribuições de John Dalton para a compreensão atômica foram substanciais, pois suas teorias inspiradas, especialmente, em Robert Boyle20, Antoine Lavoisier21 e Joseph Louis Proust22 (1754 – 1826) proporcionaram à química uma estrutura lógica e racional, desvinculada dos misticismos inerentes a alquimia e a teoria do flogisto que ainda se faziam presentes (COTTON et al., 1968; GLEISER, 2008; HAVEN, 2008). Dalton publicou, em 1808, a primeira parte do livro A new system of chemical philosophy23 e a segunda em 1810 (POLO, 2000). Nessa publicação, John Dalton apresentou a lei das proporções múltiplas e relacionou vinte átomos e as suas respectivas massas 20 Lei de Boyle. Lei de Lavoisier ou lei da conservação da massa. 22 Em 1797, Joseph Louis Proust descobriu a partir da massa das substâncias, que os elementos sempre se combinam em proporções definidas segundo suas respectivas massas, ou seja, as massas dos reagentes e as massas dos produtos que participam da reação obedecem sempre a uma proporção constante, a qual corroborava com a Lei de Lavoisier. As constatações de Proust foram generalizadas como a lei de proporções definidas ou Lei de Proust, a qual serviu como evidência ao atomismo. 23 Tradução: Um novo sistema de filosofia da química 21 43 atômicas (Figura 2.5). Nessa obra, além de sistematizar seus pressupostos, ele propôs uma simbologia para os átomos até então conhecidos24, representando-os por pequenos círculos, pontos, traços e letras dispostos no interior desses círculos (NEVES et al., 2008; TRINDADE et al., 1989). Símbolo “Pictograma” Elemento Massa Estimada por Dalton Símbolo Elemento “Pictograma” Massa Estimada por Dalton Hidrogen 1 Strontian 46 Azoto 5 Baryes 68 Carbon 5,4 Iron 50 Oxygen 7 Zinc 56 Phosphorus 9 Copper 56 Sulphur 13 Lead 90 Magnesia 20 Silver 190 Lime 21 Gold 190 Soda 28 Platina 190 Potash 42 Mercury 167 Figura 2.5: Notação (pictogramas) usada por Dalton para representação dos átomos, publicadas em seu livro Um Novo sistema filosófico da química. Fonte: Adaptado de Neves et al. (2008. p. 63), Trindade et al. (1989, p. 256) e Gleiser (2008, p. 111) As massas apresentadas na Figura 2.5 foram estimadas com base no elemento hidrogênio, o qual foi assumido como referência por Dalton, que atribui o valor 1 para a sua massa. A partir dessa padronização, as massas dos demais átomos foram estimadas em relação a esse elemento. Embora os valores calculados estivessem equivocados (TRINDADE et al., 1989), a abordagem de Dalton era essencialmente perfeita e serviu como base para o estabelecimento da classificação periódica dos elementos químicos (BRYSON, 2005). Paulatinamente, as lacunas da teoria de John Dalton foram preenchidas pelos trabalhos de outros cientistas adeptos às suas idéias, dentre os quais podem ser citados Jöns Jacob Berzelius e Stanislao Cannizarro (CHASSOT, 2004). Entretanto, ainda hoje as premissas básicas de Dalton são pertinentes, tanto que o sistema de massas atômicas empregado pela IUPAC fundamenta-se nos princípios descritos por ele, assumindo-se o elemento carbono como referência e não hidrogênio (TRINDADE et al., 1989; STRATHERN, 2002). 24 Posteriormente verificou-se que alguns átomos considerados por Dalton como tal, não eram átomos. 44 É inegável a contribuição dos experimentos desenvolvidos por Joseph-Louis GayLussac, em 1808, com gases sob pressão e temperaturas constantes, que o levaram a deduzir a chamada lei dos Volumes, a qual estabelecia que "os gases sempre se combinam nas proporções mais simples de volume" (ROSMORDUC, 1988; SCERRI, 2007; STRATHERN, 2002). Contudo as idéias de Gay-Lussac mostravam-se contraditória, uma vez que os gases ao se combinarem pareciam ocupar menos espaço. Essa inconsistência foi resolvida por Amedeo Avogadro, em 1811, quando supôs que as diminutas partículas que compõem um gás seriam agregados de um número definido de átomos, e denominou esses agregados, por moléculas, para diferenciá-los dos átomos fundamentais de Dalton, resultando na hipótese de Avogadro, a qual estabeleceu que "sob as mesmas condições de temperatura e pressão, volumes iguais de todos os gases contém o mesmo número de moléculas." (BALCHIN, 2009) Trabalho extremamente importante, que cerca de meio século depois serviu para concretização dos conceitos de pesos atômicos (massa atômica), no congresso de Karlsruhe em 1860 (BALCHIN, 2009; POLO, 2000). A partir dessa conferência observou-se um grande avanço no sentido de estabelecer a classificação periódica dos elementos (ROSMORDUC, 1988; SCERRI, 2007; STRATHERN, 2002). 2.3.5.1 Jöns Jacob Berzelius Em 1811, Jöns Jacob Berzelius (1779-1848) substituiu os pictogramas empregados por Dalton (Figura 2.5) na representação dos elementos químicos, nomeadamente pela primeira letra maiúscula do nome e, nos casos de redundância, uma letra maiúscula seguida de uma outra, minúscula, considerando-se sempre o nome original do elemento em latim ou grego (BRYSON, 2005; MELLOR, 1955). A luz dessas regras, hoje o enxofre é representado pela letra S (do latim sulfur); o cobre por Cu (do latim cuprum) e o ouro por Au (do latim aurum). Nos compostos, além dos símbolos dos elementos, segundo Berzelius a multiplicidade entre eles seria representada por números subscritos. Dessa forma, seguindo essa orientação, a água é escrita como H2O25, cuja representação indica a proporcionalidade de 2:1 entre os elementos hidrogênio e oxigênio presentes nessa substância. Berzelius é reconhecido não somente por suas contribuições na simbologia dos elementos químicos, que hoje é adotada pela IUPAC, mas também pela determinação de 25 Neves e Farias (2008) e Bryson (2005) registram que Berzelius adotou um notação sobrescrita para representar o número de átomos presentes em um composto, tal como Cu2O e H2O, posteriormente essa notação foi modificada para Cu2O e H2O. 45 massas atômicas mais exatas que John Dalton (STRATHERN, 2002). Conforme mencionado, as massas obtidas por Dalton foram estimadas com base na combinação do hidrogênio com outros átomos. No entanto, o fato desse elemento formar um número limitado de compostos binários e a proporcionalidade dos elementos em alguns compostos não ser exatamente conhecida26 introduziram erros nas massas estimadas por John Dalton (BRYSON, 2005). Simbologia de Berzelius H N O Massas de Dalton (1810) 1 5 7 Massas em1872 1,0 14,0 16,0 Massas da IUPAC (2010) 1,0079 14,007 15,999 Pictograma de Dalton Figura 2.6: Comparação entre algumas massas atômicas de Dalton e os valores já conhecidos em 1872 Fonte: Adaptado de Trindade et al., (1989) Dessa forma, Berzelius, em 1830, atribuiu o valor 100 para o oxigênio e o adotou como um novo padrão na elaboração de uma nova tabela de massas atômicas, contudo esse valor fez com que a massa dos elementos ficasse relativamente grande, logo não foi muito bem aceito. Jean Servais Stas (1813-1891), em trabalhos feitos cuidadosamente a partir de 1850, assumiu o valor 16 para o oxigênio e recalculou os valores das massas atômicas (MELLOR, 1955; PAULING, 1967). É importante observar na Figura 2.6 as diferenças entre as massas de Dalton e aquelas de 1858 e a proximidade dessas últimas com os valores atualmente orientados pela IUPAC. Afora Berzelius e Stas, outros cientistas apresentaram especial interesse na determinação das massas dos elementos. Nessa linha, destacam-se os trabalhos de Charles Gerhardt (1816 – 1856) que assumiu que os gases eram compostos por moléculas diatômicas 26 Dalton desconhecia o número de átomos de hidrogênio e oxigênio presentes em uma molécula de água. Supôs, por simplicidade, que a reação entre esses elementos era de 1:1, e concluiu, erroneamente, que o átomo de oxigênio possuia cerca de sete vezes mais massa que o átomo de hidrogênio. 46 e corrigiu alguns valores das massas disponíveis que estavam duplicados. Pierre Louis Dulong (1826 – 1919) e Alex Thérèse Pettit (1791 – 1820) que descobriram que o calor específico dos elementos sólidos quando multiplicados por suas respectivas massas atômicas fornecia uma constante (SCERRI, 2007) e principalmente Stanislau Cannizarro, que participou do congresso de Karlsruhe27, em 1860, na Alemanha, onde teve a oportunidade de apresentar, baseado na hipótese de Amedeo Avogadro28, uma definição clara acerca dos pesos atômicos (massas atômicas), bem como importância da tabela de massas de Gerhardt, com ligeiras modificações (POLO, 2000; TOLENTINO et al., 1997). Tempos depois, vários cientistas, dentre eles, William Oding, Julius Lothar Meyer e Dmitri Ivanovitch Mendeleev participantes do congresso de Karlsruhe (1860), aceitaram o peso atômico29 como uma característica inerente a cada átomo e que as propriedades desses átomos seriam função do mesmo (SCERRI, 2007; TOLENTINO et al., 1997). Com a descoberta de outros elementos, identificação, separação e determinação de suas abundâncias isotópicas Theodore William Richards (1868 - 1918) foi capaz de determinar ainda com maior exatidão o peso atômico dos elementos químicos, trabalho esse reconhecido com o Prêmio Nobel de 1914 (SCERRI, 2007), já no século XX. 2.3.6 A Evolução da Tabela Periódica 2.3.6.1 As Tríades de Johann Döbereiner Em 1817 Johann Döbereiner (1740 – 1849), baseado na hipótese de Proust identificou que os elementos cálcio (Ca), estrôncio (Sr) e bário (Ba) poderiam ser dispostos em trio com base em suas similaridades químicas. Döbereiner mostrou que a massa de combinação do estrôncio era a média aritmética das massas de combinação do cálcio e do bário (PAULING, 1967). Nessa época a maior parte dos elementos químicos ainda não era conhecida, e essa trinca, posteriormente denominada por tríade, mostrou-se um excelente 27 Segundo Tolentino e colaboradores (1997) e Polo (2000), o congresso de Karlsruhe foi o evento científico mais importante da segunda metade do século XIX. Trata-se do primeiro congresso científico internacional da área de Química, com a participação de 140 químicos de vários países. Dentre os principais objetivos do congresso estava a discussão acerca da padronização das massas atômicas. 28 As idéias de Amadeo Avogadro, no início do século XIX, foram consideradas inapropriadas, pois com os conceitos da época era impossível aceitar que dois átomos de hidrogênio poderiam combinar entre si para produzir uma molécula de hidrogênio, uma vez que imaginava-se que os elementos reagiam por afinidade entre elementos distintos. 29 Entenda-se como massa atômica 47 meio para se agrupar os elementos semelhantes. Em 1829, um ano após a descoberta do bromo (Br), Döbereiner comparou o recém-descoberto elemento com os pesos atômicos (massas atômicas) disponíveis para o cloro (Cl) e o iodo (I) constatou uma relação entre os três elementos e propôs sua segunda tríade: Cl, Br e I. Posteriormente, ele concentrou esforços no estabelecimento de uma terceira tríade entre os elementos: lítio (Li), sódio (Na) e potássio (K). Finalmente, a última tríade descoberta por Döbereiner envolvia o enxofre (S), selênio (Se), telúrio (Te) (GLEISER, 2008; SCERRI, 2007). A lei das Tríades mostrou-se incipiente, pois limita-se apenas a doze dos cinquenta e quatro elementos conhecidos e acabou por ser rejeitada pelos contemporâneos de Döbereiner por ter sido interpretada como uma mera coincidência (STRATHERN, 2002). Contudo, é interessante observar na Figura 2.7 que hoje as quatro tríades de Döbereiner pertencem aos grupos dos metais alcalinos (Li, Na e K), metais alcalinos terrosos (Ca, Sr e Ba), calcogênios (S, Se e Te) e halogênios (Cl, Br e I), uma prova de que esse era um caminho a ser explorado. Figura 2.7: Analogia entre as Tríades propostas de Döbreiner e a Tabela Periódica atual Fonte: Elaborado pelo autor Embora os trabalhos de Döbereiner não tenham exercido impacto, eles influenciaram estudos posteriores, em especial, aqueles desenvolvidos por Leopold Gmelin (POLO, 2000; SCERRI, 2007) e Lothar Meyer (SCERRI, 2007). 48 2.3.6.2 O Sistema de Leopold Gmelin Em 1843, vinte e seis anos antes de Mendeleev publicar seu influente sistema, Leopold Gmelin (1788– 1853), fundamentado nos resultados de Döbereiner e calcado em outros valores de pesos atômicos que não estavam disponíveis para seu predecessor não somente propôs novas tríades, como também sugeriu essa denominação para esse conjunto de três elementos. Enquanto Döbereiner não foi capaz de estabelecer o relacionamento entre tríades que envolviam outros metais alcalinos terrosos, Gmelin distinguiu a relação entre magnésio, bário e cálcio, ampliando assim esse e outros conjuntos de elementos (SCERRI, 2007). Embora Gmelin não tenha obtido êxito na ordenação dos elementos de transição, a partir das quatro tríades desconexas de Döbereiner, ele desenvolveu um sistema em formato de “V” dotado por cinqüenta e três elementos ordenados segundo a ordem crescente de seus números atômicos (Figura 2.8). O F Cl Br N I H Li Na K S Se Te Mg Ca Sr Ba Be Ce La P As Sb C B Bi Zr Th Al Sn Cd Zn Ti Ta W Mo V Cr U Mn Ni Fe Bi Pb Ag Hg Cu Os Ir Rh Pt Pd Au Figura 2.8: Sistema em “V” proposto por Leopold Gmelin para ordenação dos elementos em 1843. Fonte: Adptado de Scerri (2007 p. 45). Para chamar a atenção do trabalho de Leopold Gmelin, Scerri (2007) propôs uma reestruturação da Figura 2.8, por meio do deslocamento da extremidade esquerda do “V” para baixo, conforme ilustrado na Figura 2.9, a seguir. 49 O F Br Cl N I Se S H P Te Sb As C B Ti Bi Ta W Cr U Mn Ni Fe Mo V Bi Pb Ag Hg Cu Os Ir Rh Pt Pd Au Sn Cd Zn Zr Th Al Be Ce La Mg Ca Sr Ba Li Na K Figura 2.9: Deslocamento da extremidade direita do sistema de Gmelin para baixo. Fonte: Adaptado de Scerri (2007 p. 46) A remoção do boro (B), bismuto (Bi) e dos elementos centrais e a rotação do sistema “V” em 90° não compromete a ordenação proposta por Gmelin (Figura 2.10). Nesse arranjo, percebe-se o claro posicionamento de vários elementos representativos em seus respectivos grupos. 1 2 Li Na Mg K Ca Sr Ba 14 15 16 17 S Se Te F Cl Br I C P As Sb Figura 2.10: Analogia entre o sistema proposto por Leopold Gmelin e a Tabela Periódica atual Fonte: Adptado de Scerri (2007, p. 47) Tanto o sistema de Döbereiner (Figura 2.7) como o de Gmelin (Figura 2.8) não são propriamente considerados como periódicos, pois não retratam de modo explícito a periodicidade, contudo o posicionamento das tríades de Leopold Gmelin significou um avanço na ordenação dos elementos baseado no crescimento do peso atômico. 50 2.3.6.3 O Parafuso Telúrico de Alexandre Emile Béguyer De Chancourtois Em 1862, cerca de trinta anos após Döbereiner propor as tríades, Alexander Emile Béguyer De Chancourtois (1820 – 1886) desenhou um gráfico em formato helicoidal (espiral) sobre um cilindro metálico. Figura 2.11: Parafuso de Alexandre De Chancourtois Fonte: Reproduzido de Scerri (2007 p. 70) 51 De Chancourtois tomou como referência o peso atômico do oxigênio e dividiu o gráfico em dezesseis partes iguais, posteriormente dispôs os elementos químicos, segundo a ordem crescente de seus números característicos, que correspondiam aos pesos atômicos dos elementos até então conhecidos. Esse dispositivo tridimensional, representado na Figura 2.11, foi denominado por Parafuso Telúrico30 (PAULING, 1967; STRATHERN, 2002; TOLENTINO et al., 1997). Os pontos coincidentes, equivalentes às voltas do cilindro, correspondiam aos elementos cujas massas atômicas diferiam em dezesseis unidades dos elementos subseqüentes. Por meio desse arranjo, constata-se, por exemplo, na Figura 2.11 que o potássio (peso atômico 39) estava abaixo do sódio (peso atômico 23) e este por sua vez situava-se abaixo do lítio (peso atômico: 7). Na coluna seguinte, observam-se em seqüência os elementos magnésio (Mg), cálcio (Ca), ferro (Fe), estrôncio (Sr), urânio (U) e ródio (Rh). Um incauto prenúncio do grupo dos metais alcalinos e alcalinos terrosos, ao desconsiderar o posicionamento incorreto de alguns metais hoje conhecidos por elementos de transição. Ao observar que os elementos com propriedades similares apareciam em pontos aproximadamente correspondentes De Chancourtois sugeriu a hipótese de que “Les proprietées des corps sont les proprietées des nombres”31 (PAULING, 1967), ou seja, ele estava consciente que as propriedades dos elementos variavam em função das suas massas atômicas e se repetiam a cada sete elementos. Sob essa perspectiva, Strathern (2002) e Scerri (2007) concordam que a essência do sistema periódico surgiu em 1862, ou seja, sete anos antes de Mendeleev chegar a mesma conclusão. De Chancourtois redigiu um artigo que demonstrava a regularidade entre os elementos químicos no Parafuso Telúrico, contudo os editores do periódico Comptes Rendus, muito provavelmente devido à complexidade de reprodução do material omitiram a ilustração do cilindro (Figura 2.11), o que tornou o artigo praticamente incompreensível para a maioria dos leitores. Em face da dificuldade de visualização da estrutura tridimensional proposta por ele e o posicionamento equivocado de alguns elementos, o sistema não teve repercussão (SCERRI, 2007; TOLENTINO et al., 1997). Em 1863, o artigo foi republicado, de modo independente. Porém, a segunda versão exerceu menor influência ainda, quando comparada com a primeira (SCERRI, 2007; STRATHERN, 2002). 30 Segundo Scerri (2007) e Sprosen (1969) apud Tolentino et al. (1997) existem duas hipóteses para a escolha dessa denominação. A primeira delas seria pelo fato do elemento telúrio estar situado no centro do arranjo desenvolvido por Emile De Chancourtois, já a segunda seria uma analogia a tellos, terra em grego, e como geólogo ele estaria voltado para classificar os elementos da terra. 31 Tradução: As propriedades dos elementos são as propriedades dos números. 52 2.3.6.4 A Tabela de William Odling Segundo Tolentino e colaboradores (1997), a classificação de William Odling (1829 - 1921) pode ser considerada uma das precursoras mais próximas da Tabela Periódica atual, visto a sua semelhança as tabelas de Lothar Meyer e Dimitri Mendeleev. Odling, em 1864, não só agrupou os elementos com base nas suas características, como também considerou as propriedades dos compostos formados por esses elementos (SCERRI, 2007; TOLENTINO et al., 1997). Figura 2.12: Tabela de William Odling publicada em 1864 Fonte: Reproduzido de Scerri (2007, p. 83). Como critério de semelhança entre os elementos, Odling considerou os calores atômicos e a regularidade dos volumes atômicos dos elementos (TOLENTINO et al., 1997), 53 que foram ordenados em ordem crescente dos pesos atômicos recomendados por Cannizzaro32 (SCERRI, 2007). O sistema proposto (Figura 2.12) já contemplava elementos bastante familiares, tais como flúor, cloro, bromo e iodo; cálcio, bário e estrôncio; nitrogênio, fósforo, arsênio e bismuto; oxigênio, enxofre, selênio e telúrio dispostos em linhas horizontais, que hoje equivalem aos grupos da tabela atual (SCERRI, 2007; TOLENTINO et al., 1997; TRINDADE et al., 1989). Além disso, a ordenação de Odling agrupava cinqüenta e sete elementos dos até então sessenta conhecidos e apresentava lacunas (“) para um futuro preenchimento desses espaços com novos elementos. 2.3.6.5 A Tabela de John Alexander Reina Newlands Outro modelo de Tabela foi proposto em 1865 por John Alexander Reina Newlands (1837 - 1898), que por analogia as notas musicais (dó, ré, mi, fá, sol, lá, si) sugeriu que os elementos, poderiam ser agrupados em linhas verticais de sete elementos, na ordem crescente de suas massas atômicas, assumindo a similaridade entre os elementos ao longo dessas linhas horizontais. Segundo ele, o oitavo elemento a ser iniciado na coluna seguinte seria uma espécie de repetição do primeiro, como as oitavas de um piano – Lei das Oitavas33 (BRYSON, 2005, PAULING, 1967; STRATHERN, 2002). Figura 2.13: Tabela de Newlands ilustrando a lei das oitavas apresentada à Chemical Society em 1866 Nº Nº Nº Nº Nº Nº Nº Nº H 1 F 8 Cl 15 Co/Ni 22 Br 29 Pd 36 I 42 Pt/Ir 50 Li 2 Na 9 K 16 Cu 23 Rb 30 Ag 37 Cs 44 Os 51 G Mg 10 Ca 17 Zn 24 Sr 31 Cd 38 Ba/V 45 Hg 52 Bo 4 Al 11 Cr 19 Y 25 Ce/La 32 U 39 Ta 46 Tl 53 C 5 Si 12 Ti 18 In 26 Zr 33 Sn 40 W 47 Pb 54 N 6 P 23 Mn 20 As 27 Di/Mo 34 Sb 41 Nb 48 Bi 55 O 7 S 14 Fe 21 Se 28 Ro/Ru 35 Te 43 Au 49 Th 56 Observa-se a inclusão de símbolos não convencionais do ponto de vista contemporâneo, saber: G para o glicínio, posteriormente chamado de berílio; Bo para o boro; Di para o dídimio, o qual mais tarde mostrou-se ser uma mistura de terras raras; e Ro para o rhodio. Fonte: Adaptado de SCERRI (2007, p. 79) Na Figura 2.13 observa-se que o sódio figurava ao lado potássio. Já o glicínio (G) estava ao lado do magnésio (Mg) e esse ao lado do cálcio (Ca). Por sua vez o boro estava ao 32 Semelhante a Lothar Meyer e Dmitri Mendeleev (TOLENTINO et al., 1997, p. 105, 107), William Odling participou do congresso de Karlsruhe (1860), onde defendeu a importância da adoção de um único sistema de massas atômicas e após o congresso, Odling tornou-se obstinado pelas idéias de Cannizzaro (SCERRI, 2007, p. 82). 33 Segundo Scerri (2007), a tabela de Odling antecedeu a versão final das Oitavas de Newlands, apresentada a London Chemical Society em 1865. 54 lado do alumínio. O flúor (F), cloro (Cl), bromo (Br) e iodo (I) posicionados na mesma linha horizontal (STRATHERN, 2002). Lamentavelmente, as idéias de Newlands estavam a frente do seu tempo, o que fez com que a Lei das Oitavas fosse menosprezada por seus contemporâneos, principalmente por ser análoga a escala de notas musicais, e dessa forma a Chemical Society of London recusou-se a publicá-la no Journal of the Chemical Society34 (STRATHERN, 2002; BRYSON, 2005; GLEISER, 2008) A Lei das Oitavas possuía limitações, pois não previa elementos futuros. Alguns elementos, principalmente aqueles de maior massa, não enquadravam suas propriedades na sequência estabelecida por Newlands (STRATHERN, 2002), como por exemplo, os metais cobalto (Co) e níquel (Ni) intercalados entre cloro (Cl) e bromo (Br) (TOLENTINO et al., 1997). Posteriormente percebeu-se que parte desse problema era devido à incorreção dos pesos atômicos disponíveis na época (STRATHERN, 2002). 2.3.6.6 A Tabela de Julius Lothar Meyer Muitos autores creditam a Mendeleev a formulação inicial da Tabela Periódica, ignorando os trabalhos de seus contemporâneos, principalmente, àquele produzido por Lothar Meyer (1830 - 1895), que em 1864, cinco anos antes da primeira tabela apresentada por Mendeleev, desenvolveu uma tabela composta por vinte e oito elementos , dispostos em ordem crescente de seus pesos atômicos (massas atômicas) e que apresentavam uma característica em comum: a valência (SCERRI, 2007; TOLENTINO et al., 1997). Dessa forma, Meyer não só ordenou os elementos em função dos seus pesos atômicos, mas também em função de suas propriedades químicas (QUADBECK-SEEGER, 2007; SCERRI, 2007). Na tabela apresentada na Figura 2.14 observa-se espaços reservados (--), a novos elementos, como também há a interpolação de dados de elementos vizinhos. Percebe-se que abaixo do elemento silício deveria existir um elemento com um peso atômico superior a 44,55; o que implicaria no valor de peso atômico 73,1 para esse elemento desconhecido. Em 1886, ele foi isolado e nomeado por germânio e valor de seu peso foi 72,3 (SCERRI, 2007). Resultado muito próximo ao valor previsto por Lothar Meyer, que infelizmente publicou seu trabalho posteriormente (TRINDADE et al., 1989) a Mendeleev. 34 Em 1887, John Newlands obteve o reconhecimento do seu trabalho e recebeu a Medalha Dave pela Royal Society. 55 Figura 2.14: Primeira Tabela de Lothar Meyer, 1864 Fonte: Reproduzido de Scerri (2007, p. 94) Meyer insistia em encontrar propriedades que refletissem a influência dos pesos atômicos. Sob essa perspectiva, ele calculou o volume atômico a partir da relação entre os pesos específicos e os pesos atômicos dos elementos, no estado sólido (TOLENTINO et al., 1997). Finalmente em 1870, de posse dessas informações, Meyer apresentou um sistema ortogonal que refletia a periodicidade do volume atômico dos elementos em função dos seus pesos atômicos (Figura 2.15). Figura 2.15: Sistema ortogonal desenvolvido por Lothar Meyer em 1870 Fonte: Reproduzido de Scerri (2007, p. 97). 56 No gráfico, ilustrado na Figura 2.15, evidencia-se claramente a periodicidade, visto que à medida que o peso atômico aumenta o volume atômico inicialmente diminui, depois aumenta, atingindo um valor máximo e reduz novamente e assim sucessivamente. Em 1868. com base nessa constatação, Meyer elaborou uma tabela que refletia esse comportamento e incorporou-a na segunda edição do seu livro, que foi publicado tardiamente em 1872 (TOLENTINO et al., 1997). Esse derradeiro arranjo encontra ilustrado na Figura 2.16. Figura 2.16: Tabela Periódica refletindo o periodismo de Lothar Meyer, 1872. Fonte: Reproduzido de PETRIANOV et al (1981) apud Tolentino e colaboradores (1997, p. 107). Irrefutavelmente, a principal contribuição de Meyer foi o reconhecimento do comportamento periódico, ou seja, o estabelecimento de um padrão de repetição de uma propriedade dos elementos por meio de um gráfico em função do peso atômico. Paralelo a esse trabalho surgiu a proposta de Dmitri Ivanovitch Mendeleev, que também organizou os elementos químicos, a partir do mesmo princípio de Meyer (SCERRI, 2007), conforme será discutido a seguir. 2.3.6.7 A Tabela de Dmitri Ivanovitch Mendeleev É notório que os trabalhos desenvolvidos por William Odling e Lothar Meyer eram muito semelhantes à proposta de Dmitri Mendeleev (SCERRI, 2007; TOLENTINO et al., 1997), que desenvolveu o sistema, que se tornou o pilar da classificação periódica atual. Em 57 1869, Mendeleev (1834 – 1907) ordenou os elementos em ordem crescente de seus pesos atômicos e os distribuiu em oito colunas verticais e doze linhas horizontais (QUAM; QUAM, 1934). Esse arranjo, na versão manuscrita e impressa, pode ser observado na Figura 2.17, a seguir: a) b) Figura 2.17: Primeira Tabela desenvolvida por Mendeleev, em 1869. a) versão manuscrita; b) versão impressa Fonte: Reproduzido respectivamente de Gleiser (2008, p. 137) e Strathern (2002, p. 247). Em 1871, Mendeleev publicou uma nova tabela e as lacunas observadas nesse novo arranjo (Figura 2.18) denotam todos os elementos que ele julgava existir, mas que ainda não havia sido descobertos. Cabe destacar que esse conceito também havia sido utilizado por Lothar Meyer (Figura 2.14). 58 Figura 2.18: Segunda versão da Tabela Periódica de Mendeleev, publicada em 1871. Fonte: Reproduzido de Scerri (2007, p. 111) Com base nessa tabela Mendeleev previu com exatidão as propriedades dos elementos do germânio (eka-silício), semelhante a Meyer e do gálio (eka-alumínio), até então desconhecidos (TRINDADE et al., 1989). As fórmulas genéricas apresentadas no topo de cada coluna da tabela representada na Figura 2.18 referem-se aos compostos formados pelos elementos químicos constantes em cada coluna (BELTRAN et al., 1991). Por meio desse sistema, ele demonstrou o valor da Tabela Periódica na sistematização do conhecimento químico (BRYSON, 2005; GLEISER, 2008), como também na previsão do comportamento químicos de novos elementos. Em 1879, Mendeleev apresentou uma terceira versão para classificação periódica (Figura 2.19), que era muito mais semelhante a Tabela Periódica atual. Nela estavam contemplados os elementos descobertos após 1871, ano da publicação da sua segunda versão (SCERRI, 2007; TOLENTINO et al., 1997). 59 Figura 2.19: Tabela Periódica organizada por Mendeleeev em 1879. Fonte: reproduzido de Tolentino e colaboradores (1997, p. 111) Seguidamente, Mendeleev propôs um novo arranjo (Figura 2.20), no qual estavam contemplados os gases nobres no grupo zero, como também organizou os elementos em grupos e subgrupos. Analisando essa tabela percebe-se que ela foi a base para o estabelecimento daquelas tabelas periódicas que empregavam a numeração arábica ou romana acompanhadas pelos grupos A e B (TOLENTINO et al., 1997), que permaneceram em uso até 1985 (FLUKE, 1988). Figura 2.20: Tabela mais moderna organizada por Mendeleev. Fonte: Reproduzido Tolentino e colaboradores (1997, p. 112) 60 Hoje o sistema de numeração dos grupos recomendado pela IUPAC é feito por meio de algarismos arábicos de 1 até 18, começando a numeração da esquerda para a direita. Dessa forma, os sistemas de numeração dos grupos, que empregam algarismos romanos, algarismos arábicos associados às letras “A” e “B” são considerados obsoletos, desde 1988 (FLUKE, 1988), os quais consistem em uma herança de uma das tabelas propostas por Mendeleev (TOLENTINO et al., 1997). 2.3.6.8 Julius Lothar Meyer X Dmitri Ivanovitch Mendeleev Tanto Meyer como Mendeleev avançaram mais que seus predecessores. Ambos participaram do congresso de Karlsruhe juntamente com Odling e foram fortemente influenciados pelas idéias de Cannizzaro (TOLENTINO et al., 1997). Trabalhando independentemente, ambos descobriram a lei periódica (SCERRI, 2007). Lothar Meyer propôs sua primeira tabela em 1864, que por seu turno foi capaz de demonstrar graficamente o periodismo em função dos pesos atômicos (SCERRI, 2007; TRINDADE et al., 1989) e apresentou uma segunda versão, expandida, apenas em 1872. Um ano antes, Mendeleev publicou os resultados de suas pesquisas e, em 1871, lançou uma nova versão da sua tabela (Figura 2.19) e chegou a um grau de exatidão que todos os seus contemporâneos não alcançaram (BELTRAN et al., 1991). Talvez por isso a tabela periódica ficou quase que exclusivamente ligada a sua imagem (TOLENTINO et al., 1997). 2.3.6.9 A Tabela Após Henry Gwyn Jeffreys Moseley A compreensão da estrutura do núcleo do atômico a partir da descoberta da radioatividade, em 1896, por Henri Becquerel (1852 – 1908) e os trabalhos posteriores de Marie Sklodwska Courie (1867 – 1934) e Pierre Courie (1859 – 1906) proporcionaram maior compreensão acerca da estrutura atômica (BALCHIN, 2009; CHASSOT, 2004; QUADBECK-SEEGER, 2007), proporcionando a identificação dos isótopos, em 1900, por Frederick Soddy (1877 – 1956), a descoberta do nêutron, por James Chadwick (1891-1974) em 1932 (BRYSON, 2005; CHASSOT, 2004; SCERRI, 2007) e, principalmente, a constatação de que as cargas elétricas positivas constituintes do núcleo atômico, não eram 61 apenas coadjuvantes e que mereciam a mesma importância até então concedida aos pesos atômicos (TOLENTINO et al., 1997). Nessa linha, em 1913, Henry Moseley (1887 – 1915), ao estudar a emissão de raiosX por átomos de diferentes elementos bombardeados por um feixe de elétrons acelerados por forte campo elétrico, verificou que a radiação X emitida era inerente a cada elemento, quando examinadas determinadas raias do espectro descontínuo dessa radiação (MOSELEY, 1913; QUADBECK-SEEGER, 2007; TOLENTINO et al., 1997). Figura 2.21: Relação linear observada por Henry Moseley em 1913 Fonte: Reproduzido de Moseley (1913) 62 A freqüência dessas emissões estava diretamente relacionada com um número inteiro que se encontrava associado às cargas positivas presentes no núcleo do elemento sob estudo (TOLENTINO et al., 1997). Ao comparar suas observações com o posicionamento dos elementos na Tabela Periódica, Moseley constatou o relacionamento linear (Figura 2.21) entre o número de ordem de cada elemento na Tabela Periódica e a raiz quadrada do inverso da freqüência da radiação de uma das raias, conhecida como raia Kα (SCERRI, 2007; BALCHIN, 2009). Atualmente, esse número, é denominado por número atômico (Z) que corresponde ao número de partículas positivas (prótons), constantes do núcleo de qualquer átomo, que o distingue univocamente. O trabalho de Henry Moseley fez com que o número atômico se tornasse a variável mais importante da lei Periódica (SCERRI, 2007; TOLENTINO et al., 1997) e a partir dessa constatação (MOSELEY, 1913), o periodismo atrelado aos pesos atômicos foi substituído pelo periodismo em função dos números atômicos, que conseqüentemente orientou para novos leiautes da Tabela Periódica; distintos daquele proposto por Dmitri Mendeleev (BALCHIN, 2009; TOLENTINO et al., 1997). Ao ordenar os elementos em ordem crescentes de seus respectivos números atômicos, as anomalias que ainda se faziam presentes na tabela de Mendeleev foram praticamente resolvidas. O formato da Tabela Periódica atual, também foi influenciado por trabalhos desenvolvidos por outros cientistas, pós–Moseley, que não só descobriram como também sintetizaram novos elementos e propuseram novas formas de ordenação. Dentre esses pesquisadores destaca-se a Figura de Glenn Theodore Seaborg. 2.3.6.10 A Tabela Após Gleen Theodore Seaborg A última mudança substancial efetuada na Tabela Periódica aconteceu a partir de 1945, cinco anos após a descoberta do elemento plutônio por Glenn Seaborg. Além da descoberta desse elemento, Glenn Theodore Seaborg (1912 - 1999) e colaboradores sintetizaram e identificaram outros elementos transurânicos, a saber: plutônio, amerício, cúrio, berquélio, califórnio, einstéinio, férmio, mendelévio, nobélio e o elemento 106, que após muita controvérsia foi chamado seabórguio, em sua homenagem (SCERRI, 2007; TOLENTINO et al., 1997). 63 Antes de Seaborg Terras raras Pós Seaborg Lantanídeos Actnídeeos Figura 2.22: Tabela Periódica antes e depois da intervenção de Glenn Seaborg. Fonte: Traduzido adaptado de Scerri (2007, p. 23). Seaborg foi responsável por modificar o leiaute da Tabela Periódica (Figura 2.22) (SCERRI, 2007). Nesse arranjo, os novos elementos apareciam como parte de uma série iniciada pelo actínio e, por isso, foi chamada de série dos actinídeos, abaixo da série dos lantanídeos. 2.3.7 IUPAC Como Entidade Normalizadora Os anseios acerca da necessidade de colaboração internacional e padronização da linguagem Química advieram de uma série de reuniões internacionais, dentre as quais se destaca o congresso de Karlsruhe, organizado por Friedrich August Kekulé em 1860 (IUPAC, 2007a; POLO, 2000; QUADBECK-SEEGER, 2007; STRATHERN, 2002), que muito influenciou no estabelecimento da lei periódica. Mais uma vez, o desejo de padronização, se fez presente em 1911, quando em Paris, o fragmentado órgão antecessor a IUPAC, a 64 Associação Internacional das Sociedades de Química (IACS), propôs um conjunto de orientações que incluíam: i) a padronização da nomenclatura de química orgânica e inorgânica, ii) a padronização de pesos atômicos; iii) a padronização de constantes físicas; iv) a edição de tabelas de propriedades da matéria; dentre outros (IUPAC, 2007a). A IUPAC35 por sua vez, foi criada em 1919 por químicos oriundos da indústria química e universidades, que reconheceram a necessidade de padronização internacional da linguagem química. Desde então, a entidade tem promovido a comunicação a nível mundial da Química como ciência e a sua união com o setor acadêmico, industrial e público em uma linguagem comum a todos, com destaque especial durante o período da Guerra Fria, pois nessa época a entidade tornouse um foro importante na manutenção de um diálogo técnico comum entre os cientistas partidários do bloco capitalista e socialista (IUPAC, 2007a). 2.3.7.1 A Tabela Periódica segundo a IUPAC Haja vista as discussões feitas acerca da evolução da Química como ciência (KUHN, 2007), a evolução do conceito de elemento químico e a caracterização dos elementos foi possível constatar que a Tabela Periódica não surgiu de forma estanque, mas sim de modo paulatino ao longo da evolução do homem e da própria ciência e graças ao acerbo trabalho de cientistas como Boyle (1661); Lavoisier (1769), Dalton (1803), Avogadro (1811), Döbereiner (1829), Cannizzaro (1860); Chancourtouis (1862); Newlands (1865), Mendeleev (1869), Moseley (1912) dentre outros, que atualmente a Tabela Periódica pode ser considerada uma das referências mais importantes da química. Sem dúvida, os primeiros passos para a descoberta dos elementos que hoje estão presentes na Tabela periódica foi dado pelo então alquimista Robert Boyle, ao questionar a tria prima de Paracelso e os quatro elementos de Aristóteles. Felizmente, as idéias de Boyle frutificaram-se cem anos depois, por intermédio de Antoine Lavoisier, o qual não só suplantou a teoria do flogisto como direcionou a química quantitativamente. As influências do experimentalismo de Lavoisier na retomada do atomismo por Dalton, as idéias de Gay-Lussac e Avogadro e o desenvolvimento de novas técnicas analíticas, aliadas a um conjunto de pesos atômicos padronizados (Congresso de Karlsruhe), possibilitaram o desenvolvimento de um sistema periódico que se aplica a todos os elementos até então conhecidos e até mesmo para 35 A Chemical Society of London foi fundada em 1841 e a American Chemical Society foi criada em 1877 (BRYSON, 2005). 65 aqueles que poderão ser descobertos (POLO, 2000; SCERRI, 2007; TOLENTINO et al., 1997). Nessa perspectiva histórica, o Apêndice A: Tabela Periódica dos elementos segundo a IUPAC Fonte: (IUPAC, 2009) 66 Apêndice B: Linha do Tempo - elementos químicos e a Tabela Periódica fornece um panorama da descoberta dos elementos químicos ao longo da história da Química, considerandos a década em que ocorreu a caracterização dos mesmos, bem como a contribuição científica, filosófica ou o fato histórico ocorrido naquele período. Ao consultar esse anexo, percebe-se claramente que a partir do congresso de Karlsruhe, os princípios fundamentais de uma lei periódica amadureceram progressivamente entre os pesquisadores (POLO, 2000; SCERRI, 2007; TOLENTINO et al., 1997) e culminaram na tabela periódica atual (Apêndice A: Tabela Periódica dos elementos segundo a IUPAC). Nesse capítulo foram discutidas apenas algumas das principais ordenações dos elementos químicos. Arranjos mais antigos poderão ser consultados em Quam e Quam (1934, 1934a, 1934b)36 e proposições consideradas mais modernas, pós Glen Seaborg, poderão ser consultadas no site The Chemogenesis Web Book (LEACH, 2009). No próximo capítulo é apresentada a metodologia empregada na concepção desse estudo. 36 Algumas proposições de Tabelas Periódicas apresentadas por Quam e Quam (1934, 1934a, 1934b): Brauner's Table (1902); Rydberg Table (1913); Periodic Chart by Quam (1934) Rang's Periodic Table (1893); Werner's Periodic Table (1905); Courtines' Periodic Classification (1925); Bayley's Periodic System (1882); Adam's Periodic Chart (1911); Margary's Periodic Table (1921); Stareck's Natural Periodic System (1932); Baumhauer's Spiral (1870); Erdmann's Spiral Table (1902); Nodder's Periodic Table (1920); Partington's Periodic Arrangements of the Elements (1920); Janet's Helicodial Classification (1929); Crookes' Periodic Table model (1898); Emerson's Helix (1911); Periodic Table by Harkins and Hall (1916); Schaltenbrand's Periodic Table (1920); Rixon's Diagram of the Periodic Table (1933); Spring's Diagram (1881); Flavitzky's Arrangement (1887); Stephenson's Statistical Periodic Table (1929); Friend's Periodic System (1927); Vogel (1918), Stintzing (1916)Caswell (1929), dentre outros. 67 3 METODOLOGIA 3.1 Tipo de Estudo Quando se idealiza uma pesquisa é importante a seleção do perfil metodológico apropriado ao objeto pesquisado. A pesquisa qualitativa é definida por Creswell (2007 apud Novikoff 2007, p. 67) como aquela “em que o pesquisador configura os conhecimentos pautando-se nos significados diversos das experiências individuais ou sociais e historicamente construídos”. Novikoff (2007) salienta que dessa maneira, o pesquisador procura apreender e compreender o fenômeno sob estudo, segundo a perspectiva dos participantes da situação estudada e, a partir daí, apresenta a sua interpretação acerca do fenômeno estudado. Portanto, a pesquisa qualitativa não enumera e tampouco mensura eventos, bem como não se atem a instrumental estatístico para sua análise, pois se buscam dados descritivos a partir da exploração direta e interativa do problema. Por sua vez, a pesquisa quantitativa, além de apreender o discurso do sujeito, utiliza-se de ferramental estatístico para validar seus pressupostos e/ou hipóteses (NOVIKOFF, 2007). Aqui se intenta estabelecer aprofundado estudo sobre os dados e as informações coletadas tanto numéricas, quanto conceituais. Deste modo, além de oferecer os significados em relação ao ensino da química, também se pontuam quantitativamente os dados geradores dos argumentos aqui elencados para validação da proposta de um novo recurso técnico-pedagógico para esse ensino. A pesquisa aqui retratada possui características qualitativas e quantitativas uma vez que envolveu o levantamento bibliográfico e documental da legislação pertinente ao ensino, capítulos de livros didáticos e sites voltados para o ensino do conteúdo “Tabela Periódica”. Trabalhou-se de maneira exploratória sobre o tema, por meio de análises, comparações, interpretações e críticas aos livros didáticos e sites dedicados ao assunto, sempre em comparação com as orientações contidas na legislação vigente e publicações correlatas. Quanto a natureza tratou-se de uma pesquisa aplicada, uma vez que foi o desenvolvido um instrumento paradidático para o ensino-aprendizagem de química, a T Wanc®© , a qual foi submetida a avaliação de seis professores. 68 3.2 Questões de Pesquisa O interesse em se desenvolver essa dissertação residiu no fato de que, embora a Tabela Periódica seja o símbolo mais conhecido da linguagem química e um valioso instrumento didático (SCERRI, 2007; TOLENTINO et al., 1997; TROMBLEY, 2000), os trabalhos dedicados ao seu ensino não têm se mostrado adequados, visto que as limitações teórico-práticas observadas nos livros didáticos como recursos teórico-metodológicos, esvaziam o potencial reflexivo e conceitual que a tabela poderia oferecer. Essas asserções são sustentadas por trabalhos desenvolvidos por diferentes autores (BELTRAN et al., 1991; DALLACOSTA et al., 1998; EICHLER et al., 2000; NARCISO JR et al., 2000). Por igual, a experiência acumulada pelo autor dessa dissertação como professor ao longo de dezessete anos de magistério e dezoito anos na indústria petroquímica, permitiu o balizamento da perspectiva tecnicista frente à Tabela Periódica nos livros didáticos e sites dedicados ao tema em questão. Sob esse prisma, reafirmam-se os seguintes objetivos da pesquisa, geradora da presente dissertação: i) Apresentar à comunidade de professores um recurso paradidático para o ensino da Química; ii) Divulgar o potencial didático do Microsoft Excel na perspectiva crítica (progressista); iii) Ofertar um meio para que os elementos químicos sejam trabalhados a partir de suas múltiplas relações com a sociedade; iv) Contribuir para novas propostas de aplicações voltadas para o ensino por meio do uso pertinente dos laptops dos professores; v) Interpretar o capítulo Tabela Periódica presente nos livros didáticos a luz das orientações do PCNEM, PCN+ e das Orientações Curriculares para o ensino Médio; vi) Resgatar a evolução da Tabela Periódica ao longo da história da Química e vii) Observar o que pensam os professores a respeito do ensino do conteúdo Tabela Periódica e da T Wanc®©. Consoante aos objetivos descritos acima se elencou como o principal problema investigado, a viabilidade de se utilizar uma Tabela Periódica desenvolvida no Microsoft Excel, como recurso paradidático para o ensino-aprendizagem de Química. Sendo assim, sob a perspectiva da pedagogia progressista, na sua concepção foram procuradas respostas para as seguintes questões: a) O capítulo Tabela Periódica presente nos livros didáticos aponta para qual abordagem pedagógica; tradicional calcada na memorização ou progressista com base na interdisciplinaridade? b) É possível desenvolver um recurso paradidático no qual os elementos químicos sejam tratados com ênfase no processo de formação do cidadão? c) Os recursos de informática disponíveis aos professores podem ser melhor aproveitados em prol 69 do ensino de Química? d) O Microsoft Excel pode ser utilizado como um recurso didático para o ensino da química na educação básica? 3.3 Fases da Pesquisa 3.3.1 Fase 1: Levantamento no Portal CAPES e artigos correlatos Inicialmente foi realizada uma busca no portal da CAPES, para se averiguar a existência de trabalhos (1996 – 2007)37 de mesma natureza ou resultados procedentes de pesquisas similares que pudessem servir como apoio ao desenvolvimento da dissertação aqui proposta. Esse levantamento, conduzido em setembro de 2008, não apontou para dissertações ou teses de tal natureza, o que denotou a primeira dificuldade da pesquisa, contudo apontou para o seu ineditismo. Com relação as questões pertinentes a interdisciplinaridade foi descoberto em Carlos (2007) uma vasta investigação dedicada a esse conceito, que serviu como marco teórico para essa dissertação. Em alguns artigos foi possível identificar exemplos expressivos para uma mesma perspectiva quanto ao ensino da Tabela Periódica, porém em menor extensão (DALLACOSTA et al., 1998; EICHLER et al., 2000) e outros artigos que abordavam o histórico da tabela periódica (FILGUEIRAS, 1995; FLUKE, 1988; MOSELEY, 1913; POLO, 2000; QUAM et al., 1934; TOLENTINO et al., 1997) e o emprego da informática no ensino (GABINIL, et al., 2007; JUCÁ, 2006). Não obstante, a escassez de literaturas, dedicadas à evolução e ao desenvolvimento da tabela periódica, obrigou a importação de literaturas estrangeiras dedicadas à questão (QUADBECK-SEEGER, 2007; SCERRI, 2007; TROMBLEY, 2000). 3.3.2 Fase 2: Revisão de Documentos Normativos Posteriormente foram consultados os documentos normativos que sustentam a base legal da educação brasileira: i) a Lei de Diretrizes e Bases da Educação Nacional (LDBEN) nº 9.394 (BRASIL, 1996); ii) a Resolução CEB 3 (BRASIL, 1998); iii) e outros documentos de 37 Na época da pesquisa no portal CAPES as disssertações estavam disponíveis até o ano de 2006. 70 apoio dirigidos ao ensino de Química no Brasil, tais como o PCNEM (BRASIL, 1999), o PCN+ Ensino Médio (BRASIL, 2002) e as Orientações Curriculares para o Ensino Médio (BRASIL, 2006). As informações obtidas na pesquisa documental (Fase 1 e Fase 2) juntamente com outros livros, serviram de base para a redação do capítulo Revisão de Literatura. 3.3.3 Fase 3: Levantamento de Livros Didáticos A terceira etapa da pesquisa envolveu o levantamento bibliográfico de livros didáticos de química recomendados pelo Programa Nacional do Livro para o Ensino Médio (PNLEM/2007) (BRASIL, 2007) às escolas de ensino médio brasileiras. Os livros analisados encontram-se descritos no Apêndice C: Os seis livros didáticos selecionados para avaliação do conteúdo Tabela Periódica. 3.3.4 Fase 4: Levantamento de Sites Dedicados ao Tema Concomitante à etapa de avaliação dos livros didáticos foi realizada a seleção e préanálise de noventa sites dedicados ao tema. Devido à diversidade de sites, coube nessa fase a aplicação de dois critérios de exclusão, baseados, sobretudo na fidedignidade e na pertinência das informações veiculadas por tais meios, escolhendo-se trinta sites para avaliação final, que se encontram detalhados no Apêndice E: Relação dos trinta sites selecionados para avaliação. Figuram nesse conjunto os sites da Merck, IUPAC, ACS (American Chemical Society)38, NIST (National Institute of Standards and Technology)39 e da NASA (National Aeronautics and Space Administration) dentre outros considerados pertinentes ao escopo da dissertação. 3.3.5 Fase 5: Análise Interpretativa dos Livros e Sites Após a seleção das literaturas constantes do Apêndice C e dos sites discriminados no Apêndice E, foi realizada a leitura crítica desse material à luz dos PCNEM, PCN+ e nas 38 Tradução: Sociedade Americana de Química. Tradução: Instituto Nacional de Padrões e Tecnologia. 39 71 Orientações Curriculares para o Ensino Médio, sendo observados os pontos positivos e as limitações de tais publicações. Os livros e os sites foram avaliados assumindo-se além dos critérios de contextualização e interdisciplinaridade a aderência ao formato de Tabela Periódica preconizada pela IUPAC40 como linguagem padronizada (FLUKE, 1988; IUPAC, 2007), bem como os aspectos relativos a evolução da Tabela ao longo do curso da história da Química. Para tal propósito, foram criadas quatro categorias (Figura 3.1): a) Eixo Contextualizador e Interdisciplinar (ECI); b) Histórico e Desenvolvimento (HED); c) Informações Descritivas e Classificatórias (IDC); d) Linguagem Científica Atualizada (LCA). Figura 3.1: Categorias utilizadas para avaliação dos livros e sites ECI: Eixo Contextualizador e Interdisciplinar x x x x x x x x x x x x x Elementos e Toxicidade Uso genérico sem discussão Elementos no Meio Ambiente Elementos na Informática Elementos na Alimentação Elementos na Medicina Elementos na Saúde Elementos na Atmosfera Elementos no Corpo Humano Perigos e Riscos dos Elementos Contraponto nas propriedades Exercícios Contextualizados e ou Interdisciplinares Elementos e Mineralogia HED: Histórico e Desenvolvimento x x x x x x Ano descoberta Cronologia da descoberta Descobridor Origem do nome Relação com fatos históricos Tabelas anteriores x x x x x Propriedades Periódicas Propriedades Físicas Números de Oxidação Números Quânticos ConFigura ção eletrônica 40 A tabela original da IUPAC encontra-se no Apêndice A: Tabela Periódica dos elementos segundo a IUPAC Ausência Item, Tema ou Questão Avaliado ICD: Informações Descritivas e Classificatória s Categoria Presença Resposta 72 LCA: Linguagem Científica Atualizada Item, Tema ou Questão Avaliado x Ausência Categoria Presença Resposta Tabela alinhada com as recomendações da IUPAC Fonte: Elaborado pelo autor 3.3.6 Fase 6: Fundamentação Teórica e Desenvolvimento da T Wanc®© no Excel Essa fase, além de trabalhosa em termos de seleção de conteúdos abarcou a criação do produto teórico-metodológico da pesquisa – T Wanc®©. Envolveu a minuciosa seleção e escolha de referências bibliográficas de áreas correlatas ao ensino de Química, conforme descrito no Apêndice H: Referências bibliográficas utilizadas na concepção da T Wanc©, seguido de tratamento didático dos conhecimentos. Adotou-se o diálogo contextualizador e interdisciplinar considerando a Tabela Periódica “convencional” praticada pelos recursos didáticos disponíveis visando destacar os temas de notório valor para a sociedade, por meio do Microsoft Excel. Nesse caminho dialético, ao se desenvolver a T Wanc®©, tomou-se extremo cuidado no alinhamento da sua estrutura com as orientações da IUPAC (FLUKE, 1988), de modo a se manter a padronização da linguagem científica, materializando a criação de um recurso técnico-pedagógico atualizado em seu aspecto operacional, interativo e de fácil compreensão. Em outras palavras, transformou-se o conhecimento científico em conhecimento escolar, a partir do tratamento pedagógico dialógico, de modo a possibilitar ao professor novas escolhas didáticas e metodológicas, lúdicas, criativas e eficazes via tecnologia. O manuseio dessa nova ferramenta ajusta-se à demanda pelo ensino atual considerando o uso massivo da informática para as mais diversas finalidades (MORAN et al., 2007); visto que a revolução dos computadores pessoais nos últimos anos têm produzido inúmeras ferramentas para estudantes e professores no que se refere a recursos de hardware e software. Alguns exemplos de tais meios são a Internet de alta velocidade, scanners, 73 pendrives, laptops e uma infinidade de programas (JUCÁ, 2006), que vão desde aqueles mais complexos até o popular Microsoft Office Home and Student 2007, que é constituído pelo processador de textos Word 2007, o editor de apresentações Power Point 2007 e a planilha eletrônica Excel 2007 (MICROSOFT, 2009; AQUINO, 2007). Sem dúvidas, uma infinidade de softwares poderia ser utilizada para o desenvolvimento desse projeto. Optou-se pelo Microsoft Excel por quatro razões básicas, descritas a seguir: i) Programa de fácil de utilização; ii) Treinamento gratuito oferecido pelo site do fabricante; iii) Disponível nos laptops fornecidos pelo governo do estado do Rio de Janeiro aos professores; iv) Programa, considerado de baixo custo41. 3.3.6.1 Estruturação Teórica T Wanc® Toda a estrutura da T Wanc®© foi baseada nas orientações contidas na legislação vigente (BRASIL, 1996; 1999; 2002; 2006) e após minucioso estudo das referências bibliográficas citadas no Apêndice H, fez-se o corte epistemológico das informações necessárias ao propósito do projeto, o qual foi concebido a partir de uma base de dados principal (BDP), suportada por outras bases de dados, consideradas como secundárias, mas de igual importância (Figura 3.2). Na base de dados principal foram armazenadas as informações descritivas e classificatórias inerentes a cada elemento químico, tais como: símbolos, número de massa, eletronegatividade, ponto de ebulição, ponto de fusão, abundância isotópica, distribuição eletrônica, períodos, grupos, valência (ATKINS, 2000; BENVENUTTI, 2006; BROWN et al., 1999; KOTZ et al., 1998; MASTERTON et al., 1989). Essas informações foram correlacionadas aos respectivos números atômicos (Z) de cada elemento, que serviu como indexador (chave-primária), pois a partir do número atômico é que se acessam todas as informações básicas dos cento e doze elementos químicos armazenados no sistema. As publicações relacionadas no Apêndice H formam a base contextualizadora e interdisciplinar da T Wanc, visto que foram selecionadas a partir das lacunas observadas no capítulo Tabela Periódica dos seis livros didáticos e sites relacionados respectivamente no Apêndice C e Apêndice E. 41 Atualmente é possível adquiri-lo (SUBMARINO, 2010) por R$ 199,00, o que confere ao usuário o direito de instalá-lo em três computadores diferentes, ou seja, um investimento de R$ 66,33 por licença ou usuário. 74 Base de Dados Secundária (BDS1) Principal (BDP) Base de Dados Base de Dados Secundária (BDS2) Telas da T Wanc®© relacionadas a temas específicos Base de Dados (BDP X BDSn) Secundária (BDS3) Base de Dados Secundária (BDSn) Figura 3.2: Estrutura da T Wanc®© Fonte: Elaborado pelo autor Por sua vez, as informações de cunho contextualizador e interdisciplinar também foram indexadas, com base no número atômico de cada elemento químico envolvido, em diferentes bancos de dados, denominados bases de dados secundárias (BDS) (Figura 3.2). A partir do número atômico desses elementos fez-se o relacionamento entre a base de dados principal (BDP) e as bases de dados secundárias (BDS), de modo a se conceber as telas da T Wanc®© relativas a cada tema tratado pelo aplicativo (Figura 3.2). Todo o relacionamento, entre as bases de dados foi feito por meio do emprego das funções de lógica, funções de texto e funções de procura e referência que se encontram disponíveis no Microsoft Excel42 (CARMONA, 2006; LEVINE et al., 2000; MICROSOFT, 2009). Cada tela da T Wanc®© 42 Além das ferramentas gráficas, o programa inclui uma interface intuitiva, suportada por funções, agrupadas em dez categorias, descritas a seguir: a) Funções de bancos de dados; b) Funções de data e hora; c) Funções de engenharia; d) Funções financeiras; e) Funções de informações; f) Funções lógicas; g) Funções de pesquisa e referência; h) Funções de matemática e trigonométrica; i) Funções estatísticas; j) Funções de texto. Essas funções consistem em fórmulas ou ações préescritas que assumem um valor ou mais valores, executa uma operação e retorna um valor ou mais valores, as quais podem ser utilizadas separadamente ou em conjunto. 75 recebeu um tratamento gráfico e visual associado ao assunto tratado, por meio dos recursos gráficos43 e de formatação disponíveis no programa (MICROSOFT, 2009). 3.3.7 Fase 7 - Experimentação da T Wanc®© Após o desenvolvimento da T Wanc®© foi conduzida uma experimentação laboratorial da versão beta do aplicativo com um grupo de seis professores que foram convidados a comentar acerca das limitações e possibilidades da sua utilização como ferramenta de ensino-aprendizagem. O critério adotado para a seleção desses docentes fundamentou-se nas seguintes questões: a) atuar no ensino médio; b) possuir laptop e; c) Ter ministrado ou ministrar o conteúdo tabela periódica no ensino médio. Inicialmente esses professores responderam a um conjunto de perguntas, consideradas de caráter diagnóstico (Quadro 3.1 e Quadro 3.2), cujo objetivo foi avaliar o perfil do professor, seu conhecimento e interesse no desenvolvimento de aplicações no Microsoft Excel voltadas para o ensino de Química e sua experiência quanto ao processo de ensino-aprendizagem da Tabela Periódica. Quadro 3.1: Questões para análise do discurso docente: perfil do professor Análise do Discurso Docente: Perfil do Professor Resposta Pergunta Descrição da Pergunta Sim 43 P1 Possuiu Formação em Química? P2 É Professor da rede pública? P3 Ministra(ou) o conteúdo tabela periódica? P4 Um software dedicado ao tema facilitaria o ensino-aprendizagem? P5 Possui o Microsoft Excel instalado no seu computador? P6 Sabe usar o Microsoft Excel? P7 Já desenvolveu alguma aplicação no Excel voltada para ensino? Não O Excel oferece suporte para criação de diversos tipos de gráficos, cuja finalidade é exibir dados de distintas maneiras, de modo que essas informações sejam significativas para uma determinada aplicação. Ao se criar um gráfico no programa é possível selecionar uma variedade de opções, como por exemplo, gráficos de colunas, linhas, pizza, barras, área, dispersão dentre outras opções de gráficos e seus respectivos subtipos ou até mesmo a combinação de mais de um modelo de gráfico. Esses recursos foram utilizados sistematicamente na criação da T Wanc. 76 Com relação as perguntas P 5, P 6 e P 7 apresentadas no Quadro 3.1, cabe destacar que o foco recai sobre o Microsoft Excel, visto que o recurso proposto nessa dissertação fundamenta-se nesse aplicativo. Contudo foi explicitado aos professores participantes da pesquisa que a resposta caberia como positiva caso eles tivessem o conhecimento com qualquer outro tipo de planilha eletrônica e não somente no Excel. Quadro 3.2: Questões para análise do discurso docente: aulas sobre tabela periódica Análise do Discurso Docente: Aulas Sobre Tabela Periódica P8 Tem (Teve) dificuldades em abordar o conteúdo Tabela Periódica? P9 Aborda (ou) a evolução da Tabela Periódica nas aulas? P 10 Correlaciona a Tabela Periódica com o cotidiano dos alunos? P 11 Relaciona a Tabela Periódica com outras disciplinas? P 12 Os alunos mostram-se motivados pelo conteúdo? Nunca Raramente Às vezes Sempre Descrição da Pergunta Freqüentemente Pergunta Resposta Fonte: Elaborado pelo autor Após responder aos dois primeiros conjuntos de questões (Quadro 3.1 e Quadro 3.2) os professores tiveram a oportunidade de assistir um vídeo e o funcionamento da T Wanc®©, que posteriormente foi instalada em seus respectivos computadores, por sete dias, para que pudessem avaliá-la de maneira mais aprofundada. Nessa etapa, embora a tabela estivesse protegida por uma senha, que impedia a sua utilização além do período estabelecido, foi recomendado aos professores que a planilha não fosse utilizada em aulas formais e tampouco compartilhada com outros colegas ou alunos. Passado o período de testes, os professores foram convidados a responder ao terceiro conjunto de perguntas (Quadro 3.3), fundamentadas nos aspectos: a) pedagógico-metodológico; b) construção do conhecimento; c) construção da cidadania e; d) gráfico e visual. 77 Quadro 3.3: Questões para análise do discurso docente: Avaliação da T Wanc®© Análise do Discurso Docente: Avaliação da T Wanc®© P 13 P 14 P 15 P 16 P 17 P 18 P 19 P 20 Discordo Totalemnte Discordo Não sei Concordo Descrição da Pergunta Concordo Plenamente Pergunta Resposta Percebo que a T Wanc®© está em consonância com conhecimentos científicos atuais, veiculando informações e atualizadas. Percebo que as informações da T Wanc®© são adequadas e não induzem a aprendizagens equivocadas. Percebo que a T Wanc®© incentiva o debate sobre as relações entre o conhecimento popular e o conhecimento científico. Percebo que a T Wanc®© incentiva a postura de conservação da saúde e preservação dos recursos naturais. Percebo que os conteúdos são propostos de modo contextualizado e são relevantes para os alunos. Percebo que os conteúdos são propostos de modo interdisciplinar e tem conexão com o cotidiano dos alunos. Percebo que o leiaute da T Wanc®© encoraja e desperta o interesse de sua utilização. Estou disposto a testar a T Wanc®© em minhas aulas de química Fonte: Elaborado pelo autor Nessa etapa desejou-se investigar o que pensam individualmente os professores acerca do ensino do conteúdo Tabela Periódica e sobre as possibilidades da T Wanc®© como recurso de ensino-aprendizagem, não existindo a intenção de se revelar padrões de comportamento sobre o ensino do conteúdo Tabela Periódica. Embora o uso de questionários, seja bastante recomendado para casos em que o número de pesquisadores seja grande, optouse por esse meio de coleta nessa fase, de modo a se evitar intimidações aos professores participantes da pesquisa (CARLOS, 2007). 3.4 Tratamento dos Dados A categorização é o processo pelo qual idéias e objetos são reconhecidos, diferenciados e estratificados. Em linhas gerais, a categorização consiste no processo sistemático de organização de objetos ou dados provenientes de um universo ou fenômeno em grupos ou categorias, com um propósito específico a partir de regras, nas quais cada categoria corresponde a um conjunto de análise que se agrupa a partir da similaridade, concebidas como 78 dimensões importantes de um fenômeno que se deseja destacar. Dessa forma, para tratamento dos dados obtidos nas fases 5 e 7, foram criadas categorias para suportar a análise dos livros didáticos e sites, bem como para avaliação do discurso docente (perfil do professor, aulas sobre Tabela Periódica e avaliação da T Wanc®©). Quadro 3.4: Detalhamento das categorias utilizadas na análise dos livros didáticos, sites e discurso docente. Categorias para Análise de Texto (livros didáticos) Presença (sim) Ausência (não) Categorias para Análise de Texto (sites) Presença (sim) Ausência (não) Categoria para Análise do Discurso Docente (Perfil do professor) Concordância (sim) ou Presença (sim) Discordância (não) ou Ausência (não) Categorias para Análise do Discurso Docente (Aulas sobre Tabela Periódica) Sempre Frequentemente Às vezes Raramente Nunca Categorias para Análise do Discurso Docente (Avaliação da T Wanc) Concordo plenamente Concordo Não sei Discordo Discordo Totalmente Fonte: Elaborado pelo autor Considerando-se a natureza mista da pesquisa, as variáveis sob investigação, descritas no Quadro 3.4, foram classificadas como variáveis categóricas dicotômicas (VCD) e variáveis categóricas ordinais (VCO), conforme descrito no Quadro 3.5. As variáveis categóricas dicotômicas, também denominadas binárias, são aquelas que apresentam duas possibilidades de categorias ou probabilidades de resposta, tipo: sim; não ou ausência; presença. Já as variáveis categóricas ordinais são aquelas que apresentam três ou mais categorias ou possibilidades de resposta, na qual existe uma ordem ou “força” explícita entre elas, por exemplo: sempre, freqüentemente; às vezes, raramente e nunca 79 Quadro 3.5: Classificação das variáveis sob estudo: VCD e VCO Variável Categórica Dicotômica (VCD) Variável Categórica Ordinal (VCO) • Análise de Texto: livros didáticos • Análise de Texto: sites • Análise do Discurso Docente: Perfil do professor • Análise do Discurso Docente: Aulas sobre Tabela Periódica • Análise do Discurso Docente: Avaliação da T Wanc Fonte: Elaborado pelo autor Para tratamento das variáveis categóricas ordinais (VCO) (Quadro 3.5) utilizou-se a escala de Likert (PEREIRA, 2004), de cinco pontos, considerando-se as questões apresentadas no Quadro 3.2 e Quadro 3.3. A escala de Likert que foi utilizada fundamentou-se em duas séries padrão de respostas (Quadro 3.4): a) Sempre, freqüentemente; às vezes, raramente nunca e; b) Concordo plenamente; concordo; não sei; discordo; discordo totalmente. Com base nessa padronização, no próximo capítulo são consolidados e apresentados os resultados das avaliações das fases 5 e 7, baseando-se em Miles e Huberman apud Pereira (2004 p. 77) que por se tratar de uma pesquisa mista (CRESWELL, 2007 apud NOVIKOFF, 2007) orientam para que esse tipo de análise, seja calcada tanto por representações gráficas quanto em narrativas. Dessa forma, os dados obtidos serão apresentados primariamente por meio de gráficos de barras (BASTOS et al., 2006; PEREIRA, 2004) e com um breve relato, incluindo uma descrição um pouco mais detalhada de uma das situações de ensinoaprendizagem na perspectiva crítica (progressista) proporcionada pela T Wanc®©, que corresponde a fase 6 da pesquisa. 80 4 APRESENTAÇÃO E DISCUSSÃO DOS RESULTADOS 4.1 A Avaliação dos Livros Didáticos Após consultar os livros didáticos, constatou-se que aqueles disponibilizados em três volumes apresentam um maior detalhamento sobre o assunto em questão e que a maioria deles aborda a Tabela Periódica a partir da classificação dos elementos proposta por Dmitri Ivanovich Mendeleev em 1869 (STRATHERN, 2002), como se Mendeleev fosse o único a contribuir para estruturação da Tabela Periódica atual. Um posicionamento equivocado, visto que, no capítulo 2: Revisão da Literatura foi discorrida a evolução da Tabela Periódica, na qual constatou-se que Mendeleev foi um daqueles que contribuíram para a concepção da Classificação da Periódica. As tentativas de ordenações anteriores mais conhecidas, tais como o parafuso Telúrico de Alexandre de Chancourtoius e a Lei das Oitavas de John Newlands são apresentados muito superficialmente e sem a sua devida importância (SCERRI, 2007) e sem correlação com o desenvolvimento da Química como ciência (Gráfico 4.1 – Histórico e Desenvolvimento). Em geral, comenta-se acerca dos trabalhos de Henry Moseley em 1913 na reorganização da Tabela Periódica em função da ordem crescente dos números atômicos dos (QUADBECK-SEEGER, 2007). Não obstante, a contribuição de Gleen Theodore Seaborg na reestruturação do sistema periódico após a inclusão dos actinídeos (SCERRI, 2007; TOLENTINO et al., 1997) é negligenciada, bem como os novos arranjos de tabela propostos pós-Seaborg (LEACH, 2009). Constatou-se que ao longo do texto da maioria das publicações também não há referência à origem grega ou latina dos nomes dos elementos, assim como não há menção ao trabalho de Jöns Jacob Berzelius na formação da simbologia hoje praticada pela comunidade científica (Gráfico 4.1 – Histórico e Desenvolvimento). Os livros analisados não referenciam claramente a IUPAC como entidade normalizadora em âmbito mundial nas questões relativas à química. As tabelas veiculadas pela maior parte das publicações analisadas não correspondem àquela preconizada pela 81 IUPAC (FLUKE, 1988; IUPAC, 2007), no que se refere à estruturação dos grupos, ou seja, os livros não adotam a linguagem científica padronizada (Gráfico 4.1 – Linguagem Descritivas Científica). Em sua maioria, a abordagem dos grupos ainda é feita pela antiga recomendação da IUPAC. Não há orientações que a divisão em blocos A e B encontram-se em desuso, desde 1985 (FLUKE, 1988). Parte dos livros analisados ainda mantêm a classificação da Sociedade Americana de Química (ACS) para as famílias IA até VIIIA e para famílias IB até VIIIB, sem qualquer menção a esse tipo de classificação (SCERRI, 2007). Os autores fazem uso da antiga classificação da IUPAC para explicar que o número de cada família do grupo A corresponde ao número de elétrons presentes no último nível de energia do elemento. Por exemplo, o lítio (Li, família 1A) possui apenas um elétron no seu último nível de energia (Gráfico 4.1 – Informações Descritivas e Classificatórias). Essa situação é explicada pelo fato de que os elementos representativos seguem as regras da periodicidade e esse conteúdo ainda é bastante exigido nos vestibulares (BELTRAN et al., 1991; ZANON, 2008). Avaliação dos Livros por Categoria n = 6 livros Informações Descritivas e Classificatórias Histórico e Desenvolvimento 13% 87% 47% 53% Não Sim Linguagem Científica Atualizada 75% Eixo Contextualizador e Interdisciplinar 80% 25% 20% Gráfico 4.1: Resultado da avaliação dos seis livros por categoria Fonte: Elaborado pelo autor O conceito de periodicidade é explorado de maneira rudimentar por alguns autores. A maioria, sequer busca explicá-lo por meio de analogias, como por exemplo, as estações do ano, um gráfico senoidal ou um gráfico de uma onda, que seriam excelentes conexões com a Matemática e a Física, respectivamente. A classificação dos elementos em metais, não metais, semi-metais são apresentadas de modo generalizado. Não existe a preocupação em ilustrar a 82 distribuição desses elementos na superfície terrestre. Assim como, não se discute a predominância dos metais, em termos percentuais, em relação aos demais elementos. Os metais são classificados como uma classe de elementos que apresentam brilho característico, na temperatura ambiente são sólidos (exceto o mercúrio), condutores de calor e eletricidade, etc. Interessante observar, que nessa questão não há um relacionamento entre as propriedades dos elementos e as propriedades gerais, funcionais e específicas da matéria. Eixo Contextualizador e Interdisciplinar dos Seis Livros Didáticos (PNLEM 2008) Elementos e Mineralogia 17% 83% Exercícios C&I Contraponto nas propriedades 100% 17% 83% Perigos e Risco dos Elementos 33% 67% Elementos no Corpo humano 33% 67% Elementos na Atmosfera 33% 67% Elementos na Saúde 17% 83% Elementos na Medicina 100% Elementos na Alimentação 100% Elementos na Informática 100% Elementos no Meio Ambiente Elementos na Agricultura 33% Elementos e Toxicidade 83% 67% 17% Não 67% 17% Uso genérico sem discussão Sim 33% 83% Gráfico 4.2: Resultado da avaliação do eixo contextualizador e interdisciplinar dos seis livros Fonte: Elaborado pelo autor Os ametais são classificados como uma classe de elementos que não apresentam brilho característico. Contudo, nem todos os livros citam como exceção o iodo e o carbono, na forma de diamante, que apresentam brilho característico e não conduzem bem o calor e a 83 eletricidade, mas que o carbono sob a forma de grafite (alótropo do carbono) é um bom condutor de eletricidade e também empregado como lubrificante (KOTZ et al., 1998; MASTERTON et al., 1989). Percebeu-se um claro favorecimento dos elementos representativos em detrimento aos demais elementos. Contudo, as substâncias nas mais diversas formas, em nosso cotidiano não se constituem apenas de elementos representativos, mas também elementos de transição e transição interna (SHEREVE et al., 2008). Na maioria das situações propostas praticamente não se discute o porquê da utilização de um determinado elemento químico em uma aplicação ou as conseqüências do seu uso inadequado, como por exemplo: a) o processo de eutrofização, causado por nutrientes a base dos elementos nitrogênio (N); fósforo (P) e potássio (K) quando utilizados indiscriminadamente na agricultura (BAIRD, 2002; BRAGA et al., 2005; BRANCO, 2004; ODUM, 1988); b) o porquê da importância de uma alimentação rica em cálcio para pessoas acima de 50 anos e quais são os alimentos mais ricos nesse elemento, ou seja, os elementos necessários a uma vida saudável (WHITNEY et al., 2008) e, c) elementos de transição e sua importância na indústria siderúrgica (SOUZA, 1989), na pigmentação de tintas e outros materiais (SHEREVE et al., 2008); d) aspecto toxicológicos dos elementos (OIT, 200X), dentre tantos outros temas possíveis (Gráfico 4.1 – Eixo Contextualizador e Interdisciplinar e Gráfico 4.2). Outra situação que merece destaque é a representação alarmante que alguns autores apregoam a alguns elementos químicos, como por exemplo, o mercúrio (Hg) e o chumbo (Pb) em relação as suas conseqüências desastrosas no meio ambiente, sem sequer referenciar que esses elementos também possuem importância na sociedade, na utilização em medidores de pressão arterial e termômetros, no caso do mercúrio e; em baterias e na radiologia como meio de proteção no caso do chumbo. Na verdade, os elementos químicos precisam ser representados sob o aspecto positivo e negativo, pois como Paracelso asseverava que “Todas as substâncias são venenos, não há uma que não o seja. Somente a dose determina que uma dada substância não seja veneno” (LING et al., 2005), o que nos dias atuais poderia ser interpretado como sendo a concentração, uso responsável e descarte correto dos elementos químicos e suas respectivas substâncias. Observou-se que na maior parte dos livros não existe menção clara sobre a origem e a formação dos elementos no universo (TEIXEIRA et al., 2009) e principalmente a questão da abundância e a disponibilidade desses elementos na natureza (solo, água e ar), uma vez que parte deles é encontrada em grandes proporções, outros são extremamente raros e estão ameaçados de esgotamento, tal como o urânio (TEIXEIRA et al., 2009). 84 No que concerne aos exercícios, percebe-se a presença de questões relacionadas a áreas afins a química (Gráfico 4.2 – Exercícios C&I44), como por exemplo, questões que permeiam, principalmente, o meio ambiente e outras voltadas para saúde. Porém, os exercícios que seguem essa linha são aqueles herdados dos concursos vestibulares (Gráfico 4.2), contudo as atividades de fixação propostas pelos autores dos livros, em sua grande maioria, não permeiam temas, tais como saúde, alimentação, agricultura, meio ambiente, corpo humano, medicina (BELTRAN et al., 1991; ZANON, 2008), prevalecendo as informações descritivas e classificatórias, tais como, posicionamento e localização na tabela periódica, eletronegatividade, raio atômico, potencial de ionização, em prejuízo aos conteúdos mais significativos sobre os próprios elementos químicos (Gráfico 4.1), como a ocorrência, aplicações, métodos de preparação, propriedades e as correlações entre esses temas e os aspectos relativos a Ciência, Tecnologia, Sociedade e Meio Ambiente (Gráfico 4.2), o que reafirma o instrumentalismo voltado para o vestibular (NOVIKOFF et al., 2009). Os resultados referentes à avaliação dos livros didáticos, elencados no Apêndice C encontram-se disponíveis para consulta no Apêndice D: Matriz com os resultados da avaliação do capítulo Tabela Periódica dos seis livros didáticos. 4.2 A avaliação dos sites Basicamente as tabelas On line (sites) seguem a mesma linha de raciocínio, e se resumem em uma base de dados desenvolvida em uma linguagem de programação que permite o acesso dinâmico às informações relativas a um elemento químico específico ao se clicar sobre seu símbolo. As principais informações veiculadas referem-se aquelas de cunho descritivo e classificatório, tal como número atômico dos elementos, configurações eletrônicas, propriedades periódicas, tais como eletronegatividade, raio atômico, ponto de fusão, ponto de ebulição e as propriedades aperiódicas como, por exemplo, o calor específico e a massa atômica (Gráfico 4.3 – Informações Descritivas e Classificatórias). Não serão discutidos os conteúdos de cada um dos sites avaliados; apenas mencionados aqueles de maior relevância e que chamaram mais atenção nessa fase da pesquisa, como por exemplo, o site do NIST Elemental Data Index (NIST, 2005) que possui informações mais aprofundadas, conteúdos que extrapolam aos propósitos da educação básica, como por exemplo, espectros de absorção ou de emissão dos elementos. 44 Exercícios Contextualizadores e Interdisciplinares 85 A maior parte dos sites estudados encontra-se em inglês, o que pode ser considerado uma barreira técnica para muitos professores e alunos. Alguns deles podem ser encontrados em espanhol (MERCK, [200?]) e também em português, Tabela Periódica Wikipedia (WIKIPEDIA, 2008) ou pelo menos parte dele em português como o Webelements (WINTER, 2009) facilitando a utilização do seu conteúdo, mesmo considerando-se alguns erros de tradução. O WebElements (WINTER, 2009) é um portal em inglês com uma vasta quantidade de informações sobre os elementos químicos e pode ser considerado o mais completo dos trinta sites avaliados. Tanto que outros sites direcionam links para essa página ou a referenciam ou simplesmente fazem um “corte colagem” de suas informações O site The Chemogenesis Web Book (2009), também em inglês, é o portal que detém o mais abrangente acervo de proposições de tabelas periódicas, desde épocas remotas até 2010, podendo ser considerado uma exceção nessa questão e uma referência no assunto. Cabe ressaltar que algumas páginas analisadas possuíam excesso de informações, como também um leiaute pobre e pouco didático, o que certamente não estimula ou favorece sua a utilização, além de links inválidos. Situações que dificultaram o processo de análise. Avaliação dos Sites por Categoria n = 30 sites Informações Descritivas e Classificatórias Historico e Desenvolvimento 39% 61% 63% 37% Não Sim Linguagem Científica Atualizada 78% Eixo Contextualizador e Interdisciplinar 92% 22% 8% Gráfico 4.3: Resultado da avaliação dos trinta sites por categoria Fonte: Elaborado pelo autor Semelhante aos livros, a maioria dos sites não apresenta o desenvolvimento histórico da Tabela Periódica (Gráfico 4.3 – Histórico e Desenvolvimento) e tampouco uma clara 86 referência a IUPAC como entidade normalizadora. Observa-se que as tabelas veiculadas por tais meios não correspondem exatamente a tabela constante no site da IUPAC (FLUKE, 1988; IUPAC, 2007) no que se refere a estruturação dos grupos, ou seja, não se adota uma linguagem científica padronizada (Gráfico 4.3 – Linguagem Científica Atualizada). A abordagem dos grupos também é feita pela antiga recomendação da IUPAC, e não há menção que a divisão em bloco A e B encontram-se em desuso, desde 1985 (FLUKE, 1988). Alguns sites ainda mantêm a classificação da Sociedade Americana de Química (ACS) para as famílias IA até VIIIA e para famílias IB até VIIIB, sem qualquer menção a essa classificação (SCERRI, 2007), quanto a sua obsolescência. Eixo Contextualizador e Interdisciplinar dos Trinta Sites Selecionados Elementos e Mineralogia 13% 87% Exercícios C&I 3% 97% Contraponto nas propriedades 7% Perigos e Risco dos Elementos 93% 20% 80% Elementos no Corpo humano 7% 93% Elementos na Atmosfera 7% 93% Elementos na Saúde 3% 97% Elementos na Medicina 100% Elementos na Alimentação 100% Elementos na Informática 100% Elementos no Meio Ambiente 7% Elementos e Toxicidade 7% Não 93% Elementos na Agricultura 3% Uso genérico sem discussão Sim 97% 37% 63% 93% Gráfico 4.4: Resultado da avaliação eixo contextualizador e interdisciplinar dos trinta sites Fonte: Elaborado pelo autor 87 Não obstante, observa-se uma peculiaridade nos sites avaliados, tanto em português como em inglês, que é a ausência de discussão acerca dos elementos químicos e as suas relações com a sociedade (CHAGAS, 1992; CHASSOT, 2001; 1990; CHRISPINO, 1994), na categoria eixo contextualizador e interdisciplinar (Gráfico 4.3 – Eixo Contextulaizado r e Interdisciplinar e Gráfico 4.4). Em várias situações apresenta-se o elemento e a sua imagem associada a um objeto, como por exemplo, o elemento tungstênio associado a uma lâmpada incandescente, mas não há a conexão entre tais representações, ou seja, por que o tungstênio está associado a uma lâmpada de tal natureza? Nesse ponto, falta a conexão entre a propriedade descritiva, ponto de fusão, e as condições de operação de uma lâmpada incandescente (alta temperatura), e a conseqüente necessidade de utilização de um material de elevado ponto de fusão (KOTZ et al., 1998). Situações como as apontadas acima fazem, com que as imagens e as informações acerca dos elementos assumam um caráter descritivo e classificatório (Gráfico 4.3 – Informações Descritivas e Classificatórias) em detrimentos a temas de fundamental importância para a formação do cidadão (Gráfico 4.4), se encerrando na racionalidade instrumental (NOVIKOFF et al., 2009). Fato também observado durante a análise dos livros didáticos. No que concerne aos exercícios, percebe-se a ausência de questões relacionadas a áreas afins a química (Gráfico 4.4 - Exercícios C&I). Uma condição esperada, visto que pela própria natureza dos sites eles possuem apenas caráter informativo e não se atem as atividades de fixação (Gráfico 4.4). Em síntese pode-se afirmar que os sites (Gráfico 4.4) apresentam um comportamento semelhante aos livros didáticos (Gráfico 4.2) e, principalmente se for considerado que as páginas da internet normalmente são desenvolvidas com base na literatura disponível. Os resultados da avaliação dos sites, bem como a tela de abertura de cada um deles, encontram-se respectivamente disponíveis para consulta no Apêndice F e no Apêndice G. 4.3 Experimentação Laboratorial da Versão Beta da T Wanc®© 4.3.1 Análise do discurso docente: Perfil do Professor e Aulas sobre Tabela Periódica Quanto aos seis professores envolvidos na pesquisa (Gráfico 4.5), independente da formação acadêmica, (83 %) em Química ou (17%) Biologia, ou se ministra aulas na rede de 88 ensino pública (83%) ou particular (17%), todos apontam para dificuldades em se ministrar o conteúdo “Tabela Periódica”, ao longo de suas trajetórias profissionais (Gráfico 4.6) em maior ou menor extensão (P 5). A “causa” da dificuldade indicada pelos professores é a falta de interesse pelo tema em questão por parte dos alunos (P 4). Observa-se no Gráfico 4.5 que os seis professores acreditam que a adoção de um aplicativo específico (P 9), facilitaria o processo de ensino-aprendizagem de conteúdo “Tabela Periódica”. Todavia, até então esses professores ainda não haviam despertado o interesse em desenvolver alguma aplicação no Microsoft Excel voltada para ensinoaprendizagem de Química (P 12), apesar de todos eles possuírem o programa Microsoft Excel instalado em seus respectivos computadores (P 10), porém a grande maioria não sabe utilizálo (P 11). Análise do Discurso Docente: Perfil do Professor n = 6 professores (P 1) Possui formação em Química? 83% 17% (P 2) É professor da rede pública? 83% 17% (P 3) Ministra(ou) o conteúdo tabela periódica? 100% (P 9) Um software dedicado ao tema facilitaria o ensino-aprendizagem? 100% (P 10) Possui o Microsoft Excel instalado no seu computador? 100% (P 11) Sabe usar o Microsoft Excel? 17% (P 12) Já desenvolveu alguma aplicação no Excel voltada para ensino? Sim Não 83% 100% Gráfico 4.5: Análise do Discurso Docente: Perfil do professor Fonte: Elaborado pelo autor A partir do Gráfico 4.6 constata-se a maioria dos professores não relaciona a Tabela Periódica com o cotidiano dos alunos (P 7) e não fazem a sua relação com outras disciplinas 89 (P 8), como também não resgatam a evolução da Tabela Periódica ao longo da história da Química (P 6). Três professores declararam informalmente, que um dos motivos para não se abordar a evolução da Tabela Periódica ao longo da história da química é a falta de tempo e conseqüente dificuldade em se cumprir os programas estabelecidos. Segundo Dallacosta e colaboradores (1998), a raiz da questão relativa ao aprendizado da Tabela Periódica está associada: i) ao modo como o processo de ensino aprendizagem é desenvolvido; ii) à preocupação excessiva de se cumprir extensos programas, distantes da realidade do aluno e iii) ao enfoque excessivo no campo submicroscópico e por aulas predominantemente expositivas, nas quais, comumente a Tabela Periódica é tratada fora da realidade do aluno, de forma absoluta e atemporal como se fosse uma simples base de dados de onde se extraem apenas massas atômicas, números atômicos e eletronegatividades (EICHLER et al., 2000). Análise do Discurso Docente - Aulas sobre Tabela Periódica n = 6 professores (P 4) Os alunos mostram-se motivados pelo conteúdo? 17% 83% (P 8) Relaciona a Tabela Periódica com outras disciplinas? 33% 67% (P 7) Correlaciona a Tabela Periódica com o cotidiano do alunos? 33% 67% (P 6) Aborda (ou) a evolução da Tabela Periódica nas aulas? 17% 83% (P 5) Tem (Teve) dificuldades em abordar o conteúdo Tabela Periódica? Sempre Frequentemente 83% As vezes Raramente 17% Nunca Gráfico 4.6: Análise do Discurso Docente: Aulas sobre Tabela Periódica Fonte: Elaborado pelo autor O Excel propicia diferentes aplicações envolvendo o ensino da química, que embora possam contribuir para o processo de ensino-aprendizagem, ainda permanecem praticamente inexploradas (HARRIS, 2008). Fruto da falta de conhecimento dos professores na utilização desse software (P 11), o que pode ser explicado pela falta de capacitação dos professores 90 nessa ferramenta em potencial, uma vez que nos cursos de licenciatura, a prática da informática, no caso do Microsoft Excel voltado para o ensino, ainda permanece relegada ao segundo plano (GABINIL et al., 2007). Não se trata de inundar as escolas [...] de computadores, como que caídos de páraquedas. Numerosos estudos [....] mostram como a simples informatização leva apenas a que as mesmas bobagens sejam feitas com maior rapidez, além do acúmulo de equipamento sofisticado utilizado como máquinas de escrever. Trata-se de organizar a assimilação produtiva de um conjunto de instrumentos poderosos que só poderão funcionar efetivamente ao promovermos a mudança, no sentido mais amplo [...]. (DOWBOR, 2001, p. 15). Distribuir computadores para os professores pode representar um importante passo para melhoria do ensino; desde que a capacitação desses profissionais seja também considerada, situação essa, muito bem retratada na citação acima, pois a incorporação de novas tecnologias de informação nos diferentes níveis e modalidades de ensino evidencia cada vez mais a necessidade e a oportunidade de capacitação docente. A análise das respostas desses profissionais (Gráfico 4.6) evidencia a necessidade de dotá-los com recursos que facilitem a articulação dos conteúdos com o cotidiano dos alunos (P 7) e favoreçam a interdisciplinaridade (P 8), de modo que os conteúdos relacionados à química não sejam esgotados em si mesmos, mas sim tratados como fontes desencadeadoras de conhecimentos específicos e discutidos como instrumentos para uma leitura integrada da sociedade moderna (BRASIL, 2006), superando assim a racionalidade instrumental (NOVIKOFF et al., 2009). 4.3.2 Análise do discurso docente: Avaliação da T Wanc®© pelos professores Conforme mencionado no Capítulo Metodologia os professores, após assistirem a uma apresentação da versão beta da T Wanc®©, tiveram a oportunidade de testá-la durante sete dias. Posteriormente, esses profissionais foram convidados a responder a uma nova série de questões, que tinha por objetivo captar o sentimento desses profissionais quanto às possibilidades da T Wanc®© como recurso de ensino-aprendizagem, bem como levantar algumas oportunidades de melhoria. Nessa avaliação, partiu-se do pressuposto que os professores participantes da pesquisa já possuíam entendimento dos conceitos de contextualização e interdisciplinaridade, uma vez que a atividade fim dessa pesquisa era propor uma Tabela Periódica alicerçada 91 nesses promotores de ensino-aprendizagem e não avaliar o grau de entendimento dessa questão junto aos professores (BRASIL, 2006; 1999; CARLOS, 2007). Segundo as respostas dos seis professores (Gráfico 4.7), a T Wanc®© apresenta informações fidedignas (P 13) e não induz à aprendizagens equivocadas (P 14), relaciona o conhecimento popular com o conhecimento científico (P 15), além de possibilitar o tratamento de questões ambientais (P 16), a articulação dos conteúdos com cotidiano dos alunos (P 17), bem como possibilita o tratamento de outras disciplinas em consonância com a Química (P 18) por se apropriar dos conhecimentos de várias áreas do saber na compreensão de um problema (MENEZES et al., 2002). Análise do Discurso Docente - Avaliação da versão beta da T Wanc®© n= 6 professores (P 20) Estou disposto a testar a T Wanc em minhas aulas de química (P 19) Percebo que o leiaute da T Wanc encoraja e desperta o interesse de sua utilização. 100,0% 16,7% 33,3% 50,0% (P 18) Percebo que os conteúdos são propostos de modo interdisciplinar e tem conexão com o cotidiano dos alunos. 83,3% 16,7% (P 17) Percebo que os conteúdos são propostos de modo contextualizado e são relevantes para os alunos. 83,3% 16,7% (P 16) Percebo que a T Wanc incentiva a postura de conservação da saúde e preservação dos recursos naturais. 83,3% 16,7% (P 15) Percebo que a T Wanc incentiva o debate sobre as relações entre o conhecimento popular e o conhecimento científico. 33,3% 66,7% (P 14) Percebo que as informações da T Wanc são adequadas e não induzem a aprendizagens equivocadas. 16,7% 83,3% (P 13) Percebo que a T Wanc está em consonância com conhecimentos científicos atuais, veiculando informações corretas e atualizadas. 16,7% 83,3% Discordo Totalmente Discordo Não Sei Concordo Concordo Plenamente Gráfico 4.7: Análise do Discurso Docente: Avaliação da versão beta da T Wanc®© 92 Além disso, face ao entusiasmo e interesse demonstrado pelos docentes em utilizar a T Wanc®© (P 20) surgiram sugestões para criação de novas telas e módulos específicos para tratamento de exercícios contextualizados e interdisciplinares. Tais sugestões foram muito bem acolhidas, mas face ao tempo reduzido para conclusão do material e a dimensão da pesquisa, essas propostas não foram implementadas, mas serão incorporadas em uma futura revisão da T Wanc®. Com relação à pergunta: P 19 (Gráfico 4.7), vale ressaltar que um dos professores respondeu que não sabia se o leiaute da T Wanc®© encorajaria e despertaria o interesse em sua utilização, sem justificar o porquê da sua resposta. Dessa forma, decidiu-se questioná-lo acerca dessa questão, na qual foi afirmado que ele havia entendido como “...o interesse do aluno em usar a tabela e não do professor. Logo, no meu entendimento eu não poderia afirmar sobre o interesse ou não dos alunos, daí a minha dúvida. Quanto a mim, tenho pleno interesse em testar a tabela em algumas aulas.” Foi explicado, novamente, que a T Wanc®© não é, primariamente, destinada aos alunos, mas sim aos professores na mediação do processo de ensino-aprendizagem. Contudo, a resposta inicial do professor foi mantida. Nessa fase, também foram levantadas algumas oportunidades de melhoria do aplicativo orientadas pelos professores que testaram a tabela, dentre as quais se podem citar: i) Ajuste no leiaute de duas telas aplicativo; ii) Correção de erros de digitação, iii) Correção de um link corrompido; iv) Correção de dois gráficos, e v) Redução do tamanho do arquivo, por meio de um melhor tratamento gráfico das figuras utilizadas, que estava com doze megabytes e que conseqüentemente dificultava a abertura do aplicativo em computadores de baixa capacidade e migração da planilha para versão Microsoft 2007 (AQUINO, 2007; MICROSOFT, 2009) 4.4 Apresentação da T Wanc®© Não há duvidas que a experiência didática do professor e sua criatividade podem tornar o ensino da Química mais agradável e com bons resultados no aprendizado dos alunos (MAGALHÃES, 2002). A dificuldade dos estudantes em formar modelos mentais para entender conceitos e fenômenos químicos pode ser superada através de jogos, ilustrações e gravuras e, certamente, a utilização do computador na sala de aula facilita a compreensão dos conceitos químicos (FERNANDES, 2007). 93 ®© Figura 4.1: Tela de abertura contendo o detalhamento dos temas que são tratados na T Wanc . Fonte: Elaborado pelo autor Nessa perspectiva, a T Wanc®© propicia a construção e a correlação das diferentes propriedades dos elementos químicos com a Ciência, Tecnologia, Sociedade e Meio Ambiente. Esses temas relacionados à química não são esgotados em si mesmos, pois, são tratados como fontes desencadeadoras de conhecimentos específicos e discutidos como instrumentos para uma leitura integrada da sociedade moderna (BRASIL, 2006; CHASSOT, 2001). A partir da tela de abertura, ilustrada na Figura 4.1 é possível acessar as demais áreas do aplicativo, que permitem o tratamento dos seguintes temas: a) Elementos e Agricultura; b) Elementos e Terra c) Elementos e Medicamentos; d) Elementos e Nutrição; e) Elementos e Corpo Humano; f) Elementos e Toxicologia; g) Elementos e Tabela Periódica; h) Elementos e Minerais; i) Elementos e Ciclos Biogeoquímicos; j) Elementos e Poluição; k) Elementos e Informática; l) Elementos e Linha do Tempo 94 A forma de utilização da T Wanc®© é determinada pelo professor, que pode optar por utilizá-la como um todo ou apenas partes dela, de acordo com as suas necessidades, tempo disponível e principalmente em função dos objetivos de ensino-aprendizagem almejados. A Figura 4.2 ilustra genericamente, algumas das possibilidades de temas que podem ser tratados a partir da T Wanc®©, iniciando-se a partir de axiomas, que podem ser traduzidos pela presença de um determinado elemento na natureza e as suas possibilidades de inter-relações com os eixos Ciência, Tecnologia, Sociedade e Meio Ambiente. Figura 4.2: Axioma genérico considerando a interação de um átomo genérico e as suas inter-relações Fonte: Baseado em Silverthorn (2010) Assumindo-se como axioma (CARLOS, 2007; FRANSCISCHETT, 2005) o elemento cálcio na natureza torna-se possível discutir a partir da classificação geral dos elementos químicos (Figura 4.3) desde a sua abundância na crosta terrestre até a sua importância para o corpo humano e para os vegetais, bem como o seu e outros ciclos biogeoquímicos na natureza, numa perspectiva crítica (progressista). 95 Figura 4.3: T Wanc ®© Classificação geral dos elementos químicos Fonte: Elaborado pelo autor Na tela representada pela Figura 4.3 é possível estratificar os ametais, gases nobres, hidrogênio, actinídeos, lantanídeos, metais alcalinos, alcalinos terrosos e metalóides. Ao se clicar sobre cada elemento químico é apresentado o seu nome, como também é possível consultar a tabela no formato alongado, ao se clicar no botão “Tabela Expandida” (Figura 4.4). Figura 4.4: T Wanc ®© Classificação geral dos elementos químicos – Expansão dos lantanídeos e actinídeos A T Wanc®© também disponibiliza uma tela específica, na qual é dispensado um tratamento pormenorizado dos elementos químicos, considerando a origem do nome, ano da descoberta e descobridor do elemento em questão, assim como são apresentados todos os isótopos do elemento que são encontrados na natureza. Cada elemento químico pode ser consultado a partir do seu número atômico e as demais informações como, por exemplo, tipo do elemento (representativo, transição ou transição interna) e a classe dos elementos (metal, ametal, semi-metal e gás nobre) são 96 automaticamente atualizadas. O arranjo proporcionado pela tela em questão (Figura 4.5) é análogo a uma carteira de identidade, na qual o símbolo do elemento equivalente a fotografia e o número atômico como identificador (“digital”) do elemento químico. Além disso, para cada elemento são apresentadas a localização nos períodos e grupos da tabela. Figura 4.5: T Wanc ®© Tabela e a linguagem padronizada da química – Número Atômico Fonte: Elaborado pelo autor Ao selecionar determinadas áreas da tela são apresentadas as definições para os conceitos relacionados, em uma Figura flutuante, tal como o número atômico (Figura 4.5), como também se discute a simbologia proposta por Berzelius em 1818 (Figura 4.6) que hoje é a base da simbologia empregada pela IUPAC. Também é possível consultar o número CAS de cada elemento químico. O CAS Trata-se de um registro único no banco de dados internacional do Chemical Abstracts Service (CAS), uma divisão da American Chemical Society (ACS) que atribui esses números a cada produto químico ou elemento químico descritos na literatura, visto que muitos deles podem assumir diferentes nomenclaturas, principalmente sob o ponto de vista comercial (NIST Webook, 2008). Com esse número é possível acessar informações acerca dessas substâncias. Dessa forma, a tabela disponibiliza um link que permite o acesso dessas informações por meio NIST Webook (2008): 97 Figura 4.6 T Wanc ®© Tabela e a linguagem padronizada da química – Símbolo Fonte: Elaborado pelo autor Figura 4.7: Informações obtidas para o elemento cálcio (Ca) a partir do site NIST Webbok. Fonte: NIST WEBBOK (2008). Nesse caso, percebe-se que o número atômico não foi tratado pura e simplesmente com um número, mas sim com a sua devida importância e inter-relação com os demais assuntos que envolvem a questão, da identificação do elemento, inclusive aquela, atualmente 98 empregada, sob o ponto de vista global, que é a utilização do número CAS (NIST WEBBOOK 2008). Figura 4.8: T Wanc ®© Elementos Químicos e Nutrição Fonte: Elaborado pelo autor Na tela Elementos Químicos e Nutrição (Figura 4.8) em função do tipo de elemento, é possível discutir de modo pormenorizado a função de cada um deles e as conseqüências da carência e do excesso desses elementos no organismo humano (MORAN et al., 2007). A Figura 4.9 é uma excelente demonstração de como os recursos do Microsoft Excel podem ser empregados na elaboração de gráficos que permitem a avaliação da participação dos elementos-base no corpo humano (hidrogênio, oxigênio, carbono e nitrogênio) e tratamento dos macronutrientes e micronutrientes no organismo humano, permitindo assim a consonância dos citados elementos, primariamente pertencentes a Química, com a disciplina de Biologia e posterior conexão com a Nutrição, por meio de outras telas destinada a tal propósito. Ao se clicar, na barra de rolagem situada abaixo do símbolo, as informações relativas aos limites de ingestão tolerável e a ingestão adequada para homens e mulheres, em função da faixa etária, são exibidas automaticamente para cada elemento sob investigação. Além disso, os elementos químicos são visualizados simultaneamente nos seus respectivos grupos e períodos da tabela periódica, considerando-se um código de cor específico (azul, laranja e 99 verde) para cada tipo de elemento: a) Macromineral; b) Micromineral e; c) Elementos estruturais (elementos-base do corpo humano). % Figura 4.9: Ampliação de parte da tela Elementos Químicos e Nutrição. Fonte: Elaborado pelo autor Partindo-se do gráfico de barras: Macrominerais e Microminerais Presentes no Corpo Humano, representado na Figura 4.9, é possível acessar por meio do hyperlink45: “Consultar fontes desses elementos?”, as principais fontes naturais para os microminerais e 45 O hyperlink é uma palavra ou Figura que permite o acesso direto a uma parte específica de um documento ou arquivo. 100 macrominerais necessárias ao corpo humano (WHITNEY et al., 2008) em uma tela específica a esse propósito (Figura 4.10). Na tela Elementos Químicos e Nutrição – Fontes naturais (Figura 4.10), são discutidas as melhores e piores fontes dos elementos químicos por quilocalorias, por meio do uso de ferramentas gráficas: gráficos de barras, colunas e setores. As informações relativas a cada elemento é acessada a partir do nome do elemento. Figura 4.10: T Wanc ®© Elementos Químicos e Nutrição – Fontes naturais Fonte: Elaborado pelo autor Partindo-se da tela exibida na Figura 4.10 é possível simular diferentes dietas equilibradas com o número de calorias envolvidos, considerando-se as fontes naturais de cada elemento em questão. O professor, ao clicar sobre o símbolo do elemento é conduzido à tela: Elementos Químicos e Nutrição – Simulação de dieta (Figura 4.11), a partir da qual é possível criar diferentes dietas, sempre considerando os limites de ingestão dietética (homens e mulheres) em função da idade. Nessa tela, encontram-se disponibilizados cada tipo de alimento com suas respectivas informações nutricionais. Por meio de botões de ação, é possível selecionar o alimento desejado, como também alterar a quantidade de cada componente da dieta. À medida que é feita essa escolha, a quantidade do elemento químico presente na dieta é exibida em miligramas, em uma balança, e o número de calorias envolvido e são automaticamente 101 exibido, por meio de um gráfico denominado por “dietômetro”, permitindo mais uma vez o emprego das ferramentas gráficas e funções de cálculo do Microsoft Excel no desenvolvimento de recursos gráficos voltados para o ensino da Química, nesse caso com interface com as questões nutricionais relacionadas aos elementos químicos. Entende-se por dieta equilibrada aquela que oferece a quantidade certa de nutrientes, garantindo a nutrição adequada ao organismo (WHITNEY, et al., 2008). Uma dieta saudável pode reduzir o risco do surgimento de doenças crônicas como a constipação, diabetes, doenças cardiovasculares, entre outras favorecendo a qualidade de vida (HERLIHY et al., 2002; SACKHEIM et al., 2001). Indubitavelmente, a qualidade dos alimentos ingeridos deve ser observada, pois uma dieta equilibrada em gorduras é fundamental para o bem estar do ser humano (WHITNEY, et al., 2008). Figura 4.11: T Wanc ®© Elementos Químicos e Nutrição – Simulação de dietas Fonte: Elaborado pelo autor A partir da seleção dos alimentos e suas respectivas quantidades é possível gerar e até mesmo imprimir um relatório ilustrado que apresenta os valores referentes ao total de miligramas obtidos na dieta, e o total de quilocalorias envolvido, sempre em comparação com as necessidade diárias recomendadas para homens e mulheres em função da idade. Para acessar a dieta criada basta o professor clicar no botão “Ver Dieta”, que o hyperlink irá direcioná-lo ao relatório referente ao elemento em questão (Figura 4.12). 102 Figura 4.12: T Wanc ®© Elementos Químicos e Nutrição – Resultado da simulação de uma dieta Fonte: Elaborado pelo autor O relatório estratifica cada fonte do elemento, por meio de uma legenda colorida, na qual se encontram identificados por um código de cor as fontes dos alimentos empregados na dieta: pães e cereais, hortaliças, frutas, leite e seus derivados, leguminosas, nozes e sementes, carnes brancas, vermelhas, ovos e outros, como também aquelas que são consideradas como fontes excelentes para o elemento cálcio, como a amêndoa, a couve chinesa e a sardinha com espinhas (WHITNEY et al., 2008). No desenvolvimento dessa tela tomou-se extremo cuidado em sinalizar para o usuário que essas informações possuem apenas objetivos didáticos. Dessa forma, existe uma mensagem de alerta que informa sobre a finalidade didática do relatório e não terapêutica. Figura 4.13: Detalhe da legenda usada identificação dos tipos de alimentos usados na dieta Fonte: Elaborado pelo autor 103 Dessa forma, acredita-se que situações como as apresentadas na Figura 4.14, as quais induzem a automedicação promovida pela mídia, podem ser melhor discutidas, assumindo-se um enfoque preventivo aos invés do remediativo, que geralmente é mais custoso e arriscado, pois não se mede as conseqüências do uso abusivo de medicamentos em detrimento a uma alimentação saudável. Figura 4.14: Propaganda em favor do uso de medicamentos à base de cálcio para tratamento sintomático contra a osteoporose, uma doença que atinge mais de vinte e cinco milhões de pessoas no mundo. Fonte: Folha Universal (2010, p. 13) A baixa ingestão de cálcio durante a fase de crescimento limita a capacidade dos ossos alcançarem sua massa e densidade ideais. A maioria das pessoas atinge um pico de massa óssea por volta dos vinte anos; e ossos densos protegem melhor contra a perda óssea e fraturas relacionadas à idade. Todos os adultos naturalmente perdem massa óssea conforme envelhecem, começando entre os trinta e quarenta anos. Essa perda ocorre por meio da urina, fezes e suor, pois o cálcio que é absorvido pela dieta alimentar não é absorvido adequadamente. A osteoporose é uma doença que atinge os ossos e caracteriza-se quando a quantidade de massa óssea diminui substancialmente e desenvolve ossos ocos, finos e de extrema sensibilidade, mais suscetíveis a fraturas (TORTORA et al., 2006). Tal condição faz parte do processo normal de envelhecimento e é mais comum em mulheres do que em 104 homens. A doença progride lentamente e raramente apresenta sintomas antes que aconteça algo de maior gravidade, como uma fratura espontânea, isto é, não relacionada a traumas ou quedas (TORTORA et al., 2006; WHITNEY et al., 2008). Contudo, a osteoporose pode ter sua evolução retardada por medidas preventivas, principalmente no que se refere a alimentação (WHITNEY et al., 2008). Porém, o uso abusivo de cálcio pode acarretar sérios danos ao organismo que vão desde constipação, risco aumentado de formação de cálculos nos rins, disfunção renal até as interferências de outros macrominerais e microminerais no corpo humano (FRANCO, 2008; SANTOS, 2008; WHITNEY et al., 2008). Toda essa discussão em torno do elemento cálcio, partindo-se da Tabela Periódica convencional é aplicável aos demais elementos que apresentam funções específicas no corpo humano, tal como o sódio, potássio, zinco, fósforo, magnésio, enxofre, dentre outros. Da mesma forma que uma dieta balanceada em cálcio é necessária para mantenabilidade da saúde humana, o mesmo conceito é aplicável a nutrição vegetal, que envolvem macronutrientes e micronutrientes, conforme ilustrado na Figura 4.15, a seguir. Figura 4.15: T Wanc ®© Elementos e Agricultura Fonte: Elaborado pelo autor Por meio da tela: Elementos e Agricultura é possível discutir também a função dos macronutrientes e micronutrientes na nutrição vegetal, bem como as conseqüências da 105 carência desses elementos para o desenvolvimento dessas espécies. Nesse caso, seguindo a base axiomática (CARLOS, 2007; FRANSCISCHETT, 2005) definida inicialmente, também foi considerado o elemento cálcio e o carbono, de maneira a correlacioná-los com a nutrição humana a partir do consumo de vegetais, que são ricos em cálcio, tal como a couve chinesa (WHITNEY et al., 2008), mas que possuem dependência ao ciclo biogeoquímico tanto do cálcio como do carbono que estão intimamente relacionados (Figura 4.16). Figura 4.16: T Wanc ®© Tabela periódica e os ciclos biogeoquímicos Fonte: Elaborado pelo autor A partir de cada elemento químico em questão é possível estudar o seu ciclo biogeoquímicos (BRAGA et al., 2005; BRANCO, 2004; ODUM, 1988; LENZI et al., 2009; SARIEGO, 1994; SCARLATO et al., 1992; UZINIAN et al., 2008), por meio de um hyperlink que direciona a uma tela especifica, que permite a discussão do assunto. No caso do cálcio, trata-se de um elemento extremamente importante para os seres humanos, pois participa da composição das estruturas dos seres vivos: ossos, carapaças, paredes celulares, além de atuar na transmissão de impulsos nervosos, nos processos de contração muscular e a coagulação sanguínea (HERLIHY et al., 2002; SACKHEIM et al., 2001). Nos vegetais ele atua como ativador de enzimas e regulador do pH do solo (TOMA, 1984). As principais fontes do elemento são as rochas calcáreas que, ao sofrerem erosão e lixiviação o liberam para o meio (TEIXEIRA et al., 2009; UZINIAN et al., 2008). 106 No solo, sob a forma iônica (Ca²⁺), é absorvido pelos vegetais e, por meio das cadeias alimentares, passa para os animais. Dessa forma, a principal fonte de cálcio para aos vegetais é o solo e, esse pode perdê-lo para atmosfera, pelos ventos que carregam minúsculas partículas de solo e pela ação lixiviadora das chuvas, que o arrastam para os cursos d’água (TEIXEIRA et al., 2009; UZINIAN et al., 2008). No oceano, o cálcio que é absorvido pelos seres marinhos serve para construção de suas estruturas protetoras, tais como: conchas, carapaças, escamas, espinhas (UZINIAN et al., 2008). Com a morte desses seres vivos, ocorre a deposição desse material calcáreo, rico em cálcio, no fundo dos oceanos, o que propicia a formação de novas rochas. Os movimentos da crosta terrestre favorecem o afloramento desse material, tornado o elemento cálcio novamente disponível para os seres vivos (ODUM, 1988; LENZI et al., 2009; SARIEGO, 1994; SCARLATO et al., 1992; UZINIAN et al., 2008). Figura 4.17: T Wanc ®© Tabela Periódica e ciclo biogeoquímico do cálcio Fonte: Tela desenvolvida pelo autor baseado em Uzunian e Birner (2008) Enfim, para se ter boa saúde, os seres vivos dependem da assimilação de vários elementos químicos em diferentes proporções e todos esses elementos encontram-se nas rochas, nas águas e no ar, servindo como nutrientes tanto para vegetais como para os animais (TEIXEIRA et al., 2009). Com base no exposto, acredita-se que a T Wanc®© possui uma 107 abordagem diferenciada daquela tradicionalmente utilizada no processo de ensino aprendizagem da Tabela Periódica, que permitem a articulação de diferentes conteúdos com o cotidiano, utilizando temas sociais e o envolvimento de várias disciplinas. Considerando-se os 112 elementos químicos constantes em suas bases de dados (BDP e BDS), trabalham-se temas interdisciplinares como metalurgia (LEPREVOST, 1978), geologia (TEIXEIRA et al., 2009), geografia, e temas voltados para saúde (TORTORA et al., 2006), corpo humano (HERLIHY et al., 2002; SACKHEIM et al., 2001) meio ambiente (BAIRD, 2002; BRAGA et al., 2005; BRANCO, 2004; ODUM, 1988; LENZI et al., 2009; SARIEGO, 1994; SCARLATO et al., 1992), toxicidade (OIT, 200X) e alimentação (FRANCO, 2008; SANTOS, 2008; WHITNEY et al., 2008). Sendo assim, no próximo capítulo com base na avaliação dos livros didáticos, sites e na avaliação da T Wanc®© pelos professores são apresentas as conclusões e propostas para continuidade desse estudo. 108 5 CONCLUSÕES A etapa mais importante da pesquisa foi a utilização do Microsoft Excel para o desenvolvimento da Tabela Periódica e a revisão da literatura sob o ponto de vista da legislação vigente (LDBEN, PCNEM e PCN+), o que possibilitou a fundamentação legal para tratamento do tema, levantamento das questões da pesquisa, bem como a avaliação do conteúdo Tabela Periódica nos livros didáticos e sites. Os livros de química pesquisados são excelentes instrumentos na organização e orientação de conteúdos didáticos, assim como alguns sites dedicados ao tema podem ser utilizados como apoio na mediação do assunto em questão. Porém, a análise interpretativa desses instrumentos (livros e sites), apontou para uma abordagem ainda limitada a memorização e no acúmulo de informações de caráter descritivo e classificatório, contrapondo as orientações contidas nos PCNEM e as Orientações Curriculares do ensino Médio. Destarte, as limitações teórico-práticas observadas nesses instrumentos frente ao ensino da química, se encerram na racionalidade instrumental (NOVIKOFF et al., 2009) esvaziando o potencial reflexivo e conceitual que a Tabela Periódica poderia nos oferecer. Essa deficiência temática e entorvos metodológicos observados em parte dos livros e sites analisados sinalizam para a necessidade do desenvolvimento de materiais didático de apoio ao ensino da Tabela Periódica, tal como a T Wanc®©. Segundo a avaliação dos seis professores participantes da pesquisa, a T Wanc®© permite a discussão de temas, tais como saúde, meio ambiente e alimentação, de maneira simples, além de relacionar a Química com outras ciências, como por exemplo, a Biologia, Geografia, Geologia e Ecologia, ainda podendo servir como material de apoio às aulas de química, em especial quando do tratamento do conteúdo Tabela Periódica. Os ajustes e sugestões apontados pela equipe de avaliação, não invalidaram o potencial da T Wanc®© como recurso de ensino, pelo contrário possibilitou a introdução de melhorias significativas ao aplicativo. 109 Acredita-se que os recursos utilizados na construção da T Wanc®© poderão ser empregados pelos professores na criação de outras aplicações voltadas ao ensino da química e certamente, nessa linha de raciocínio os recursos de informática hoje disponibilizados a esses profissionais poderão ser melhor aproveitados em prol do ensino de Química. Como continuidade desse projeto, sugere-se aplicá-lo em escolas da Rede Pública ou Particular de Ensino. Para esse momento, propõem-se a realização de dois testes de múltipla escolha contendo questões nos moldes do Exame Nacional do Ensino Médio (ENEM). A primeira avaliação teria um caráter diagnóstico, cujo propósito seria aferir o conhecimento dos alunos e a segunda verificar os avanços conseguidos com a utilização da T Wanc®©. Propõe-se também a adaptação da tabela para deficientes visuais, bem como o desenvolvimento de cursos de capacitação de professores de Ensino Médio no uso do Microsoft Excel para desenvolvimento de aplicações para o ensino da Química. Consoante ao exposto acredita-se que todos os objetivos estabelecidos nessa pesquisa foram atendidos, como também todas as questões levantadas foram respondidas. 110 REFERÊNCIAS BIBLIOGRÁFICAS ACS. ACS Chemistry for Life. 2007. Disponível <http://acswebcontent.acs.org/games/pt.html>. Acesso em 30 Jan. 2009. em: AMABIS, José Mariano; MARTHO, Gilberto Rodrigues. Fundamentos da Biologia Moderna. 4. ed. São Paulo: Moderna, 2006. AQUINO, Jane Ferreira de. Guia Prático de Excel 2007. 1. ed. São Paulo: Normad, 2007 ATKINS, Peter. Moléculas. Tradução Paulo Santos e Fernando Galembeck. São Paulo: EDUSP, 2000. BABOR, Joseph A.; AZNÁREZ, José Ibarz. Química General Moderna: una introducción a la Química Física y a la Química descriptiva superior (Inorgánica, Orgánica y Bioquímica). 8. ed. Barcelona: Marín, 1974. BAIRD, Colin. Química Ambiental. 2. ed. Porto Alegre: Bookman, 2002. BALCHIN, Jon. Ciência: 100 Cientistas que Mudaram o Mundo. Tradução Lucia Sano. São Paulo: Madras, 2009. BANKS, Alto J. et al. Periodic Table Live! 2004. Disponível <http://genchem.chem.wisc.edu/lab/PTL/PTL.htmll>. Acesso em: 5 Jan. 2009. em: BARBALANCE, Kenneth. Environmental Chemistry Periodic Table of Elements. 2009. Disponível em: <http://environmentalchemistry.com/yogi/periodic/>. Acesso em: 26 Jan. 2009. BASTOS, João Luiz Dornelles; DUQUIA, Rodrigo Pereira. Tipos de dados e formas de apresentação na pesquisa clínico-epidemiológica. Scientia Medica. n. 3. v. 16. jul./set. 2006. Disponível em: <http://revistaseletronicas.pucrs.br/ojs/index.php/scientiamedica/article/view/1915/1420>. Acesso em: 01. Dez. 2009. BELTRAN, Nelson; CISCATO, Carlos. Química. 2. ed. São Paulo: Cortez, 1991. 111 BENVENUTTI, Edilson Valmir. Química Inorgânica: átomos, moléculas, líquidos e sólidos. 2. ed. Porto Alegre: UFRGS, 2006. BENTOR, Yinon. Chemical Elements Interactive Periodic Table of the Elements. 2008. Disponível em: <http://www.chemicalelements.com/>. Acesso em: 28 Dez. 2008. BERGIER, Jacques. Os Impérios da Química Moderna. São Paulo: Hemus, 1973. BIANCHI, J. et al. Universo da Química. 1ed; São Paulo: FTD, 2005. BÍBLIA. Velho e Novo Testamento. Tradução João Ferreira de ALMEIDA. Rio de Janeiro: Imprensa Bíblica Brasileira, 1990. BRAGA, Benedito et al. Introdução à Engenharia Ambiental: o desafio do desenvolvimento sustententável. 2. ed. São Paulo: Peason Prentice Hall, 2005. BRANCO, Samuel Murgel. O Meio Ambiente em Debate. 3. ed. São Paulo: Moderna, 2004. BRASIL. Lei de Diretrizes e Bases da Educação Nacional. Lei no 9.394, de 20 de dezembro de 1996. Disponível em: <http://portal.mec.gov.br/seed/arquivos/pdf/tvescola/leis/lein9394.pdf>. Acesso em: 07 Set. 2008. ______. Ministério da Educação (MEC), Secretaria de Educação Média e Tecnológica. PCN + Ensino médio: orientações educacionais complementares aos Parâmetros Curriculares Nacionais Ciências da Natureza, Matemática e suas Tecnologias. 2002. Disponível em: <http://portal.mec.gov.br/seb/arquivos/pdf/CienciasNatureza.pdf>. Acesso em: 07 Set. 2008. ________. Ministério da Educação (MEC), Secretaria de Educação Média e Tecnológica (Semtec). Parâmetros Curriculares Nacionais para o Ensino Médio. 1999. Disponível em: <http://portal.mec.gov.br/seb/arquivos/pdf/ciencian.pdf>. Acesso em: 02 Nov 2008 ______. Ministério da Educação e Cultura (MEC). Resolução CEB Nº 3, de 26 de Junho de 1998. Disponível em: <http://portal.mec.gov.br/cne/arquivos/pdf/rceb03_98.pdf>. Acesso em: 08 Set. 2008 ______. Ministério da Educação e Cultura (MEC), Secretaria de Educação Básica (SEB). Orientações Curriculares para o Ensino Médio (Ciências da Natureza, Matemática e suas Tecnologias). 2006. Disponível em: <http://portal.mec.gov.br/seb/arquivos/pdf/book_volume_02_internet.pdfr>. Acesso em: 7 Set. 2008. ______.Química: catálogo do Programa Nacional do Livro para o Ensino Médio PNLEM/2008. Fundo Nacional de Desenvolvimento da Educação Secretaria de Educação Básica. Brasília: Ministério da Educação, Secretaria de Educação Básica, 2007. 112 BRIAN D, Adams. Interactive Periodic Table. 2006. Disponível <ttp://www.touchspin.com/chem/DisplayTable.html>. Acesso em: 11 Jan. 2008. em: BROWN, Theodore, LEMAY, Eugene e BURSTEN, Bruce. Química Ciência Central. Tradução orácio MACEDO. Rio de Janeiro: LTC, 1999. BRYSON, Bill. Breve História de Quase Tudo. São Paulo: Companhia das Letras, 2005. BURSZTYN, Marcel; PERSEGONA, Marcelo. A Grande Transformação Ambiental: uma cronologia da dialética homem-natureza. Rio de Janeiro: Garamond, 2008. CANTO, E; PERUZZO, F. Química na Abordagem do Cotidiano. 2. ed. São Paulo: Moderna, 2003. CARLOS, Jairo Gonçalves. Interdisciplinaridade no Ensino Médio: desafios e potencialidades. 2007. 171 f. Dissertação (Mestrado Profissionalizante em Ensino de Ciências) Universidade de Brasília. 2007. Disponível em: <http://repositorio.bce.unb.br/bitstream/10482/2961/1/2007_JairoGoncalvesCarlos.pdf.> Acesso em: 17 Abr 2009. CARMONA, Tadeu.Universidade VBA. São Paulo: Digerati Books, 2006. CARREIRA, Wanderley; PINTO, Wilma. "Química em Geral" a partir da Tabela Periódica no Microsof Excel: uma estratégia para o ensino da química na educação básica. 2009. Disponível em: <http://ensciencias.uab.es/congreso09/numeroextra/art-1977-1980.pdf>. Acesso em: 03 Jan. 2010. CDCC. Tabela do Centro de Divulgação Científica e Cultural da USP. 2008. Disponível em: <http://www.cdcc.sc.usp.br/quimica/tabelaperiodica/tabelaperiodica1.htm>. Acesso em: 27 Jan. 2009. CHAGAS, Aécio Pereira. Como se Faz Química: uma reflexão sobre a química e a atividade do químico. 2. ed. São Paulo: Unicamp, 1992. CHEMICOOL. Chemicool Periodic Table. <http://www.chemicool.com/>. Acesso em: 20 Dez. 2008. 2008. Disponível em: CHASSOT, Attico. A Ciência Através dos Tempos. 2. ed. São Paulo: Moderna, 2004. ______. Da Química Às Ciências: um caminho ao avesso. In: ROSA, Maria Inês Petrucci; ROSSI, Adriana Vitorino. Educação Química no Brasil: memórias, políticas e tendências. Campinas: Átomo, 2008. cap. 10, p. 217-234. ______. A Educação no Ensino de Química. Ijuí: Unijuí, 1990. 113 ______. Alfabetização Científica: questões e desafios para a educação. 2. ed. Ijuí: Unijuí, 2001. CHRISPINO, Alvaro. O Que é Química. 3. ed. São Paulo: Brasiliense, 1994. CORROSION SOURCE. Corrosion Source Periodic Table of Elements. 2000. Disponível em: <http://www.corrosionsource.com/handbook/periodic/>. Acesso em: 12. Dez. 2008. COTTON, F. Albert; LYNCH, Lawrence; MACEDO, Horácio. Curso de Química. v. 3 [S. l.]: Fórum, 1968. CRESWELL, John. Projeto de Pesquisa: métodos qualitativo, quantitativo e misto. Porto Alegre: Artmed, 2007. DALLACOSTA, Adriana; FERNANDES, Anita Maria da Rocha; BASTOS, Rogério Cid. Desenvolvimento de um Software Educacional para O Ensino de Química Relativo à Tabela Periódica. 1998. IV Congresso da Rede Iberoamericana de Informática Educativa. Disponível em: <http://www.niee.ufrgs.br/ribie98/TRABALHOS/160.PDF>. Acesso em: 02 Nov. 2008. DAYAH, Michael. Michael Dayah’s Periodic Table of Elements. 2008. Disponível em: <http://www.dayah.com/periodic/>. Acesso em: 07 Dez. 2008. DEL REY, Mario. Tudo Sobre Diamantes. Barueri: Disal, 2009. DOWBOR, Ladislau. Tecnologias do Conhecimento: os desafios da educação. 3. ed. Rio de Janeiro: Vozes, 2001. DURAND, Marie-Françoise et al. Atlas da Mundialização: compreender o espaço contemporâneo. Tradução Carlos Roberto Sanches Milani. São Paulo: Saraiva, 2009. EICHLER, Marcelo e DEL PINO, José Claudio. Computadores em Educação Química: estrutura atômica e tabela periódica. 2000. São Paulo: Química Nova. Dez. 2000. v. 23. n. 6. Disponível em: <http://www.scielo.br/pdf/qn/v23n6/3542.pdf>. Acesso em: 01 Fev. 2009. ENCHEVERRIA, Agustina; MELLO, Irene Cristina; GAUCHE, Ricardo. O Programa Nacional do Livro Didático de Química No Contexto da Educação Brasileira. In: ROSA, Maria Inês Petrucci; ROSSI, Adriana Vitorino. Educação Química no Brasil: Memórias, Políticas e Tendências. São Paulo: Átomo, 2008.cap. 3, p. 63 - 84. FARIAS, Robson. História da Alquimia. Campinas: Átomo, 2007. FELTRE, R. Química. 6. ed. São Paulo: Moderna, 2005. FERNANDES, Maria Luiza Machado. O Ensino de Química e o Cotidiano. Curitiba: Ibpex, 2007. 114 FILGUEIRAS, Carlos A. L. A Revolução Química de Lavosier: Uma Verdadeira Revolução? São Paulo: Química Nova. 1995. v. 18. n. 2. Disponível em: <http://quimicanova.sbq.org.br/qn/qnol/1995/vol18n2/v18_n2_14.pdf>. Acesso em: 25 Dez. 2009. FLUKE, E. New Notations In The Periodic Table. Pure & Appl. Chem. v. 60. n. 3. p. 431436. 1988. Disponível em: <http://www.iupac.org/publications/pac/1988/pdf/6003x0431.pdf>. Acesso em: 15 Nov 2009. FOLHA UNIVERSAL. Folha Universal, Rio de Janeiro, 21 Fev. 2010, Caderno Geral. p. 13 FRANCO, Guilherme. Tabela de Composição dos Alimentos. 9. ed. São Paulo: Atheneu, 2008. FRANSCISCHETT, Mafalda Nesi. O Entendimento da Interdisciplinaridade No Cotidiano. 2005. Disponível em: <http://www.bocc.uff.br/pag/francishett-mafaldaentendimento-da-interdisciplinaridade.pdf>. Acesso em: 02 Nov 2009. FURTADO, Peter. 1001 Dias que Abalaram o Mundo. Rio de Janeiro: Sextante, 2009. G1. Saiba Mais Sobre a Estrutura da Tabela Periódica. 2009b. Disponível em: <http://video.globo.com/Videos/Player/Noticias/0,,GIM1150175-7823SAIBA+MAIS+SOBRE+A+ESTRUTURA+DA+TABELA+PERIODICA,00.html>. Acesso em: 01 de Dez de 2009. ______. Conheça os Elementos Químicos que Compõem a Tabela Periódica. 2009a. Disponível em: <http://video.globo.com/Videos/Player/Noticias/0,,GIM1076936-7823CONHECA+OS+ELEMENTOS+QUE+COMPOEM+A+TABELA+PERIODICA,00.html>. Acesso em: 01 Dez 2009. GABINIL, Wanderlei Sebastião; DINIZ, Renato Eugêneo da Silva. A Experiência de um Grupo de Professores Envolvendo Ensino de Química e Informática. Ensaio. Jul. 2007. Disponível em: <http://www.fae.ufmg.br/ensaio/>. Acesso em: 20 Nov. 2008 GAGNON, Steve. It's Elemental: The Periodic Table of Elements. 200X. Disponível em: <http://education.jlab.org/itselemental/index.html>. Acesso em: 2 Jan. 2010. GARRITZ, A.; CHAMIZO, J. A. Química. Wilmington: Addison-Weslley Iberoamericana, 1994. GENERALIC, Eni. Eni Generalic Periodic Table of the Elements. 2008. Disponível em: <http://www.ktf-split.hr/periodni/en/index.html>. Acesso em 20 Jan. 2009. GIFFORD, Clive. Guia Essencial de Química. Lisboa: Presença, 1994. GLEISER, Marcelo. Mundos Invisíveis. São Paulo: Globo, 2008. 115 HARRIS, Daniel C. Análise Química Quantitativa. 7. ed. Rio de Janeiro: LTC, 2008. HAVEN, Kendall. As 100 Maiores Descobertas Científicas de Todos os Tempos. Tradução Sergio Viotti. 2. ed. São Paulo: Ediouro, 2008. HERLIHY, Barbara; MAEBIUS, Nancy. Anatomia e Fisiologia do Corpo Humano Saudável e Enfermo. Tradução Edson Aparecido Liberti. São Paulo: Manole, 2002. HEWITT, Paul. Física Conceitual. 9. ed. Tradução Triesti Freire Ricci e Maria Helena Gravina. Porto Alegre: Bookman, 2002. HILL, Lewis. Segredos da Propagação de Plantas. Tradução: Jusmar Gomes. São Paulo: Nobel, 1996. HINES, Eric. Resumão Meteorologia. Série de Geociência. n. 3. Tradução Maria Ignez T. França. São Paulo: Barros, Fisher & Associados, 2009. HINRICHS, Roger; KLEINBACH, Merlin. Energia e Meio Ambiente. 3. ed. Tradução Flávio Maron Vichi e Leonardo Freire Mello. São Paulo: Pioneira Thomson Learning, 2003. INEP. Educacenso. Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira. 2009 Disponível em: <http://www.inep.gov.br/basica/censo/Escolar/Matricula/censoescolar_2009.asp?metodo=1& ano=2009&UF=RIO+DE+JANEIRO&MUNICIPIO=&Submit=Consultar>. Acesso em: 31 Dez 2009. IUPAC. Periodic Table Of Elements. 2007. Disponível <http://www.iupac.org/reports/periodic_table/>. Acesso em: 25 Dez. 2009. em: ______. About IUPAC. Disponível em: <http://old.iupac.org/general/about.html>. Acesso em: 15 Fev. 2010. JUCÁ, Sandro César. A Relevância dos Softwares Educativos na Educação Profissional. Ciência & Cognição. v. 8. 2006. Disponível em: <http://www.cienciaecognicao.org>. Acesso em: 12 Out. 2008. KOTZ, John; TREICHEL, Paul. Química e Reações Químicas. Tradução Horácio Macedo. 3. ed. v. 1. Rio de Janeiro: LTC, 1998. KROGT, Peter van der. Elementymology & Elements Multidict. 2009. Disponível em: <http://www.vanderkrogt.net/elements/>. Acesso em: 10 Jan. 2009. KUHN, Thomas Samuel. A Estrutura das Revoluções Científicas. Tradução Beatriz Vianna Boeira e Nelson Boeira. São Paulo: Perspectiva, 2007. 116 LEACH, Mark R. The Chemogenesis Web Book. 2009. Disponível em: <http://www.metasynthesis.com/webbook/01_intro/intro.html>. Acesso em: 28 Fev. 2009. LENZI, Ervim; FAVERO, Luzia Otilia Bortotti. Introdução à Química da Atmosfera: ciência, vida e sobrevivência. Rio de Janeiro: LTC, 2009. LEPREVOST, Alsedo. Minerais Para a Indústria. Rio de Janeiro: LTC, 1978. LEVINE, David; BERENSON, Mark; STEPHAN, David. Estatística: Teoria e aplicações Usando o Microsoft Excel em Português. Rio de Janeiro: LTC, 2000. LIDE, Daniel R. CRC Press Periodic Table Online. 2005. Disponível em: <http://www.chemnetbase.com/periodic_table/per_table.html>. Acesso em: 12 Dez. 2008 LING, Louis J. et al. Segredos em Toxicologia. Porto Alegre: Artmed, 2005. LÜCK, H. Ação Integrada: administração, supervisão e orientação educacional. 25. ed. Petrópolis: Vozes, 2007. MAGALHÃES, Mariza. Técnicas Criativas para Dinamizar Aulas de Química. Niterói: Muiraquitã, 2002. MAIA, Daltamir Justino; BIANCHI, J. C. de A. Química Geral Fundamentos. São Paulo: Person Prentice Hall, 2007. MARTINS, Jader Benuzzi. A História do Átomo de Demócrito aos quarks. Rio de Janeiro: Ciência Moderna, 2001. MASTERTON, William; HURLEY, Cecile. Chemistry: Principles & Reactions. Orlando: Saunders College, 1989. MATEUS, Alfredo. Química na Cabeça. Belo Horizonte: UFMG, 2001. MELLOR, J. W. Química Inorgânica Moderna. 3. ed. Tradução Alcides Caldas. Porto Alegre: Globo, 1955. MENEZES, Ebenezer Takuno de; SANTOS, Thais Helena dos. 2002. Dicionário Interativo da Educação Brasileira. 2002. Disponível em: <http://www.educabrasil.com.br/eb/dic/dicionario.asp>. Acesso em: 01 Fev 2010 MERCK. Merck Periodic Table Of The Elements 2.0. [200?]. Disponível em: <http://pse.merck.de/merck.php>. Acesso em: 10 Fev. 2009. MICROSOFT. Microsoft On Line. Disponível em: <http://office.microsoft.com/ptbr/suites/FX101674081046.aspx>. 2009. Acesso em: 1 Abr. 2009. 117 MORAN, José Manuel; MASETTO, Marcos T.; BEHRENS, Marilda Aparecida. Novas Tecnologias e Mediação Pedagógica. 13. ed. Campinas, SP: Papirus, 2007.MORTMER, F; MACHADO, A. Química. 1 ed. São Paulo: Scipione, 2005. MOSELEY, Henry G. J. The High Frequency Spectra of the Elements. 1913. Disponível em: <http://www.chemistry.co.nz/henry_moseley_article.htm>. Acesso em: 15 Fev. 2010. NARCISO JR, Jorge; JORDÃO, Marcelo. Tabela Periódica: não decore isso. São Paulo: Do Brasil, 2000. NASA. Genesis Education: Modeling the Periodic Table Interactive Simulation. [200?]. Disponível em: <http://genesismission.jpl.nasa.gov/educate/scimodule/cosmic/ptable.html>. Acesso em: 26 Dez. 2008. NEVES, Luiz Seixas; FARIAS, Robson Fernandes. História da Química. Campinas: Átomo, 2008. NIST. NIST Elemental Data Index. 2005. <http://www.nist.gov/physlab/data/edi.cfm>. Acesso em 1. Dez. 2008. Disponível NIST WEBBOOK. CAS Number Search. 2008. Disponível <http://webbook.nist.gov/chemistry/cas-ser.html>. Acesso em: 15 Mar. 2009 em: em: NOBREGA, O. et al. Química. 1. ed.São Paulo: Ática, 2005. NOELS, Ivan. Mokeur’s Periodic Table. <http://profmokeur.ca/chemistry/>. Acesso em: 13 Jan. 2009. 2009. Disponível em: NOVIKOFF, Cristina et al. As Racionalidades nos Programas de Mestrado Profissional em Ensino de Ciências. Simpósio Nacional de Ensino de Ciência e Tecnologia. Ponta Grossa: Universidade Tecnológica do Paraná, 2009. NOVIKOFF, Cristina. Mapa conceitual de pesquisa científica (Material de aula). [Duque de Caxias]: UNIGRANRIO, 2007. OBSERVATÓRIO NACIONAL. Grandes Descobertas Precursoras. 2010. Disponível em: <http://www.on.br/site_edu_dist_2008/site/conteudo/modulo1/6grandes_descobertas_precursoras/descobertas.html>. Acesso em: 14 Fev. 2010 ______. Cosmologia Grega. 2009. Disponível <http://www.on.br/site_edu_dist_2008/site/conteudo/modulo1/2-cosmologia-grega/6platao.html>. Acesso em: 15 Dez. 2009 ODUM, Eugene. Ecologia. Tradução Christopher Tribe. Rio de Janeiro: Guanabara, 1988. em: 118 OIT. Metales: Propriedades Químicas y Toxicidad. Enciclopedia de Salud y Seguridad del Trabajo. [200?]. Disponível em <http://www.mtas.es/es/publica/pub_electronicas/destacadas/enciclo/general/contenido/tomo2 /63.pdf>: Acesso em: 20 Set. 2008. PAULING, Linus. Química Geral. Rio de Janeiro: Ao Livro Técnico, 1967. PEREIRA, Júlio Cesar Rodrigues. 2004. Análise de Dados Qualitativos: Estratégias Metodológicas para as Ciências da Saúde Humanas e Sociais. São Paulo: Edusp, 2004. POLO, Pascual Román. Historia de La Química: El Congreso de Karlsruhe y Sus Personajes. Anales de la Real Sociedad Española de Química. v. 96. n. 4. 2000. Disponível em: <http://dialnet.unirioja.es/servlet/fichero_articulo?codigo=866736&orden=89285> Acesso em: 01 Mar. 2009. PUCKETT, Jim et al. Exporting Harm: The High-Tech Trashing of Asia. [S. l.]: BAN, SVTC, 2002. Disponivel em: <http://www.ban.org/E-waste/technotrashfinalcomp.pdf>. Acesso em: 05 Jan. 2009. QIVTX. Integral Scientist Modern Standard Periodic Table. 2003. Disponível em: <http://www.qivx.com/ispt/ptw_st.php>. Acesso em: 05 Jan. 2009. RADIOCHEMISTRY SOCIETY. Radiochemistry Society Periodic Table of the Elements. [200?]. Disponível em: <http://www.radiochemistry.org/periodictable/index.shtml>. Acesso em: 30 Dez. 2008. REMBAR. Rembar Periodic Table of the Elements. 1996. <http://www.rembar.com/PeriodicTable.htm>. Acesso em: 23 Dez. 2009. Disponível em: ROGERS, Peter. Preparando-se para Enfrentar a Crise da Água. [S. l]: Scientific American Brasil. p. 60-67. Set. 2008. RSC. Visual Elements Periodic Table. [200?]. Disponível em: <http://www.chemsoc.org/viselements/pages/pertable_fla.htm>. Acesso em: 4 Jan. 2009. RUSSEL, Hoffman. Animated Periodic Table. [200?]. Disponível em: <http://www.animatedsoftware.com/elearning/Periodic%20Table/AnimatedPeriodicTable.swf f>. Acesso em: 14. Jan. 2009. QUADBECK-SEEGER, Hans-Jürgen. 2007. World of the Elements Elements of the Word. Tradução José Oliveira. [S. l]: Wiley-Verlag Gmb & Co.2007. QUAM, G. N.; QUAM, M. B. Types of Graphic Classifications of The Elements: Part I. 1934. Disponível em: <http://www.metasynthesis.com/webbook/35_pt/JCE_PTs_1934_short.pdf > Acesso em: 2 Jan. 2010. 119 ______. Types of Graphic Classifications of The Elements: Part II. 1934a. Disponível em: <http://www.meta-synthesis.com/webbook/35_pt/JCE_PTs_1934_medium.pdf> Acesso em: 2 Jan. 2010. ______. Types of Graphic Classifications of The Elements: Part III. 1934b. Disponível em: < http://www.meta-synthesis.com/webbook/35_pt/JCE_PTs_1934.pdf> Acesso em: 2 Jan. 2010. ROSMORDUC, Jean. Uma História da Física e da Química: de Tales a Einstein. Rio de Janeiro: Jorge Zahar, 1988. SACKHEIM, George; LEHMAN, Dennis. Química e Bioquímica para Ciências Biomédicas. 8. ed. São Paulo: Manole, 2001. SANTOS, Raul Dias dos. Derrube o Coleterol! São Paulo: Abril, 2008. SANTOS, W. et al. Química e Sociedade. Projeto de Ensino de Química e Sociedade. ed. São Paulo: Nova Geração, 2005. SARIEGO, José. As Ameaças ao Planeta Azul. São Paulo: Scipione, 1994. SCARLATO, Francisco; PONTIN, Joel. Do Nicho ao Lixo: ambiente, sociedade e educação. São Paulo: Atual, 1992. SCERRI, Eric R. The Periodic Table: Its Story and Its Significance. Oxford: Oxford University, 2007. SCHUMANN, Walter. Gemas do Mundo. Barueri: Disal, [200?]. SCIENTIFIC AMERICAN. A Ciência na Antiguidade. Scientific American. v. 3. p. 64-70. [200?]. SÉRGIO FRANCO MEDICINA DIAGNÓSTICA. Bioinforme. 7. ed. Rio de Janeiro, 2006. SHEREVE, R. N.; BRINK JR, J. A. Indústrias de Processos Químicos. Rio de Janeiro: LTC, 2008. SILVERTHORN, Dee Unglaub. Fisiologia Humana: uma abordagem integrada. 5. ed. Porto Alegre: Artmed, 2010. SMITH, Collen; MARKS, Allan; LIEBERMAN, Michael. Bioquímica Médica Básica de Marks. 2. ed. Tradução Ângela de Mattos Dutra.. Porto Alegre: Artmed, 2007. SOUZA, Sérgio Augusto de. Composição Química dos Aços. São Paulo: Edgard Blücher, 1989. 120 SPRENGER, Marilee. Memória: como ensinar para o aluno lembrar. Tradução Magda França Lopes. Porto Alegre: Artmed, 2008. STRATHERN, Paul. O Sonho de Mendeleiev: a verdadeira história da química. Tradução Maria Luiza Borges. Rio de Janeiro: Jorge Zahar, 2002. SUBMARINO. Informática. Disponível em: <http://www.submarino.com.br/produto/12/1862064/office+2007+home+e+student+3+usuari os+-+microsoft>. Acesso em: 10 Jan. 2010. TABELA PERIÓDICA ONLINE. Tabela Periódica Online. 2008. Disponível em: <http://www.tabela.oxigenio.com>. Acesso em: 19 Dez. 2008. TEIXEIRA, Wilson et al. Decifrando a Terra. São Paulo: Companhia Editora Nacional, 2009. TOLENTINO, Mario; ROCHA-FILHO, Romeu C; CHAGAS, Aécio Pereira. Alguns Aspectos Históricos da Classificação Periódica dos Elementos Químicos. São Paulo: Química Nova. 1997. v. 20. n 1. Disponível em: <http://www.scielo.br/pdf/qn/v20n1/4922.pdf> Acesso em: 31 Dez. 2008. TOMA, Henrique Eisi. Química Bioinorgânica. São Paulo: USP, 1984. TORREIRA, Raúl Perrgallo. Manual de Segurança Industrial. São Paulo: Margus, [199?]. TORTORA, Gerard; GRABOWSKI, Sandra. Corpo Humano: Fundamentos de Anatomia e Fisiologia. 6.ed. Tradução Maria Regina Borges-Osório. Porto Alegre: Artmed, 2006. TRINDADE, Diamantino; PUGLIESI, Marcio. Química Básica Teórica. São Paulo: Ícone, 1989. TROMBLEY, Linda. Mastering The Periodic Table. Maine: Walch, 2000. UZINIAN, Armênio; BIRNER, Ernesto. Biologia. Volume único 3. ed. São Paulo: Harbra, 2008.VAISTMAN, Delmo Santiago; AFONSO, Júlio Carlos; DUTRA, Paulo Bechara. Para que Servem os Elementos Químicos. Rio de Janeiro: Interciência, 2001. VANIN, José Atílio. Alquimistas e Químicos: o passado, o presente e o futuro. 2. ed. São Paulo: Moderna, 2005. VIANNA, Marcos Rocha. 2001. Casas de Química para Estações de Tratamento de Água. 2. ed. Belo Horizonte: Imprimatur Artes, 2001. VANOVSCHI, Vitalii. WebQc Periodic Table of Chemical Elements. 2008. Disponível em: <http://www.webqc.org/periodictable.php>. Acesso em: 16 Dez. 2009. 121 VISUALENTITIES. Visualentities Periodic Table 2.0. [200?]. Disponivel <http://www.visualentities.com/applets/periodictable.htm>. Acesso em: 27 Dez. 2008. em. WHITNEY, Ellie; ROLFES, Sharon Rady. Nutrição 1: 10. ed. v. 1. Entendendo os nutrientes. Tradução All Tasks. São Paulo: Cengage Learning, 2008. WHIZZY, David. David’s Whizzy Periodic Table. [199?]. Disponível <http://www.colorado.edu/physics/2000/applets/a2.html>. Acesso em: 20 Dez. 2008. em: WIKIPEDIA. Wikipedia. 2008. Disponível <http://pt.wikipedia.org/wiki/Tabela_peri%C3%B3dica>. Acesso em: 31 Dez. 2009. em: WINTER, Mark. Webelements. 2009. Disponível em: <http://www.webelements.com/>. Acesso em: 19 Mar. 2009. ZANON, Lenir Basso. Tendências Curriculares no Ensino de Ciências/Química: um olhar para a contextualização e a interdisciplinaridade como princípios da formação escolar. In: ROSA, Maria Inês Petrucci; ROSSI, Adriana Vitorino. Educação Química No Brasil. São Paulo: Átomo, 2008. cap. 11, p. 235 - 262. Apêndice A: Tabela Periódica dos elementos segundo a IUPAC 122 Fonte: (IUPAC, 2009) 3500 a. C até 476 1400 1410 1420 1430 1440 1450 1453 1460 1470 1480 1490 1500 1510 1520 1530 1540 1550 1560 1570 1580 1590 1600 1610 1620 1630 1640 1650 1660 1670 1680 1690 1700 1710 1720 1730 1740 1750 Década Ni, Mg, Bi, Zn Co, Pt P As Au, Ag, Cu, Fe, Sn, Pb, Sb, Hg, S, C Elemento Identificado na Década --x-- Século Lançadeira volante Destruição dos Incas Colombo chega a América Cabral chega ao Brasil Reforma religiosa Destruição dos Astecas Capitanias hereditárias Primeriro livro impresso Queda de Constantinopla Escola de Sagres Alguns Acontecimentos Históricos na Década 1735: Classificação da natureza (Carolus Linnaeus) 1752: Natureza da eletricidade 1785: Lei da força elétrica 1796: Vacina contra varíola 1799: Pilha voltaica 1610: Galileu descobre as quatro luas de Júptier 1640: Estudos sob pressão atmosférica 1656: Prova da existência do vácuo Algumas Contribuições Científicas No Periodo Estudo sobre o gás “fixo” – CO2 (Josepph Black) As leis de Newton O flogisto de George Stahl O Químico Cético de Robert Boyle A Terra Pinguis de Johan Becher O Novum Organum scientarum de Francis Bacon O livro Alchemia de Andreas Libavius Pierre Gassend e a divulgação do epicurismo As revoluções das orbitas celestes de Copérnico A tria prima de Paracelso 123 • Tales; • Leucipo; • Demócrito; • Epicuro; • Platão; • Aristóteles; • Lucrécio Algumas Infuências Filosóficas ou Científicas Observadas na Década Apêndice B: Linha do Tempo - elementos químicos e a Tabela Periódica XV XVI XVII XVIII Renascimento Renascimento Iluminismo • Idade antiga: 3500 a. C – 476 Gd, Pr, Nd, Ge, F, Dy Ar, He, Kr, Ne, Xe, Po, Ra, Ac Rn, Eu, Lu Pa Hf, Re, Tc Fr Np, At, Pu, Cm, Am, Pm, Bk Cf, Es, Fm, Md, No Lr, Rf, Db Sg Bh, Mt, Hs Ds, Rg, 112 Ga, Ho, Yb, Sc, Tm Cs, Rb, Tl, In, He Ti, Y Be V, Nb, Ta, Rh, Pa, Os, Ir, Ce, K, Na, B, Ca, Sr, Ru, Ba I, Th, Li, Se, Cd Si, Al, Br La Er H N, O, Cl, Mn, Ba Mo, W, Te, Zr, U Elemento Identificado na Década Século •Idade Média: 476 – 1453 Primeira Guerra Mundial A Grande Depressão Segunda Guerra Mundial Início da Guerra Fria “Corrida” espacial Inicio da Guerra do Vietnã Fim da Guerra do Vietnã Queda do Muro de Berlim Fim da Guerra Fria Crise econômica Primerio telefone Primeira lâmpada Primeiro Automóvel Abertura do Canal de Suez Máquina de costura • Idade Moderna: 1453 – 1789 1905: A relatividade de Albert Einsten 1907: Datação radioativa 1913: Os isótopos 1919: A criação da IUPAC 1925: O Princípio da Exclusão 1927: O Princípio da Incerteza 1932: O Neutron de James Chadwick 1939: A Fissão nuclear 1942: O primeiro reator nuclear 1962: Os quarks 1800: Infravermelho 1801: Ultravioleta 1806: Ligações Eletroquímicas 1811: Leid de Avogadro 1825: A lei de Ampère 1833: Leis da Eletrólise ( M. Faraday) 1864: Radiação eletromagnética 1895: Raios-X 1896: Radioatividade 1897: Raios catódicos (elétron) Revolução Industrial Corte portuguesa no Brasil Independência do Brasill Lei das fábricas Independência dos EUA Primeira ponte de ferro Revolução Francesa Algumas Contribuições Científicas No Periodo 1799: Humpry Davy demonstra as propriedades do óxido nitroso Alguns Acontecimentos Históricos na Década Fonte: Elaborado pelo autor, baseado em Babor et al (1974); Scerri (2007), Furtado (2009) e Balchin (2009). 1760 1770 1780 1789 1790 1800 1810 1820 1830 1840 1850 1860 1861 1862 1863 1864 1865 1866 1867 1868 1869 1870 1871 1876 1879 1880 1890 1900 1910 1920 1930 1940 1950 1960 1970 1980 1990 2000 2010 2020 Legenda Década XIX XX XXI 124 • Idade Contemporânea: 1789 – atualidade Glen Seaborg e os actnídeos Os gases nobres de William Ramsay, Lord Rayleigh A teoria quantica de Max Planck Henri Moseley e a releitura da lei periódica A mecânica ondulatória de Erwin Schrödinger As tabelas de Dimitri Mendeleev e Lothar Meyer As Oitavas de John Newlands A tabela de William Odling O Parafuso Telúrico de Alexandre De Chancourtois Stanislao Cannizzaro e o congresso de Karlsruhe A retomada do atomismo por John Dalton, Gay-Lussac, A hipótese de Amedeo Avogadro A simbologia proposta por Jacob Berzelius As Tríades de Döbereiner O sistema de Leopold Gmelin Algumas Infuências Filosóficas ou Científicas Observadas na Década Estudo sobre o ar “inflamável” – H2 (Henry Cavendish) O ar deflogisticado (O2) de Joseph Priestley. O Tratado Elementar de Química de Antoine Lavoisier Química Química Universo da Química Química Química na Abordagem do Cotidiano Química e Sociedade NOBREGA, O. et al BIANCHI, J. et al FELTRE, R. CANTO, E; PERUZZO, F. SANTOS, W. et al Título MORTMER, F; MACHADO, A. Autor Único Três Três Único Único Único Vol Nova Geração Moderna Moderna FTD Ática Scipione Editora Sim Sim Sim Sim Sim Sim PNLEM 125 Fonte: Elaborado pelo autor 2005 (1. ed) 2005 (1. ed) 2005 (1. ed) 2005 (6. ed) 2003 (2. ed) 2005 (1. ed) Ano (Edição) Apêndice C: Os seis livros didáticos selecionados para avaliação do conteúdo Tabela Periódica Elementos e T oxicidade Uso genérico sem discussão Elementos na Agricultura Elementos no Meio Ambiente Elementos na Informática Elementos na Alimentação Elementos na Medicina Elementos na Saúde Elementos na Atmosfera Elementos no Corpo humano Perigos e Risco dos Elementos Contraponto nas propriedades Exercícios C&I Elementos e Mineralogia ECI ECI ECI ECI ECI ECI ECI ECI ECI ECI ECI ECI ECI ECI HED HED HED HED HED HED IDC IDC IDC LCA Livro A N S N N N N N N N N N N S N S N N S N N S S S N Livro B N S N N N N N N N N N N S N N N N N N N S S S N Livro C N S N N N N N N N N N N S N N N N N N N S S S N Livro D N S N N N N N N N N N N S S N N S S N N S S S S Publicações Avaliadas Livro E N S N N N N N N N N N N S N N N N N N N S S S N Livro F N S N N N N N N N N N N S S N N N N N N S S S S Não 100% 0% 100% 100% 100% 100% 100% 100% 100% 100% 100% 100% 0% 67% 100% 0% 100% 0% 100% 0% 33% 67% 17% 83% 0% 100% 17% 83% 33% 67% 0% 100% 0% 100% 0% 100% 0% 0% 0% 0% 0% 0% 0% 0% 0% 0% 100% 33% S im Legenda: ECI: Eixo Contextualizado e Interdisciplinar; HED: Histórico e Desenvolvimento; IDC: Informações Descritivas e Classificatórias; LCA: Linguagem Cientifica Atualizada; N: Indica ausência; S: Indica presença Propriedades Periódicas Propriedades Físicas e Químcas Configuração eletrônica T abela Alinhada com a IUPAC Ano descoberta Cronologia da descoberta Descobridor Origem do nome Relação com fatos históricos T abelas anteriores Itens Avaliados Tipo Apêndice D: Matriz com os resultados da avaliação do capítulo Tabela Periódica dos seis livros didáticos 126 Inglês Inglês Inglês Inglês http://pse.merck.de/merck.php http://genchem.chem.wisc.edu/lab/PTL/PTL.html http://environmentalchemistry.com/yogi/periodic/ http://education.jlab.org/itselemental/index.html http://www.animatedsoftware.com/elearning/Periodic%20Ta ble/AnimatedPeriodicTable.swf http://www.touchspin.com/chem/DisplayTable.html http://www.physics.nist.gov/PhysRefData/Elements/cover.ht ml http://www.vanderkrogt.net/elements/ http://www.radiochemistry.org/periodictable/index.shtml http://pt.wikipedia.org/wiki/Tabela_peri%C3%B3dica Merck Periodic Table of the Elements (MERCK, [200?]) Periodic Table Live! (BANKS, et al., 2004) Environmental Chemistry Periodic Table of Elements (BARBALANCE, 2009) It’s Elemental – The Periodic Table of Elements. (GAGNON, 200X) Animated Periodic Table (RUSSEL, [200?]) Interactive Periodic Table (BRIAN D, 2006) NIST Elemental Data Index (NIST, 2005) Elementymology & Elements Multidict (KROGT, 2009) Radiochemistry Society Periodic Table of the Elements (RADIOCHEMISTRY SOCIETY, [200?]) Wikipedia (WIKIPEDIA, 2008) S3 S4 S5 S6 S7 S8 S9 S 10 S 11 S 12 127 Português Inglês Inglês Inglês Inglês Inglês Inglês http://www.chemsoc.org/viselements/pages/pertable_fla.htm Visual Elements Periodic Table (RSC, [200?]) S2 Inglês Idioma http://www.webelements.com Endereço Eletrônico WebElements Periodic Table (WINTER, 2009) Nome do site Avaliado S1 Código do Site Apêndice E: Relação dos trinta sites selecionados para avaliação http://profmokeur.ca/chemistry/ http://www.meta-synthesis.com/webbook/35_pt/pt3.html http://www.qivx.com/ispt/ptw_st.php http://www.chemicool.com/ http://www.visualentities.com/applets/periodictable.htm http://www.chemnetbase.com/periodic_table/per_table.html http://www.dayah.com/periodic/ http://www.corrosionsource.com/handbook/periodic/ http://www.colorado.edu/physics/2000/applets/a2.html http://www.iupac.org/reports/periodic_table/ Mokeur’s Periodic Table (NOELS, 2009) The Chemogenesis web book (LEACH, 2009) Integral Scientist Modern Standard Periodic Table (QIVTX, 2003) Chemi Cool Periodic Table (CHEMICOOL, 2008) VisualEntities Periodic Table 2.0 (VISUALENTITIES, [200?])t CRC Periodic Table Online (LIDE, 2005) Michael Dayah’s Periodic Table of Elementshttp://www.dayah.com/periodic (DAYAH, 2008) Corrosion Source Periodic Table of Elements (CORROSION SOURCE, 2000) David’s Whizzy Periodic Table (WHIZZY, [199?]) IUPAC Periodic Table (IUPAC, 2007) S 16 S 17 S 18 S 19 S 20 S 21 S 22 S 23 S 24 S 25 http://www.webqc.org/periodictable.php http://www.ktf-split.hr/periodni/en/index.html Eni Generalic Periodic Table of the Elements (GENERALIC, 2008) S 15 WebQC Periodic Table of Chemical Elements (VANOVSCHI, 2008) http://genesismission.jpl.nasa.gov/educate/scimodule/cosmic/ ptable.html Genesis Education: Modeling the Periodic Table Interactive Simulation (NASA, [200?]) S 14 S 26 http://www.chemicalelements.com/ Endereço Eletrônico Chemical Elements Interactive Periodic Table of the Elements (BENTOR, 2008) Nome do site Avaliado S 13 Código do Site Inglês Inglês Inglês Inglês Inglês Inglês Inglês Inglês Inglês Inglês Inglês Inglês Inglês Inglês Idioma 128 S 30 S 29 http://www.tabela.oxigenio.com Tabela Periódica Online (TABELA S 28 Inglês Português Português Inglês Idioma 129 Fonte: Elaborado pelo autor http://acswebcontent.acs.org/games/pt.html ACS Chemistry for Life (ACS, 2007) http://www.cdcc.sc.usp.br/quimica/tabelaperiodica/tabelaperi odica1.htm (CDCC, 2008) Tabela do Tabela do Centro de Divulgação Científica e Cultural da USP PERIÓDICA ONLINE, 2008) http://www.rembar.com/PeriodicTable.htm Endereço Eletrônico Rembar Periodic Table of the Elements (REMBAR, 1996) Nome do site Avaliado S 27 Código do Site 2 N N N N N N N N N N N N N N S S S S S N S S S S S N 3 N N N N N N N N N N N N N N S N S N N N S S S N N S 4 N S N N N N N N N N N N N N S N S S N N S S S S S N 5 S S S S N N N N S S S S N S S N S S N N S S S S S N 6 N S N N N N N N N N N N N N S N S S N N S S N N S N 7 N N N N N N N N N N N N N N N N N N N N S S S S S N 8 N N N N N N N N N N N N N N S N N N N N S S S S S N 9 N N N N N N N N N N N N N N N N N N N N N S N N N N 10 N N N N N N N N N N N N N N S N S S N S N N N N N N 11 N S N N N N N N N N S N N N S N S S N N S N N N N N 12 N S N N N N N N N N S N N N S N S S N N S S S N S N 13 N N N N N N N N N N N N N N S N S S N N S S N N N N 14 N N N N N N N N N N N N N N N N N N N N S S S N S N 16 N N N N N N N N N N N N N N S N S N N N S S S N S N 17 N S N N N N N N N N N N N N S S S S N S S S S S S S 18 N N N N N N N N N N S N N N S N S S N S S S S S S N 19 N N N N N N N N N N N N N N S N S S N N S S S S S S Sites Avaliados 15 N N N N N N N N N N N N N N S N S S N N N N N N N N 20 N S N N N N N N N N N N N N S S S S N N S S N N N N 21 N S N N N N N N N N N N N N N N N S N N S N N N N N 22 N S N N N N N N N N N N N S S S N N N N S S S S S S 23 S S N N N N N N N N S S S S S N S S N S S S S N N N 24 N N N N N N N N N N N N N N S N N N N N N N N N N N 25 N N N N N N N N N N N N N N S N N N N N N N N N N S 26 N N N N N N N N N N N N N N N N N N N N S S S N N N 27 N N N N N N N N N N N N N N N N N N N N S S N N N N 28 N N N N N N N N N N N N N S S N S N N N S S N N N N 29 N N N N N N N N N N N N N N N N S N N N S S N N S N 30 N N N N N N N N N N N N N N N N N N N S S S S S S N Não 83% 80% 57% 37% 53% 17% 73% 13% 63% 53% 3% 17% 17% 20% 43% 63% 47% 83% 27% 87% 37% 47% 97% 83% 7% 93% 37% 63% 3% 97% 7% 93% 0% 100% 0% 100% 0% 100% 3% 97% 7% 93% 7% 93% 20% 80% 7% 93% 3% 97% 13% 87% S im Legenda: ECI: Eixo Contextualizado e Interdisciplinar; HED: Histórico e Desenvolvimento; IDC: Informações Descritivas e Classificatórias; LCA: Linguagem Cientifica Atualizada; N: Indica ausência; S: Indica presença Propriedades Periódicas Propriedades Físicas Números de Oxidação Números Quânticos Configuração eletrônica T abela Alinhada com a IUPAC 1 N S N S N N N S S S S N N N S N S S N N S S S S S N 130 Site 1: WebElements Periodic Table; Site 2: Visual Elements Periodic Table; Site 3: Merck Periodic Table of the Elements; Site 4: Periodic Table Live!; Site 5: Environmental Chemistry Periodic Table of Elements; Site 6: It’s Elemental – The Periodic Table of Elements; Site 7: Animated Periodic Table; Site 8: Interactive Periodic Table; Site 9: NIST Elemental Data Index; Site 10: Elementymology & Elements Multidict; Site 11: Radiochemistry Society Periodic Table of the Elements; Site 12: Wikipedia; Site 13: Chemical Elements Interactive Periodic Table of the Elements; Site 14: Genesis Education: Modeling the Periodic Table Interactive Simulation; Site 15: Eni Generalic Periodic Table of the Elements; Site 16: Mokeur’s Periodic Table; Site 17: The chemogenesis web book; Site 18: Integral Scientist Modern Standard Periodic Table; Site 19: Chemi Cool Periodic Table; Site 20: Visual Entities Periodic Table Applet; Site 21: CRC Periodic Table Online; Site 22: Michael Dayah’s Periodic Table of Elements; Site 23: Corrosion Source Periodic Table of Elements; Site 24: David’s Whizzy Periodic Table; Site 25: IUPAC Periodic Table; Site 26: WebQC Periodic Table of Chemical Elements; Site 27: Rembar Periodic Table of the Elements; Site 28: Tabela Periódica Online; Site 29: Tabela do CDCC USP; Site 30: Tabela ACS. 46 Elementos e T oxicidade Uso genérico sem discussão Elementos na Agricultura Elementos no Meio Ambiente Elementos na Informática Elementos na Alimentação Elementos na Medicina Elementos na Saúde Elementos na Atmosfera Elementos no Corpo humano Perigos e Risco dos Elementos Contraponto nas propriedades Exercícios C&I Elementos e Mineralogia ECI ECI ECI ECI ECI ECI ECI ECI ECI ECI ECI ECI ECI ECI HED HED HED HED HED HED IDC IDC IDC IDC IDC LCA Ano descoberta Cronologia da descoberta Descobridor Origem do nome Relação com fatos históricos T abelas anteriores Itens Avaliados Tipo Apêndice F: Matriz com o resultado da avaliação dos sites selecionados46 Site 2 Site 8 Site 14 Site 20 Site 26 Site 1 Site 7 Site 13 Site 19 Site 25 Site 27 2 Site 1 Site 15 Site 9 Site 3 Site 28 Site 22 Site 16 Site 10 Site 4 Apêndice G: Imagem de abertura dos sites avaliados Site 29 Site 23 Site 17 Site 11 Site 5 Site 30 Site 24 Site 18 Site 12 Site 6 131 TOMA, Henrique Eisi. Química Bioinorgânica. São Paulo: USP/OEA, 1984. FRANCO, Guilherme. Tabela de Composição dos Alimentos. 9. ed. São Paulo: Atheneu, 2008. WHITNEY, Ellie; ROLFES, Sharon Rady. Nutrição 1: Entendendo os nutrientes. 10. ed. Tradução: All Tasks. Vol. 1. São Paulo: Cengage Learning, 2008. HINES, Eric. Resumão Meteorologia. Série de Geociência. n. 3. Tradução Maria Ignez T. França. São Paulo: Barros, Fisher & Associados, 2009. GLEISER, Marcelo. Poeira das Estrelas. São Paulo: Globo, 2006. TRINDADE, Diamantino, PUGLIESI, Marcio. Química Básica Teórica. São Paulo: Ícone, 1989. QUADBECK-SEEGER, Hans-Jürgen. World of the Elements Elements of the Word. Tradução: José Oliveira. Wiley-Verlag Gmb & Co. KGaA, 2007. ROSMORDUC, Jean. Uma História da Física e da Química: de Tales a Einstein. Rio de Janeiro: Jorge Zahar, 1988. TEIXEIRA, Wilson; TOLEDO, M. Cristina Motta; FAIRCHILD, Thomas Rich; TAIOLI, Fabio. Decifrando a Terra. São Paulo: Companhia Editora Nacional, 2009. SCHUMANN, Walter. Gemas do Mundo. Barueri: Disal, [200?]. Alimentação Alimentação Atmosfera Evolução da Química e a linha do tempo Evolução da Química e a linha do tempo Evolução da Química e a linha do tempo Evolução da Química e a linha do tempo Geologia Geologia HILL, Lewis. Segredos da Propagação de Plantas. Tradução: Jusmar Gomes. São Paulo: Nobel, 1996. Fundamentação teórica baseada em Agricultura Agricultura Tabela e sua relação com a (o) Apêndice H: Referências bibliográficas utilizadas na concepção da T Wanc®© 132 SHEREVE, R. N.; BRINK JR, J. A. Indústria de Processos Químicos. Rio de Janeiro: LCTC; 2008. LEPREVOST, Alsedo. Minerais Para a Indústria. Rio de Janeiro: LTC, 1978. GIFFORD, Clive. Guia Essencial de Química. Lisboa: Pesença, 1994. SOUZA, Sergio Augusto. Composição Química dos Aços. São Paulo, Edgard Blucher, 1989. VAISTMAN, Delmo Santiago; AFONSO, Júlio Carlos; DUTRA, Paulo Bechara. Para que Servem os Elementos Químicos. Rio de Janeiro: Interciência, 2001. BAIRD, Colin. Química Ambiental. 2. ed. Porto Alegre: Bookman, 2002. BRAGA, Benedito et al. Introdução à Engenharia Ambiental: o desafio do desenvolvimento sustententável. 2. ed. São Paulo: Peason Prentice Hall, 2005. BRANCO, Samuel Murgel. O Meio Ambiente em Debate. 3. ed. São Paulo: Moderna, 2004. SCARLATO, Francisco, PONTIN, Joel. Do Nicho ao Lixo: ambiente, sociedade e educação. São Paulo: Atual, 1992. SARIEGO, José. As Ameaças ao Planeta Azul. São Paulo: Scipione, 1994 ROGERS, Peter. Preparando-se para Enfrentar a Crise da Água. [S. l]: Scientific American Brasil. p. 6067. Set. 2008. Indústria Indústria Indústria Indústria Meio Ambiente Meio Ambiente Meio Ambiente Meio Ambiente Meio-Ambiente Meio Ambiente FURTADO, Peter. 1001 Dias que Abalaram o Mundo. Rio de Janeiro: Sextante, 2009. DEL REY, Mario. Tudo Sobre Diamantes. Barueri: Disal, 2009. Fundamentação teórica baseada em Indústria História Geologia Tabela e sua relação com a (o) 133 AMABIS, José Mariano; MARTHO, Gilberto Rodrigues. Fundamentos da Biologia Moderna. 4. ed. São Paulo: Moderna, 2006. UZINIAN, Armênio; BIRNER, Ernesto. Biologia. Volume único. 3. ed. São Paulo: Harbra, 2008. BURSZTYN, Marcel; PERSEGONA, Marcelo. A Grande Transformação Ambiental: uma cronologia da dialética homem-natureza. Rio de Janeiro: Garamond, 2008. DURAND, Marie-Françoise et al. Atlas da Mundialização: compreender o espaço contemporâneo. Tradução Carlos Roberto Sanches Milani. São Paulo: Saraiva, 2009. TORTORA, Gerard; GRABOWSKI, Sandra. Corpo Humano: Fundamentos de Anatomia e Fisiologia. 6.ed. Tradução: Maria Regina Borges-Osório. Porto Alegre: Artmed, 2006. HERLIHY, Barbara, MAEBIUS; Nancy. Anatomia e Fisiologia do Corpo Humano Saudável e Enfermo. Tradução: Edson Aparecido Liberti. São Paulo: Manole, 2002. SACKHEIM, George; LEHMAN, Dennis. Química e Bioquímica para Ciências Biomédicas. 8. ed. São Paulo: Manole, 2001. SÉRGIO FRANCO MEDICINA DIAGNÓSTICA. Bioinforme. 7. ed. Rio de Janeiro, 2006. SMITH, Collen; MARKS, Allan; LIEBERMAN, Michael. Bioquímica Médica Básica de Marks. 2. ed. Edição: Ângela de Mattos Dutra. Porto Alegre: Artmed, 2007. SILVERTHORN, Dee Unglaub. Fisiologia Humana: uma abordagem integrada. Porto Alegre: Artmed, 2010. LING, Louis J. et al. Segredos em Toxicologia. Porto Alegre: Artmed, 2005. OIT. Metales: Propriedades Químicas y Toxicidad. OIT. [200?]. TORREIRA, Raúl Peragallo. Manual de Segurança Industrial. Margus Publicações, [199?]. PUCKETT, Jim et al. Exporting Harm: The High-Tech Trashing of Asia. [S. l.]: BAN, SVTC, 2002. Meio Ambiente Meio-Ambiente/Histórico Meio-Ambiente/Histórico Saúde Saúde Saúde Saúde Saúde Saúde Toxicologia Toxicologia Toxicicologia Toxicologia e Tecnologia da Informação Fundamentação teórica baseada em Meio Ambiente Tabela e sua relação com a (o) 134 WHITNEY, Ellie, e Sharon Rady ROLFES. Nutrição 1: Entendendo os nutrientes. 10. ed. Tradução: All Tasks. Vol. 1. São Paulo: Cengage Learning, 2008. HINES, Eric. Resumão Meteorologia. Série de Geociência. n. 3. Tradução Maria Ignez T. França. São Paulo: Barros, Fisher & Associados, 2009. GLEISER, Marcelo. Poeira das Estrelas. São Paulo: Globo, 2006. TRINDADE, Diamantino, e Marcio PUGLIESI. Química Básica Teórica. São Paulo: Ícone, 1989. QUADBECK-SEEGER, Hans-Jürgen. World of the Elements Elements of the Word. Tradução: José Oliveira. Wiley-Verlag Gmb & Co. KGaA, 2007 ROSMORDUC, Jean. Uma História da Física e da Química: de Tales a Einstein. Rio de Janeiro: Jorge Zahar, 1988. TEIXEIRA, Wilson, M. Cristina Motta TOLEDO, Thomas Rich FAIRCHILD, e Fabio TAIOLI. Decifrando a Terra. São Paulo: Companhia Editora Nacional, 2009. SCHUMANN, Walter. Gemas do Mundo. Barueri: Disal, [200?] DEL REY, Mario. Tudo Sobre Diamantes. Barueri: Disal, 2009 Alimentação Atmosfera Evolução da Tabela Periódica e a linha do tempo Evolução da Tabela Periódica e a linha do tempo Evolução da Tabela Periódica e a linha do tempo Evolução da Tabela Periódica e a linha do tempo Geologia Geologia Geologia Indústria SHEREVE, R. N.; BRINK JR, J. A. Indústria de Processos Químicos. Rio de Janeiro: LCTC; 2008. FURTADO, Peter. 1001 Dias que Abalaram o Mundo. Rio de Janeiro: Sextante, 2009. FRANCO, Guilherme. Tabela de Composição dos Alimentos. 9. ed. São Paulo: Atheneu, 2008 Alimentação História TOMA, Henrique Eisi. Química Bioinorgânica. São Paulo: USP/OEA, 1984. Fundamentação baseada em Agricultura Tabela e sua relação com 135 LEPREVOST, Alsedo. Minerais Para a Indústria. Rio de Janeiro: LTC, 1978 GIFFORD, Clive. Guia Essencial de Química. Lisboa: Pesença, 1994. SOUZA, Sergio Augusto. Composição Química dos Aços. São Paulo, Edgard Blucher, 1989 VAISTMAN, Delmo Santiago, Júlio Carlos AFONSO, e Paulo Bechara DUTRA. Para que Servem os Elementos Químicos. Rio de Janeiro: Interciência, 2001. BAIRD, Colin. Química Ambiental. 2. ed. Porto Alegre: Bookman, 2002. BRAGA, Benedito et al. Introdução à Engenharia Ambiental: o desafio do desenvolvimento sustententável. 2. ed. São Paulo: Peason Prentice Hall, 2005. BRANCO, Samuel Murgel. O Meio Ambiente em Debate. 3. ed. São Paulo: Moderna, 2004. SCARLATO, Francisco, e Joel PONTIN. Do Nicho ao Lixo: ambiente, sociedade e educação. São Paulo: Atual, 1992. SARIEGO, José. As Ameaças ao Planeta Azul. São Paulo: Scipione, 1994 ROGERS, Peter. Preparando-se para Enfrentar a Crise da Água. [S. l]: Scientific American Brasil. p. 6067. Set. 2008 AMABIS, José Mariano; MARTHO, Gilberto Rodrigues. Fundamentos da Biologia Moderna. 4. ed. São Paulo: Moderna, 2006. UZINIAN, Armênio; BIRNER, Ernesto. Biologia. Volume único 3. ed. São Paulo: Harbra, 2008. BURSZTYN, Marcel; PERSEGONA, Marcelo. A Grande Transformação Ambiental: uma cronologia da dialética homem-natureza. Rio de Janeiro: Garamond, 2008 Indústria Indústria Indústria Meio Ambiente Meio Ambiente Meio Ambiente Meio Ambiente Meio-Ambiente Meio Ambiente Meio Ambiente Meio Ambiente Meio-Ambiente/Histórico Fundamentação teórica baseada em Indústria Tabela e sua relação com a (o) 136 TORTORA, Gerard, e Sandra GRABOWSKI. Corpo Humano: Fundamentos de Anatomia e Fisiologia. 6.ed. Tradução: Maria Regina Borges-Osório. Porto Alegre: Artmed, 2006. HERLIHY, Barbara, e Nancy MAEBIUS. Anatomia e Fisiologia do Corpo Humano Saudável e Enfermo. Tradução: Edson Aparecido Liberti. São Paulo: Manole, 2002. SACKHEIM, George, e Dennis LEHMAN. Química e Bioquímica para Ciências Biomédicas. 8. ed. São Paulo: Manole, 2001. SMITH, Collen, Allan MARKS, e Michael LIEBERMAN. Bioquímica Médica Básica de Marks. 2. ed. Edição: Ângela de Mattos Dutra. Porto Alegre: Artmed, 2007. SILVERTHORN, Dee Unglaub. Fisiologia Humana: uma abordagem integrada. Porto Alegre: Artmed, 2010 LING, Louis J. et al. Segredos em Toxicologia. Porto Alegre: Artmed, 2005 OIT. Metales: Propriedades Químicas y Toxicidad. OIT. [200?] TORREIRA, Raúl Peragallo. Manual de Segurança Industrial. Margus Publicações, [199?]. PUCKETT, Jim et al. Exporting Harm: The High-Tech Trashing of Asia. [S. l.]: BAN, SVTC, 2002. Saúde Saúde Saúde Saúde Saúde Toxicologia Toxicologia Toxicicologia Toxicologia e Tecnologia da Informação Fonte: Elaborado pelo autor DURAND, Marie-Françoise et al. Atlas da Mundialização: compreender o espaço contemporâneo. Tradução Carlos Roberto Sanches Milani. São Paulo: Saraiva, 2009. Fundamentação teórica baseada em Meio-Ambiente/Histórico Tabela e sua relação com a (o) 137 Apêndice I: T Wanc®© – Tela de abertura ampliada 138
Download