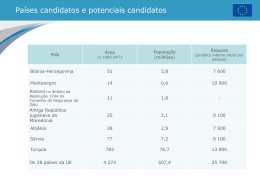
UFG-PS/2007 PROVAS DA SEGUNDA ETAPA – PS2007/UFG Esta parte do relatório mostra o desempenho dos candidatos do grupo 2 na prova de Química da 2ª etapa do PS2007. Inicialmente, são apresentados os dados gerais dos candidatos do grupo 2. Em seguida, são apresentados dois gráficos sobre a prova: o primeiro mostra a distribuição do total de candidatos da 2ª fase em relação às notas obtidas em Química e o segundo contém as médias das notas alcançadas em cada questão da prova. A nota máxima em cada questão é 5,0. Na seqüência, temos a questão, a resposta esperada (RE) e mais dois gráficos demonstrando o desempenho do total de candidatos do grupo 2 e dos candidatos do curso que teve a maior nota de corte no grupo (Medicina) nesta questão. Estes gráficos serviram de base para as análises sobre a questão, que são apresentadas logo em seguida. Dados gerais - Candidatos do grupo 2 PS2007/UFG - Nº de candidatos 1ª etapa 2ª etapa Inscritos Presentes Classificados Presentes Aprovados Grupo 2 10538 9977 2427 2376 748 Total 29265 27556 9233 8950 3621 4067 3821 475 468 110 Medicina QUÍMICA – G2 Média por questão - Química G2 PS2007/UFG - 2ª etapa Distribuição das notas de Química G2 ps2007 - 2ª etapa 2,76 3 2,5 35 30 25 20 15 10 5 0 2 1,5 1,44 1,31 1,21 0,91 1 0,49 0,31 0,5 0 0 200 400 600 800 1000 1200 1400 1600 1800 2000 2200 2400 8 Figura 1: Distribuição das notas dos candidatos presentes do GRUPO 2 ▬▬▬ QUESTÃO 9 10 11 12 13 14 Figura 2: Média dos candidatos presentes do GRUPO 2 por questão 08 ▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬ Um analista necessita de 100 mL de uma solução aquosa de NaCl 0,9% (m/v). Como não dispõe do sal puro, resolve misturar duas soluções de NaCl(aq): uma de concentração 1,5% (m/v) e outra de 0,5% (m/v). Calcule o volume de cada solução que deverá ser utilizado para o preparo da solução desejada. RE: CSol1 x VSol1 + CSol2 x VSol2 = CSolFinal x VSolfFnal 1,5 x VSol1 + 0,5 x VSol2 = 0,9 x 100 1,5 x VSol1 + 0,5 x VSol2 = 90 VSol1 + VSol2 = 100 VSol1 = 100 - VSol2 Logo, 1,5 x (100 - VSol2) + 0,5 x VSol2 = 90 VSol2 = 60 mL VSol1 = 100 – 60 VSol1 = 40 mL (5,0 pontos) 1 UFG-PS/2007 Química - Questão 8 - Medicina PS2007/UFG - 2ª etapa Química G2 - Questão 8 1800 1600 1400 1200 1000 800 600 400 200 0 380 400 350 300 250 200 150 50 28 50 5 4,5 4 3 1,5 0 100 8 1 1 3 4 4,5 0 Notas 0 Figura 3: Distribuição das notas da questão 8 dos candidatos presentes 1,5 5 Figura 4: Distribuição das notas dos candidatos presentes - Medicina Análise da questão: Nesta questão, foram abordados conhecimentos de soluções (aspectos quantitativos e qualitativos). Foram exigidas habilidades de realizar e interpretar cálculos na resolução de problemas químicos, envolvendo grandezas e medidas físicas. Os gráficos mostram uma alta concentração de notas zero no grupo 2 e uma alta concentração de notas 5,0 no curso de Medicina, o que significa que os candidatos desse curso obtiveram bom desempenho nesta questão. ▬▬▬ QUESTÃO 09 ▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬ De acordo com um estudo de indicadores ácido-base (Quim. Nova 2006, 29, 600), o equilíbrio ácido-base do corante azul de bromofenol pode ser representado por OH Br O Br Br Br Br Br HO C O S Br HO O + C SO3- Br O H+ IND IND Cor amarela Cor azul - Concentração de azul de bromofenol (mol/L) e o perfil da concentração desse corante em função do pH é representado no gráfico abaixo. III 0,4 0,2 0,0 4 2 6 Com base nas informações apresentadas, a) identifique as espécies químicas presentes na solução em I, II e III; RE: Em I, tem-se IND 2 pH UFG-PS/2007 Em II, tem-se IND e IND - - Em III, tem-se IND (3,0 pontos) b) calcule o valor da constante de equilíbrio em II, sabendo que nesse pH, [H+] = 3,2 x 10-4 mol/L. - RE: K = [IND ].[H+] / [IND] - Como em II, [IND] = [IND ] K = [H+] = 3,2 x 10-4 mol L-1 (2,0 pontos) Química - Questão 9 - Medicina PS2007/UFG - 2ª etapa Química G2 - Questão 9 1800 1600 1400 1200 1000 800 600 400 200 0 120 104 94 100 80 70 66 59 60 47 40 8 7 5 5 4,5 4 3,5 3 2,5 2 1,5 1 0,5 0 20 6 2 0 Notas 0 Figura 5: Distribuição das notas da questão 9 dos candidatos presentes 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 Figura 6: Distribuição das notas dos candidatos presentes - Medicina Análise da questão: Nesta questão, foi abordado o conhecimento das variáveis envolvidas nas transformações químicas e físicas. Foram exigidas habilidades de compreensão e utilização da linguagem simbólica que representa as reações químicas. Os gráficos acima mostram uma alta concentração de zeros no grupo 2 e uma melhor distribuição de notas no curso de Medicina. A alta concentração de zeros no grupo 2 talvez possa ser explicada pelo fato de a questão exigir uma habilidade que pressupõe a mobilização da capacidade de interpretação da linguagem simbólica. ▬▬▬ QUESTÃO 10 ▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬ Superóxido de potássio sólido, KO2(s), é comumente empregado em máscaras protetoras contra gases. Esse superóxido remove tanto o vapor d´água exalado quanto o gás carbônico. O vapor d´água é removido após reagir com o superóxido. O gás carbônico é removido após reagir com um dos produtos da reação anterior. Escreva as equações químicas que representam as reações químicas envolvidas. RE: Equação que representa a reação entre o vapor de água e o peróxido: 4KO2(s) + 2H2O(g) 4KOH(s) + 3O2(g) OU 2KO2(s) + 2H2O(g) 2KOH(s) + H2O2(l) + O2(g) Remoção do gás carbônico: 3 UFG-PS/2007 KHCO3(s) KOH(s) + CO2(g) OU K2CO3(s) + H2O 2KOH(s) + CO2(g) (5,0 pontos) Química - Questão 10 - Medicina PS2007/UFG - 2ª etapa Química G2 - Questão 10 2500 250 2000 200 194 1500 150 1000 100 500 74 50 17 5 4,5 4 3 2,5 2 1,5 1 0,5 0 0 52 45 36 35 3 4 10 5 0 Notas 0 Figura 7: Distribuição das notas da questão 10 dos candidatos presentes 0,5 1 1,5 2 2,5 5 Figura 8: Distribuição das notas dos candidatos presentes - Medicina Análise da questão: Nesta questão, foram abordados conhecimentos dos aspectos dinâmicos das transformações químicas. Foi exigida a habilidade de estabelecer relações entre os aspectos macroscópicos dos fenômenos físicos e químicos e os modelos teóricos que os explicam. Percebe-se, pelos gráficos, uma alta concentração de zero tanto no grupo 2 quanto no curso de Medicina. Isso possivelmente se explique em razão desse conteúdo ser pouco explorado no ensino médio. ▬▬▬ QUESTÃO 11 ▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬ O processo de enriquecimento de urânio passa pela separação de hexafluoretos de urânio, UF6, que são constituídos por diferentes isótopos de urânio. As velocidades de efusão desses hexafluoretos são muito próximas, sendo que a razão entre a velocidade de efusão do hexafluoreto que contém o isótopo de urânio mais leve em relação ao que contém o mais pesado é de 1,0043. De acordo com a lei de efusão de Graham, essa razão é igual à raiz quadrada da relação inversa de suas massas molares. Sendo a massa molar da substância que contém o isótopo de urânio mais leve igual a 349 g/mol, calcule a massa atômica do isótopo mais pesado. RE: Vleve / Vpesado = 1,0043 = (MMpesado/MMleve)1/2 (1,0043)2 = MMpesado/349 MMpesado = 352 g/mol A massa molar do UF6 = 352 = U + 6F = U + 6x19 Logo, a massa atômica do urânio mais pesado é 238 u. pontos) 4 (5,0 UFG-PS/2007 Química - Questão 11 - Medicina PS2007/UFG - 2ª etapa Química G2 - Questão 11 1200 180 1000 160 155 140 800 120 600 100 400 80 74 72 58 60 200 40 37 4 4,5 25 20 5 4,5 4 3 2,5 2 1,5 0 0 42 5 0 Notas 0 Figura 9: Distribuição das notas da questão 11 dos candidatos presentes 1,5 2 2,5 3 5 Figura 10: Distribuição das notas dos candidatos presentes - Medicina Análise da questão: Nesta questão, foram abordados conhecimentos sobre propriedades do estado gasoso. Foram exigidas habilidades de realizar e interpretar cálculos na resolução de problemas químicos, envolvendo grandezas e medidas físicas. A questão tem uma distribuição de notas em todos os níveis de acertos, com predominância de zero no grupo 2. Houve uma melhora na distribuição das notas dos candidatos do curso de Medicina, que apresentaram uma concentração de notas 2,5. A dificuldade dos candidatos do grupo 2 talvez se explique pelo fato de a questão envolver vários conceitos químicos associados à habilidade mencionada. ▬▬▬ QUESTÃO 12 ▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬ Considere que uma amostra contendo 1 litro de uma solução dos nitratos de prata e chumbo (1,0 x 10-4 mol de cada) é titulada com uma solução de NaCl (1,0 x 10 -4 mol/L). Após a adição de 32 mL do titulante, haverá uma certa quantidade de precipitado. Calcule a concentração, em mol/L, do cátion desse precipitado que ainda permanece em solução. Dados: Substância KPS AgCl 1,6 x 10-10 PbCl2 1,6 x 10-5 RE: O produto que vai prepitar após a adição de 32 mL do titulante será o AgCl(s), devido ao fato de seu KPS ser menor que o do PbCl2(s). A concentração do cátion em solução será de 5 x 10-5 mol/L, pois: Em 32 mL de NaCl(aq.) tem-se [Cl-] = 3,2 x 10-6 mol/L [Ag+] = KPS/[Cl-] = 1,6 x 10-10/3,2 x 10-6 = 5 x 10-5 mol/L (5,0 pontos) Química - Questão 12 - Medicina PS2007/UFG - 2ª etapa Química G2 - Questão 12 2500 200 180 2000 175 186 160 140 1500 120 1000 100 80 500 53 48 60 40 20 5 4,5 4 3 2 1 0,5 0 0 3 2 1 3 4 4,5 0 Notas 0 Figura 11: Distribuição das notas da questão 12 dos candidatos presentes 1 2 5 Figura 12: Distribuição das notas dos candidatos presentes - Medicina Análise da questão: 5 UFG-PS/2007 Nesta questão, foram abordados conhecimentos sobre o comportamento químico das substâncias e dos materiais. Foram exigidas habilidades de compreensão e previsão das relações qualitativas e quantitativas dos processos químicos. Percebe-se uma alta concentração de notas baixas no grupo 2 e no curso de Medicina. Isso talvez possa ser explicado pelo fato de a habilidade e o conhecimento exigidos serem difíceis para o candidato. ▬▬▬ QUESTÃO 13 ▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬ O diagrama de fases da água é representado abaixo. 760 4,6 0,01 100 T /oC As diferentes condições ambientais de temperatura e pressão de duas cidades, A e B, influenciam nas propriedades físicas da água. Essas cidades estão situadas ao nível do mar e a 2400 m de altitude, respectivamente. Sabe-se, também, que a cada aumento de 12 m na altitude há uma mudança média de 1 mmHg na pressão atmosférica. Sendo a temperatura em A de −5 ºC e em B de −35 ºC, responda: a) Em qual das duas cidades é mais fácil liquefazer a água por compressão? Justifique. RE: Na cidade A. De acordo com o diagrama de fases, a pressão a ser exercida na água para que ocorra a liquefação é menor. (2,0 pontos) b) Quais são as mudanças esperadas nos pontos de fusão e ebulição da água na cidade B com relação à A. RE: Como B está a aproximadamente 2400 m de altitude, a pressão atmosférica é menor. Conseqüentemente, a temperatura de fusão da água será maior que em A, e a temperatura de ebulição será menor que em A. (3,0 pontos) 6 UFG-PS/2007 Química - Questão 13 - Medicina PS2007/UFG - 2ª etapa Química G2 - Questão 13 600 120 500 99 100 400 79 80 300 52 39 20 22 0 0,5 26 23 15 16 4,5 5 5 4,5 4 3,5 3 2,5 2 20 1,5 40 0 1 100 0,5 60 0 200 77 0 Notas Figura 13: Distribuição das notas da questão 13 dos candidatos presentes 1 1,5 2 2,5 3 3,5 4 Figura 14: Distribuição das notas dos candidatos presentes - Medicina Análise da questão: Nesta questão, foram abordados conhecimentos sobre as propriedades físicas das substâncias e dos materiais. Foram exigidas habilidades de reconhecer e interpretar gráficos e tabelas que representam resultados de experimentos. Percebe-se uma boa distribuição de notas em todos os níveis de acertos tanto no grupo 2 quanto no curso de Medicina. Isso demonstra, possivelmente, um bom desempenho dos candidatos quanto às habilidades e ao conhecimento exigido na questão. ▬▬▬ QUESTÃO 14 ▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬ A oxidação completa de 1 mol de glicose (C6H12O6), no metabolismo aeróbico, produz 38 mols de trifosfato de adenosina (ATP), e cada mol de ATP fornece 8 kcal de energia útil para o organismo. Por outro lado, a oxidação completa de 1 mol de glicose, durante a combustão, libera 673 kcal. Dessa forma, a) calcule a taxa de aproveitamento de energia no metabolismo aeróbico; RE: Metabolismo aeróbico: 1mol de glicose 38 x 8 = 304 kcal Oxidação completa: 1mol de glicose 673 kcal Logo, a taxa de aproveitamento = 304/673 = 0,45 ou 45% (2,0 pontos) b) considerando que toda energia venha do metabolismo aeróbico da glicose, calcule a massa desse carboidrato que deverá ser ingerida para que um atleta realize uma corrida de 15,2 minutos, sabendo que o organismo do atleta consome 10 kcal/minuto. RE: Consumo total de energia = 15,2 min X 10 kcal/min = 152 kcal como 1mol de glicose no metabolismo aeróbico fornece 304 kcal, então temos 1 mol de glicose x 180 g 304 kcal 152 kcal x = 90 g de glicose (3,0 pontos) 7 UFG-PS/2007 Química - Questão 14 - Medicina PS2007/UFG - 2ª etapa Química G2 - Questão 14 5 0 50 4,5 100 4 100 3,5 150 3 200 2,5 200 2 300 1,5 250 1 400 0,5 300 0 500 271 57 4 2 0 1 14 3 68 31 13 5 2,5 3 0 Notas Figura 15: Distribuição das notas da questão 14 dos candidatos presentes 1,5 2 3,5 4 4,5 5 Figura 16: Distribuição das notas dos candidatos presentes - Medicina Análise da questão: Nesta questão, foram abordados conhecimentos de cálculos envolvidos nos processos químicos e físicos. Foram exigidas habilidades de realizar e interpretar cálculos na resolução de problemas químicos, envolvendo grandezas e medidas físicas. Os gráficos mostram que a distribuição das notas é boa no grupo 2, mas tem uma grande concentração de notas mais altas no curso de Medicina. A facilidade encontrada por muitos candidatos talvez se explique pelo conhecimento abordado também ser amplamente trabalhado em biologia. 8
Download