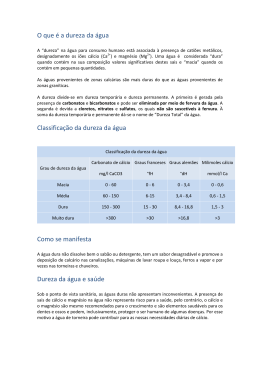
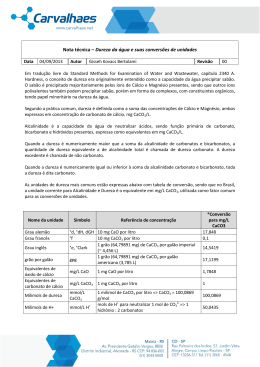
FACULDADE SANTO AGOSTINHO DE SETE LAGOAS ENGENHARIA AMBIENTAL - QUÍMICA AMBIENTAL - Nome: ______________________________________________________________ Dureza da água É uma medida da concentração de cátions multimetálicos em solução. Os cátions mais frequentemente associados à dureza são os cátions divalentes Ca2+ e Mg2+. As principais fontes de dureza são a dissolução de minerais contendo cálcio e magnésio, provenientes das rochas calcárias e dos despejos industriais. A ocorrência de determinadas concentrações de dureza causa um sabor desagradável e pode ter efeitos laxativos. Além disso, causa incrustação nas tubulações de água quente, caldeiras e aquecedores, em função da maior precipitação salina nas temperaturas elevadas (ou seja, em maiores temperaturas ocorre maior precipitação dos sais de cálcio e magnésio). A expressão “água dura” é usada para qualificar a água rica em íons como cálcio (Ca2+) e Magnésio (Mg2+). A presença desses íons pode ser explicada pelo contato, nos lençóis subterrâneos, como substâncias como o carbonato de cálcio presente no calcário, ou com uma mistura de carbonatos de cálcio e de magnésio presente no mineral dolomita (CaCO3.MgCO3). Há dois tipos de dureza: a dureza temporária, que é decorrente da presença de carbonatos e bicarbonatos e pode ser eliminada por fervura simples da água, e dureza permanente, consequência da presença de cloretos, nitratos e sulfatos, que não é eliminada por simples fervura. À união dessas duas propriedades dá-se o nome de “dureza geral” ou “dureza total” da água. A dureza da água é na maioria das vezes medida em partes por milhão (ppm) de carbonato de cálcio (CaCO3). Quanto maior a concentração de carbonato de cálcio, mais dura é a água. No Brasil, estabelece-se o limite máximo de 500mg de CaCO3/L para a água ser classificada como potável. Os tipos de água podem ser classificados quanto à dureza de acordo com os parâmetros apresentados na seguinte tabela: Concentração de CaCO3 (ppm em massa x volume) 0 – 70 ppm 70 – 135 ppm 135 – 200 ppm 200 – 350 ppm Mais de 250 ppm Classificação quanto à dureza Mole Mole (branda) Média dureza Dura Muito dura Nos combates a incêndio, irrigação de jardins e lavagem de ruas, pequenas alterações de dureza na água não chegam a causar problemas. Porém, para os demais usos domésticos ou industriais a água dura pode causar alguns inconvenientes. O principal é a formação de incrustações nas tubulações de água devido ao acúmulo de calcificações. Uma maneira simples de identificar a dureza da água é o “teste da espuma”. Se o sabão ou sabonete, pasta de dentes, xampu ou outro tipo de cosmético fizerem muita espuma na água é porque ela é mole. Caso contrário, a água é dura. Por isso, para o uso em atividades como tomar banho, lavar louças e roupas, fazer a barba, lavar o carro e muitos outros empregos, a água dura não é tão eficiente como a mole. Calcula-se que 10 mg/L de CaCO3 provocam o desperdício de 190 gramas de sabão puro, por cada metro cúbico de água. Alguns produtos químicos presentes na água dura, tais como os carbonatos, são inibidores de corrosão, e podem prevenir danos em canalizações ou contaminações por produtos de corrosão potencialmente tóxicos. Os métodos mais comumente empregados para a determinação de cálcio são o titulométrico do EDTA (ácido etilenodiaminotetracético), o titulométrico do permanganato e o espectrofotométrico da absorção atômica. Métodos instrumentais em geral são os mais indicados porque não requerem separações trabalhosas. Magnésio (Mg): O magnésio é um elemento essencial para a vida animal e vegetal. A atividade fotossintética da maior parte das plantas é baseada na absorção da energia da luz solar, para transformar água e dióxido de carbono em hidratos de carbono e oxigênio. Esta reação só é possível devido à presença de clorofila, cujos pigmentos contêm um composto rico em magnésio. A falta de magnésio no corpo humano, pode provocar diarreia ou vômitos bem como hiperirritabilidade ou uma ligeira calcificação nos tecidos. O excesso de magnésio é prontamente eliminado pelo corpo. Entre outras aplicações dos seus compostos, salienta-se a utilização do óxido de magnésio na fabricação de materiais refratários e nas indústrias de borracha, fertilizantes e plásticos, o uso do hidróxido em medicina como antiácido e laxante, do carbonato básico como material isolante em caldeiras e tubagens e ainda nas indústrias de cosméticos e farmacêutica. Por último, os sulfatos (sais de Epsom) são usados como laxantes, fertilizantes para solos empobrecidos em magnésio e ainda nas indústrias têxteis e papeleira; e o cloreto é usado na obtenção do metal, na indústria têxtil e na fabricação de colas e cimentos especiais. As aplicações do metal são múltiplas, como a construção mecânica, sobretudo nas indústrias aeronáutica e automobilística, quer como metal puro, quer sob a forma de ligas com alumínio e zinco, ou com metais menos frequentes, como o zircônio, o tório, os lantanídeos e outros. TRATAMENTO DA ÁGUA DURA: O tratamento da água dura para a retirada de Ca2+ e Mg2+ é conhecido por abrandamento ou amolecimento e consiste em fazer a água atravessar uma resina que captura os íons Ca2+ e Mg2+, substituindo-os por íons não prejudiciais ao homem, tais como o Na+ e o H+. Esse procedimento é chamado de método da troca iônica. A remoção da dureza pode também ser efetuada por fervura ou pela adição de algumas substâncias “amolecedoras”, tais como: Hidróxido de Sódio (NaOH), Carbonato de Sódio (Na2CO3), Fosfato de Sódio (Na3PO4) e Sulfato de Alumínio (A2(SO4)3). Observação: A água fornecida pelo SAAE em Sete Lagoas tem dureza média de carbonato de cálcio em torno de 140,0 mg/L e dureza total média em torno de 195,0 mg/L, parâmetros portanto abaixo do mínimo exigido pela Organização Mundial de Saúde que é de 500 mg/L. (Fonte: SAAE Sete Lagoas) QUESTÕES (RESPONDER E ENTREGAR EM FOLHA À PARTE, HOJE!) 01. Conceitue dureza da água. 02. Quais os principais cátions responsáveis pela dureza da água? Qual a origem desses cátions na água? 03. Diferencie dureza temporária e dureza permanente. Por que a simples fervura elimina a dureza temporária? O que é dureza total? 04. Qual o limite de dureza, no Brasil, para considerar-se a água como potável? 05. O que é o “teste da espuma”? 06. O que é um “método titulométrico”? 07. Cite as formas de tratamento da água dura. 08. Como se classifica a água fornecida pelo SAAE-Sete Lagoas em termos de dureza?
Baixar