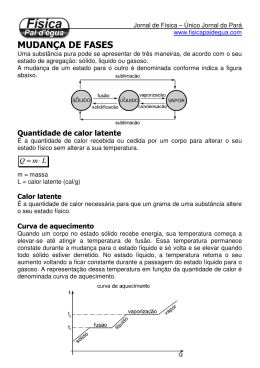
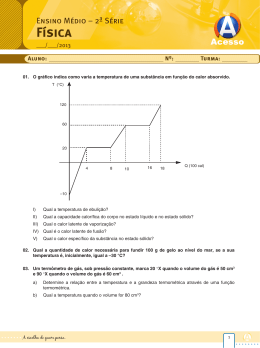
Exemplo 01 Uma substância de massa 200 g absorve 5000 cal durante a sua ebulição. Calcule o calor latente de vaporização. Exemplo 02- Quantas calorias deve absorver uma pedra de 400 g de gelo a 0ºC para fundir totalmente Exemplo 03- Quantas calorias deve liberar 500 g de água para solidificar a 0ºC Exemplo 04- Quantas calorias deve absorver para 250g de água vaporize a 100ºC Nos exemplos 5, 6 e 7 considere as seguintes informações: a temperatura de fusão do Pb é de 327ºC e seu calor latente de fusão é 6 cal/g. Suponha um bloco de Pb, sólido, cuja massa é de 20 g, a temperatura de 327ºC. 05-Para fundir totalmente o bloco de Pb, devemos fornecer a ele, no mínimo: A) 6 cal B) 120 cal C) 327 cal D)20 cal 06- Supondo que tenham sido fornecidas as calorias calculadas na questão anterior, concluímos que o Pb líquido formado estará a uma temperatura de: A) 447ºC B) 333ºC C) 327ºC D) 321ºC 07-Se fornecermos ao bloco sólido 200 cal de calor, obteremos 20 g de Pb líquido a uma temperatura de: A) 527ºC B) 333ºC C) 327º C D) 321ºC Tabela de calores latentes A tabela abaixo apresenta alguns elementos e seus respectivos calor latentes e fusão e ebulição, assim como a temperatura detransição de fase.1 Ponto de Fusão ºC Substância Calor Latente de Fusão cal/g) Ponto de Ebulição (ºC) Calor Latente de Vaporização (cal/g) Chumbo 327 5,8 platina 1775 27 enxofre 119 13 Mercúrio -39 2,8 357 65 Nitrogênio -210 6,1 -196 48 Prata 961 21 Água 0 80 100 540 Exemplo 01 Qual a quantidade de calor que 50 g de gelo a -20ºC precisam receber para se transformar em água a 40ºC? Dado: cgelo = 0,5 cal/g.ºC; cágua = 1 cal/g. ºC; LF = 80 cal/g. Exemplo 02 – pág 173 Qual a quantidade de calor que devemos fornecer a 20g de gelo a 0ºC para transformá-lo em vapor d água, superaquecido a 200ºC
Download