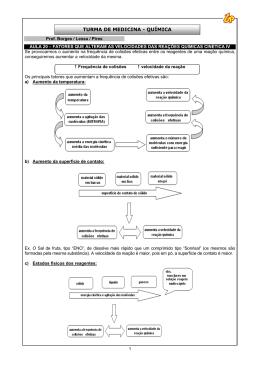
Cinética Química A Cinética Química estuda a velocidade das reações e os fatores que a influenciam, estuda ainda a possibilidade de controlar essa velocidade, tornando as reações mais rápidas ou mais lentas, com base no mecanismo das reações. Velocidade média em função das substâncias Considere a reação genérica balanceada, esquematizada a seguir, na qual dias substâncias A e B reagem entre si na proporção aA + bB, produzindo duas novas substâncias na proporção cC + dD : aA+bB→cC+dD No início da reação (tempo zero), tem-se apenas as substâncias A e B. Uma vez iniciado o processo , as quantidades das substâncias A e B vão diminuindo progressivamente, enquanto começam a surgir as substâncias C e D, em quantidades que vão aumentando até que a reação se complete. Define-se então: A velocidade média, Vm, calculada em função de uma das substâncias participantes da reação é a razão entre a quantidade consumida ou produzida da substância e o intervalo de tempo, Δt, em que isso ocorreu. Desse modo, a velocidade, média da reação genérica esquematizada acima pode ser calculada por uma das expressões abaixo: Consumo de reagentes Vm = − Vm = − quantidade de A consumido Δt quantidade de B consumido Δt Formação de produtos ou Vm = ou Vm = quantidade de C produzido Δt quantidade de D produzido Δt As quantidades das substâncias consumidas ou produzidas são normalmente expressas em variação de concentração em quantidade de matéria que aqui simbolizamos por Δ [ ]. Podem ser expressas também em variação de massa, Δm, variação de quantidade de matéria, Δn, ou em variação de pressão parcial, Δp, no caso de reagentes ou de produtos que estejam na fase gasosa. O intervalo de tempo, Δt, deve ser expresso numa unidade que se ajuste ao tipo de reação: segundos, minutos, horas ou dias. Considere, por exemplo, que durante a reação citada anteriormente tenha sido medida a concentração em quantidade de matéria de A consumido e de C produzido, em intervalos de tempo regulares, de cinco em cinco minutos, obtendo-se o resultado descrito na tabela abaixo: Tempo (min.) [A] mol/L consumido [C] mol/L produzido 0 8,5 0 5 7,0 0,5 10 5,5 1,0 15 4,0 1,5 20 2,5 2,0 25 1,0 2,5 Com base nesses resultados, podemos calcular a velocidade média da reação em função de A ou de C, no intervalo de tempo que quisermos: 1 Professor William de Paula - Velocidade média da reação em função de A consumido no intervalo de tempo entre 5 e 20 minutos. Vm = − Δ[ A] Δt ⇒ Vm = − [ A] final − [ A] inicial t final − t inicial ⇒ Vm = − 2,5 − 7,0 20 − 5 ⇒ Vm = 4,5 Vm = 0,3mol / L. min 15 - Velocidade média da reação em função de C ´produzido no intervalo de tempo entre 5 e 20 minutos. Vm = Δ[C ] Δt ⇒ Vm = [C ] final − [C ]inicial t final − t inicial ⇒ Vm = 2,0 − 0,5 20 − 5 ⇒ Vm = 1,5 15 Vm = 0,1mol / L. min Observe que a velocidade média calculada em função dos reagentes (no caso A) tem valor Δ[ A] negativo, pois, à medida que a reação se processa, a quantidade de reagentes vai diminuindo, portanto, para os reagentes é necessário o sinal negativo na frente da equação, para que a velocidade seja positiva. Já a velocidade média calculada em função dos produtos, no caso C, tem valor positivo, pois, à medida que a reação se processa, a quantidade de produtos vai aumentando. Para evitar o problema do sinal, costuma-se trabalhar com os valores da velocidade de qualquer substância que participe da reação em módulo. Condições necessárias 1. Colisão favorável Para que duas ou mais substâncias possam reagir é evidente que suas moléculas devem colidir entre si, de modo que haja quebra das ligações com conseqüente formação de outras novas, dando origem, assim, a novas substâncias. As colisões entre as moléculas podem ser não-efetivas e efetivas. Colisões não-efetivas Colisões efetivas São aquelas em que não há quebra de São aquelas em que há quebra de ligações ligações e, consequentemente, não existe e conseqüente formação de outras novas. formação de outras novas. Neste caso não Neste caso, ocorre a reação ocorre a reação Para que uma colisão seja efetiva, o choque entre as moléculas deve acontecer com uma orientação favorável e suficiente energia. Analisemos, por exemplo, algumas colisões entre moléculas H2 e I2: 2 Professor William de Paula Quanto maior o número de colisões efetivas entre as moléculas dos reagentes, maior é a velocidade da reação. Mais colisões efetivas ⇒ maior velocidade 2. Energia de ativação e complexo ativado Energia de ativação é a quantidade mínima de energia necessária para que a colisão entre as partículas dos reagentes, feita numa orientação favorável, seja efetiva e, portanto, resulte em reação. Vejamos o caminho da energia através de um gráfico para a seguinte reação: H2(g) + I2(g) → 2HI(g) Ponto 1: As moléculas reagentes não possuem suficiente energia para reagirem. Ponto 2: A energia do sistema é maior, mas ainda não suficiente para que se verifique uma colisão efetiva. Ponto 3: Neste ponto, a energia é suficiente para a reação. Dá-se, então, a formação de um composto intermediário, instável, denominado complexo ativado. Aqui temos um estado ativado ou estado de transição. Ponto 4: Está vencida a "montanha" de energia. As moléculas do produto estão praticamente formadas. Ponto 5: As moléculas do produto (HI) estão definitivamente formadas. O complexo ativado de uma reação é uma estrutura intermediária e instável entre os reagentes e os produtos. 3 Professor William de Paula No caso da reação entre H2(g) e I2(g), formando HI(g), por exemplo, o complexo ativado seria representado da seguinte maneira: H ⎯ H(g) + I ⎯ I (g) H H → Reagentes I I Complexo ativado H → I H ⏐ I + H ⏐ I Produtos A representação gráfica de uma reação envolvendo a energia de ativação (Ea) pode ser de dois tipos: Reação exotérmica Reação endotérmica Quanto menor a energia de ativação, mais facilmente se forma o complexo ativado e, portanto, mais rápida é a reação. Menor energia de ativação ⇒ maior velocidade Fatores que influem na velocidade 1. Temperatura Aumentar a temperatura significa aumentar a energia cinética das molécula, ou seja, aumentar a velocidade das moléculas. É fácil perceber que moléculas mais rápidas colidem com mais freqüência e com mais violência. Logo, mais moléculas reagem em um certo espaço de tempo e, com isso, a velocidade aumenta. Quanto mais alta é a temperatura. maior é o número de moléculas em condições de reagir e, portanto, mais rápida é a reação. Maior temperatura ⇒ maior velocidade Regra de Van't Hoff Um aumento de 10ºC na temperatura duplica a velocidade de uma reação. 2. Pressão Quando falamos em influência da pressão na velocidade de uma reação, devemos pensa somente nos reagentes gasosos. Se aumentamos a pressão, diminuindo o volume, aumentamos o número de colisões e, portanto, a velocidade. Quanto maior é a pressão parcial de um participante gasoso, mais rápida é a reação. Maior pressão parcial ⇒ maior velocidade 4 Professor William de Paula 3. Concentração dos reagentes Observe, inicialmente, a seguinte experiência: Um químico colocou um pedaço de palha de aço numa cuba com solução diluída de ácido clorídrico (HCl) e notou que a reação durou um certo tempo (difamos,20 min.). Depois, o químico repetiu o experimento, usando, porém, uma solução de ácido clorídrico mais concentrada e notou que a reação foi mais rápida (digamos, 8 min.). Porque essa diferença de tempo? Porque na solução mais concentrada de ácido clorídrico temos mais íons H3O+ por litro. Logo, ocorrem mais colisões entre esses íons e a palha de aço, e a reação se torna mais rápida. Como conseqüência, podemos dizer que o aumento da concentração dos reagentes tende a aumentar a velocidade da reação. A primeira observação da influência da concentração dos reagentes na velocidade de uma reação foi feita pelo químico alemão Karl Friedrich Wenzel, no século XVIII, quando estudava a ação dos ácidos sobre metais. Entretanto, somente em 1864 essa influência foi rigorosamente enunciada, através da lei da ação das massas, pelos cientistas noruegueses Cato Maximilian Guldberg e Peter Waage. Quanto mais alta é a concentração, maior é a probabilidade de ocorrerem colisões efetivas e, portanto, mais rápida é a reação. Maior concentração ⇒ maior velocidade 4. Superfície de contato A reação de um sólido com outro reagente qualquer ocorre através de colisões das partículas do reagente com a superfície do sólido. Logo, não interessa saber qual a concentração do sólido, mas sim qual a sua superfície de contato. Quanto maior essa superfície, maior o número de colisões e maior a velocidade. Considere um prego e uma palha de aço. Suponhamos que as massas do prego e da palha de aço sejam as mesmas. Entretanto, é fácil perceber que as superfícies de contato são diferentes. Vamos colocar o prego e a palha de aço em soluções de ácido clorídrico (HCl) de mesma concentração. Percebemos, agora, que a reação da palha de aço com o ácido é bem mais rápida que a reação do prego com o acido, o que nos mostra que a velocidade realmente depende da superfície de contato, e não da concentração do prego ou da palha de aço. 5 Professor William de Paula A palha de aço apresenta uma superfície de contato muito maior; assim, sofre um número maior de colisões dos íons H+. Por isso, reage mais rapidamente. Quanto maior a superfície de contato do sólido, maior é o número de colisões por parte d outro reagente e, assim. Mais rápida é a reação. Maior superfície de contato ⇒ maior velocidade Catálise Catalisador é uma substância que aumenta a velocidade de uma reação química sem ser efetivamente consumida no processo Catálise é o nome dado ao aumento de velocidade provocado pelo catalisador. A Ação do Catalisador Os catalisadores abaixam a energia de ativação da reação. Note que a presença do catalisador diminui a energia de ativação de Ea2 para Ea1, isto é, diminui a "montanha de energia" que as moléculas devem vencer para que ocorra a reação. Assim, mais moléculas podem reagir e, em conseqüência, a velocidade da reação aumenta. O mecanismo de ação dos catalisadores é bastante complexo e não está ainda perfeitamente esclarecido. Entretanto, podemos dizer que: • O catalisador apresenta concentração constante, é devolvido "intacto" no final do processo. 6 Professor William de Paula Equação da velocidade Sendo a reação química. aA + bB → cC + dD a equação da velocidade é dada por: V = k.[A]α[B]β onde; V → velocidade da reação K → Constante cinética da reação [A],[B] → Concentração dos reagentes em mol/l α → Ordem da reação em relação ao reagente A β → Ordem da reação em relação ao reagente B Cada reação química tem um valor para K específico. Os valores de α e β são determinados experimentalmente, todavia é comum que estes valores sejam iguais aos coeficientes estequiométrico, assim. α=a β=b logo: V = k.[A]a[B]b A velocidade de uma reação num dado instante e cada temperatura, é proporcional ao produto das concentrações molares dos reagentes, elevadas a potências iguais aos respectivos coeficientes na equação química balanceada. Observe a aplicação dessa lei para as seguintes reações: H2(g0 + Cl2(g) → 2HCl(g) V = k . [H2] [Cl2] [H2] = concentração molar do H2(g) [Cl2] = concentração molar do Cl2(g) N2(g) + 3H3(g) → 2NH3(g) V = k.[N2] [H2]3 Obs.: IPC....IMPORTANTE PRA CARAMBA A etapa lenta: um fator decisivo na velocidade Consideremos a reação: 4HBr + O2 → 2H2O + 2Br2 Sua velocidade é dada por: V = k . [HBr] [O2] 7 Professor William de Paula E não por V = k . [HBr]4 [O2]. A reação ocorre em três etapas: 1ª Etapa (lenta): HBr + O2 →HOOBr 2ª Etapa (rápida): HOOBr + HBr → 2HBrO 3ª Etapa: (rápida): 2HBrO + 2HBr → 2H2O + 2Br2 e o comando da velocidade é dado pela etapa lenta. Então: HBr + O2 →HOOBr V = k . [HBr] [O2] Exercícios 1. (Cesgranrio-RJ) O gráfico ao lado representa a variação das concentrações das substâncias X, Y e Z durante a reação em que elas tomam parte. A equação que representa a reação é: a) X + Z →Y d) Y → X + Z c) X → Y + Z b) X + Y → Z e) Z → X + Y 2. A relação a seguir mostra a variação da concentração de uma substância A, em função do tempo, em uma reação química: aA+bB→cC+dD t(min) [A] mol/L 0,0 11,0 2,0 7,0 4,0 4,3 6,0 3,0 8,0 2,0 10,0 1,0 12,0 0,5 14,0 0,3 16,0 0,2 18,0 0,2 Qual será o valor da velocidade média da reação de A correspondente ao intervalo entre 4 e 14 minutos? 3. (UFV-MG) A formação do dióxido de carbono (CO2) pode ser representada pela equação: C(s) + O2(g) → CO2(g) Se a velocidade de formação do CO2 for de 4 mol/minuto, o consumo de oxigênio, em mol/minuto, será: a) 8. b) 16. c) 2. d) 12 .e) 4. 8 Professor William de Paula 4.(PUC) Em determinada experiência, a reação de formação de água está ocorrendo com o consumo de 4 mols de oxigênio por minuto. Conseqüentemente, a velocidade de consumo de hidrogênio é de: H2 + ½ O2 → H2O a) 2 mois/minuto b) 4 mois/minuto c) 8 mois/minuto d) 12 mola/minuto e) 16 mois/minuto 5.(Puccamp-SP) A combustão do butano C4H10 corresponde à equação: C4H10 + 6,5 O2 → 4 CO2 + 5 H2O Se a velocidade da reação for 0,05 mol butano/minuto, qual a massa de CO2 produzida em meia hora? (C = 12, H = 1, O = 16) 6. O gráfico que melhor representa a massa de um catalisador (m), em função do tempo da reação é: Exercícios - Lei da velocidade 7. Considere as reações elementares: a) 2 HCl(g) → H2(g) + Cl2(g) b) H2(g) + I2(g)→ 2 HI(g) c) 2 CO(g) + O2(g)→ 2 CO2(g) d) 2 NH3(g)→ N2(g) + 3 H2(g) e) N2(g) + 3 H2(g) → 2 NH3(g) Escreva as equações de velocidade dessas reações. 8. Investigações experimentais mostraram que, para a reação em fase gasosa NO2 + CO → CO2 + NO A lei cinética é V = K.[NO2]2. Qual dos mecanismos a seguir pode ser o verdadeiro mecanismo dessa reação? Justifique. Mecanismo I: NO2 + CO → CO2 + NO (etapa única) Mecanismo II: 2 NO2 → NO3 + NO (etapa lenta) NO3 + CO → NO2 + CO2 (etapa rápida) Mecanismo III: NO2 → NO + O (etapa lenta) CO + O → CO2 (etapa rápida) 9 Professor William de Paula 9.(Acafe-SC) Óxido nítrico reage com hidrogênio, produzindo nitrogênio e vapor de água, de acordo com a seguinte equação: 2 NO(g) + 2 H2(g) → N2(g) + 2H2O(g) Acredita-se que essa reação ocorra em duas etapas: 2 NO + H2 → N2O + H2O (lenta) N2O + H2 → N2 + H2O (rápida) De acordo com esse mecanismo, assinale a expressão de velocidade da reação. a) V = K [NO]2 [H2] b) V = K [NO2] [H2O] c) V = K [NO] [H2] d) V = K [N2] [H2O] e) V = K [N2] [H2O]2 10 (UNI-RIO) Num laboratório, foram efetuadas diversas experiências para a reação: 2 H2(g) + 2 NO(g) → N2(g) + 2 H2O(g) Com os resultados das velocidades iniciais obtidos, montou-se a seguinte tabela: experimento [H2] [NO] v(mol.L-1.s-1) 1 0,10 0,10 0,10 2 0,20 0,10 0,20 3 0,10 0,20 0,40 Escreva a equação da Lei da velocidade. 11. Sendo a reação: 2 CO(g) + O2(g) → 2 CO2(g) o que ocorre com a velocidade de formação do CO2, se a concentração de CO for triplicada e a concentração de O2 dobrada? 12. (Cesgranrio-RJ) A equação X + 2 Y→ XY2 representa uma reação, cuja equação da velocidade é: v = k [X] [Y] Indique o valor da constante de velocidade, para a reação dada, sabendo que, quando a concentração de X é 1 M e a de Y é 2 M, a velocidade da reação é de 3 mol/L · m: Exercícios – fatores 13. (UERJ) A sabedoria popular indica que, para acender uma lareira, devemos utilizar inicialmente lascas de lenha e só depois colocarmos as toras. Em condições reacionais idênticas e utilizando massas iguais de madeira em lascas e em toras, verifica-se que madeira em lascas queima com mais velocidade. O fator determinante, para essa maior velocidade da reação, é o aumento da: a) pressão b) temperatura c) concentração d) Superfície de contato 10 Professor William de Paula 14. (Puccamp) Considere as duas fogueiras representadas a seguir, feitas, lado a lado, com o mesmo tipo e quantidade de lenha. A rapidez da combustão da lenha será a) maior na fogueira 1, pois a superfície de contato com o ar é maior. b) maior na fogueira 1, pois a lenha está mais compactada, o que evita a vaporização de componentes voláteis. c) igual nas duas fogueiras, uma vez que a quantidade de lenha é a mesma e estão no mesmo ambiente. d) maior na fogueira 2, pois a lenha está menos compactada, o que permite maior retenção de calor pela madeira. e) maior na fogueira 2, pois a superfície de contato com o ar é maior. . 15. (UFMG) A elevação de temperatura aumenta a velocidade das reações químicas porque aumenta os fatores apresentados nas alternativas, EXCETO: a) A energia cinética média das moléculas. b) A energia de ativação. c) A freqüência das colisões efetivas. d) O número de colisões por segundo entre as moléculas. e) A velocidade média das moléculas 13 (Unicamp-SP) Observe os diagramas 1 e 2 representativos de uma mesma reação química. Para cada curva do diagrama 1 há uma curva correspondente no diagrama 2. Quais curvas representam a reação na presença de um catalisador? Explique. 15. (CESGRANRIO) È dada a reação A + B → C cuja expressão da velocidade é v = K [A][B] Afirma-se que os fatores que aumentam a velocidade da reação são: I) aumento de temperatura. II) diminuição da concentração molar de A. III) aumento da conçentração molar de B. IV) uso de catalisador. Assinale a opção correta: a) I, II, III, IV são verdadeiras. b) I, II, III são verdadeiras; IV é falsa, c) 1, III, IV são verdadeiras; II é falsa. d) l e II são verdadeiras; III e IV são falsas e) III e IV são verdadeiras; I e II são falsas. 11 Professor William de Paula
Download