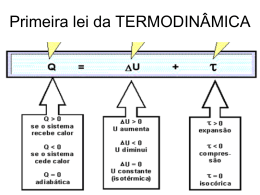
LICEU DE ESTUDOS INTEGRADOS Aluno: ........................................................................................... Data: .......................... Série: 2º ano do ENSINO MÉDIO Professor: Marcos Antônio APOSTILA DE FÍSICA II BIMESTRE TERMODINÂMICA É a ciência que estuda as relações entre o calor o trabalho, que ocorrem durante determinados fenômenos (por exemplo, entre um gás perfeito é o meio externo). Equivalência calor - trabalho: 1 cal = 4,186 J 1. TRABALHO (Շ) a) Trabalho numa transformação Isobárica (p=cte) O trabalho realizado por um gás, numa transformação isobárica, é dado pelo produto da variação de volume sofrida pelo gás. h Շ = P.(V2 - V1) V1 V2 Շ = P.V n.R.T T1 T2 Calor Expansão: V2 > V1 Շ > 0 (o sistema realiza trabalho sobre o meio) Compressão: V2 < V1 Շ < 0 (o meio realiza trabalho sobre o gás) Se V2 = V1 Շ = 0 b) Transformação Qualquer (P = variável) p 2 Área( A) 1 N Շ Gráfico P x V a V c) Transformação Cíclica ou Fechada: É aquela na qual os estados: final e inicial coincidem (pressão, volume e temperaturas são iguais). P P Շ<0 Շ>0 V Ciclo no sentido horário: Շ > 0 V Ciclo no sentido. Anti-horário: Շ< 0 “Numa transformação cíclica, o trabalho total é dado pela área interna do gráfico”. τ cíclo N Área int erna 2. ENERGIA INTERNA (U) A energia interna de um sistema é a somatória de todas as energias dos átomos e moléculas existentes no sistema. Para gases perfeitos e gases reais monoatômicos a energia interna corresponde à energia cinética de translação das moléculas e é dada por: 3 3 U .nRT .pV 2 2 Onde: n = número de mols do gás; 3 3 U E C .nRT .PV 2 2 R = constante universal dos gases; T = variação de temperatura absoluta do gás. LEI DE JOULE “A energia interna de uma dada quantidade de um gás perfeito é função exclusiva de sua temperatura”. T > 0 U > 0 (a energia interna do sistema aumenta) T < 0 U < 0 (a energia interna do sistema diminui) T = 0 U = 0 (a energia interna do sistema não varia) Exceção: Nas mudanças de estado. Propriedade: A energia interna é função de ponto; portanto, a variação da energia interna (U) não depende dos estados intermediários. 3. PRIMEIRA LEI DA TERMODINÂMICA É o Princípio da conservação da Energia aplicado à Termodinâmica. Seja o sistema: Calor Q U Շ U = Q - Շ U = Variação da energia interna do sistema Q = Energia trocada com o meio exterior na forma de calor Շ= Energia trocada com o meio exterior na forma de trabalho Enunciado: “A variação da energia interna (U) de um sistema é dada pela diferença entre o calor trocado(Q) com o meio externo e o trabalho () realizado no processo termodinâmico” Importante! Transformação adiabática Q=0 → Não ocorrem trocas de calor entre o sistema e o meio. → São muito rápidas. Transformação isocórica Calor absorvido Q > 0 Expansão Շ=0 Շ>0 Calor cedido Q<0 Compressão Շ < 0 Transformações gasosas e a primeira Lei da Termodinâmica Em Resumo Transformação Isobárica Trabalho Շ = p. V Calor Q = U + Շ Isotérmica Շ=Q U = 0 Isométrica Շ=0 Q=Շ Q = U Adiabática Շ = - U Q=0 Cíclica Շ=Q Q=Շ U = - Շ U = 0 V. E. Interna U 0 U = Q Notas: 1ª) Numa compressão adiabática, temos: Շ < 0 Ui < Uf O gás aquece, tem-se: Aumentos da energia interna, de temperatura, de pressão e diminuição de volume (Շ < 0). 2ª) Numa expansão adiabática, temos: Շ > 0 Ui > Uf O gás esfria, tem-se: Diminuições da energia interna, de temperatura, de pressão e aumento de volume (Շ> 0). 4. SEGUNDA LEI DA TERMODINÂMICA A Segunda Lei da Termodinâmica estabelece as condições em que é possível a transformação de calor em trabalho (tem um caráter estatístico estabelece as probabilidades de ocorrência de um fenômeno) Enunciados: 1°) Segundo Rudolf Clausius (1822 – 1888), físico e matemático alemão: “O calor só flui espontaneamente do corpo mais quente - temperatura maior para o corpo mais frio – temperatura menor”. 2°) Segundo Lord Kelvin (1824 – 1907), físico e matemático britânico e Max Planck ( 1858 – 1947 ) , físico alemão: “É impossível construir uma máquina térmica, que opere num ciclo termodinâmico, cujo único efeito seja retirar calor de uma fonte quente e convertê-lo integralmente em trabalho mecânico”. 5. MÁQUINAS TÉRMICAS São dispositivos que, operando em ciclos, transformam calor em trabalho. A substância operante pode ser vapor d´água, um gás, um líquido, etc. Q1 Fonte quente T1 1 Շ T2 Q2 Fonte Fria 1 1 Balanço Energético: A energia que entra na máquina é igual a energia que sai da máquina (pelo princípio de conservação da energia): Q1 = Շ + Q2, vem: Շ = Q 1 - Q2 Rendimento de uma máquina Térmica (): η energia..útil energia.. total 1 Q2 Q1 Q1 Em que: Q1 e Q2 em módulo Q1 = calor retirado da fonte quente (energia total); Q2 = calor rejeitado à fonte fria ( energia perdida ); = trabalho útil obtido (energia útil – mecânica). Q2 ≠ 0 η 1 ou η 100 % 6. A Potência de uma Máquina Térmica é dada por: Pot T (Watt, W) 7. REFRIGERADOR (Máquina frigorífica) Dispositivo que opera em sentido contrário ao de uma máquina térmica, retirando calor (Q2) da fonte fria (congelador) e cedendo calor (Q1) à fonte quente (meio exterior). Esse trabalho não é espontâneo, recebendo energia de um agente exterior (compressor); portanto, tal dispositivo não contraria a Segunda Lei da Termodinâmica. Q1 Fonte T1 Quente (trabalho externo) T2 Fonte Q2 Fria Q2 τ e e = número adimensional (não possui unidade); não podendo ser expressa em porcentagem. Eficiência (e): é expressa pela relação entre a quantidade de calor retirada da fonte fria (Q 2) e o trabalho externo envolvido nessa transferência (). 8. CICLO DE CARNOT Em 1824, Carnot idealizou um ciclo reversível (teórico) que proporciona rendimento máximo. O Ciclo de Carnot (fig. abaixo) é constituído por duas Transformações Adiabáticas (BC e DA) alternadas com duas Transformações Isotérmicas (AB e CD), todas elas reversíveis, sendo o ciclo também reversível. p Adiabáticas A Q1 Isotermas B T1 D C 0 Q2 T2 V Rendimento Máximo: ηMÁX 1 T2 T1 CARNOT demonstrou a relação: Q1 Q2 T1 T2 Rendimento (Máx.): máx < 100 % T2: temperatura absoluta da fonte fria; T1: temperatura absoluta da fonte quente. Conclusões 1ª) O rendimento no ciclo de Carnot é função exclusiva das temperaturas absolutas das fontes quente e Fria, não dependendo, portanto, da substancia operante utilizada. 2ª) Há ciclos teóricos reversíveis que podem ter rendimento igual ao do Ciclo de Carnot, mas nunca maior. Mesmo assim, não alcança 100 % ( = 1), pois isso exigiria uma fonte fria no zero absoluto (T2 = 0) e, em conseqüência, teríamos a completa conversão de calor da fonte quente em trabalho ( = Q), o que contraria a Segunda Lei da Termodinâmica. 9. Princípio da degradação da energia - uma variação da 2ª Lei da Termodinâmica A energia utilizável diminui à medida que o universo evolui. Outras formas de energia ordenadas (mecânica, elétrica, química) Conversão não integral, baixo rendimento. Convertem-se Integralmente (100 %) Energia desordenada de agitação térmica ENTROPIA (desordem) É uma propriedade intrínseca dos sistemas, caracterizada pelo fato de seu valor aumentar quando aumenta a desordem nos processos naturais. Em todos os fenômenos naturais, a tendência é uma evolução para um estado da maior desordem (maior entropia). As transformações naturais sempre levam a um aumento na entropia do Universo. De acordo com Clausius, a variação de entropia S de um sistema, quando uma quantidade de calor Q lhe é fornecida num processo isotérmico reversível, à temperatura T, é dada: Função de Estado, medida em J/K S Q T
Baixar