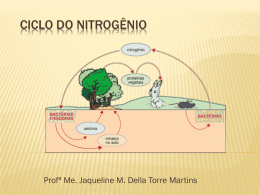
BC-1302 – Química dos elementos Aula 08 1 Propriedades Atômicas BC-1302 – Química dos elementos Configuração Eletrônica e Estados de Oxidação Configuração Eletrônica Estados Oxidação N [He] 2s2 2p3 -3, -2, -1, 0, 1, 2, 3, 4, 5 P [Ne] 3s2 3p3 -3, 0, 1, 3, 5 As [Ar] 3d10 4s2 4p3 -3, 0, 3, 5 Sb [Kr] 4d10 5s2 5p3 0, 3, 5 Bi [Xe] 4f 14 5d10 6s2 6p3 0, 3, 5 BC-1302 – Química dos elementos Nitrogênio Antimônio Fósforo Arsênio Bismuto BC-1302 – Química dos elementos BC-1302 – Química dos elementos Portanto a condutividade diminui do As p/ Bi Tendência oposta na condutividade Sugere caráter molecular mais pronunciado no estado sólido Ocorrência na Natureza BC-1302 – Química dos elementos • Gás diatômico (N2) Nitrogênio • 78 % da atmosfera, mas é o 33º em abundância relativa na crosta terrestre • Possui ligação tripla N!N • Energia de dissociação altíssima (941,4 kJ/mol) ! molécula muito estável ! gás pouco reativo (utilizado c/o atmosfera inerte) • ocorre também na forma de nitrato de sódio (por exemplo o salitre do Chile) • está presente nas proteínas (comp. Média: 50% C, 25% O, 17%N, 7%H, 0,5%S, 0,5%P em peso) • Lavoisier chamou de azoto (sem vida) por ser praticamente inerte Ocorrência na Natureza Fósforo • É o 11o elemento mais abundante na crosta terrestre BC-1302 – Química dos elementos • Existe em três formas alotrópicas: P4 branco ! muito reativo (inflama em contato com o ar) P4 vermelho ! pouco reativo (inflamado por atrito ou aquecimento) P negro ! não reativo (inerte) P4 preto P4 branco P4 vermelho (sólido polimérico) Ocorrência na Natureza Fósforo BC-1302 – Química dos elementos • Fluoroapatita – 3Ca3(PO4)2.CaF2 • Hidroxiapatita – [3Ca3(PO4)2.Ca(OH)2] • Cloroapatita – [3Ca3(PO4)2.CaCl2] http://tasaclips.com/photos.html Ocorrência na Natureza Arsênio, Antimônio e Bismuto • São pouco comuns, mas bem conhecidos (desde a antiguidade) BC-1302 – Química dos elementos • Podem ser encontrados em várias formas alotrópicas • Principal fonte são os sulfetos, que ocorrem combinados com outros minérios Ouro-pigmento ou Orpimento Estibina Realgar As2S3 Sb2S3 As4S4 Bismutinita – Bi2S3 e Bismita – Bi2O3 BC-1302 – Química dos elementos Propriedades Atômicas Propriedades Atômicas Configuração Eletrônica BC-1302 – Química dos elementos Elementos com 5 elétrons no nível mais externo É possível que os elementos adquiram 3 elétrons e passem a apresentar configuração eletrônica de gás nobre (N-3, P-3) Conf. Eletr. de elementos do Grupo 15 ns2 np3 Possuem no de oxidação máximo de 5 (quando os 5 elétrons participam de ligações) A tendência do par eletrônico s não participar de ligações aumenta com o aumento do número atômico ! efeito do par inerte. Nesses casos só os elétrons p participam e os compostos são trivalentes. Configuração eletrônica do fósforo BC-1302 – Química dos elementos 3s 3p P no estado fundamental P no estado excitado Hibridização sp3d P [Ne] 3s2 3p3 3d0 3d O N ([He] 2s2 2p3) pode formar ligações múltiplas fortes p! p! produzindo uma série de compostos que não têm análogos nos BC-1302 – Química dos elementos outros elementos (N2 = 994 KJ.mol-1). BC-1302 – Química dos elementos Propriedades Químicas Propriedades Químicas Hidretos BC-1302 – Química dos elementos Todos os elementos do grupo 15 formam hidretos voláteis de fórmula MH3 A facilidade de formação, a tendência de utilizar o par de elétrons isolados na formação de ligações coordenadas e a facilidade de substituição de hidrogênio por outros grupos diminuem da NH3 para o BiH3 NH3 – amônia PH3 – fosfina AsH3 – arsinaTóxicos SbH3 – estibina BiH3 – bismutina (pouco estável) Agentes redutores fortes 107o Óxidos e Oxi-ácidos BC-1302 – Química dos elementos Nitrogênio Demais elementos Trihaletos e Pentahaletos BC-1302 – Química dos elementos O nitrogênio não forma pentahaletos pela inexistência de orbitais d disponíveis em seus átomos. Forma trihaleto (mais estável é o NF3) Os demais elementos formam pentahaletos do tipo MX5 e trihaletos do tipo MX3 os trihaletos são covalentes com exceção do BiF3 que é iônico e o SbF3 que possui caráter intermediário Bipirâmide trigonal BC-1302 – Química dos elementos Ou PCl5 Hidrólise: PCl5 está no limite iônico-covalente. Nos estados gasoso e líquido é covalente e no estado sólido é iônico BC-1302 – Química dos elementos Métodos de Obtenção • Indústria: Liquefação e destilação fracionada do ar p.e. (N2) = - 196 oC p.e. (Ar) = - 186 oC p.e. (O2) = - 183 oC • No laboratório BC-1302 – Química dos elementos • é usado na fabricação de explosivos pólvora BC-1302 – Química dos elementos Principais Compostos Fertilizantes (fixação de nitrogênio) Fertilizantes possuem no mínimo 3 componentes básicos: Nitrogênio ! normalmente (NH4)2SO4 ! promove crescimento de folhas Fósforo ! Promotor de crescimento de raízes - superfosfato ! Ca3(PO4)2 tratado com H2SO4 conc. - superfosfato triplo ! Ca3(PO4)2 tratado com H3PO4 conc. Potássio ! promotor de floração K2SO4 Principais Compostos Amônia BC-1302 – Química dos elementos • Gás tóxico, condensa a -33 oC (líquido incolor) • Muito solúvel em água devido a formação de ligações de hidrogênio • Os elétrons desemparelhados do orbital p do Nitrogênio formam ligações com três átomos de outros elementos produzindo moléculas com arranjo eletrônico tetraédrico, mas geometria trigonal piramidal. Amônia BC-1302 – Química dos elementos • o Nitrogênio só pode ter 8 elétrons no segundo nível eletrônico, assim, o par de elétrons não ligantes pode ser coordenado a um átomo receptor conferindo ao N o número de coordenação máximo 4 (hibridização sp3) H + NH4+ (cátion Amônio) Amônia BC-1302 – Química dos elementos • NH3 pode coordenar-se à íons [Cu(NH3)4]2+ [Co(NH3)6]3+ BC-1302 – Química dos elementos PROCESSO HABER-BOSCH Fritz Haber Nobel de Química em 1918 Carl Bosch Nobel de Química em 1931 BC-1302 – Química dos elementos Reação exotérmica • À medida que a pressão aumenta, a quantidade de amônia presente no equilíbrio aumenta. • À medida que a temperatura diminui, a quantidade de amônia no equilíbrio aumenta. BC-1302 – Química dos elementos Na prática as condições são: 200 atm de pressão, temperatura entre 380-450 oC e catalisador de “ferro ativado” BC-1302 – Química dos elementos Magnetitas (ferro) contendo: • K2O Mais porosos • CaO Mais ativos em • MgO temperaturas baixas • Al2O3 • SiO2 • Traços de TiO2, ZrO2 e V2O5 BC-1302 – Química dos elementos • Alta pressão: desloca o equilíbrio para menor volume. • Retirada da amônia formada • Alta temperatura BC-1302 – Química dos elementos No Brasil: 1952: 1ª Unidade de amônia sintética (foi posteriormente desativada) Santo André - SP RHODIA BC-1302 – Química dos elementos Amônia 16.000.000.000 Kg NH3/ano EUA (maior parte é utilizado como fertilizante) BC-1302 – Química dos elementos Amônia Principais Compostos BC-1302 – Química dos elementos Hidrazina • tem semelhanças estruturais e químicas com o peróxido de hidrogênio. • É um forte redutor em meio básico e um redutor moderado em meio ácido ou neutro. Ex.: reduz I2 O2 e Cu2+ • Na indústria é utilizada no tratamento de água para alimentação de caldeiras para prevenir a oxidação das mesmas (remove o O2 dissolvido na água) N2H4 (aq) + O2 (g) ! N2 (g) + 2 H2O (l) !H = -621 kJmol-1 • é uma base mais fraca que a amônia N2H4 (aq) + HX ! N2H5+ + XN2H6+2 + 2X- ou N2H4 (aq) + 2HX ! Utilizada na fabricação de propelentes, combustível de foguetes, fabricação de espelhos de prata e cobre Principais Compostos Utilizado em air bags BC-1302 – Química dos elementos Azidas ou Azotetos Detonam por impacto e liberam N2 • azida de sódio pode ser obtida: • azida de chumbo [(Pb(N3)2] é usada como detonador de explosivos • triazina cianídrica (ou triazoteto cianúrico) é um poderoso explosivo Principais Compostos Óxidos e oxiácidos do nitrogênio BC-1302 – Química dos elementos • Todos os oxiácidos do nitrogênio possuem ligações múltiplas p! - p!. • O mesmo não ocorre com os demais elementos do grupo Fórmula No oxid. Nome N2O +1 Óxido nitroso NO +2 Óxido nítrico N2O3 +3 Sesquióxido de nitrogênio NO2N2O4 +4 Dióxido de Nitrogênio (tetróxido de dinitrogênio) N2O5, NO3- +5 Pentóxido de dinitrogênio e ânion nitrato Óxido nitroso ou óxido de dinitrogênio (N2O) • razoavelmente estável, obtido pelo aquecimento cuidadoso do nitrato de amônio • foi usado como anestésico (gás hilariante) BC-1302 – Química dos elementos • é utilizado na produção de azidas • é uma molécula linear e um híbrido de ressonância • como é solúvel em gorduras, é empregado como espumante e propelente em sprays de chantilly. • utilizado para elevar a potência de motores (conhecido com NOs) com poder comburente, cuja aplicação em motores à combustão interna, tem por objetivo aumentar a capacidade de queima na câmara de combustão e consequentemente a energia produzida. Óxido de nitrogênio ou óxido nítrico (NO) • número de oxidação +2 • é um óxido neutro e incolor BC-1302 – Química dos elementos • no laboratório é obtido pela reação de ácido nítrico com metais • industrialmente obtido a partir da amônia (1000 oC, Pt)- processo Ostwald • o N2 da atm é convertido em NO nos motores de aviões. Este, por sua vez, é convertido em HNO2 na presença de água e contribui para a chuva ácida. NO (g) + O3 (g) ! NO2 (g) + O2 (g) • Reage com o O3 da camada de ozônio: • Em nosso organismo, em pequenas quantidades, ajuda a dilatar os vasos sanguíneos. Dióxido de nitrogênio (NO2) BC-1302 – Química dos elementos • é um gás castanho, sufocante e tóxico. • no estado gasoso está em equilíbrio com seu dímero N2O4 incolor marrom Paramagnético Diamagnético Dióxido de nitrogênio (NO2) BC-1302 – Química dos elementos • é produzido pela oxidação de NO na presença de O2 • no laboratório pode ser obtido pelo aquecimento de Pb(NO3)2 • em água forma o ácido nítrico e o óxido de nitrogênio 3 NO2 (g) + H2O (l) ! 2 HNO3 (aq) + NO (g) • N2O4 é anidrido misto N2O4 (g) + H2O (l) ! HNO3 (aq) + HNO2 (aq) • N2O4 e NO2 são agentes oxidantes fortes Principais Compostos Ácido Nítrico BC-1302 – Química dos elementos • é um agente oxidante forte quando concentrado e a quente. O nitrogênio tem número de oxidação +5. • industrialmente é produzido pelo processo de Ostwald BC-1302 – Química dos elementos • o ânion nitrato está em ressonância • o HNO3 na presença de H2SO4 produz íon nitrônio (NO2+) que é usado na nitração de compostos aromáticos • mistura de HCl c/ HNO3 forma-se a água régia (do latim: capacidade de dissolver metais nobres como ouro e platina) 25% 75% BC-1302 – Química dos elementos Principais Compostos Métodos de Obtenção BC-1302 – Química dos elementos Obtido a partir da Apatita (minérios de fosfato de cálcio) a maior parte do fósforo é usado na fabricação de H3PO4 • é componente fundamental dos fertilizantes • é importante na formação dos ácidos nucléicos (grupamento fosfato) e dos ossos (Ca3(PO4)2) e dos fluidos biológicos (fosfatos). • é empregado também na produção de P4S10 (fósforos de segurança) e POCl3 Principais usos dos fosfatos 70% fertilizantes (superfosfatos, superfosfato triplo, fosfato de amônio) BC-1302 – Química dos elementos 13% detergentes ( fosfato de sódio e pirofosfato de sódio) 8% rações animais 3% indústria farmacêutica 2% tratamento de água dura 1% proteção de metais 0,7% fabricação de organofosforados ( inseticidas) 2,3% outros Trióxido de fósforo É dimérico e por isso é representado por P4O6 e não P2O3 É o anidrido do ácido fosforoso BC-1302 – Química dos elementos P4O6 (s) + 6 H2O (l) ! 4 H3PO3 (aq) É um sólido branco e mole (P.F. 24 oC) que queima ao ar e forma P4O10 Pentóxido de fósforo É o óxido mais importante desse elemento É um dímero de fórmula P4O10 e não P2O5 É o anidrido do ácido fosfórico. P4O10 (s) + 6 H2O (l) ! 4 H3PO4 (aq) É usado como agente secante http://www.youtube.com/watch? v=Oke8GinWDG8&feature=PlayList&p=12000EE9CF0D8808&index=26 BC-1302 – Química dos elementos • Suprimento de energia para células ATP + H2O (l) ! ADP + HPO42- (aq) + H+ (aq) !G = - 30 KJ.mol-1 BC-1302 – Química dos elementos Métodos de Obtenção • Existem duas variedades alotrópicas de cada um - uma tetraédrica (As4 e Sb4 ) semelhante ao Pbranco - uma forma metálica muito menos reativa • Existe na forma metálica (átomos grandes, ponto de ebulição baixo) Empregado como liga em detectores de incêndio. BC-1302 – Química dos elementos Métodos de Obtenção • podem ser obtidos de seus minerais • ou como subprodutos do processamento de minerais de outros metais: As – subproduto da extração de minérios de Ni, Co e Fe Sb - subproduto da extração de minérios de Zn Bi - subproduto da extração de minérios de Pb (PbS) São facilmente reduzidos por aquecimento com carvão BC-1302 – Química dos elementos A estabilidade dos pentahaletos dimuniu conforme desce no grupo PF5 PCl5 PBr5 PI5 AsF5 (AsCl5) – reativo e instável SbF5 SbCl5 BiF5 muito reativo – reage explosivamente com água Formam menos óxidos que o nitrogênio e fósforo, provavelmente devido a incapacidade de formar ligações duplas As4O6 (III) As4O10 (V) Sb4O6 (III) Bi2O3 (iônico) (SbO2)n (III e V) Sb4O10 (V) Geralmente os estados de oxidação mais elevados são mais ácidos BC-1302 – Química dos elementos Principais usos • é utilizado c/o dopante em circuitos integrados e lasers • Apesar de ser venenoso é essencial para o crescimento das galinhas, cabras, porcos • Em tecnologias de semicondutores para produzir detectores de infravermelho e diodos emissores de luz • O óxido é utilizado c/o retardante de chama • Compostos de Bi(V) são bons ag. Oxidantes • Medicina por exemplo o seu óxido é usado em pomadas contra hemorróidas
Baixar