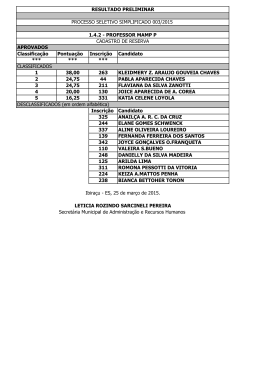
CENTRO DE CIÊNCIAS EXATAS, AMBIENTAIS E DE TECNOLOGIAS Faculdade de Química Tecnológica BIOQUÍMICA A Profa. Dra. Celene Fernandes Bernardes 2012 BIOQUÍMICA A Professora Dra. Celene Fernandes Bernardes Monitora Rafaella Theodoro Buratto PLANO DA DISCIPLINA Ementa Estruturas e propriedades químicas de carboidratos, lipídeos, aminoácidos e proteínas. Mecanismo de ação enzimática. Objetivo Geral Compreender as estruturas e propriedades químicas de carboidratos, lipídeos, aminoácidos e proteínas e atividade enzimática. Objetivos Específicos Identificar e caracterizar as estruturas e propriedades químicas de carboidratos, lipídeos, aminoácidos e proteínas; Identificar as estruturas moleculares de enzimas e caracterizar mecanismos enzimáticos; Desenvolver e aprimorar técnicas laboratoriais para identificar, caracterizar e quantificar sistemas tampões biológicos, aminoácidos, proteínas, carboidratos, lipídeos e vitaminas e para analisar atividade enzimática. Conteúdo Programático a) Aminoácidos, peptídeos e proteínas: estruturas químicas, caráter ácido básico, propriedades químicas e funções biológicas. Estudo dirigido 1. Hemoglobinas – caracterização estrutural, transporte de gases e relação com os mecanismos de manutenção do pH biológico. Estudo dirigido 2. Atividades práticas: Cromatografia de aminoácidos; Caracterização de aminoácidos e proteínas; Titulação de aminoácidos – Relatório 1. Precipitação, purificação, eletroforese e quantificação de proteínas; Sistemas tampões biológicos. b) Enzimas: estrutura molecular, mecanismo de ação, fatores físico-químicos que influem na atividade enzimática, cinética enzimática, enzimas regulatórias e cofatores. Estudo dirigido 3. Atividades Práticas: Caracterização da atividade da enzima amilase salivar. Análise de fatores físico-químicos que interferem na atividade enzimática; Cinética enzimática – elaboração e análise de gráficos – Relatório 2. c) Carboidratos: estruturas e propriedades químicas e funções biológicas. Estudo dirigido 4. Atividades práticas: Identificação geral de carboidratos; Caracterização de carboidratos redutores e polissacarídeos; Análise quantitativa de glicose plasmática, urinária e em alimentos – Relatório 3. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 2 d) Lipídeos: estruturas e propriedades químicas e funções biológicas. Estudo dirigido 5. Atividades práticas: Solubilidade dos triglicerídeos; Identificação e separação de ácidos graxos; Caracterização do glicerol; Saponificação e identificação de sabões insolúveis; Análise quantitativa de colesterol e triglicerídeos em diferentes amostras. Critérios de Avaliação Média semestral = (prova teórica 1 + prova teórica 2 + nota prática ) /3 Nota prática = prova prática (70%) + relatórios (30%) Recuperação = Discussão dos tópicos abrangidos nas provas e nos estudos dirigidos. Uma prova optativa em substituição à prova teórica de menor nota, elaborada com o conteúdo correspondente à prova em substituição, para os alunos que não atingiram a média final igual a 5,0. Bibliografia LEHNINGER,A.L., NELSON,D.L., COX,M.M. Princípios de Bioquímica. São Paulo: Sarvier, 1995. MARZZOCO,A. & TORRES,B.B. Bioquímica Básica. Rio de Janeiro: Guanabara Koogan, 1999. HARPER, H.A., MURRAY, R.K. Harper: Bioquímica. São Paulo: Atheneu, 2002. BERG, J.M. , Tymoczko, J.L., Stryer, L. Bioquímica. Rio de Janeiro: Guanabara Koogan, 2004. CAMPBELL,M.K. Bioquímica. Porto Alegre: Artmed, 2000. CHAMPE,P.C., HARVEY, R.A., BOLNER, A.R. Bioquímica Ilustrada. São Paulo: Artmed, 2000. STRYER,L. Bioquímica. Rio de Janeiro: Guanabara Koogan, 1996. VOET,D. & VOET,J.G. Biochemistry. New York: John Wiley, 1995. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 3 CRONOGRAMA BIOQUÍMICA A 2012 CONTEÚDO TEÓRICO CONTEÚDO PRÁTICO 28/02 Apresentação de programa. Aminoácidos. 2/03 6/03 Aminoácidos, peptídeos e proteínas. 9/03 13/03 Proteínas – discussão do estudo dirigido 1 16/03 20/3 23/03 30/3 Sistemas tampões biológicos 3/4 10/4 Hemoglobinas – caracterização estrutural e transporte de gases – sistemas tampões biológicos - acidoses e alcaloses. Discussão do estudo dirigido 2. Enzimas Divisão de equipes – apresentação de programa e regras de segurança Cromatografia e caracterização de aminoácidos (reação de ninidrina, reação xantoproteica). Titulação de aminoácidos – determinação de pK e ponto isoelétrico. Relatório 1 – análise de gráfico + exercícios Caracterização (reação de biureto), separação e purificação de proteínas. Eletroforese e análise quantitativa de proteínas. 6/04 13/04 17/4 Cinética enzimática. 20/04 24/4 27/04 1/05 Enzimas regulatórias. Discussão do estudo dirigido 3 FERIADO FERIADO Avaliação da atividade da enzima amilase salivar – estudo do efeito de pH e temperatura. Cinética enzimática. Relatório 2 – análise e interpretação de gráfico. Análise de vitamina C. 8/05 15/05 22/5 29/5 5/06 12/06 19/6 Prova teórica 1. Carboidratos Carboidratos – Discussão do estudo dirigido 4. Lipídeos Lipídeos . Discussão dos Estudos dirigidos 5. Prova teórica 2 Vista de provas – recuperação de conteúdos 11/05 18/05 25/05 1/06 8/06 15/06 22/06 26/6 Prova substitutiva da prova teórica de menor nota (para os alunos que não atingiram a média final 5,0) 29/06 24/02 27/3 4/05 Análise quantitativa de glicose. Relatório 3 – gráfico + análise e interpretação dos resultados Recuperação de conteúdos – vista de prova Caracterização de carboidratos Análise quantitativa de triglicerídeos e colesterol Caracterização de ácidos graxos e glicerídeos FERIADO Prova prática (70% da nota prática) Prova segunda chamada – para aqueles que faltaram na prova 1 ou 2 ou na prova prática Vista de provas e notas Obs.: as datas poderão ser adequadas conforme a necessidade BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 4 Bioquímica A AULAS PRÁTICAS BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 5 UNIDADE I – Aminoácidos, Peptídeos e Proteínas. Objetivos Teóricos e Práticos: Caracterizar a estrutura química fundamental dos aminoácidos. Identificar a estrutura química e os nomes dos aminoácidos protéicos. Caracterizar as propriedades ácido-básicas dos aminoácidos. Relacionar com pK dos radicais amino e carboxílico e com o ponto isoelétrico. Descrever estrutura primária de peptídeos e proteínas. Descrever estrutura tridimensional de peptídeos e proteínas. Caracterizar as propriedades das proteínas em solução. Caracterizar métodos de separação, identificação e quantificação de aminoácidos e proteínas. Classificar proteínas e peptídeos considerando a estrutura química e a função biológica. Experimentos Ilustrativos: Cromatografia de aminoácidos. Identificação de aminoácidos e proteínas. Precipitação e purificação de proteínas. Fracionamento das proteínas do leite. Eletroforese e quantificação de proteínas. EXPERIMENTO 1 – Cromatografia de aminoácidos Princípio A cromatografia é um processo físico-químico de separação de componentes de uma mistura através de duas fases imiscíveis (fase móvel e estacionária), uma delas deslocando-se em relação à outra. A separação cromatográfica ocorre através da migração diferencial dos componentes da mistura do sistema bifásico. Durante a passagem da fase móvel sobre a fase estacionária, os componentes da mistura são distribuídos entre as duas fases, de tal modo que são seletivamente retidos pela fase estacionária, resultando em migração diferencial de cada componente. Substâncias diferentes migram em velocidades diferentes de acordo com a afinidade para cada uma das fases. A afinidade baseia-se na solubilidade relativa e no comportamento ácido-basico das diferentes substâncias. A substância deslocará através de um movimento de passagem de uma fase para outra (difusão), de uma maneira desordenada, cada molécula independente da sua vizinha. Disto resulta que algumas moléculas adiantam e outras atrasam. A área ocupada originalmente pela substância irá aumentar enquanto houver deslocamento. O processo de difusão pode ocorrer devido ao gradiente de concentração, aonde as moléculas tendem a migrar de uma zona de maior para uma de menor concentração; como também pode estar relacionado com a natureza porosa do sistema cromatográfico, aonde a desigualdade do sistema pode acarretar deslocamentos diferentes de um mesmo tipo de molécula. Este tipo de difusão, caracterizado como difusão de Eddy ou turbulência, varia com a espessura do sistema e com o grau de irregularidade das partículas do sistema. Os métodos cromatográficos podem ser classificados considerando a forma física do sistema, aonde a fase estacionária pode ser colocada em um tubo (cromatografia em coluna) ou disposta sobre uma superfície plana (cromatografia planar). Outro tipo de classificação considera o estado físico da fase móvel, caracterizando a cromatografia líquida, a gasosa e a supercrítica. Esta última quando a fase móvel apresenta-se na forma de vapor pressurizado, com temperatura acima da temperatura crítica e viscosidade maior que a do líquido, mas mantendo as propriedades de interação com os solutos. Os métodos cromatográficos também podem ser classificados considerando o mecanismo de separação das substâncias, que pode ser físico (cromatografia de adsorção ou partição), químico ou mecânico. O método cromatográfico utilizado para a separação de aminoácidos pode ser classificado como planar, líquida e de partição, aonde o suporte de papel Whatmann n 1e tanto a fase móvel (n-butanol e ácido acético) quanto a estacionária (água) são líquidas. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 6 Reagentes Solvente - n-butanol, ácido acético e água, na proporção de 4:1:1. Padrão de aminoácido metionina – solução aquosa 1mol/L Padrão de aminoácido arginina – solução aquosa 1mol/L Padrão de aminoácido fenilalanina – solução aquosa 1mol/L Amostra de mistura de aminoácidos – solução 1mol/L de metionina + arginina + fenilalanina (1:1:1) Amostra de targifor – solução aquosa de targifor Amostra de metilcolim – solução aquosa de metilcolim Amostra de edulcorante aspartame – solução aquosa de edulcorante contendo aspartame Revelador – ninidrina – solução de ninidrina 0,25g% em acetona Técnica 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Preparar a cuba cormatográfica com o solvente específico para separação de aminoácidos. Saturar a cuba por no mínino 15 minutos. Prepara o suporte cromatográfico (papel Whatmann n 1 17cm x 14cm ) e demarcar os pontos de aplicação dos padrões e amostras. Padrões:- aminoácido metionina ( Met ). aminoácido arginina ( Arg ) . aminoácido fenilalanina ( Phe ). Amostras:- mistura dos padrões (MP) Targifor (T) Metilcolim (M) Edulcorante aspartame (A) Aplicar um toque de cada padrão e amostra nos respectivos locais demarcados no cromatograma. Fazer um cilindro com o cromatograma e colocar na cuba cromatográfica. Esperar a fase móvel fluir pelo papel até atingir 2,0cm da extremidade superior. Marcar a linha de frente do solvente. Secar o cromatograma e revelar com ninidrina à quente ( 80 C ). Demarcar as manchas. Calcular os valores de Rf para identificar os aminoácidos presentes nas amostras, comparando com os padrões. Resultados Padrões = Rf (Met) = ___________. Rf (Arg) = ___________ . Rf (Phe) = __________ . Amostras = misturas de padrões = Rf ____ . Rf ____ . Targifor = Rf ____ . Metilcolim = Rf ____ . Aspartame = Rf ____ . Questões 1. Qual o princípio da separação de aminoácidos de uma mistura através do processo de cromatografia, utilizado em aula prática? 2. Qual a característica das moléculas de aminoácidos que possibilita a separação através de cromatografia de partição? 3. Qual a finalidade das substâncias “padrões”? 4. Quais aminoácidos constituem a molécula de aspartame, que é responsável pela característica “doce” ao paladar? 5. Qual a finalidade da ninidrina no processo de cromatografia de aminoácidos? BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 7 EXPERIMENTO 2 – Identificação de Aminoácidos - Reação de Ninidrina Soluções de -aminoácidos, peptídeos e proteínas, quando aquecidas na presença de ninidrina, apresentam coloração arroxeada. A ninidrina atua como um agente oxidante dos aminoácidos resultando amônia, CO2 e aldeído. A reação de grupos amino livres com ninidrina resulta no produto de condensação denominado Púrpura de Ruhermann. Reagentes Solução aquosa 0,25 g% - aminoácidos glicina e valina Proteína ovoalbumina – solução aquosa 1g% Reativo de ninidrina Amostras Leite, suco de fruta neutralizado Procedimentos e resultados 1. Identificar 6 tubos de ensaio e proceder conforme indicado abaixo: TUBOS PADRÕES E AMOSTRAS 1 2,0 mL de aminoácido glicina 2 2,0 mL de aminoácido valina 3 2,0 mL de proteína ovoalbumina Controle Negativo 4 2,0 mL de água destilada Amostras 5 2,0 mL de leite 6 2,0 mL de suco de fruta Controles Positivos 2. 3. 4. 5. RESULTADOS Acrescentar 5 gotas de reativo de ninidrina em cada tubo. Homogeneizar. Aquecer em banho-maria fervente até observar coloração azul arroxeada nas soluções padrões de aminoácidos e proteína. Retirar do banho-maria, verificar a coloração das soluções e comparar a coloração das amostras com a dos controles. Interpretar os resultados avaliando a presença de aminoácidos na composição das amostras. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 8 EXPERIMENTO 3 – Identificação de Aminoácidos Aromáticos – Reação Xantoproteica Os aminoácidos tirosina e triptofano contêm anéis aromáticos com radicais orto-para dirigentes que reagem com ácido nítrico formando compostos nitrosos de coloração amarela. Ocorre reação de nitração ou substituição de hidrogênio do anel aromático pelo NO2. Peptídeos e proteínas que contenham desta classe de aminoácidos em sua estrutura molecular, resultam em coloração amarela quando na presença de ácido nítrico. Reagentes Aminoácido glicina – solução aquosa 0,25 g% Aminoácido valina – solução aquosa 0,25 g% Aminoácido tirosina – solução aquosa 0,25g% Aminoácido triptofano – solução aquoso 0,25g% Proteína ovoalbumina – solução aquosa 1g% Ácido nítrico 20% solução aquosa Procedimentos e resultados 1. Identificar 6 tubos de ensaio e proceder conforme indicado abaixo: Controles negativos Controles positivos Amostras TUBOS PADRÕES E AMOSTRAS 1 2,0 mL de aminoácido glicina 2 2,0 mL de aminoácido valina 3 2,0 mL de água 4 2,0 mL de aminoácido tirosina 5 2,0 mL de aminoácido triptofano 6 2,0 mL de proteína ovoalbumina RESULTADOS 7 8 2. 3. 4. Acrescentar 1,0mL de ácido nítrico a 20% em cada tubo. Homogeneizar. Aquecer, se necessário, em banho-maria fervente até observar coloração amarela nas soluções de controle positivo (aminoácidos aromáticos) e comparar com a coloração das amostras Interpretar os resultados avaliando a presença de aminoácidos aromáticos na composição das amostras. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 9 EXPERIMENTO 4 – Avaliação Tamponante do Aminoácido Glicina Reagentes Solução ácida 0,1 mol/L de aminoácido glicina Hidróxido de sódio 0,4 mol/L Técnica 1. Titular 40,0mL da solução ácida 0,1 mol/L de aminoácido glicina com hidróxido de sódio 0,4 mol/L. 2. Verificar o pH a cada adição de 1,0mL de base. 3. Construir um gráfico do efeito tamponante do aminoácido glicina, relacionando os valores de pH com os volumes de ácido e base obtidos na realização do experimento. Identificar os pontos de maior efeito tampão e as espécies químicas predominantes. Resultados Volume de NaOH (mL) 0,0 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 9,0 10,0 11,0 12,0 13,0 14,0 15,0 pH ( glicina ) Volume de NaOH (mL) 16,0 17,0 18,0 19,0 20,0 21,0 22,0 23,0 24,0 25,0 26,0 27,0 28,0 29,0 30,0 pH ( glicina ) Interpretações Os pontos de maior efeito tamponante correspondem aos valores de pKa das espécies químicas predominantes nas soluções. O pKa corresponde ao valor de pH aonde ocorre equilíbrio entre a concentração molar do sal e do ácido. Experimentalmente, pode ser verificado aonde verifica-se maior resistência à variação de pH, mesmo quando adicionado ácido ou base. O pKa pode ser determinado através da equação de Henderson Hasselback, quando a concentração molar do sal for igual à do ácido. Tampão glicina - pKa (radical carboxílico glicina) = 2,34. pKa (radical amino da glicina) = 9,60. Fisiologicamente, o tampão eficiente corresponde àquele que apresenta pKa mais próximo ao pH dos líquidos biológicos. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 10 RELATÓRIO 1 – GRÁFICO + ESTUDO DIRIGIDO 1 Estudo dirigido: Relação entre a curva de titulação e as propriedades ácido-básicas da glicina. (referência – Princípios de Bioquímica – Lehninger) Um volume de 100 mL de solução de glicina 0,1mol/L e com pH 1,72 foi titulado com solução de NaOH 2 mol/L. Durante a titulação o pH foi acompanhado e os resultados lançados no gráfico abaixo. Os pontoschave da titulação foram marcados de I a V no gráfico. Para cada uma das afirmativas abaixo, identificar o ponto-chave na titulação. a) b) c) d) e) f) g) h) i) j) k) l) m) n) o) p) q) r) s) em qual ponto a glicina estará presente predominantemente como a espécie +H3N-CH2-COOH? em qual ponto a carga média líquida da glicina é + ½? Em qual ponto o grupo amino de metade das moléculas da glicina está no estado ionizado? Em qual ponto o pH tem valor igual ao pKa de ionização do grupo carboxila da glicina? Em qual ponto o pH tem valor igual ao pKa de ionização do grupo amino protonado? Em quais pontos a glicina tem capacidade máxima de tamponamento? Em qual ponto a carga líquida média da glicina é igual a zero? Em qual ponto o grupo carboxila da glicina está completamente titulado (primeiro ponto de equivalência)? Em qual ponto metade dos grupos carboxila está ionizada? Em qual ponto a glicina está completamente titulada (segundo ponto de equivalência)? Em qual ponto a forma predominante é +H3N-CH2-COO-? Em qual ponto as estruturas das formas predominantes correspondem a uma mistura meio a meio de + H3N-CH2-COO- e H2N-CH2-COO-? Em qual ponto a carga líquida média da glicina é –1? Em qual ponto as estruturas das formas predominantes correspondem a uma mistura meio a meio de + H3N-CH2-COOH e +H3N-CH2-COO-? Qual ponto corresponde ao ponto isoelétrico? Em qual ponto a carga líquida média da glicina é –1/2? Qual ponto corresponde ao final da titulação? Se desejar utilizar a glicina como um tampão eficiente, quais pontos representam os piores valores de pH para a capacidade tamponante? Em qual ponto da titulação a espécie predominante é H 2N-CH2-COO-? BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 11 EXPERIMENTO 5 – Identificação de Proteínas - Reação de Biureto Soluções de polipeptídeos e proteínas, na presença de Reagente de Biureto, que contém íons cúpricos em meio alcalino, resultam em complexo de coloração arroxeada. A cor é devido a um complexo de coordenação do átomo de cobre e quatro átomos de nitrogênio, cada um decorrente de uma ligação peptídica. Desta forma, aminoácidos e dipeptídeos não reagem com o Biureto, sendo necessárias, no mínimo, duas ligações peptídicas para que a reação ocorra. Reagentes Aminoácido glicina – solução aquosa 0,25 g% Aminoácido valina – solução aquosa 0,25 g% Proteína ovoalbumina – solução aquosa 1g% Reativo de Biureto Procedimentos e resultados 1. Numerar 5 tubos de ensaio e proceder conforme indicado abaixo: TUBOS PADRÕES OU AMOSTRAS Controles Negativos 2. 3. 4. 5. 1 2,0 mL de aminoácido glicina 2 2,0 mL de aminoácido valina Controle Positivo 3 2,0 mL de proteína ovoalbumina Amostras 4 2,0 mL de leite 5 2,0 mL de suco de fruta RESULTADOS Acrescentar 1,0 mL do Reativo de Biureto em cada tubo.(CUIDADO – SOLUCÃO ALCALINA) Homogeneizar. Observar a coloração das soluções controles e comparar com a coloração das amostras. Interpretar os resultados avaliando a presença de proteínas na composição das amostras. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 12 EXPERIMENTO 6 – Precipitação protéica com ácidos fortes A mudança de pH e o aquecimento são fatores que acarretam a desnaturação de proteínas. Desnaturação é a alteração da conformação protéica, podendo ocorrer alterações na estrutura tridimensional da proteína, permanecendo íntegra a estrutura primária. Com a desnaturação são alteradas as interações não covalentes, como pontes de hidrogênio e ligações iônicas, que estabilizam a conformação tridimensional das proteínas. Desta forma, ficam expostos os grupos hidrofóbicos presentes no interior das moléculas, acarretando a interação destes grupos e coagulação protéica, evidenciada através de precipitado. A desnaturação acarreta a perda da atividade biológica e funcional e altera as propriedades das proteínas, acarretando aumento na reatividade química e diminuição da solubilidade. Reagentes Solução protéica – solução aquosa de ovoalbumina 1g% Ácido nítrico concentrado Técnica 1. Colocar 2,0 mL de solução protéica em um tubo de ensaio. 2. Adicionar 1,0 mL de ácido nítrico concentrado. 3. Homogeneizar lentamente e observar o precipitado branco característico de proteínas. Resultados Proteína Ovoalbumina + ácido nítrico = ______________________________________________ EXPERIMENTO 7 – Precipitação protéica com solventes orgânicos Os solventes orgânicos apresentam menor constante dielétrica que a água, diminuindo a repulsão entre as cargas opostas; em conseqüência, ocorrendo maior interação entre as moléculas protéicas e diminuição da solubilidade. A adição de etanol (constante dielétrica igual a 24) ou acetona (constante dielétrica igual a 21,4) em uma solução protéica aquosa (constante dielétrica da água igual a 80) aumenta as forças de atração entre as cargas opostas, acarretando agregação das moléculas. Em meio ácido ou alcoólico pode ser observada a precipitação da glicoproteína “mucina” presente na saliva. A mucina constitui de 0,1 a 0,3% dos componentes da saliva e caracteriza a alta viscosidade deste fluido bucal, que normalmente apresenta densidade da ordem de 1000 a 1020. Reagentes Etanol anidro Acetona Técnica 1. Identificar dois tubos de ensaio e colocar: Tubo 1: 1,0 mL de leite + 2,0 mL de etanol Tubo 2: 1,0 mL de leite + 2,0 mL de acetona 2. Homogeneizar e observar o precipitado branco característico de proteínas. Resultados Tubo 1 = leite + etanol = _____________________________________________________________ Tubo 2 = leite + acetona = ___________________________________________________________ BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 13 EXPERIMENTO 8 – Precipitação protéica por Sais de Metais Pesados Sais de metais pesados,como o mercúrio, acarretam a precipitação protéica devido à interação de cargas opostas. As proteínas com cargas negativas, atuando como ânions, podem formar sais insolúveis com determinados cátions como Ag++, Fe++ e Hg++. Reagentes Solução protéica – solução aquosa de ovoalbumina 1g% Cloreto mercúrico – solução aquosa 5 g% Técnica 1. Colocar 2,0 mL de solução protéica em um tubo de ensaio. 2. Adicionar 30 gotas de solução de cloreto mercúrico 5g%, lentamente, pelas paredes do tubo. 3. Observar turvação da solução caracterizando precipitação de proteínas. Resultados Ovoalbumina + cloreto mercúrico = ________________________________________________________ EXPERIMENTO 9 – Precipitação protéica por “Salting out” “Salting out” caracteriza a precipitação de proteínas de suas soluções aquosas por adição de sal. Os sais de íons bivalentes como MgCl 2 e (NH4)2SO4 têm efeito na solubilidade das proteínas globulares devido alterarem a força iônica das moléculas. Concentrações elevadas de sais podem remover a água de hidratação das moléculas protéicas, expondo as cargas elétricas e possibilitando uma maior interação eletrostática entre as moléculas. Desta forma, pode ocorrer agregação das moléculas e precipitação. Reagentes Sulfato de amônia – solução aquosa 50 g% Técnica 1. Colocar 2,0 mL de leite em um tubo de ensaio. 2. Adicionar 2,0 mL de solução de sulfato de amônia a 50g%, lentamente, pelas paredes do tubo. 3. Observar turvação da solução caracterizando precipitação de proteínas. Resultados Leite + sulfato de amônia = _____________________________________________________________ EXPERIMENTO 10 – Diálise – Purificação Proteica A diálise é uma técnica que permite a separação de substâncias de peso molecular diferentes através de uma membrana semi-permeável. Moléculas menores são difundidas através da membrana e as maiores ficam retidas dentro da câmara de diálise. A técnica de diálise pode ser utilizada para purificar proteínas, separando-as do sal que foi utilizado como agente precipitante. Através do teste com cloreto de bário comprova-se que o sal precipitante, o sulfato de amônia, por ter menor peso molecular que as proteínas, foi dialisado. A reação do cloreto de bário com o sulfato de amônia resulta em cloreto de amônia e sulfato de bário, insolúvel em meio aquoso. O resultado negativo da reação de Biureto comprova que as proteínas não foram dialisadas. Devido ao alto peso molecular, as proteínas ficaram retidas na câmara de diálise. Reagentes Cloreto de bário - solução aquosa 10g% Reativo de Biureto Técnica 1. Colocar a proteína precipitada pela técnica de “salting out” em uma câmara de diálise. 2. Colocar a câmara de diálise em um bécker contendo água destilada. 3. Aguardar aproximadamente 5 minutos. 4. Comprovar a diálise do sal para a água realizando os testes descritos a seguir: BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 14 Teste A = Comprovação da diálise do sal 1. Identificar 3 tubos de ensaio e colocar: a) 1,0 mL da solução do becker b) 1,0 mL de água c) 1,0 mL de solução de sulfato de amônia 2. Acrescentar 10 gotas de cloreto de bário a 1g%. Homogeneizar e observar. Teste B = Comprovação da ausência de proteínas na solução dialisada 1. Identificar 3 tubos de ensaio e colocar: a) 1,0 mL da solução do becker b) 1,0 mL de água c) 1,0 mL de leite 2. Acrescentar 1,0 mL do Reativo de Biureto. Homogeneizar e observar. Resultados e Interpretações Teste A = tubo a) ____________________________________________________________________ Tubo b) ____________________________________________________________________ Tubo c) ____________________________________________________________________ Teste B = tubo a) ____________________________________________________________________ Tubo b) ____________________________________________________________________ Tubo c) ____________________________________________________________________ Interpretar os resultados considerando que, no Teste a, o aparecimento de precipitado branco caracteriza a diálise do sulfato de amônia para a água do becker e no teste b, o desenvolvimento de solução com coloração azul, característica de resultado negativo da reação de Biureto, comprova a ausência de diálise de proteínas para a água do bécker. EXPERIMENTO 11 – Precipitação Protéica por Ponto Isoelétrico – Fracionamento das Proteínas do Leite O fracionamento das proteínas do leite pode ser realizado através da precipitação da caseína no ponto isoelétrico. Ponto isoelétrico é o pH aonde as proteínas apresentam-se como íons dipolores que são moléculas eletricamente neutras. Cada proteína apresenta um ponto isoelétrico específico. Neste pH, as moléculas protéicas apresentam interação eletrostática entre os grupos carregados e pouca interação com a água, o que acarreta a agregação molecular e precipitação. Acima do ponto isoelétrico as proteínas atuam como ácido, doando prótons e apresentando carga líquida negativa. Abaixo do ponto isoelétrico, as proteínas atuam como base, recebendo prótons e apresentando carga líquida positiva. Nestas situações, devido a mínima interação eletrostática entre os grupos carregados, as moléculas se repelem e não observa-se precipitação protéica. O ponto isoelétrico da proteína caseína do leite é 4,6, ocorrendo precipitação e permanecendo em solução as lactoglobulinas, que têm ponto isolelétrico igual a 5,25 e as lactoalbuminas. Reagentes Ácido acético 0,1 mol/L e Reativo de Biureto Técnica 1. Em um bécker de 50 mL colocar 20,0 mL de leite integral tipo A. Adaptar a um peagâmetro. 2. Acrescentar ácido acético 0,1 mol/L, gota a gota, com agitação suave e constante, até atingir o ponto isoelétrico da caseína (pH 4,6), no qual o leite coagula. 3. Colocar o conteúdo em tubo específico e centrifugar por 5 minutos a 3000 r.p.m. 4. Separar o sobrenadante e adicionar 1,0 mL do Reativo de Biureto. 5. Ressuspender o precipitado em 2,0 mL de água destilada e adicionar 1,0 mL de Reativo de Biureto. 6. Verificar a coloração das soluções. 7. Interpretar os resultados considerando a composição de proteínas no precipitado e no sobrenadante. Resultados Sobrenadante = _______________________________________________________________________ Precipitado = _________________________________________________________________________ BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 15 EXPERIMENTO 12 – Eletroforese de Proteínas plasmáticas Eletroforese é uma técnica utilizada para separar partículas com cargas através de um campo elétrico. Dependendo da carga elétrica líquida, a substância desloca-se para o pólo de carga contrária, com velocidade relativa que depende da intensidade do campo elétrico, do tamanho e da carga líquida total das partículas e do atrito do suporte eletroforético. O caráter anfótero das proteínas possibilita a separação destas moléculas através do processo de eletroforese. Dependendo do pH do meio em relação ao ponto isoelétrico das proteínas, estas podem apresentar cargas positivas, negativas ou carga efetiva neutra, podendo ser separadas utilizando um campo elétrico. As proteínas do soro humano apresentam carga efetiva negativa quando colocadas em um meio com pH 8,6, possibilitando a migração para o polo positivo, através do processo de anadoforese. As frações protéicas verificadas através desde processo são albumina, 1- globulinas, 2- globulinas, - globulinas e - globulinas. A proteína fibrinogênio pode ser verificada quando o processo de eletroforese for realizado no plasma. As moléculas migram distâncias diferentes dependendo do ponto isoelétrico e do peso molecular de cada fração protéica. A fração albumina, que possui ponto isolelétrico igual a 4,7, migra uma distância maior do ponto de aplicação em direção ao pólo positivo do que a fração - globulina, que apresenta ponto isoelétrico igual a 7,2. A eletroforese é uma técnica bastante utilizada na separação de proteínas e consiste de um exame clínico quando realizada em fluídos biológicos. A figura abaixo representa o perfil eletroforético das proteínas do soro. Reagentes Tampão veronal pH 8,6 Corante Ponceau’S Ácido acético – solução 5% Metanol anidro Solução diafanizadora – metanol + ácido acético + glicerina na proporção 85:14:1 Técnica 1. Preparar a cuba/fonte eletroforética com o tampão veronal pH8.6 e adaptar as fitas de acetato de celulose. 2. Aplicar o soro na borda catódica da fita. 3. Deixar a corrente fluir por 40 minutos. 4. Realizar a coloração das proteínas em corante Ponceau’S por 5 minutos, com subsequente descoloração da fita em ácido acético 5%. 5. Desidratar as fitas em metanol e verificar as frações protéicas coradas. 6. Diafanizar as fitas colocando inicialmente, por 5 minutos, em solução de metanol, ácido acético e glicerina 85:14:1 e depois em estufa a 80 C. 7. Através do processo de densitometria, verificar o perfil eletroforético das proteínas do soro. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 16 Resultados Consiste da identificação das frações protéicas e cálculos de valores relativos e valores absolutos (g/dL) para cada fração protéica. A quantificação de cada fração protéica (valor absoluto em g/dL) é obtida pela relação do valor relativo (%) com a concentração de proteínas totais da amostra (experimento 13). Obs.: os valores relativos foram propostos aleatoriamente como descritos na tabela abaixo Fração Proteica Valores Relativos (%) Valores Absolutos (g/dL) Valores de referência (g/dL) Albumina 59,1 4,15 g/dL 0,51 1-globulinas 3,6 0,25 g/dL 0,08 2-globulinas 9,2 0,64 g/dL 0,11 - globulinas 10,2 0,71 g/dL 0,20 -globulinas 17,9 1,26 g/dL 0,42 Comparar os resultados com os valores de referência considerados para a eletroforese do soro de adultos normais. EXPERIMENTO 13 – Análise quantitativa de proteínas por espectrofotometria A reação de Biureto, utilizada para a análise de proteínas plasmáticas totais, envolve a formação de um complexo entre quatro nitrogênios de ligações peptídicas e o íon cobre do reativo. A reação ocorre em meio básico e o complexo de cor violeta desenvolvido é proporcional à concentração de proteínas na amostra. Reagentes Reativo de Biureto = 15 g de sulfato de cobre pentahidratado + 6 g de tartarato duplo de sódio e potássio + 3 % de hidróxido de sódio 10 g% Padrão de proteínas = solução aquosa de soroalbumina bovina 7 g/dL Procedimentos e resultados 1. Identificar 4 tubos de ensaio e proceder conforme esquema abaixo: Reativo de Biureto Padrão ou amostras B (branco) 3,0mL - P (padrão 7 g/dL) 3,0mL 50 L A1 (amostra de soro 1) 3,0mL 50 L Tubos 2. 3. 4. 5. Resultados Absorbância Concentração (g/dL) Homogeneizar as soluções e Incubar por 15 minutos em banho-maria a 37 C. Resfriar em água corrente. Verificar os valores de absorbância do padrão (tubo P) e da amostras (tubos A1 e A2) em 540nm de comprimento de onda, calibrando o aparelho com o tubo B (branco). Calcular a concentração de proteínas (g/dL) nas amostras, considerando a seguinte relação: [PROTEÍNAS] (g/dL)= Absorbância da amostra x FATOR Fator = concentração de proteínas no padrão (=7,0 g/dL) Absorbância do padrão Valores de Referência: Soro humano (sangue colhido em jejum) = 6,1 a 7,9g/dL BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 17 UNIDADE II – pH e Sistemas Tampões Biológicos. Química da Respiração. Acidoses e Alcaloses. OBJETIVOS TEÓRICOS E PRÁTICOS: Caracterizar pH, pK e sistemas tampões. Identificar os métodos práticos para avaliação de pH. Descrever o mecanismo de ação dos sistemas tampões. Verificar experimentalmente a função de sistemas tampões. Caracterizar os sistemas tampões com atividade em sistemas biológicos. Caracterizar os mecanismos de manutenção do pH fisiológico. Caracterizar acidoses e alcaloses. Descrever as trocas gasosas nos alvéolos e nos tecidos Descrever o transporte de gases no sangue e a função da hemoglobina EXPERIMENTOS ILUSTRATIVOS: Caracterização de pH e sistemas tampões. Caracterização de sistemas tampões biológicos. INTRODUÇÃO: Potencial Hidrogeniônico = pH = - log [H+] O pH indica o caráter ácido-básico de uma solução. Soluções neutras apresentam pH igual a 7,0, que corresponde à concentração de íons hidrogênio igual a 1 x 10 -7 mol/L. -7 Soluções ácidas apresentam a concentração de íons hidrogênio maior que 1 x 10 mol/L e, conseqüentemente, o pH menor que 7,0. Soluções básicas ou alcalinas apresentam a concentração de íons hidrogênio menor que 1 x 10 -7 mol/L e, conseqüentemente, o pH maior que 7,0. Solução Tampão é aquela que resiste à adição ou perda de ácido ou base, sem que ocorra acentuada mudança na concentração hidrogeniônica da solução e, consequentemente, no pH. Geralmente são misturas de um ácido fraco ou uma base fraca em presença do sal correspondente. O pH de uma solução tampão e a variação do pH em função da adição de um ácido ou de uma base pode ser calculado à partir da equação de Henderson-Hasselbach, onde: pH = pKa + log [sal] . [ácido] pK = logarítmo negativo da constante de dissociação do ácido. A análise da equação de Henderson-Hasselbach indica que o pH da solução será igual ao pKa (ou pKb) do ácido fraco (ou da base) quando a concentração molar de sal e de ácido for a mesma. Este valor de pH corresponde ao tamponamento mais eficiente da solução; caracterizado como o ponto de equilíbrio entre as moléculas doadoras (ácido fraco) e as aceptoras de H + (ânion), reagindo com a mesma eficiência à adição de bases ou ácidos. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 18 EXPERIMENTO 1 – Caracterização de pH e Sistema Tampão Reagentes Ácido acético 0,1mol/L Acetato de sódio 0,1mol/L Ácido clorídrico 0,1mol/L Hidróxido de sódio 0,1mol/L Fosfato dibásico de sódio (Na2HPO4) ou potássio (K2HPO4) 0,1mol/L Fosfato monobásico de sódio (NaH2PO4) ou potássio (KH2PO4) 0,1mol/L Técnica 1. Identificar 6 béckers ou copos plásticos e colocar as soluções indicadas abaixo: 2. 3. 4. 5. 6. BÉCKER SOLUÇÕES pH inicial ÁCIDO OU BASE 1 20,0mL ácido acético + 20,0mL acetato sódio 1,0mL ácido clorídrico 2 20,0mL ácido acético + 20,0mL acetato sódio 1,0mL hidróxido sódio 3 20,0mL fosfato monobásico + 20,0mL fosfato dibásico 1,0mL ácido clorídrico 4 20,0mL fosfato monobásico + 20,0mL fosfato dibásico 1,0mL hidróxido sódio 5 40,0mL água 1,0mL ácido clorídrico 6 40,0mL água 1,0mL hidróxido sódio pH final Verificar o pH inicial de cada solução utilizando aparelho peagâmetro. Adicionar 1,0 mL de ácido clorídrico 0,1 mol/L nos béckers numerados 1, 3 e 5. Homogeneizar e verificar o pH final. Adicionar 1,0 mL de hidróxido de sódio 0,1 mol/L nos béckers numerados 2, 4 e 6. Homogeneizar e verificar o pH final. Interpretar os resultados. Interpretações As soluções dos béckers 1 e 2 resistem à variação de pH quando da adição de ácido ou base, o que caracteriza SOLUÇÃO TAMPÃO. Os íons acetato do Sistema Tampão reagem com os íons hidrogênio do ácido clorídrico produzindo ácido acético que, devido ser fracamente dissociável, não acarreta mudança apreciável no pH do meio. A adição de hidróxido de sódio à solução tampão acarreta discreto aumento no valor do pH, quando comparado com a mesma quantidade de hidróxido de sódio adicionada à água. Na solução tampão ocorre reação dos íons hidrogênio, decorrentes da dissociação do ácido acético, com os radicais hidroxilas da base, produzindo água e acetato. O efeito tamponante é mais eficiente no valor de pH 4,76, que corresponde ao pK do ácido acético. A eficácia do sistema tampão preparado em aula pode ser avaliada comparando o valor do pH verificado quando da adição da mesma concentração de sal e ácido e o valor teórico do pK. CH3-COO- + H+ CH3-COOH CH3-COOH CH3-COO- + H+ As soluções dos béckers 3 e 4 também resistem à variação de pH quando da adição de ácido ou base, o que caracteriza SOLUÇÃO TAMPÃO. Os íons HPO 42- do Sistema Tampão reagem com os íons hidrogênio do ácido clorídrico produzindo H2PO4- que, devido ser fracamente dissociável, não acarreta mudança apreciável no pH do meio. A adição de hidróxido de sódio à solução tampão acarreta discreto aumento no valor do pH, quando comparado com a mesma quantidade de hidróxido de sódio adicionada à água. Na solução tampão ocorre reação dos íons hidrogênio, decorrentes da dissociação do H 2PO4- , com os radicais hidroxila da base, produzindo água e HPO 42-. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 19 EXPERIMENTO 2 – Caracterização de Sistemas Tampões Biológicos Reagentes Fosfato dibásico de sódio (Na2HPO4) ou potássio (K2HPO4) 0,1mol/L Fosfato monobásico de sódio (NaH2PO4) ou potássio (KH2PO4) 0,1mol/L Técnica 1. 2. 3. 4. Numerar 2 béckers e colocar as soluções indicadas abaixo: Bécker 1 – 40,0 mL de água Bécker 2 – solução tampão = 20,0 mL de fosfato dibásico + 20,0 mL de fosfato monobásico Verificar o valor do pH com aparelho pHmetro. Mantendo as soluções em contato com o eletrodo do aparelho pHmetro, assoprar por 30 segundos e verificar o pH. Interpretar os resultados. Resultados BÉCKER pH inicial pH após assoprar 1 = água 2 = solução tampão Interpretação As soluções dos béckers 1 e 2 resistem à variação de pH quando da adição de ácido ou base, o que caracteriza SOLUÇÃO TAMPÃO. Os íons HPO42- do Sistema Tampão reagem com os íons hidrogênio do ácido clorídrico produzindo H 2PO4- que, devido ser fracamente dissociável, não acarreta mudança apreciável no pH do meio. A adição de hidróxido de sódio à solução tampão acarreta discreto aumento no valor do pH, quando comparado com a mesma quantidade de hidróxido de sódio adicionada à água. Na solução tampão ocorre reação dos íons hidrogênio, decorrentes da dissociação do H 2PO4- , com os radicais hidroxila da base, produzindo água e HPO 42-. Ao assoprar, ocorre reação do CO2 com a água, resultando ácido carbônico, que, após dissociação, libera íons hidrogênio. Na água, os íons hidrogênio acarretam a diminuição do pH; entretanto, no sistema tampão, os íons hidrogênio são tamponados pelo HPO 42-, não ocorrendo alterações significativas no valor do pH. HPO42- + H+ H2O + CO2 H2PO4H2CO3 H2PO4- + OH- HPO42- + H2O H+ + HCO3- QUESTÕES 1. Em qual solução do experimento 2 (tampão ou água) foi verificada menor variação de pH após a adição de HCl e NaOH? Qual a função de um sistema tampão? 2. Qual a constituição química de um sistema tampão e qual o mecanismo de atuação? 3. Em que valor de pH o sistema tampão tem melhor atividade? Explicar. 4. O sistema tampão acetato (experimento 2) foi corretamente preparado? Como pode ser verificado? Caso não tenha sido corretamente preparado, quais as possibilidades de explicação para o erro? 5. O pH inicial verificado para a solução tampão do experimento 3 é ideal para manutenção do pH fisiológico da saliva e do plasma sanguíneo? Explicar. 26. Qual a proporção do par conjugado sal e ácido, correspondente às formas HPO 4 e H2PO4 , para constituição do tampão fosfato visando à manutenção do pH aproximado de 6,8 da saliva e 7,4 do plasma sanguíneo? Considerar pK do par conjugado do tampão fosfato igual a 6,7. 7. Qual o mecanismo de reação do sistema tampão fosfato para manutenção do pH fisiológico quando da adição de ácido ou base? 8. Relacionar alterações no equilíbrio da equação abaixo com o pH do sangue. Caracterizar os termos acidose respiratória, acidose metabólica, alcalose respiratória e alcalose metabólica. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 20 UNIDADE III – Enzimas OBJETIVOS TEÓRICOS E PRÁTICOS Caracterizar: estrutura molecular de enzimas, cofatores, coenzimas e substrato. Descrever o mecanismo de ação das enzimas. Identificar os fatores que influem na atividade enzimática – concentração de enzima, concentração de substrato, tempo de reação, pH e temperatura. Caracterizar cinética enzimática. Caracterizar e determinar graficamente a constante de Michaelis e Menten (Km) e a velocidade máxima da reação enzimática. Caracterizar afinidade e especificidade enzimática Caracterizar enzimas regulatórias do metabolismo. EXPERIMENTOS ILUSTRATIVOS Avaliação da atividade da enzima amilase salivar. Efeito do tempo de incubação, do pH e da temperatura. Cinética enzimática - Efeito da concentração do substrato na atividade da enzima invertase – Determinação de Km e velocidade máxima de reação. EXPERIMENTO 1 – Avaliação da atividade da enzima amilase salivar – efeito do pH e da temperatura. A enzima -amilase presente na saliva, em condições específicas de pH 6.8 e temperatura 37 C, catalisa a hidrólise das ligações osídicas -1-4 da cadeia glicosídica do polissacarídeo amido. A hidrólise do amido, catalisada pela -amilase, é considerada parcial e os produtos resultantes são uma mistura de moléculas de glicose, maltose e dextrina limite. Dextrina limite é um tipo de glicosana não degradável pela ação catalisadora da -amilase devido apresentar ligações osídicas do tipo -1,6 nas extremidades das cadeias. A hidrólise das ligações osídicas -1,6 pode ser catalisada pela enzima específica amilo-1,6-glicosidase. A hidrólise do amido pode ser evidenciada na presença de iodo. Devido à hidrólise, o tamanho da cadeia glicosídica do amido diminui e a reação com o iodo não ocorre, deixando de ser evidente a coloração azul arroxeada característica de amido na presença de iodo. A atividade enzimática de hidrólise do polissacarídeo amido pela enzima amilase salivar pode ser evidenciada em condições ideais de temperatura (37 C) e pH 6,8. O efeito da temperatura sobre a velocidade das reações enzimáticas é duplo. A velocidade da reação aumenta com o aumento da temperatura até que um máximo seja atingido, num mecanismo denominado de ativação térmica. Acima da temperatura de atividade enzimática máxima, ocorre diminuição da velocidade da reação devido ao processo de desnaturação protéica. As enzimas apresentam atividade máxima é um determinado valor ou faixa de pH, denominado de pH ótimo. A variação do pH afeta o caráter iônico dos grupos carboxila e amina da molécula protéica, o que pode acarretar alteração da conformação da molécula e impedir a ligação do substrato no sítio ativo da enzima, alterando a atividade. Reagentes Tampão Fosfato 0,1 mol/L pH 6,8 (KH2PO4 0,1 mol/L + NaOH 0,1 mol/L até pH 6,8) Amido – solução aquosa a 1 g%, Glicose – solução aquosa a 1 g% Reativo de Lugol – solução de iodo 0,1 mol/Litro NaOH – solução aquosa de hidróxido de sódio 0,1 g% HCl – solução aquosa de ácido clorídrico 0,1% BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 21 Procedimentos e resultados 1. Coleta da enzima: Coletar 1,5 mL de saliva e diluir na proporção 1:4 com tampão fosfato pH 6.8 (1,5 mL de saliva + 4,5 mL de tampão). Reservar a saliva diluída para ser utilizada em etapas posteriores. 2. Caracterização de padrões: 1. Identificar 2 tubos de ensaio e proceder conforme esquema abaixo: RESULTADOS 3. 4. 5. 6. Tubo 1 (Padrão de não hidrólise) 2,0 mL de amido 2 gotas do Reativo de Lugol Tubo 2 (Padrão de hidrólise total) 2,0 mL de glicose 2 gotas do Reativo de Lugol Homogeneizar e observar. Coloração azul-arroxeada evidencia a formação de complexo de iodo com o polissacarídeo amido, caracterizando um padrão indicativo de que não ocorreu hidrólise . Coloração amarela caracteriza padrão de hidrólise total do amido. Reservar os tubos para comparação com a análise das amostras a seguir. 3. Avaliação do efeito do pH na atividade enzimática 1. Identificar 3 tubos de ensaio e proceder conforme esquema abaixo: Tubo 1 Tubo 2 Tubo 3 2,0mL amido 2,0mL amido 2,0mL amido 2,0mL tampão fosfato pH6,8 2,0mL HCl 2,0mL NaOH 500 L saliva 500 L saliva 500 L saliva 20 minutos em banho-maria a 37 C 2 gotas reativo lugol 2. 3. 2 gotas reativo lugol 2 gotas reativo lugol (ou quantidade suficiente para observar coloração) Agitar e observar a coloração. Comparar com a coloração das soluções padrões e verificar a hidrólise de cada amostra. Tubos Condições Experimentais 1 amido + enzima – pH 6,8 – 37 C 2 amido + enzima – pH ácido - 37 C 3 amido + enzima – pH básico – 37 C RESULTADOS BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 22 4. Avaliação do efeito da temperatura na atividade enzimática 1. Identificar 3 tubos de ensaio e proceder conforme esquema abaixo: Tubo 1 2. 3. Tubo 2 Tubo 3 2,0mL amido 2,0mL amido 2,0mL amido 2,0mL tampão fosfato pH6,8 2,0mL tampão fosfato pH6,8 2,0mL tampão fosfato pH6,8 5 minutos a 37 C 5 minutos gelo 5 minutos água fervente 500 L saliva 500 L saliva 500 L saliva 20 minutos a 37 C 20 minutos gelo 20 minutos água fervente 2 gotas reativo lugol 2 gotas reativo lugol 2 gotas reativo lugol Agitar e observar a coloração. Comparar com a coloração das soluções padrões e verificar a hidrólise de cada amostra. Tubos Condições Experimentais 1 amido + saliva - 20 minutos – pH 6,8 – 37 C 2 amido + saliva - 20 minutos – pH 6,8 – gelo 3 amido + saliva - 20 min. – pH 6,8 – água fervente RESULTADOS Questões 1. Qual a característica molecular das enzimas? 2. Qual é o substrato da enzima amilase salivar? Qual a característica molecular do substrato? 3. Por que é conveniente fixar o pH e a temperatura na realização dos experimentos enzimáticos? 4. Por que na presença de iodo (reativo de lugol) a solução de amido muda de cor? 5. Por que a solução de glicose não adquire coloração arroxeada na presença de lugol? 6. Como pode ser comprovada a hidrólise do amido? BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 23 EXPERIMENTO 2 – Cinética enzimática - Efeito da concentração do substrato na atividade da enzima invertase – Determinação de Km e velocidade máxima de reação A relação entre a concentração do substrato e a velocidade da reação enzimática pode ser determinada mantendo-se constante a concentração de enzima e aumentando-se, gradativamente, a concentração de substrato, em condições ideais de pH e temperatura. A análise gráfica dos resultados permite determinar a velocidade máxima da reação (Vmáx) e a constante de Michaelis e Menten (Km). Reagentes Suspensão de invertase 0,2 g/dL – diluição 1:20 Tampão acetato 0,05 mol/L, pH 4,7 Solução de sacarose 0,2 mol/L tamponada em pH 4,7 Reativo de cor – constituído das enzimas glicose oxidase e peroxidase, 4-aminoantipirina e fenol. Técnica 1. Identificar 7 tubos de ensaio e proceder conforme esquema abaixo: Reagentes Tubos 1 (branco) 2. 3. 4. 5. 6. 2 3 4 5 6 7 Tampão acetato 3,0 mL 2,5 mL 2,0 mL 1,5 mL 1,0 mL 0,5 - Sacarose 0,2 mol/L - 0,5 mL 1,0 mL 1,5 mL 2,0 mL 2,5 mL 3,0 mL Invertase 0,2 mL 0,2 mL 0,2 mL 0,2 mL 0,2 mL 0,2 mL 0,2 mL Agitar as soluções. Incubar a aproximadamente 25 C (temperatura ambiente), por 5 minutos e adicionar 1,0 mL do reativo de cor em cada tubo. Homogeneizar as soluções e incubar por 15 minutos em Banho-maria a 37 C. Resfriar em água corrente. Verificar a absorbância das amostras em 505nm de comprimento de onda, calibrando o aparelho com o tubo 1 (BRANCO). 7. Calcular a concentração de substrato em cada tubo, considerando a relação abaixo CiVi = CfVf Ci = concentração inicial de sacarose = 0,2mol/L Vi = volume inicial de sacarose – específico para cada tubo Cf = concentração final de sacarose Vf = volume final de sacarose diluída = 3,0 mL 8. Fazer um gráfico relacionando os valores de absorbância (correspondem à quantidade de produtos formados, que caracterizam a atividade da enzima) em função da concentração de substrato. Resultados e Interpretações TUBOS [SUBSTRATO] mol/L ABSORBÂNCIA 1/[SUBSTRATO] 1/ABSORBÂNCIA 1 (BRANCO) zero Zero zero zero 2 3 4 5 6 7 BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 24 RELATÓRIO 2 1. Demonstrar o gráfico e interpretar os resultados do efeito da concentração de substrato na velocidade da reação. 2. Calcular o inverso para os resultados de concentração de substrato e de absorbância e construir o gráfico do “duplo recíproco”, segundo Lineweaver Burk. 3. Determinar a constante de Michaelis e Menten (Km) e a velocidade máxima da reação. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 25 UNIDADE IV – Carboidratos OBJETIVOS TEÓRICOS E PRÁTICOS Caracterizar as estruturas químicas dos carboidratos considerando o radical funcional, o número de carbonos e a isomeria. Identificar os principais monossacarídeos, dissacarídeos e polissacarídeos. Caracterizar carboidratos energéticos e estruturais. Caracterizar as propriedades químicas dos carboidratos. Caracterizar métodos de identificação e quantificação de carboidratos. Caracterizar métodos de separação e hidrólise de polissacarídeos. Identificar derivados de carboidratos. EXPERIMENTOS ILUSTRATIVOS Identificação de carboidratos. Caracterização de carboidratos redutores e polissacarídeos. Análise quantitativa de glicose em alimentos e amostras biológicas. EXPERIMENTO 1 – Análise quantitativa de glicose A análise quantitativa de glicose é realizada através de técnica espectrofotométrica e permite quantificar glicose em solução. A coloração da solução envolve a oxidação da glicose a ácido glucônico e peróxido de hidrogênio, numa reação catalisada pela enzima glicose-oxidase (GOD). O peróxido de hidrogênio é decomposto em presença da enzima peroxidase (POD) possibilitando a oxidação da 4-aminoantipirina a 4antipirilquinimina, resultando em um produto de coloração vermelha cuja intensidade é diretamente proporcional à concentração de glicose na solução. GLICOSE + O2 + H2O GOD ÁCIDO GLUCÔNICO + H2O2 2H2O2 + 4-AMINOANTIPIRINA + FENOL POD ANTIPIRILQUINONOMINA + 4H2O Reagentes Reativo de cor – constituído das enzimas glicose oxidase e peroxidase, de 4-aminoantipirina e de fenol. Solução padrão – glicose 200 mg/dL Amostras de soro, urina, refrigerante comum e refrigerante “diet” Procedimentos e resultados a) Diluição da solução padrão de glicose 1. Diluir a solução padrão de glicose, conforme tabela abaixo: tubo Glicose padrão Água (mL) 200 mg/dL (mL) Concentração de glicose (mg/dL) 1 1,0 4,0 40 2 2,0 3,0 80 3 3,0 2,0 120 4 4,0 1,0 160 5 5,0 - 200 BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 26 b) Curva padrão e quantificação de glicose em amostras 1. Numerar 10 tubos de ensaio e proceder conforme esquema abaixo: Tubos Reativo de cor Soluções diluídas de glicose ou amostras RESULTADOS 1 (branco) 3,0 mL - 2 (glicose 40 mg/dL) 3,0 mL 25 L 40 mg/dL 3 (glicose 80 mg/dL) 3,0 mL 25 L 80 mg/dL 4 (glicose 120 mg/dL) 3,0 mL 25 L 120 mg/dL 5 (glicose 160 mg/dL) 3,0 mL 25 L 160mg/dL 6 (glicose 200 mg/dL) 3,0 mL 25 L 200 mg/dL 7 (amostra soro) 3,0 mL 25 L 8 (amostra de urina) 3,0 mL 25 L 9 (amostra refrigerante 1:10) 3,0 mL 25 L 10 (amostra refrigerante diet) 3,0 mL 25 L ABSORBÂNCIA - CONCENTRAÇÃO - Homogeneizar as soluções e incubar por 15 minutos em Banho-maria a 37 C. Resfriar em água corrente. Verificar a absorbância das soluções diluídas de glicose e das amostras em 505nm de compri mento de onda, calibrando o aparelho com o tubo 1 (BRANCO). 5. Construir um gráfico de curva padrão, considerando no eixo X os valores de concentração de glicose nas soluções diluídas e no eixo Y, os correspondentes valores de absorbância. 6. Interpolar no gráfico de curva padrão os valores de absorbância das amostras e determinar a concentração de glicose correspondente. 7. A concentração de glicose nas amostras também pode ser determinada através de um fator espectrofotométrico, determinado através da média das concentrações e dos valores correspondentes de absorbância. 2. 3. 4. [GLICOSE] na amostra =FATOR x ABSORBÂNCIA AMOSTRA FATOR = . média das concentrações das soluções diluídas de glicose . média dos valores de absorbância das soluções diluídas de glicose Obs.: para amostras diluídas multiplicar a concentração de glicose pelo fator de diluição. Valores de Referência Soro humano (sangue colhido em jejum) = 70 a 115mg/dL Urina = até 100mg/L RELATÓRIO 3 – GRÁFICO COM DEMONSTRAÇÃO DA CONCENTRAÇÃO DE GLICOSE DAS AMOSTRAS. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 27 EXPERIMENTO 2 – Identificação de Carboidratos – Reação de Molisch Os carboidratos, em presença de ácido sulfúrico concentrado, são desidratados originando furfural ou derivados. A complexação de furfural com substâncias fenólicas (reativo de Molisch) origina produtos coloridos. A reação de Molisch não é específica para carboidratos; entretanto, constitui prova qualitativa da presença de carboidratos em uma amostra. + 3H2O Hidroxi metil furfural glicose OH HIDROXI METIL FURFURAL PRODUTO COLORIDO + -naftol Reagentes Solução aquosa 1 g% de glicose, frutose, maltose, sacarose e amido Reativo de Molisch, Ácido sulfúrico concentrado Amostras Leite, suco de fruta neutralizado, mel diluído, batata Procedimentos e resultados 1. Numerar 10 tubos de ensaio e colocar 2,0mL de cada solução indicada abaixo TUBOS Monossacarídeos AMOSTRAS 1 2,0mL de solução de glicose 2 2,0mL de solução de frutose 3 2,0mL de solução de maltose 4 2,0mL de solução de sacarose 5 2,0mL de solução de amido Controle Negativo 6 2,0mL de água destilada Amostras 7 2,0mL de leite 8 2,0mL de suco de fruta 9 2,0mL de mel 10 2,0mL de suspensão de batata Dissacarídeos Controles RESULTADOS Positivos Polissacarídeo 2. 3. 4. 5. 6. 7. Acrescentar 5 gotas do Reativo de Molisch em cada tubo. Homogeneizar. Adicionar 2,0 mL de ácido sulfúrico concentrado, lentamente, pelas paredes de cada tubo. CUIDADO Observar. O aparecimento de um anel violeta na interfase das soluções caracteriza a presença de carboidratos. Comparar os padrões com as amostras. Interpretar os resultados avaliando a presença de carboidratos na composição das amostras. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 28 EXPERIMENTO 3 – Caracterização de Carboidratos Redutores – Reação de Fehling Os carboidratos que possuem hidroxila semi-acetálica livre podem reduzir íons, por exemplo de Cu ++ e Ag . O Reativo de Fehling é constituído de solução de sulfato de cobre (Fehling A) e tartarato duplo de sódio e potássio em meio fortemente alcalino (Fehling B). O sulfato de cobre, em meio alcalino, forma hidróxido cúprico. O tartarato duplo de sódio e potássio complexa-se com os íons Cu++, não ocorrendo a precipitação do hidróxido cúprico. O carboidrato redutor, na presença do reativo de Fehling, é oxidado a ácido do carboidrato e o cobre é reduzido a óxido cuproso, que pode ser evidenciado pela presença de um precipitado vermelho tijolo. O ácido é, em seguida, salificado pela base alcalina. A quantidade de Cu++ reduzido a Cu+ é proporcional à quantidade de carboidrato redutor presente na amostra. + Reagentes Solução aquosa 1 g% de glicose, frutose, sacarose, maltose e amido Reativo de Fehling A e Fehling B Amostras Leite, suco de fruta neutralizado, mel diluído, batata Procedimentos e resultados 1. Numerar 10 tubos de ensaio e colocar 2,0mL de cada solução indicada abaixo TUBOS AMOSTRAS Controles Monossacarídeos 1 2,0 mL de solução de glicose Positivos Redutores 2 2,0 mL de solução de frutose Dissacarídeo Redutor 3 2,0 mL de solução de maltose Controles Dissacarídeo não Redutor 4 2,0 mL de solução sacarose Negativos Polissacarídeo não Redutor 5 2,0 mL de solução de amido 6 2,0mL água 7 2,0 mL de leite 8 2,0 mL de suco de fruta 9 2,0 mL de mel 10 2,0 mL de suspensão de batata Amostras 2. 3. 4. 5. RESULTADOS Acrescentar 1,0 mL do Reativo de Fehling A mais 1,0mL do Reativo de Fehling B (CUIDADO) em cada tubo. Homogeneizar. Aquecer, em banho-maria fervente, por aproximadamente 2 minutos. Retirar do banho-maria e observar a coloração das soluções. Coloração marrom tijolo indica a presença de carboidrato redutor. Comparar os controles com as amostras e avaliar a presença de carboidratos redutores na composição das amostras. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 29 EXPERIMENTO 4 – Caracterização de Polissacarídeos - Reação de Lugol O amido é um polissacarídeo constituído de duas glicosanas distintas, a amilose e a amilopectina. Em meio aquoso a cadeia linear longa, não ramificada de amilose assume várias formas, entre elas a helicoidal. Nesta forma apresenta a propriedade de fixar iodo no interior da hélice, resultando em complexo corado em azul. O glicogênio apresenta uma glicosana mais ramificada que a amilopectina, adquirindo coloração vermelha na presença de iodo. Reagentes Solução aquosa 1 g% de glicose, frutose, sacarose, maltose e amido Reativo de lugol Amostras Leite, suco de fruta neutralizado, mel diluído, batata Procedimentos e resultados 1. Numerar 10 tubos de ensaio e colocar 2,0mL de cada solução indicada abaixo TUBOS Monossacarídeos Controles Negativos Controle Positivo Amostras 2. 3. 4. 5. Dissacarídeos Polissacarídeo AMOSTRAS 1 2,0mL de solução de glicose 2 2,0mL de solução de frutose 3 2,0mL de solução de maltose 4 2,0mL de solução de sacarose 5 Água 6 2,0mL de solução de amido 7 2,0 mL de leite 8 2,0 mL de suco de fruta 9 2,0 mL de mel 10 2,0 mL de suspensão de batata RESULTADOS Acrescentar 5 gotas do Reativo de Lugol em cada tubo. Homogeneizar. Observar a coloração das soluções. Coloração azul intensa indica a presença de polissacarídeo amido. Comparar os padrões com as amostras e identificar a presença de amido na composição das amostras. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 30 UNIDADE V – Lipídeos OBJETIVOS TEÓRICOS E PRÁTICOS Caracterizar as estruturas químicas e propriedades dos ácidos graxos e dos lipídeos triglicerídeos, cerídeos, esterídeos, fosfolipídeos, esfingolipídeos e terpenos. Identificar análises que caracterizam as estruturas e propriedades dos triglicerídeos. Caracterizar a reação de saponificação e diferenciar sabões solúveis e insolúveis em água. Descrever a composição lipídica de membranas biológicas. EXPERIMENTOS ILUSTRATIVOS: Caracterização de triglicerídeos, ácidos graxos e glicerol. Saponificação e caracterização de sabões insolúveis. Análise quantitativa de triglicerídeos, colesterol e lipoproteínas. Índice de iodo e saponificação BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 31 EXPERIMENTO 1 – Análise quantitativa de triglicerídeos A análise quantitativa de triglicerídeos é realizada através de técnica espectrofotométrica, com reações totalmente enzimáticas e permite quantificar triglicerídeos em solução. A hidrólise dos triglicerídeos é catalisada por uma lipase para produção de glicerol e ácidos graxos livres. O glicerol gerado é fosforilado por adenosina 5’-trifosfato, em presença de glicerol quinase, resultando glicerol 3’-fosfato. O glicerol 3’-fosfato é oxidado, numa reação catalisada pela enzima Lglicerol 3’-fosfato oxidase produzindo água oxigenada. Um cromógeno vermelho é produzido por ação de peroxidase que catalisa a reação de 4-aminoantipirina e 2-hidroxi-3-5-diclorobenzenosulfonato de sódio com água oxigenada. LIPASE TRIGLICERÍDEOS GLICEROL + ATP GLICEROL + ÁCIDOS GRAXOS GLICEROL QUINASE GLICEROL-3-Pi + O2 GLICEROL-3-Pi + ADP GLICEROL-3-Pi OXIDASE DIHIDROXIACETONA + H2O2 2H2O2 + 4-AMINOANTIPIRINA + 2-HIDROXI-3,5-DICLOROBENZENOSULFONATO PEROXIDASE QUINONEIMINA + 4H2O Reagentes Reativo de cor – solução contendo lípase, ATP, glicerol quinase, glicerol 3-fosfato oxidase, 4aminoantipirina, 2-hidroxi-3,5-diclorobenzenosulfonato e enzima peroxidase Padrão de triglicerídeos – solução de trioleína 200 mg/dL Amostras: soro, urina, ovo, leite Procedimentos e resultados 1. Numerar 6 tubos de ensaio e proceder conforme esquema abaixo: Tubos Reativo de cor Padrão ou amostra 1 – Branco 2,0 mL - 2 – Padrão 2,0 mL 25 L 3 – amostra de soro 2,0 mL 25 L 4 – amostra de urina 2,0 mL 25 L 5 – amostra de gema ovo 1:100 2,0 mL 25 L 2,0 mL 25 L 62. 3. 4. 5. amostra de leite 1:10 RESULTADOS Absorbância concentração mg/dL 200 Homogeneizar as soluções e incubar por 15 minutos em Banho-maria a 37 C. Resfriar em água corrente. Verificar a absorbância do padrão e das amostras em 505nm de comprimento de onda, calibrando o aparelho com o tubo 1 (BRANCO). Calcular a concentração de triglicerídeos nas amostras, considerando a seguinte relação: [TRIGLICERÍDEOS] = Fator x absorbância da amostra x diluição FATOR = concentração do padrão absorbância do padrão Valores De Referência (soro de sangue coletado em jejum de 12 horas) = 30 a 170mg/dL. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 32 EXPERIMENTO 2 – Análise quantitativa de colesterol total e frações lipoproteicas A determinação das lipoproteínas de alta densidade – HDL - desempenha papel importante na prevenção e na terapia de cardiopatias coronarianas. As lipoproteínas HDL são capazes de captar o colesterol dos tecidos periféricos e reconduzi-los ao fígado, para serem degradados. Este mecanismo, denominado transporte reverso do colesterol, constitui a teoria da anti-aterogenicidade do HDL, onde baixas concentrações de HDL estão diretamente relacionadas com a incidência de doenças cardiovasculares. Para análise quantitativa no soro, as frações plasmáticas de lipoproteínas de baixa densidade (LDL) e muito baixa densidade (VLDL) são precipitadas seletivamente por sulfato de dextran na presença de íons magnésio, permanecendo no sobrenadante a fração de alta densidade (HDL). O teor de colesterol total e da fração HDL é determinado por técnica espectrofotométrica após reação colorimétrica enzimática. O colesterol é oxidado pela enzima colesterol oxidase, com prévia hidrólise enzimática dos ésteres mediante a ação de uma lipase de origem fúngica. A reação da água oxigenada gerada na oxidação do colesterol com fenol e 4-aminofenazona, catalizada pela peroxidase, resulta na formação de uma quinonimina vermelha. ÉSTERES DE COLESTEROL COLESTEROL + O2 LIPASE COLESTEROL + ÁCIDOS GRAXOS COLESTEROL OXIDASE H2O2 + 4-AF + FENOL PEROXIDASE COLESTEN-3-ONA + H2O2 4(P-BENZOQUINONA MONOIMINO) FENAZONA + 4H2O Reagentes: Reativo precipitante = sulfato de dextran 0,032 mmol/L + solução de cloreto de magnésio 1,5 mmol/L Reagente de cor = enzimas lipase, colesterol oxidase e peroxidase + 4-aminofenazona (4-AF) 0,025 mol/L+ fenol 0,055 mol/L Padrão de colesterol – solução de colesterol 200 mg/dL Amostra de soro Técnica Parte A – Separação da fração HDL colesterol 1. 2. 3. 4. 5. Em um tubo cônico adicionar 500 l de soro + 500 l do reativo precipitante. Homogeneizar vigorosamente sem inverter o tubo, por 30 segundos. Deixar em repouso por 10 minutos, na temperatura ambiente. Centrifugar durante 15 minutos a 3000 rpm. Utilizar o sobrenadante límpido como amostra para a dosagem de colesterol na fração HDL. Parte B – Dosagem de Colesterol Total e fração HDL 1. 2. 3. 4. Numerar 4 tubos de ensaio e proceder conforme esquema abaixo: Tubos Reagente de cor Padrão de Amostra de Colesterol soro total Amostra de HDL (sobrenadante) B (branco) 3,0mL - - - P (padrão) 3,0mL 50 L - - C (colesterol total) 3,0mL - 50 L - F (fração HDL) 3,0mL - - 50 L Homogeneizar as soluções e incubar por 15 minutos em Banho-maria a 37 C. Resfriar em água corrente. Verificar os valores de absorbância do padrão (tubo P) e das amostras (tubos C e F) em 505nm de comprimento de onda, calibrando o aparelho com o tubo B (branco). Calcular a concentração de colesterol total e HDL-colesterol nas amostras, considerando a seguinte relação: 33 BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 5. [COLESTEROL TOTAL] (mg/dL) = FATOR x ABSORBÂNCIA DA AMOSTRA C FATOR = CONCENTRAÇÃO DO PADRÃO ABSORBÂNCIA DO PADRÃO [HDL COLESTEROL] (mg/dL) = FATOR x ABSORBÂNCIA DA AMOSTRA F x 2 Obs.: multiplica-se por 2 devido à diluição da amostra de soro no processo de precipitação da fração HDL [LDL COLESTEROL] (mg/dL) = [COLESTEROL TOTAL] – ([HDL] + [VLDL]) [VLDL COLESTEROL] (mg/dL) = [triglicerídeos] / 5 Resultados Tubos Absorbância Concentração de colesterol (mg/dL) Padrão (tubo P) 200 mg/dL Colesterol total (tubo C) - HDL – colesterol (tubo F) - LDL – colesterol - VLDL - colesterol - Interpretações A concentração de colesterol total e frações em amostras de soro, pode ser comparada com os valores de referência, para inferir possibilidades de alterações clínicas ou fisiológicas. Valores De Referência Colesterol total = 180 mg/dL (homens) e 200 mg/dL (mulheres) HDL colesterol = 52 13 mg/dL (homens) e 65 16 mg/dL (mulheres) LDL colesterol = < 135 mg/dL 25% (homens) e < 159 mg/dL 24,6% (mulheres) VLDL colesterol = < 61 mg/dL 25% (homens) e 16 mg/dL 24,6% (mulheres) BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 34 EXPERIMENTO 3 – Solubilidade de Triglicerídeos A solubilidade dos triglicerídeos depende da polaridade do solvente. Considerando que “semelhante dissolve semelhante”, os triglicerídeos são mais facilmente solúveis em solventes menos polares, como a acetona. Reagentes Álcool etílico e Acetona Procedimentos e resultados 1. 2. 3. Numerar 3 tubos de ensaio e colocar 5 gotas de óleo de soja em cada tubo. Acrescentar 5,0 mL dos solventes, conforme tabela abaixo e homogeneizar. Verificar a solubilidade do óleo de soja em cada solvente considerando que solução límpida caracteriza solubilidade total, sistema turvo caracteriza solubilidade parcial e sistema heterogêneo bifásico caracteriza insolubilidade. TUBOS LIPÍDEO SOLVENTE 1 Óleo de soja Água 2 Óleo de soja etanol 3 Óleo de soja acetona RESULTADOS EXPERIMENTO 4 – Prova do Corante O corante apresenta característica hidrofóbica e lipossolúvel. Reagentes Corante Sudan IV Técnica 1. Colocar 3,0 mL de água destilada em um tubo de ensaio. 2. Acrescentar uma ponta de espátula de corante sudan IV e agitar. 3. Observar a solubilidade do corante em água. 4. Acrescentar 50 gotas de óleo de soja e tornar a agitar. 5. Observar a solubilidade do corante em óleo. Resultados Solubilidade do corante em água = ________________________________________ Solubilidade do corante em óleo = __________________________________________ EXPERIMENTO 5 – Identificação de Ácidos Graxos Livres Nos triglicerídeos a maior parte dos ácidos graxos encontra-se na forma esterificada, ocorrendo apenas traços na forma livre. Os ácidos graxos livres sofrem dissociação em água, conferindo à solução um caráter levemente ácido. Reagentes Papel indicador universal de pH Técnica Verificar o pH do óleo de soja utilizando papel indicador universal de pH. Resultados pH = _______ BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 35 EXPERIMENTO 6 – Caracterização do Glicerol – Teste da Acroleína O glicerol, quando aquecido, sofre reação de desidratação e oxidação intramolecular, formando o produto propenal-2, comumente denominado de acroleína. O bissulfito de potássio tem a função de catalisar a reação de desidratação. A produção de acroleína comprova que a porção alcoólica do triglicerídeo é constituída do álcool glicerol. Reagentes Glicerol Bissulfito de potássio Técnica 1. Numerar 2 tubos de ensaio e proceder conforme esquema abaixo: Tubo 1 5 gotas de glicerol Cristais de Bissulfito de potássio Tubo 2 5 gotas de óleo de soja Cristais de Bissulfito de potássio Aquecer em chama direta do bico de bunsen. Observar. O aparecimento de fumaça branca, com forte cheiro irritante, caracteriza a formação de acroleína. Interpretar os resultados considerando o princípio do experimento e a presença de glicerol na composição do óleo de soja. 2. 3. 4. 5. Resultados Tubo 1 (glicerol) = ________________________________________________________________ Tubo 2 (óleo vegetal)= _____________________________________________________________ EXPERIMENTO 7 – Saponificação As ligações de éster dos triglicerídeos são sensíveis à hidrólise alcalina resultando na liberação de glicerol e na formação de sal de ácido graxo (sabão). Os sabões são compostos anfipáticos, contendo grupos hidrofóbicos (pouca afinidade por água) e hidrofílicos (maior afinidade pela água). Esta característica confere aos sabões a propriedade de dispersão em água através da formação de agregados, denominados micelas. Os grupos hidrofílicos carboxila dos sais de ácido graxo, carregados negativamente, ficam expostos e interagem com a fase aquosa e as cadeias hidrocarbonadas hidrofóbicas, ficam voltadas para dentro do agregado. Reagentes Hidróxido de potássio – solução alcoólica 10 g% Técnica 1. Colocar 60 gotas de óleo de soja em um erlenmeyer. 2. Acrescentar 10,0 mL de solução alcoólica de KOH a 10 g%. 3. Aquecer até observar consistência pastosa. ATENÇÃO. 4. Esfriar e transferir o material obtido para um bécker de 100mL. 5. Adicionar 30,0 mL de água destilada e homogeneizar utilizando um bastão de vidro. 6. Observar. 7. A formação de espuma caracteriza a presença de sabão. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 36 EXPERIMENTO 8 – Sabões Insolúveis Sais de ácidos graxos com cátions monovalentes são solúveis em água; enquanto os sabões de cátions bivalentes são menos solúveis em meio aquoso e não emulsionam substâncias oleosas. Em águas duras, ricas em sais de Ca2+ e de Mg2+, os ânions do sabão formam sais insolúveis com os cátions alcalino-terrosos, perdendo o efeito detergente característico. Reagentes Cloreto de cálcio – solução aquosa 10 g% Técnica 1. Colocar um pouco da solução de sabão obtido no experimento anterior em um tubo de ensaio. 2. Acrescentar 5 gotas de solução de cloreto de cálcio 10g%. Agitar. 3. Observar. A verificação de um precipitado grumoso indica a formação de sabão de cálcio. 4. Interpretar os resultados considerando a solubilidade de sal de ácido graxo com íons de potássio e de cálcio. Resultados Avaliar a solubilidade dos sabões em água: sabão de potássio (experimento 5) = _________________________________________________ sabão de cálcio (experimento 6) = ___________________________________________________ EXPERIMENTO 9 – Separação de Ácidos Graxos Os ácidos graxos livres podem ser obtidos por acidificação da solução saponificada. Reagentes Fenolftaleína – solução alcoólica 0,1 g% Ácido clorídrico 1 mol/L Técnica 1. Adicionar 2 gotas de solução alcoólica de fenolftaleína 0,1g% no bécker contendo a solução de sabão obtida no experimento 5. 2. Agitar com bastão de vidro e acrescentar, lentamente, solução de ácido clorídrico até viragem da fenolftaleína de rósea para incolor. Desta forma, separam-se os ácidos graxos que, sendo insolúveis e pouco densos, flutuam e solidificam-se pelo resfriamento. Questões: 1. Que características um composto normalmente apresenta para ser classificado como lipídeo? 2. Em que classe de lipídeos estão os óleos vegetais e as gorduras animais? 3. Por que um glicerídeo é mais solúvel em solventes apolares? 4. Por que o pH de um óleo vegetal é levemente ácido? 5. Como pode ser comprovada a presença de glicerol na constituição de um glicerídeo? 6. Qual a reação química que resulta “sabão” a partir de glicerídeo e base? 7. Qual a diferença estrutural entre o ácido graxo “esteárico” e o “oléico”? BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 37 EXPERIMENTO 10– Índice de Iodo Índice de iodo representa o número de gramas de iodo que se adiciona a 100 gramas de óleo ou gordura. Indica o grau de insaturações dos ácidos graxos. Na determinação do índice de iodo a solução de Wijs ( iodo-cloro ) é adicionada a uma quantidade conhecida de amostra, ocorrendo a introdução dos halogênios nos carbonos das duplas ligações dos ácidos graxos. A solução aquosa de iodeto de potássio é utilizada para reagir com o excesso dos halogênios da solução de Wijs, que não reagiram com os ácidos graxos. O iodo livre em solução é determinado através da titulação com tiossulfato, em presença de amido como indicador. -CH2 – CH = CH – CH2 + ICl ( excesso ) + KI I2 + 2Na 2 S2 03 -CH2 – CH - CH - CH2 + Cl I I I Cl I Cl I2 + KCL 2NaI + Na2 S4 08 Reagentes Clorofórmio Solução de Wijs – solução de iodo cloro Iodeto de potássio – solução aquosa 10 g% Tiossulfato de sódio 0,1 mol/L Amido – solução aquosa 1 g% Técnica 1. Pesar aproximadamente 0,25 g de amostra em um erlenmeyer e dissolver em 25,0 ml de clorofôrmio. 2. Acrescentar 25,0 ml da solução de Wijs, homogeneizar e tampar. 3. Deixar em repouso, ao abrigo da luz, por 40 minutos. 4. Acrescentar 15,0 ml da solução de KI a 10% e homogeneizar. 5. Titular com a solução de tiossulfato a 0,1mol/L usando 3,0 ml da solução de amido 1g% como indicador. 6. Realizar uma prova em Branco, repetindo a técnica descrita anteriormente, com todos os reagentes exceto a amostra. 7. Determinar o índice de iodo considerando a relação abaixo:I I = Eq. C. fc (Vb – Va) x 100 Peso da amostra (g) Eq = equivalente grama do iodo = 126,9. C = concentração do tiossulfato = 0,1 mol/L fc = fator de correção da concentração do tiossulfato Vb = volume de tiossulfato ( litros ) - titulação da prova em Branco. Va = volume de tiossulfato ( litros ) - titulação da amostra. Resultados Volume de tiossulfato gastos na titulação da prova em Branco = ____________ . Volume de tiossulfato gastos na titulação da amostra = ____________ . Índice de iodo da amostra = _____________. Interpretar o resultado comparando com outras amostras de óleo e manteiga, considerando que quanto maior o índice de iodo, maior a concentração de ácidos graxos insaturados e menor o ponto de fusão. Valores de Referência amostra Índice de iodo Óleo de algodão Óleo de soja Óleo de milho manteiga 100 a 116 118 a 143 124 26 a 40 Ácidos graxos insaturados 70,5% 86,0% 86,7% 46,9% Ponto de fusão C -2 -22 -12 +31,5 BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 38 EXPERIMENTO 11 - Índice de saponificação O índice de saponificação representa o número de miligramas de KOH necessário para saponificação total dos ácidos graxos livres e combinados de 1 grama de gordura. Indica o peso molecular médio dos ácidos graxos. Na determinação do índice de saponificação,uma quantidade conhecida de amostra é aquecida na presença de KOH em excesso. Neste processo ocorre a saponificação dos ácidos graxos. O excesso de base é titulado com ácido clorídrico e o índice de saponificação é calculado. Reagentes Hidróxido de potássio – solução alcoólica 5,6 g% Fenolftaleína – solução alcoólica 0,1 g% Ácido clorídrico 1 mol/L Técnica 1. Pesar aproximadamente 2,5 g de amostra e colocar em um balão de fundo redondo. 2. Adicionar 25,0 ml da solução de KOH alcoólico a 5,6 g% e aquecer em refluxo até que a amostra esteja completamente saponificada (aproximadamente 35 minutos). OBS:- saponificação total é quando a mistura encontrar-se totalmente límpida. 3. Após esfriar, lavar o condensador com água destilada e desconectar do balão. 4. Adicionar 10 gotas da solução de fenolftaleína à solução saponificada e titular com ácido clorídrico 1 mol/L. 5. Realizar uma prova em Banco, repetindo a técnica descrita anteriormente, com todos os reagentes, exceto a amostra. 6. Determinar o índice de saponificação considerando a relação abaixo:IS = Eq. C. fc. ( Vb – Va ) peso da amostra (g) Eq = equivalente grama do KOH = 56. C = concentração do ácido clorídrico = 1 mol/L fc = fator de correção do ácido clorídrico. Vb = volume de HCl ( ml ) gasto na titulação da prova em Branco. Va = Volume de HCl ( ml ) gasto na titulação da amostra. Resultados Volume de HCl gasto na titulação da prova em Branco = ________ . Volume de HCl gasto na titulação da amostra = ________ . Índice de saponificação da amostra = _______________ Interpretar os resultados comparando com outras amostras de óleo, considerando que quanto maior o índice de saponificação, menor o número de carbonos na cadeia hidrocarbonada e consequentemente, menor o peso molecular dos ácidos graxos. A comparação com os valores de referência infere o grau de pureza da amostra. Valores de referência Óleo de amendoim = 185 a 198. Óleo de algodão = 190 a 198. Óleo de soja = 189 a 196. Óleo de milho = 187 a 196. Óleo de oliva = 185 a 195 . Óleo de girassol = 185 a 195 . Questões – RELATÓRIO 4 – Demonstração comparativa dos resultados e questões abaixo. 1. 2. Esquematizar as reações de saponificação com KOH e separação de ácidos graxos com os triglicerídeos: trioleato de glicerila e triestearato de glicerila. Qual dos triglicerídeos esquematizados acima (trioleato e triestearato de glicerila) apresenta menor ponto de fusão? A resposta foi considerando qual característica química do composto? BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 39 UNIDADE VI – Vitamina C OBJETIVOS TEÓRICOS E PRÁTICOS Identificar as moléculas classificadas como vitaminas. Caracterizar vitaminas hidrossolúveis e lipossolúveis. Identificar as vitaminas com função antioxidante. Caracterizar o mecanismo de ação química e biológica das vitaminas antioxidantes. EXPERIMENTO - Análise Quantitativa de Vitamina C O ácido ascórbico (vitamina C) na presença de iodo é oxidado a ácido deidroascórbico. O iodo atua como agente oxidante, sendo reduzido a ácido iodídico. A titulação do ácido ascórbico com iodo, utilizando amido como indicador, permite quantificar a Vitamina C em diferentes amostras. Reagentes Ácido ascórbico – solução aquosa 200 mg% = padrão de vitamina C Ácido sulfúrico 2 mol/L; Iodo –solução aquosa 0,025 mol/L; Amido – solução aquosa 1 g% Técnica A. Titulação do padrão de ácido ascórbico: 1. Colocar uma alíquota de 50,0 mL de solução de ácido ascórbico a 200 mg% em um erlenmeyer. 2. Adicionar 10,0 mL de solução de ácido sulfúrico 2 mol/L. 3. Titular com iodo 0,025 mol/L, utilizando 1,0 mL de solução de amido 1 g% como indicador. 4. Verificar o volume de iodo gasto na titulação (volume de iodo necessário para atingir o ponto de viragem de incolor para violeta). B. Dosagem de Vitamina C (ácido ascórbico) em amostras 1. Transferir uma alíquota de 50,0 mL de amostra para um erlenmeyer. 2. Adicionar 10,0 mL de solução de ácido sulfúrico 2 mol/L. 3. Titular com iodo 0,025 mol/L utilizando 1,0 mL de solução de amido 1 g% como indicador. 4. Anotar o volume de iodo gasto na titulação. 5. Calcular a concentração de vitamina C nas amostras, relacionando o volume de iodo gasto na titulação da amostra com o volume de iodo gasto na titulação do padrão de ácido ascórbico 200 mg%. Resultados Volume de iodo Padrão Amostra de suco de laranja Amostra de suco de limão Amostra de suco de abacaxi Amostra de suco de acerola Amostra de suco de caju Amostra de “redoxon” ou similar Concentração de vitamina C (mg%) 200 mg% BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 40 REFERÊNCIAS BIBLIOGRÁFICAS ARANHA, F.L. Bioquímica Didática. Ed. Copola, Campinas, 1998. BERNARDES, C.F. Bioquímica Experimental. Manual, Campinas, 2001. BOBBIO, F.O. & BOBBIO, P.A. Manual de Laboratório de Química de Alimentos. Ed. Livraria Varela, São Paulo, 1995. CAMPBELL, M.K. Bioquímica. Ed. Artmed, Porto alegre, 2000. CAMPBELL, J.M. & CAMPBELL, J.B. Matemática de Laboratório. Ed. Roca, São Paulo, 1986. CECCHI, H.M. Fundamentos Teóricos e Práticos em análise de Alimentos. Ed. Da UNICAMP, Campinas, 2001. CHAMPE, P.C. & HARVEY, R.A. Bioquímica Ilustrada. Ed. Artmed, Porto alegre, 2000. CISTERNAS, J.R., VARGA, J., MONTE, O. Fundamentos de Bioquímica Experimental. Ed. Atheneu, São Paulo, 1997. COLLINS, C.H. & BRAGA, G.L. Introdução a Métodos Cromatográficos. Ed. UNICAMP, Campinas, 1997. DEVLIN, T.M. Manual de bioquímica com correlações clínicas. Ed. Edgard Blucher Ltda, São Paulo, 2000. FOX, E.L., BOWERS, R.W., FOSS, M.L. Bases Fisiológicas da Educação Física e dos Desportos. Ed. Guanabara Koogan, Rio de Janeiro, 1991. HIRANO, Z.M.B. e col. Bioquímica – Manual Prático. Universidade Regional de Blumenau. EDIFURB, Blumenau, 2001. HOUSTON, M.E. Bioquímica Básica da Ciência do Exercício. Ed. Roca, São Paulo, 2001. LEHNINGER, A.L., NELSON, D.L., COX, M.M. Princípios de Bioquímica. Ed. Sarvier, São Paulo, 2002. MARZZOCO, A. & TORRES, B.B. Bioquímica Básica. Ed. Guanabara, Rio de Janeiro, 1999. MONTGOMERY, R.F. e col. Bioquímica: uma abordagem dirigida por casos. Ed. Artes Médicas, São Paulo, 1994. MORETTO, E. & FETT, R. Tecnologia de óleos e gorduras vegetais. Ed. Varela, São Paulo, 1998. MURRAY, R.K., GRANNER, D.K., MAYES, P.A., RODWELL, V.M. Harper: bioquímica. Ed. Atheneu, São Paulo, 2002. NEPOMUCENO, M.F., RUGGIERO, A.C. Manual de Bioquímica. Ed. Tecmedd, Ribeirão Preto, SP, 2004. RAVEL, R. Laboratório clínico. 6ª ed. Ed. Guanabara Koogan, Rio de Janeiro, 1997. REMIÃO, J.O.R., SIQUEIRA, A.J.S., AZEVEDO, A.M.P. Bioquímica – guia de aulas práticas. Pontifícia Universidade Católica do Rio Grande do Sul, EDIPUCRS, Porto Alegre, 2003. SILVA, D.J. Análise de alimentos. Ed. Universidade Federal de Viçosa, 1998. STRYER, L. Bioquímica. Ed. Guanabara Koogan, Rio de Janeiro, 1996. VILLELA, G.G., BACILA, M., TASTALDI, H. Técnicas e experimentos de bioquímica. Rio de Janeiro, Guanabara Koogan, 1973. ZANCAN, G.T. e col. Bioquímica – aulas práticas. Universidade Federal do Paraná, 6ª. Ed. , Curitiba, 2002. BIOQUIMICA A- Faculdade de Química Tecnológica – CEATEC – PUC-Campinas Profa. Dra. Celene Fernandes Bernardes 41
Download