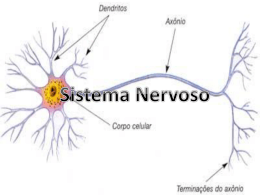
Paula Cristina Capponi Ferrari MIELOENCEFALITE PROTOZOÁRIA EQÜINA (MEP) Relatório de Estágio Curricular apresentado ao Curso de Medicina Veterinária da Faculdade de Ciências Biológicas e de Saúde da Universidade Tuiuti do Paraná, como requisito parcial para obtenção do título de Médico Veterinário. Professor Orientador: Dr. Antonio Carlos do Nascimento Orientador Profissional: Drª Henriette Graf Curitiba 2006 SUMÁRIO LISTA DE TABELAS........................................................................................ vi RESUMO ........................................................................................................... v 1 INTRODUÇÃO.......................................................................................... 1 2 CONSIDERAÇÕES GERAIS DO SISTEMA NERVOSO......................... 2 3 EXAME NEUROLÓGICO......................................................................... 7 4 MIELOENCEFALITE PROTOZOÁRIA EQÜINA (MEP)........................ 13 4.1 Histórico............................................................................................... 13 4.2 Epidemiologia...................................................................................... 15 4.3 Ciclo de Vida do Parasito..................................................................... 16 4.4 Sinais Clínicos..................................................................................... 19 4.5 Patologia.............................................................................................. 22 4.6 Diagnóstico.......................................................................................... 23 4.7 Diagnóstico Diferencial........................................................................ 26 4.8 Achados Laboratoriais......................................................................... 28 4.9 Tratamento........................................................................................... 28 4.10 Prognóstico........................................................................................ 32 4.11 Profilaxia............................................................................................ 33 5. REFERÊNCIA BIBLIOGRÁFICA................................................................. 35 ii LISTA DE FIGURAS FIGURA 1 – Didelphis virginiana (gambá)........................................................ 18 FIGURA 2 – Ciclo Biológico do Sarcocistis neurona........................................ 19 FIGURA 3 – Eqüino com incoordenação motora..............................................21 iIii RESUMO O objetivo desta revisão bibliográfica é apresentar uma enfermidade que acomete o Sistema Nervoso dos eqüinos, para isto é de fundamental importância revisar os mecanismos e estruturas que fazem parte do Sistema Nervoso. É necessário compreender o mecanismo de resposta aos estímulos nervosos, bem como a realização de um exame clínico minuncioso para a interpretação dos sinais clínicos gerados para o diagnóstico correto frente às diversas manifestações clínicas da Mieloencefalite Protozoária Eqüina (MEP). iv 1 INTRODUÇÃO A Mieloencefalite Protozoária Eqüina (MEP) é uma doença neurológica provocada por protozoário caracterizada por incoordenação motora decorrente da diminuição da propriocepção e fraqueza muscular. Sinais de atrofia muscular neurogênica e de paralisia de nervos cranianos podem estar presentes, é uma doença de curso geralmente fatal acomete animais de qualquer raça, sexo e idade. Apesar dos poucos trabalhos nacionais encontrados na literatura especializada relatando a enfermidade, a doença tem sido cada vez mais diagnosticada por hospitais e profissionais autônomos constituindo hoje a principal suspeita clínica de animais com incoordenações motoras. O objetivo desse trabalho é demonstrar as características clínicas, epidemiológicas, formas de diagnóstico e tratamento dessa indesejável doença em qualquer plantel eqüino. 2 2. CONSIDERAÇÕES GERAIS DO SISTEMA NERVOSO O sistema nervoso coordena as funções dos diversos órgãos dos animais e a adaptação destes ao ambiente (KOLB, 1980). O exame do sistema nervoso dos animais de grande porte é essencial para completa avaliação clínica. Esta avaliação deve ser adequadamente realizada, pois os problemas neurológicos são freqüentes em bovino, eqüinos, ovinos e caprinos (FEITOSA, 2004). Para poder cumprir ordenadamente suas funções, o sistema nervoso é composto por uma extensa rede de tecido especializado em recepção e transmissão de “sinais” necessários para que o animal esteja perfeitamente integrado ao seu meio (THOMASSIAN, 2005). O Sistema Nervoso (SN) coordena, junto com os sistemas endócrinos, uma atividade conjunta de estímulo e reação com os meios externo e interno. Nos organismos mais simples, essas funções são assumidas por células sensoriais; nos seres mais complexos, as mudanças do ambiente conduzem a excitação para um efetor, célula muscular ou glandular (FEITOSA, 2004). Nas regiões corpóreas restantes, superficial ou profundamente a célula sensorial transporta o estímulo, já codificado, para um grande número de células musculares, glandulares ou para outras células nervosas (KONIG e LIEBICH, 2004). O Sistema Nervoso Central é formado pelo: cérebro, cerebelo, bulbo e medula espinhal. O cérebro, cerebelo e o bulbo estão alojados no interior do crânio, e a medula espinhal está situada em um canal flexível formado pelas 3 vértebras cervicais, torácicas, lombares, sacrais e coccigeas (THOMASSIAN, 2005). Os órgãos ou estruturas que constituem o Sistema Nervoso Central encontram-se envoltos por três membranas conjuntivas que são as meninges. A membrana externa, denominada dura-máter, está fusionada ao periósteo na cavidade craniana, não existindo essa fusão no canal espinhal, o que permite a livre movimentação de flexão dorsal, ventral e lateral do canal vertebral sem que ocorra qualquer dano à medula. O espaço compreendido entre o periósteo vertebral e a dura-máter é chamado de espaço epidural. A membrana média é a aracnóide, e a mais interna, intensamente vascularizada e delicada que envolve diretamente o cérebro, é a pia-máter. Entre a aracnóide e a pia-máter existe um espaço preenchido por tecido ”esponjoso” conhecido como espaço subaracnóideo por onde circula, o liquido cefalorraquidiano (THOMASSIAN, 2005). No sistema nervoso central, os neurônios encontram-se na substância cinzenta. Esta está localizada na periferia do cérebro e cerebelo, no centro da medula e distribuída em núcleos no tronco encefálico. A substância branca é formada por axônios mielinizados que se distribuem em tratos, estes tratos podem ser eferentes (motores) ou aferentes (sensitivos); estes últimos transmitem informação referente a dor, temperatura, propriocepção, tato, sabor, etc. Alguns desses tratos transmitem, também, informações referentes ao Sistema Nervoso Autônomo (SNA). Os tratos são denominados segundo seu local de origem e terminação (espinhocerebelares, vestibuloespinhais, etc.) (CORREA 2001). 4 O neurônio é a unidade funcional do Sistema Nervoso. Seu neuroplasma possui um número variável de prolongamentos (dendritos e axônio) de comprimentos variáveis e diferentes ramificações. Os dendritos transportam o estímulo para o corpo celular (aferente), e o axônio, do corpo celular para a periferia (eferente). As células nervosas necessitam, para a transmissão de mensagens e secreção, de células nutricionais e células de suporte. Esse trabalho é assumido por células da glia. (KONIG et. al, 2004). O tecido nervoso é constituído por neurônios e por células gliais que servem para nutrir, isolar e acondicionar neurônios, permanecem com capacidade para se dividir. Em casos de perda de neurônios, forma-se no lugar desses, uma grande quantidade de células gliais, o que constitui a cicatriz neuroglial (KOLB, 1980). As células da Glia (neuroglia) assumem funções tróficas no Sistema Nervoso Central. Elas estão entre capilares e células nervosas. As células da glia formam a barreira hematoencefálica (KONIG et. al, 2004). O cérebro é a parte mais importante do Sistema Nervoso Central por constituir o grande centro de recepção e controle de todos os “impulsos” recebidos. É formado por dois hemisférios que se ligam entre si e em cujo interior encontram-se duas cavidades chamadas de ventrículos cerebrais, onde se forma grande parte do liquido cefalorraquidiano. É constituído de várias regiões especializadas responsáveis por todo o sistema de comando nervoso do organismo. (THOMASSIAN, 2005). A medula espinhal é um eixo cilíndrico de cor esbranquiçada, de acordo com o segmento, é levemente achatada dorso ventralmente. A medula espinhal se prolonga desde a porção posterior do encéfalo até a porção final do canal 5 medular. Basicamente é constituída por nervos ventrais, responsáveis pelas funções motoras dos músculos pelas secreções, e raízes dorsais que são constituídas pelos nervos sensoriais encarregados de trazer ao Sistema Nervoso Central as sensações de tato, calor, frio e dor do corpo do animal (THOMASSIAN, 2005). Todas as raízes nervosas cerebrais, constituídas pelos 12 pares de nervos cranianos, e as raízes medulares formam o conjunto denominado de Sistema Nervoso Periférico, existindo, entretanto, nesse conjunto, um sistema nervoso cujo funcionamento independe da consciência e da vontade, sendo por esse motivo denominado de Sistema Nervoso Autônomo (THOMASSIAN, 2005). O sistema nervoso visceral ou autônomo atua nos processos de manutenção da vida para o trabalho conjunto harmônico dos órgãos internos. Eles regulam a respiração, a circulação, a digestão, o metabolismo, as secreções, a troca de água, a temperatura corpórea, a reprodução, etc. (KONIG et. al, 2004). É simples compreender que o comportamento, a fisiologia, a capacidade de percepção, e as qualidades físicas primárias são características de cada espécie e dependem basicamente do nível de funcionamento do organismo como um todo, controlado pelo grande e complexo computador que é o sistema nervoso (THOMASSIAN, 2005). Os nervos cranianos podem ser rapidamente avaliados quando observamos a simetria facial, integridade da função visual, movimentação da língua e deglutição. Dificilmente, se estas funções estiverem íntegras, existirão alterações nos nervos cranianos. A presença de anormalidades em dois ou 6 mais pares de nervos cranianos é indicativa de anormalidades encefálicas, enquanto alterações em apenas um par são sugestivos de lesões periféricas. (ROBINSON, 1997). O sistema vestibular é um sistema proprioceptivo, que ajuda o animal a manter sua orientação e posicionamento no ambiente em que esta, mantém e coordena a posição, os movimentos da cabeça, tronco e membros e a manter o equilíbrio durante a locomoção e o descanso. Os núcleos dos nervos cranianos que controlam os movimentos dos olhos estão em contato com o sistema vestibular. As lesões na medula espinhal causam diversos graus de debilidade, ataxia, alterações nocioceptivas e do sistema nervoso autônomo. A presença e gravidade dos sinais clínicos dependem de dois fatores: o segmento da medula em que está localizada a lesão; e a extensão e profundidade da mesma, que determinam os tratos que foram afetados (motores, proprioceptivos ou sensitivos) e se está afetada, também, a substância cinzenta, considerando que quando estão afetados os cornos dorsais as alterações são sensitivas ou proprioceptivas e quando estão afetados os cornos ventrais as alterações são motoras (CORREA, 1998). O liquido cefalorraquidiano é produzido pelos plexos coróides dos ventrículos cerebrais, na sua quase totalidade; pequena parte origina-se nos vasos e meninges. Este liquor percorre todo o sistema nervoso central e é drenado pelo plexo venoso. Suas funções principais são as proteções (um amortecedor das vibrações e choques que sofrem o eixo encefalomedular), lubrificação (isola as grandes estruturas nervosas, impedindo a ação nociva da evaporação) (VASCONCELLOS, 1995). 7 3 EXAMES NEUROLÓGICOS A avaliação neurológica nunca deverá ser iniciada antes de uma completa descrição do animal, onde cada item contribuirá significativamente, juntamente com uma anamnese minuciosa ou, pelo menos, com a maioria das informações sobre o problema. Algumas patologias têm um curso rápido e também resolução rápida, favorável ou não, ao passo que as lesões degenerativas assumem uma evolução, do início ao fim, gradativa com prognóstico geralmente desfavorável. O exame neurológico baseia-se na avaliação do comportamento, nível de consciência, postura e movimentos (andar, trotear e galopar), pares de nervos cranianos, reações posturais e, quando possível, na realização de reflexos espinhais. Podem-se incluir exames complementares como análise de líquido cefalorraquidiano, radiografias simples ou contrastadas (mielografia), eletrocardiografia, eletroneuromiografia, tomografia computadorizada e ressonância magnética. As etapas do exame neurológico são: identificação e anamnese; exame físico; identificação dos sinais; interpretação das informações; localização das lesões; diagnóstico diferencial; exames complementares; diagnóstico; prognóstico; tratamento; recomendações. Segundo (FEITOSA, 2004) o exame é dificultado pelo escasso acesso para avaliação direta, quando comparado a outros sistemas. Isto é percebido já que nenhuma estrutura nervosa pode ser palpada diretamente e, com exceção da papila óptica, também não pode ser visualizada. O exame neurológico deve ser realizado tendo como base a resposta obtida em provas específicas da avaliação funcional, isto é, estimulam-se as estruturas do sistema nervoso e observa-se a resposta, que 8 deve ser classificada como normal ou anormal. Alguns critérios para determinar a localização das lesões medulares são mencionados a seguir: 1) Paralisia dos neurônios motores superiores (NMS) causa paralisia espástica, aumento do tônus muscular e dos reflexos; 2) Paralisia dos neurônios motores inferiores (NMI) causa paralisia flácida, com diminuição dos reflexos e do tônus muscular e atrofia muscular neurogênica rápida; 3) Uma lesão moderada na medula cervical pode causar sinais de ataxia somente nos membros pélvicos; 4) Em um animal sem sinais neurológicos da cabeça a lesão pode estar localizada em qualquer região da medula; 5) É difícil diferenciar entre ataxia e debilidade, mas não é importante uma vez que os tratos ascendentes proprioceptivos e os tratos motores descendentes estão juntos na substância branca da medula; 6) Com lesões compressivas locais na medula cervical ou tronco encefálico os sinais neurológicos são mais severos nos membros pélvicos do que nos torácicos; 7) Quando o animal está em decúbito lateral e não consegue levantar a cabeça, a lesão pode estar localizada nos tratos descendentes do tronco encefálico ou na medula cervical provavelmente entre C1 e C4. Lesões unilaterais impedem que o animal levante a cabeça quando a lesão está do lado superior. Um animal com lesão entre a C4 e T2 pode levantar a cabeça, mas permanecer em decúbito e tanto os membros posteriores quanto os anteriores apresentam paralisia espástica. Uma lesão 9 completa, antes da T2 resulta em morte por asfixia devida a paralisia do nervo frênico; 8) Alterações nos membros pélvicos, sem alterações nos torácicos, indicam lesão tóraco-lombar. Em caso de lesões severas nesta região o animal pode adotar a posição de cão sentado. Se não consegue adotar esta posição é possível que a lesão esteja localizada cranial à T2; 9) Lesões localizadas na intumescência torácica (C6-T2) causam severas alterações nos membros torácicos e pélvicos. Nesta região lesões somente de neurônio motor inferior (NMI) afetam exclusivamente os membros torácicos e não os pélvicos; 10) Lesões da região sacra causam incontinência urinária e retenção de material fecal. Não causam paralisia ou ataxia dos membros pélvicos; 11) A síndrome de Schiff-Sherrington ocorre nas lesões compressivas graves da região tóraco-lombar, que causa paralisia de neurônio motor inferior (NMI) nos membros pélvicos e de neurônio motor superior (NMS) nos membros torácicos. Isto porque neurônios localizados entre L1 e L7 são responsáveis pela inibição de alguns neurônios motores da intumescência torácica; 12) Uma lesão leve da medula afeta os tratos espinhocerebelares e vestíbulo espinhais (do nervo motor superior) que estão localizados superficialmente, causando debilidade extensora (do nervo motor superior) e ataxia; 13) Em lesões bilaterais graves ocorre perda de nociocepção do periósteo dos dedos e da cauda; 10 14) As provas dos reflexos espinhais são úteis para localizar lesões em áreas específicas. Em um reflexo monossináptico (reflexo patelar, por exemplo) participa um neurônio sensitivo, um neurônio motor inferior, o nervo aferente e o eferente. A ausência de reflexo indica uma lesão em alguma dessas estruturas. Se está alterada somente a porção motora o animal não tem reflexo mas sente dor; 15) Lesões dos plexos lombossacro e braquial causam paralisia ou paresia dos membros pélvicos ou torácicos com redução ou ausência dos reflexos e da sensibilidade; 16) As provas de sensibilidade para detectar hiperestesia, parestesia ou anestesia, utilizando agulhas, por exemplo, podem servir para localizar lesões da medula espinhal. O pescoço deverá ser flexionado para a direita assim como para a esquerda no sentido de perceber a reação do animal ou ainda a recusa do mesmo frente a esse tipo de manobra, e também avaliar a existência de alguma crepitação nas estruturas ósseas. Com essas manobras intensificam as lesões do tipo luxação cervical. Outro ponto importante é que na articulação atlanto-occipital façam-se manobras com a cabeça de cima para baixo e de um lado para o outro a fim de perceber a existência da integridade articular nessa região. A pesquisa de sensibilidade de pele também traz informações importantes, aumentos de volume na região cervical, atrofias musculares. Em alguns casos, a região dorsal e caudal à luxação cervical pode tornar-se inicialmente insensível ou pouco sensível a estímulos externos. Nos eqüinos adultos devido ao seu tamanho e peso, e em potros devido ao temperamento de fuga algumas provas não são possíveis de serem realizadas, mesmo assim 11 ainda é possível fazer uma boa avaliação neurológica.(VASCONCELLOS, 1995). Quando o examinador distende o membro do animal para frente, retirando-o do solo e mantendo-o seguro, o que se espera é que o animal tente puxar o membro da mão do examinador e colocá-lo na posição inicial. Este é o reflexo de retração e vai estar presente se os segmentos C6-T2 da medula estiverem íntegros, assim como os nervos do plexo braquial. Esta prova deve ser aplicada nos dois membros anteriores do animal. Quando se faz pressão na sola do casco do animal, este, em condições normais, retrai o membro imediatamente (sinal de Babinski), indicativo de integridade medular nos segmentos C6-T2. A avaliação do segmento C1-T2 seria através da movimentação do animal onde o mesmo seria empurrado de um lado para o outro, na região da escápula, observando-se a reação. A interpretação baseiase no fato de que as lesões nervosas a nível destes segmentos dificultam o posicionamento dos membros anteriores e algumas vezes os posteriores (FEITOSA, 2004). Podemos comparar o tempo de queda de um membro em relação a outro; para isso levantamos para frente um membro distendido até a altura de aproximadamente 50 cm do solo, e então deixamo-lo cair comparando o tempo de queda entre os dois membros. A interpretação é de que não havendo lesão no segmento C1-T2, os dois membros caem no mesmo espaço de tempo; havendo lesão, o lado afetado cairá mais rápido. Essa lesão poderá ter origem sobre o plexo braquial (atrofia generalizada da musculatura do membro), ou luxações cervicais com lesão neurológica unilateral ou bilateral. Pensa-se em 12 alteração em nível dos segmentos T2-S4, quando após um minucioso exame da cabeça, pescoço e membros anteriores, nenhuma lesão caracterizada clinicamente tenha sido encontrada (VASCONCELLOS, 1995). Para se examinar o tronco deve-se observar a existência de atrofias musculares localizadas ou generalizadas, unilateral ou bilateral, escoliose, cifose, lordose. Pesquisa-se a sensibilidade de pele, verificando se o cavalo se defende das moscas, mapeando a sensibilidade de pele da região compreendida entre a escápula e a tuberosidade do íleo, dorsalmente, lateralmente e ventralmente ao tronco. Com os reflexos nervosos do membro pélvico podem-se achar lesões no segmento toracolombar; os reflexos podem estar normais, ausentes, deprimidos ou aumentados nas regiões próximas ao reflexo. A percussão do ligamento patelar deve produzir extensão do jarrete se os segmentos L4-L6 e o nervo femoral estiverem íntegros. A percussão dos músculos gastrocnêmio e tibial cranial causa extensão e flexão do jarrete respectivamente. Essa manobra testa os nervos tibial e fibular alem dos segmentos L6-S2 da medula. Com a percussão do tendão do músculo gastrocnêmico há uma flexão do pé, isto ocorrerá se os segmentos L4-S2 da medula estiverem íntegros. Também os membros posteriores poderão ser estendidos para frente e levantados do chão, semelhante ao exame feito com os membros anteriores, assim como a pesquisa do sinal de Babinski. Com essas manobras avaliamos o plexo pélvico com o segmento medular T2-S2. Em alguns cavalos acometidos com lesões musculares entre o segmento T1L3 a paralisia do membro pélvico é acompanhada por uma rigidez dos músculos extensores dos membros anteriores, enquanto o animal se encontrar em decúbito lateral. A este sinal dá-se o nome de fenômeno de Shiff- 13 Sherrington. Os segmentos sacrais (S1-S2) são responsáveis pela inervação da região caudal da garupa, bexiga, genitália e cauda (THOMASSIAN, 2005). O exame clínico consta em estimular o ânus com um objeto pontiagudo. A resposta esperada é que imediatamente o animal contraia o ânus e a cauda é sobreposta ao esfíncter energicamente. Usa-se fazer a palpação retal para a verificação da retenção fecal e também se há distensão da bexiga. As lesões nos segmentos sacrais ocasionam uma incontinência urinária, diminuição do reflexo perineal, comuns na neurite da cauda eqüina, onde também existem lesões nos nervos oriundos dos segmentos coccigeos, ocasionando diminuição do tônus da cauda e hipoalgesia regional (FEITOSA, 2004). A marcha é avaliada quando o cavalo anda a passo, trota, galopa, anda de lado, recua, movimenta-se em plano inclinado; livre e com os olhos vedados. O intuito é a detecção de sinais que possam indicar lesão tanto no motoneurônio superior quanto inferior, patologias de medula (compressões, processos degenerativos, rompimentos e processos infecciosos) que manifestam clinicamente como alterações posturais ou distúrbios da marcha; em eqüinos é difícil de avaliar essas alterações dado o tamanho do animal fato que não ocorre em pequenos animais (VASCONCELLOS, 1995). 4 MIELOENCEFALITE PROTOZOÁRIA EQÜINA (MEP) 4.1 Histórico A Mieloencefalite Protozoária Eqüina (MEP) foi identificada pela primeira vez como mielite segmentar em 1964 na Universidade do Kentucky. Os 14 primeiros casos foram detectados em cavalos de raça pura que retornaram após participarem de corridas no oeste dos Estados Unidos. Os casos subseqüentes foram encontrados em eqüinos nativos na maior parte dos Estados Unidos, Canadá, Panamá e no Brasil. A doença foi denominada mielite segmentar por causar lesões discretas distribuídas de forma aleatória na medula espinhal. À medida que mais casos eram examinados ficou evidente que com freqüência o cérebro era acometido então uma nova denominação foi adotada mielite-encefalite. As lesões da MEP incluem áreas de necrose e hemorragia junto com inflamação não-supurativa das substâncias brancas e cinzentas (REED e BAYLY, 2000). Embora o protozoário causador da doença, tenha sido identificado primeiramente em 1974 de difícil diagnóstico, esta doença foi considerada esporádica e rara. Porém, recentemente os pesquisadores começaram a entender melhor o seu desenvolvimento e afirmam que o agente causador é idêntico ao protozoário conhecido como Sarcocystis Falcatula, que por sua vez, é um parasito que acomete diversas espécies de pássaros. Apesar dos gambás serem considerados animais hospedeiros do Sarcocystis neurona o parasita primeiro se instala em um pássaro antes de terminar seu ciclo de vida no gambá (MERCATELLI, 2006). A MEP tem sido descrita desde o começo da década de 60, porém, acreditava-se que ela era causada pelo Toxoplasma gondii. Somente no final da década de setenta e começo da de oitenta conseguiu-se concluir que o agente causal da doença não era o T. gondii, e sim uma espécie de Sarcocystis. Apesar da MEP já ter sido identificada há muito tempo, ainda é 15 considerada como uma doença emergente que possui profunda importância econômica para criadores e veterinários (RÊGO, 2000). Importantes trabalhos epidemiológicos foram realizados no Brasil indicando que existe positividade sorológica, indicando que existe contato com o parasito, além da confirmação da presença deste parasito na espécie de gambá presente no país (SILVA et al.2003). 4.2 Epidemiologia A maioria das informações sobre MEP foi obtida a partir de infecções de ocorrência natural. Em ordem decrescente de freqüência, as raças mais acometidas foram Puro-Sangue Inglês, mestiças e Quarto-de-Milha, embora estivessem representadas muitas outras raças e também pôneis (REED e BAYLY, 2000). Vários cavalos são afetados em pistas de corrida ou em estabelecimentos de criação. O mesmo não se observa em cavalos criados apenas por prazer ou pôneis, que parecem ser menos afetados. (BOY, 1990) Cavalos de todas as idades podem ser afetados, mas com maior freqüência são os de um a seis anos de idade. A maioria dos casos ocorre na primavera e verão. Já houve relatos de casos de potros com apenas dois meses de idade que desenvolveram a doença. (REGO 2000). Os eqüinos acometidos costumam ter história de estresse recente, ou seja, transporte, treinamento intenso ou participações em corridas, parto, etc. Muitos eqüinos acometidos foram transportados recentemente, dificultando a determinação do local onde ocorreu a exposição. Se o início dos sinais clínicos 16 tivesse relação com o estresse, o período de incubação e a ocorrência sazonal seriam altamente variáveis (REED e BAYLY, 2000). Estudos sorológicos apontam graus variáveis de exposição dos eqüinos ao S. neurona, de acordo com a região geográfica. Estas diferenças podem ser atribuídas a variações climáticas que possivelmente possam ter efeito sobre a transmissão da parasita. Na América do Sul, a sorologia determinou a exposição em 35,6% e 35,5% dos animais estudados, respectivamente, no Brasil e Argentina. Apesar do grande número de animais soropositivos, apenas uma minoria dos cavalos desenvolvem os sinais clínicos da doença. Numerosos casos são relatados nas Américas e casos de MEP foram descritos na Europa, África do Sul e Ásia em eqüinos importados do continente Americano (SILVA et al, 2003). 4.3 Ciclo de Vida do Parasito A transmissão principalmente é causada pelo gambá onde ele libera esporocistos no ambiente por suas fezes. O cavalo ingere esporocistos por alimento contaminado ou água. A forma em que os esporocistos migram ao sistema nervoso central para causar doenças não está bem clara. Após os esporocistos serem ingeridos eles invadem o SNC pelo sistema circulatório. Ao atingir o Sistema Nervoso Central (SNC) pode se proliferar por reprodução assexuada e a doença é causada pela presença deles, com resposta inflamatória associada. Insetos, pássaros ou pequenos mamíferos também podem transportar ou ingerir os esporocistos, contribuindo como ciclo de 17 transmissão da MEP. O cavalo é hospedeiro definitivo e não transmite a doença. (DUBEY 1986). Embora o ciclo de vida definitivo do Sarcocystis neurona não seja ainda conhecido, estudos recentes sugerem que alguns tipos de pássaros servem como hospedeiro para este organismo. Baseado no ciclo de vida de organismos similares é provável que os parasitas multiplicam-se no intestino de alguns pássaros, que não ficam doentes, mas depositam estágios de infecção do parasita em suas fezes, que podem contaminar comida e água, e ser ingerido por vários animais, incluindo cavalo. Uma vez consumido (água, comida) os parasitas parecem se submeter a um desenvolvimento através da corrente sangüínea ou via tecidos para sistema nervoso central. Sarcocystis são protozoários coccídios que necessitam dois hospedeiros (DUBEY 1991). Toda a espécie de Sarcocystis tem o ciclo de vida heteroxênico, com estágios assexuados desenvolvendo-se somente no hospedeiro intermediário e, estágio sexuado, ocorrendo somente nos hospedeiros definitivos. Os hospedeiros intermediários e definitivos variam muito de acordo com cada espécie de Sarcocystis. O hospedeiro definitivo torna-se infectado ingerindo tecido muscular ou neural contaminado pelo Sarcocystis maduros. O hospedeiro intermediário torna-se infectado ingerindo esporocistos na comida e água contaminadas. Os hospedeiros intermediários permitem a infecção cruzada entre as espécies e permitem também hospedeiros aberrantes como os cavalos. (SILVA 2003). Os cavalos são hospedeiros intermediários incomuns do S. neurona e infectados pela ingestão do esporocisto do parasita na comida ou água contaminadas por fezes de gambá (Didelphis virginiana) (Fig. 1), o hospedeiro 18 definitivo. Assim que os cavalos ingerem os esporocistos, eles encistam e ganham à circulação, porém, aparentemente nunca encistam no tecido do cavalo. Em alguns eqüinos, eles migram para o SNC, onde continuam a reprodução assexuada nos neurônios e células da microglia, sem formar cistos teciduais. Os merozoítos existem livres no citoplasma das células do SNC, sugerindo que esses merozoítos do S. neurona nunca se maturem para a segunda geração de divisão, sendo assim, sem a fase infectante, os cavalos não podem transmitir o protozoário para nenhum outro animal, incluindo outros cavalos e, até mesmo os gambás (REGO, 2000). FIGURA 1:Didelphis virginiana (gambá) Fonte: EBINGER, 2002 19 FIGURA 2: Ciclo biológico do S. neurona FONTE: SILVA, 2003 4.4 Sinais Clínicos Os sinais clínicos são variáveis, dependem da região e da extensão das lesões podendo ser multifocais. Observa-se malácia e reação inflamatória não supurativa. As lesões afetam mais freqüentemente a medula e a apresentação mais comum é uma alteração na locomoção, com o comprometimento de um ou mais membros, dependendo da localização das lesões na medula. Usualmente, há ataxia assimétrica dos membros posteriores, fraqueza e atrofia muscular. Quando está envolvido o tronco encefálico e os núcleos dos nervos cranianos observa-se depressão, ataxia, paralisia facial e protusão, flacidez e paralisia da língua, atrofia dos músculos temporal e masseter e disfagia. 20 Quando a lesão é cerebral pode serem observadas depressão, alterações no comportamento, cegueira e diminuição das respostas sensoriais à ameaça no lado da face contra lateral à lesão. (SMITH, 1994). Os sinais clínicos de MEP podem se desenvolver em alguns cavalos quando os parasitas passam para medula espinhal e cérebro causando lesões. Outros cavalos aparentemente podem desenvolver imunidade e eliminam os organismos sem mostrar evidências clínicas de infecção. Os sinais clínicos de MEP são extremamente variáveis, dependendo da localização do S. neurona no encéfalo ou medula espinhal, em conseqüência da lesão neuronal direta provocada pelo parasito ou danos secundários provocados pela resposta inflamatória (FENGER, 1997). A variabilidade dos sinais clínicos é um reflexo da natureza focal, multifocal ou difusa das lesões, que ocorrem de forma aleatória nas substâncias cinzenta e branca do cérebro, do tronco cerebral ou da medula espinhal. Geralmente, o exame físico está dentro dos limites normais, e o eqüino parece atento e alerta, embora se possa observar atrofia muscular focal. O início dos sinais clínicos pode ser gradual, porém são mais típico esses serem sinais discretos na fase aguda, às vezes com progressão muito rápida. O exame neurológico costuma revelar ataxia e incoordenação (Fig. 3) em todos os quatro membros, que às vezes exibem lateralização, ou pode haver anormalidades da marcha, com apenas um membro acometido. A infecção por S. neurona pode resultar em sinais do tronco cerebral e da medula espinhal, muitas vezes causando lesão do neurônio motor inferior da medula espinhal ou de nervos cranianos, o que acarreta atrofia muscular, mais comum nas regiões do quadríceps e glútea no trem posterior, mas também pode simular 21 aprisionamento do nervo supra-escapular paralisia radial ou polineurite eqüina. Quando o tronco cerebral é acometido, podem ser evidentes a atrofia dos músculos masseteres e temporais e, ocasionalmente, da língua, com inclinação da cabeça, paralisia do nervo facial e dificuldade à deglutição. É importante o exame minucioso para detectar sinais de desgaste muscular, bem como perda da sensação ao longo do pescoço, na face ou no corpo (REED e BAYLY, 2000). FIGURA 3: Eqüino com incoordenação motora FONTE: SILVA, 2003 O curso da doença pode ser agudo ou crônico, com intensidade variável dos sinais, podendo ser confundida com outras enfermidades neurológicas medulares dos eqüinos. A doença é reconhecida pelo proprietário como queda no desempenho, tropeços ocasionais e relutância em movimentar-se (GANSTROM, 1998). Modo assimétrico de andar, dificuldade para manter o comando de um membro específico, andar cambaleante, problemas comportamentais (isto é sacudindo a cabeça, dificuldade de treinamento) são sinais comumente relatados mais cedo. Depressão, disfagia e paralisia da língua e laringe também são observadas (SILVA, 2003). 22 Sinais precoces de anormalidades neurológicas são freqüentemente confundidos com claudicações. Isto ocorre, pois a paresia pode ser discreta, necessitando de bloqueios anestésicos locais para diferenciação entre doença neurológica e osteomuscular (FENGER, 1997). A sobrevivência dos animais acometidos depende da severidade das lesões, sendo que indivíduos com sinais clínicos moderados ou severos têm maior probabilidade de entrar em decúbito permanente tendo que ser eutanasiados (FENGER, 1997). 4.5 Patologia As lesões da MEP incluem áreas de necrose e hemorragia junto com inflamação não-supurativa das substâncias brancas e cinzentas (REED e BAYLY, 2000). É provável que o S. neurona cause poucas alterações patológicas no hospedeiro intermediário apropriado. No entanto as lesões do SNC em eqüinos costumam ser extensas. Áreas multifocais de hemorragia a descoloração leve do cérebro ou da medula espinhal podem ser visíveis ao exame macroscópico. As lesões podem ser microscópicas ou ter vários centímetros de largura. O tronco cerebral e a medula espinhal são acometidos com maior freqüência. À microscopia, as lesões caracterizam-se por áreas focais a difusa de inflamação não-supurativa e necrose, com infiltração perivascular de células mononucleares, incluindo linfócitos, macrófagos e plasmócitos. Células gigantes, eosinófilos e células granulosas compostas também estão presentes nos infiltrados inflamatórios. As substâncias cinzentas ou a branca, ou mesmo 23 ambas, podem ser acometidas. Têm sido encontrados microorganismos em neurônios, leucócitos e no endotélio vascular, embora eles tendam a desenvolver-se com mais freqüência em neurônio (REED e BAYLY, 2000). Quando afeta difusamente o cérebro, o que é mais raro, a MEP pode ser confundida com doenças encefálicas comuns de eqüinos como as encefalomielites virais e a leucoencefalomalácea, porém a epidemiologia e as lesões características dessas duas doenças permitem diagnóstico diferencial (BARROS, et al., 1986). 4.6 Diagnóstico A presença de uma manqueira que não responde a um tratamento com antiinflamatório, analgésico e nem com um bloqueio anestésico no membro afetado e, que ainda apresenta sinais clínicos de uma doença neurológica, já nos dá indicio de MEP (MERCATELLI, 2006). A MEP não é de fácil diagnóstico. Uma característica da doença é que tende a afetar um lado ou parte do cavalo mais que outra, ou seja, os sinais clínicos tendem a ser unilaterais. Com a suspeita de MEP, amostras de sangue e liquido cefalorraquidiano (LCR) devem ser analisadas. Se o exame de sangue for positivo, isto indica que o cavalo somente foi exposto ao organismo, mas não que atacou o SNC ou que desenvolverá sinais clínicos. O método de analise é o Western blot analysis também pode ser utilizado para LCR e soro sanguíneo. Resultado de Western blot analysis negativo em LCR geralmente descarta a MEP. Na maioria dos casos cavalos com MEP, a colheita do LCR é essencial ao diagnóstico (SILVA, 2003). 24 A coleta de fluido cerebroespinhal, geralmente é feita por punção do espaço subracnoideo na região lombo-severa é mais segura, uma vez que o canal medular pode ser penetrado sem complicação enquanto que uma penetração medular na região atlanto occiptal poderia levar a distúrbios neurológico. Além disso, o fluxo do fluido cerebroespinhal tem direção caudal e se a lesão se localiza na medula, a região posterior pode ser mais rica em anticorpos.Identificação positiva no LCR do anticorpo produzido em resposta ao antígeno único para S. neurona usando o teste “Western immunoblot” é, aproximadamente 90% sensível e específico para diagnóstico da MEP. Um resultado positivo do LCR indica que os parasitos penetraram e estimularam uma resposta imune local. Em contraste, análise immunoblot positiva indica somente exposição ao organismo, e não implica necessariamente em MEP como a causa dos sinais neurológicos, se eles estiverem presentes (GRANSTROM, 1993). A análise pelo Western Blot do soro e do fluido cerebroespinhal fornece informações antemortem sobre a exposição e odesenvolvimento de uma infecção ativa de Sarcocystis neurona. Este teste utiliza merozoítos cultivados para detectar anticorpos contra o parasita e tem alta especificidade (89%) e sensibilidade (89%). Um exame negativo do soro indica que o animal não foi exposto ao parasito e a possibilidade de MEP é muito pequena. Quando o teste é positivo para fluido cerebroespinhal, indica que o parasita penetrou a barreira encefálica e estimulou a resposta imune. O teste é muito sensível e específico mas depende de uma barreira encefálica intacta. Se a barreira encefálica está danificada (como em casos de herpesvírus), ou há contaminação de sangue na coleta da amostra, os anticorpos do soro podem contaminar a amostra, 25 resultando num falso positivo. Para afastar essa possibilidade pode-se solicitar a dosagem de albumina ou de IGC, um aumento indica lesão da barreira encefálica, hemorragia no fluido vertebroespinhal ou ainda aumento persistente no soro. Assim o diagnóstico da MEP pode ser feito com base nos sintomas clínicos, sinais neurológicos e exame de Western Blot para anticorpos contra Sarcocystis neurona no fluído cerebroespinhal. Resultado falso-negativo é raro, mas pode ocorrer em cavalos os quais são testados antes do desenvolvimento suficiente da resposta ao anticorpo, naqueles tratados previamente com corticosteróides e naqueles com focos crônicos inativos do organismo. Outras razões para resultado falso-positivo da análise immunoblot do LCR inclui erro técnico ou laboratorial e uma resposta imune para infecção, antes dos sinais clínicos. Alta prevalência de resultados positivos de LCR ocasionalmente tem sido instituída entre grupos de cavalos jovens clinicamente normais, sugerindo infecção subclínica do SNC e pode ocorrer produção de anticorpo no LCR de cavalos normais. Entretanto, o significado positivo do LCR de cavalos clinicamente normais comumente é obscuro (SILVA, 2003). Um importante avanço no diagnóstico ante mortem da doença foi o desenvolvimento do “immunoblot“ (Western Blot), usado na identificação do anticorpo para S. neurona. A utilização do “immunoblot” é na diluição de 1:10 no LCR do eqüino. Através do resultado desse teste, obtém-se diagnóstico positivo, suspeito positivo ou negativo (GRANSTROM, 1993). É prudente que o médico veterinário solicite e avalie as dosagens de IgG e determine o quociente de albumina (QA), tanto no soro sanguíneo como no liquido cefalorraquidiano, para certificar-se se realmente ocorreu produção intratecal de anticorpos pela presença do parasita no SNC. Eventualmente os testes 26 imunodiagnósticos podem resultar em falsos-negativos, ou serem resultantes da imunoincompetência do cavalo em responder a presença do Sarcocystis (THOMASSIAN, 2005). 4.7 Diagnóstico Diferencial Segundo BARROS (1991), quando a MEP afeta principalmente a medula, deve ser diferenciada de várias doenças neurológicas que se manifestam por sinais clínicos de incoordenação em eqüinos e que talvez, sejam mais freqüentes. Entre essas estão: a) as lesões produzidas por malformações das vértebras cervicais, a chamada mielopatia por estenose das vértebras cervicais; nessa afecção conhecida como bambeira e que corresponde a síndrome de Weobbep, há lesões degenerativos focais da medula espinhal cervical resultante de estreitamento anatômico, funcional ou de ambos dos forames entre as vértebras cervicais C2 e C7. b) a mieloencefalopatia degenerativa dos cavalos; é uma doença de cavalos jovens com idade média de aparecimento aos 6 meses. Produz lesões mais simétricas e a substância cinzenta é poupada. Assim os animais apresentam incordenação simétricas e não apresentam sinais de fraqueza muscular relativos à alteração de substância cinzenta. c) mieloencefalite por herpesvírus; tem um aparecimento clínico súbito, envolve vários animais de todas as idades em uma mesma propriedade, curso com febre e paralisia de bexiga com gotejamento contínuo de urina. Os sinais clínicos são mantidos estáveis após 2-3 dias. A doença está associada a casos 27 de afecções respiratórias, abortos, nos outros animais do rebanho Testes sorológicos pareador revelam aumento de anticorpos neutralizantes contra o agente causual, o herpesvírus eqüino-I, o que ajuda sobremaneira na diferenciação clínica. d) nematodíase cerebroespinhal; o exame líquido cefalorraquidiano indica uma moderada plecocitose e eosinofilia. e) simples traumatismos; com uma repercussão na medula podem apresentar um quadro clínico semelhante a MEP. Nos casos de traumatismo os sinais clínicos não são progressivos, tendem a ficar estáveis ou regredir e são focais. Em casos de fratura geralmente há hipoalgesia ou analgesia das áreas correspondentes aos segmentos afetados. Cavalos afetados pela mielopatia por estenose das vértebras cervicais (MEVS) malformações das vértebras cervicais são mais novos, a doença tornase evidente nos primeiros doze a quinze meses de vida, embora possa haver ao redor dos 4 anos, além disso os sinais clínicos da MEP são mais acentuado e progressivo, a fraqueza muscular a ataxia são mais acentuada. Exame de raios-X mostra um estreitamento do canal vertebral no caso de MEVC o que pode confirmar na necropsia. As lesões afetam mais a porção cervical, principalmente a substância branca e são degenerativas. O diagnóstico diferencial em eqüinos com suspeita de infecção por S. neurona pode ser feito com qualquer doença do SNC, embora, dependendo da localização neuroanatômica, certos problemas possam ser mais prováveis (REED e BAYLY, 2000). O diagnóstico diferencial deve ser feito entre: Mielopatia Estenóica Cervical Eqüina, Mielopatia Eqüina por Vírus, Injúria Traumática da Medula 28 Espinhal, Neurite da Cauda Eqüina, Encefalite Viral, Meningite, Osteomielite Vertebral, Raiva, Abscesso Cerebral e Anormalidade Congênita. (SILVA, 2003). 4.8 Achados Laboratoriais A mieloencefalite por protozoários não produz alterações consistentes no hemograma ou na bioquímica sérica, embora possam ser observadas anormalidades inespecíficas como linfopenia, hiperfibrinogenemia, elevações da bilirrubina sérica, uréia e enzimas teciduais, possivelmente relacionadas com estresse, terapia com corticóides, traumas, anorexia e danos musculares. No liquido cefalorraquidiano (LCR) geralmente não são observadas alterações da coloração, celularidade, turbidez, proteína, enzimas, glicose e eletrólitos. Entretanto, podem ocorrer elevações na proteína total, pleocitose mononuclear aumento da atividade da creatinafosfoquinase (SILVA, 2003). 4.9 Tratamento Os sinais clínicos servem para suspeitar de MEP, mas não são diagnósticos. Cerca de um terço dos cavalos com MEP mostram alguma resposta ao tratamento dentro dos primeiros dez a quatorze dias de tratamento. Se o cavalo deixa de responder dentro de duas semanas, mais exames complementares devem ser requisitados para confirmação do diagnóstico (ROBINSON, 1997). Uma terapia específica para cavalos com MEP não foi ainda definida, embora a doença pareça ser tratável. Admite-se que sendo o agente etiológico 29 um Coccidio, seria sensível a drogas usadas contra Toxoplasma gondii. Nessa linha alguns autores têm tentado com sucesso relativo, o tratamento da MEP com drogas, inibidores de ácido fólico como sulfas, pirimetranino e combinações sulfa-trimetropina (Mayhuv, et al., 1976; Scarratt 1983). Como tratamento com corticosteróides definitivamente agrava o quadro clínico da MEP (Duby et al., 1974, Dov et al., 1984, De Lalunta, 1977), essa terapia, comum em nosso meio em doenças neurológicas de eqüinos, deve ser prescrita com extremo cuidado. O tratamento talvez seja eficaz, se iniciado tão logo se suspeite da MEP. A doença cerebral é mais facilmente resolvida clinicamente do que a doença na medula espinhal, e qualquer atrofia muscular, possivelmente, seja permanente. Os sinais clínicos geralmente começam a melhorar uma semana após tratamento estima-se que 50-70% dos eqüinos tratados apresentarão melhora após a quimioterapia. As recomendações atuais de tratamento incluem trimetroprim-sulfonamida, na base de 15-20 mg/Kg, por via oral, duas vezes ao dia, combinados com a pirimetamina oral na dose de 1 mg/Kg, uma vez ao dia, durante 30 dias, após os sinais clínicos terem parados de evoluir. A presença de alimentos pode, afetar de modo adverso, e o alimento devem ser suspensos 1-2 horas antes e após o tratamento. Como foi notado, o tratamento especifico anti-MEP deve continuar, no mínimo por 30 dias após a evolução clinica ter cessado. A duração do tratamento é de 21 dias. A recidiva é possível se os eqüinos não forem tratados por tempo suficiente, e a reativação da infecção pode ocorrer durante período de estresse. Achados indicam que os esquemas presentes da quimioterapia não removem completamente os parasitas do sistema nervoso central. Se ocorrer recidiva todo esquema de tratamento deve ser repetido. A inflamação é 30 responsável por muitos dos sinais clínicos observados nas infecções agudas, e o uso dos agentes antiinflamatórios é benéfico. A flunixin meglumine, na base de 1,1 mg/Kg duas vezes ao dia por via parenteral, ou a fenilbutazona por via oral na base de 4,4 mg/Kg duas vezes ao dia podem ser valiosas. O dimetilsufóxido intravenoso (DMSO) na dose de 1 mg/kg uma vez ao dia em solução a 10% durante três dias também é recomendado. O uso dos corticosteroides deve ser evitado, se possível, e restrito a 1-3 dias com dexametasona (0,05 mg/Kg) nos eqüinos gravemente acometidos. A suplementação com vitamina E (8.000-9.000 UI/dia) pode apresentar efeitos antiinflamatórios benéficos e promover a cura do tecido nervoso lesado (ADAMS, R, et al 2003) Uma detecção adiantada da doença irá significar um tratamento e uma prevenção mais bem sucedidos dos danos mais adicionais. Entretanto, os cavalos podem sofrer danos permanentes. Os tratamentos comuns incluíram antimicrobiano de amplo espectro (por exemplo, sulfonamidas e pirimetamina), medicamentos anti-protozoários (diclazuril, toltrazuril), drogas antiinflamatórias não esteroidais tais como flunixin meglumine e fenilbutazona, corticosteróides, dimetilsulfoxido (DMSO) , vitamina E, e ácido fólico. Atualmente o tratamento mais indicado para esta doença é: ● A pirimetamina (1,0 mg/kg diários) e os sulfonamides (20 mg/kg diários) são combinados e usados geralmente por até 90 dias. O ácido Fólico é administrado ao mesmo tempo para impedir a anemia durante tratamentos com pirimetamina; ● A terapia antiinflamatória é indicada em casos agudos de MEP. Isto pode incluir o tratamento com fenilbutazona ou flunixin meglumine (1,1 mg/kg 31 por 3-7 dias), assim como a adição de DMSO (1g/kg em uma solução de 10%) administrada intravenosamente ou pela sonda nasogástica; • Diclazuril, um aprovado coccidiostático para uso nas aves domésticas, foi usado exclusivamente, porém, não era aprovado para uso nos cavalos. A dose é de 2,5 mg/kg (do ingrediente ativo) cada 12 horas por ao menos 21 dias; • Toltrazuril é um coccidiostático usado em desmame em suínos neonatal. Foi introduzido no mercado como uma suspensão de 5% • Um produto novo, Ponazuril (5 mg/kg) dado por via oral, uma vez ao dia, por 28 dias tem sido introduzido recentemente no mercado dos EUA para tratar especificamente a MEP (MERCATELLI, 2006). • A suplementação com vitamina E (8000 UI/dia) pode ser útil no tratamento, uma vez que possui atividade antioxidante que resulta em propriedades antiinflamatórias quando em altas concentrações no sistema nervoso central (SILVA, 2003). Os eqüinos gravemente acometidos podem estar em decúbito e requerem cuidado constante ou hospitalização, e os eqüinos gravemente atáxicos devem ficar confinados na baia com cama alta. Ainda em alguns casos, a volta prematura do animal ao trabalho pesado pode prolongar o tempo de recuperação e promover a recidiva. (BROWN, 2002). Sempre que possível deve-se realizar fisioterapia nos animais acometidos, pois isto diminui a atrofia muscular neurogênica, melhora a propriocepção e permite uma melhor adaptação dos animais aos déficits presentes (SILVA 2003). 32 O antígeno da vacina contra Sarcocystis neurona é produzido a partir de protozoários mortos. A licença do produto é condicional. Estudos de eficácia e teste de potência estão em desenvolvimento. Para vacinação de cavalos saudáveis (que serão expostos subsequentemente ao S. neurona) como uma ajuda na prevenção de MEP. Testes de segurança a campo incluíram cavalos soropositivos e soronegativos. Devido ao período de incubação prolongado e patogenia da infecção por S. neurona, a vacinação de cavalos saudáveis infetados pode não prevenir a progressão da doença ou os sinais clínicos de MEP (FORT DODGE 2006). 4.10 Prognóstico O prognóstico depende, particularmente, da extensão, severidade e duração das lesões. Se um animal afetado sobreviver aos três primeiros dias de tratamento, os sinais clínicos geralmente estabilizam e depois começam a melhorar em uma semana. A melhora pode continuar por meses e até anos após a parada do tratamento, porém a recuperação é, na maioria das vezes, incompleta. Lesões no cérebro parecem se resolver clinicamente mais fácil do que lesões na medula espinhal, porém atrofias musculares em qualquer região são sempre de caráter permanentemente irreversíveis (REGO, 2000). A maioria dos cavalos afetados por MEP que são tratados com as dosagens recomendadas de antibióticos por pelo menos três meses, melhoram. Recuperação para normal pode ocorrer em 50 a 75% dos casos, mas depende, sobretudo, da severidade e duração dos sinais neurológicos quando a doença é identificada. É impossível predizer quais indivíduos 33 responderão bem e quais terão danos residuais permanentes, porque os sinais clínicos são os mesmos, sejam eles resultantes de neurônio danificados ou edema e inflamação em torno dos neurônios. O melhor prognóstico indicado é a rápida resposta à medicação antiinflamatória e algumas respostas ao tratamento anti-protozoário dentro dos primeiros dez a quatorze dias. Em geral, cavalos que são severamente afetados, não voltam ao normal e, cavalos que são suavemente afetados, são mais prováveis de retornar ao normal. Entretanto, existem exceções suficientes em ambas as categorias. Cavalos nos quais os sinais são detectados mais cedo no curso da doença, são plausíveis a responder bem, mas é difícil nos primeiros exames determinar quanto tempo os sinais clínicos suaves podem estar presentes (ROBINSON, 1997). 4.11 Profilaxia Devido a seus hábitos onívoros noturnos e de se alimentarem com matéria em decomposição, os gambás são atraídos por comida, seja lixo, grãos ou rações de outros animais domésticos, fazendo-se necessário o armazenamento de quaisquer fontes de alimentação em recipientes fechados. O desperdício de grãos deve ser minimizado, uma vez que estimula o consumo por parte dos gambás (FENGER, 1997). Os gambás mantêm diversos locais de ninho, incluindo árvores ocas e tocas, geralmente perto das florestas. Os proprietários dos cavalos devem: remover os gambás dos pastos e florestas; Impedir a exposição dos cavalos às fezes do gambá; Impedir gambás nos celeiros de feno e das áreas de 34 armazenamento da ração; Lavagem das áreas infectadas. Os desinfetantes sozinhos são ineficazes para áreas contaminadas (MERCATELLI, 2006). Recentemente, foi desenvolvida uma vacina contra MEP, produzida a partir de protozoários mortos. Sabe-se que ela não provoca efeitos colaterais nos animais, entretanto, testes de eficácia e potência ainda estão em desenvolvimento. A recomendação para a vacina consiste de duas aplicações. A primeira dose deve ser seguida de uma segunda dosificação três a seis semanas depois, com reforço anual, porém a vacina atualmente está liberada apenas nos Estados Unidos (SILVA et al, 2003). 35 4 REFERÊNCIAS BIBLIOGRÁFICAS BARROS, C. S. L. et al. Mieloencefalite eqüina por protozoário. Pesq. Vet. Brás, v.6, pg 45-49, 1986. BOY, M.G. et al. Protozoal Encephalomyelitis in Horses. 82 cases (19721986). J. Am. Vet. Med. Assoc; 196:632; 1990. BROWN, C.M. BERTONE, J.J. Consulta Veterinária em 5 minutos Espécie Eqüina. São Paulo: Varela 2002, pág. 886-887. CORREA, R. F. et al. Doença de Ruminantes e Eqüinos, vol. 1, Ed. Varela. São Paulo. 2001. DUBEY, J, P, MILLER, S. Equine protozoal myeloencephalits in pony. J. Am. Vet. Med Assoc. v188, pag 1311-1312, 1986. DUBEY, J. P. et al. Sarcocystis neurona n. sp (Protozoa: Apicomplexa), the etiologic agent of equine protozoal myeloencephalits. J. Parasitol, v. 77, pg 212218, 1991. FEITOSA, F.L.F. Semiologia veterinária. Editora; Roca, p.507-526, 2004 FENGER, C.K. et al. Equine protozoal myeloencephalitis In RABINSON NE (ed); Current Terapy in Equine Medicine , 4 ed. Philadelphia, WB Saunders; 1997. FORT DODGE. Equine Protozoal Myeloencephalits. www.epmvacine.com/consumer/defaut.html. Acessado em 27/07/06. GRANSTROM, D.E. Equine Protozoal Encephalomyelitis: Antigen analysis of cultural Sarcocystis Neurona Merozoites. J.Vet. Diagn. Invest; 5:88, 1993. 36 GRANSTROM,D.E. et.al. Diclazuril and Equine Protozoal Myeloencephalitis. AAEP proceedings, v.43, p.13, 1998. KONIG, H.E. LIEBICH,H.G. Anatomia dos animais domésticos. Artmed, p.203-240, 2004. KOLB, Fisiologia Veterinária, Rio de Janeiro, 1980, quarta edição, editora Guanabara. MERCATELLI, G.R. MEP mais conhecido como o mal da bambeira. Revista Brasileira de Medicina Veterinária. São Paulo, v. 5, n.4, p.18-22, mar 2006. REED, S.M. BAYLY, WM. Medicina Interna Eqüina, Rio de Janeiro: Guanabara 2000.pag 419-422. REGO, E.B. MEP (mieloencefalite protozoária eqüina - um dos causadores de bambeira). http://www.cavalo.com.br/conteudo.asp?id=31&area=3. Acesso em 23/07/2006. ROBINSON, N.E. Current therapy in equine medicine. W.B.Saunders Company. Philadelphia, v.4, 1997. SILVA, D. P. et al. Mieloencefalite protozoária equina: revisão de literatura. Revista Conselho Federal de Medicina Veterinária, Brasília, v. 9,n.28/29,p. 3440, janeiro a agosto 2003. SMITH, B.P. Tratado de Medicina Interna de Grandes Animais. 2 vol. Ed..Manole, São Paulo, 1994.1738p.. THOMASSIAN, A. Enfermidades dos cavalos. São Paulo: editora: Varela, pág. 451-474. 2005. VASCONCELLOS, L.A.S. Problemas neurológicos na clinica eqüina. Editora: Varela, São Paulo, cap 4: pág.33-36,1995. 37
Download