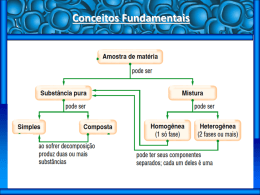
Atividade 1 - Revisão 1os anos Décio ago/09 Química Nome: Nº: Turma: Substâncias e Misturas Objetivo O objetivo desta ficha é revisar alguns dos tópicos trabalhados no 1º semestre. As dúvidas devem ser encaminhadas por e-mail até o dia 06/08/2009. Não se esqueça de, no e-mail, colocar o seu nome e o título RevSubstâncias. Conceito de Química É a ciência que estuda os materiais, isto é, a estrutura, as propriedades físicas e químicas dos materiais. Conceito de material ou matéria É tudo que tem massa e volume, isto é, tudo com que lidamos no nosso dia a dia. Exemplos: madeira (material); pedaço de madeira (corpo); cadeira de madeira (objeto). Fórmula molecular — substância formado representada Material —————→ substância —————→ fórmula Fórmula é a representação de uma substância (indica os elementos e a quantidade de átomos ou íons desses elementos). Substância Fórmula água H2O amônia NH3 gás carbônico CO2 cloreto de sódio NaCl glicose C6H12O6 ozônio O3 hidrogênio H2 Cada unidade H2O é chamada de molécula. Molécula é uma partícula contendo átomos ligados. Representa uma molécula de água. Observações: • Elemento químico: átomos com o mesmo número de prótons. Exemplos: elemento hidrogênio: átomos com um próton; elemento hélio: átomos com dois prótons. • • Átomo é o constituinte de um elemento químico. Substância é formada sempre pelos mesmos elementos químicos, cujas massas estão em proporção constante. Exemplo: água é sempre formada de hidrogênio e oxigênio e a massa de oxigênio é sempre oito vezes maior que a massa de hidrogênio (dados experimentais). Tipos de substância a) Substância simples: formada por um único elemento químico. Exemplos: O2, H2, Na. Fórmulas das principais substâncias simples: metais e gases nobres: Fe, Al, Cu, He, Ne, Ar, Kr, Xe, Rn; diatômicas: H2, O2, N2, F2, Cl2, Br2, I2; triatômica: O3; tetratômica: P4 (fósforo branco); macromoléculas: grafite (C), diamante (C). b) Substância composta ou composto químico: formada por dois ou mais elementos químicos. Exemplos: H2O, NaCl, C6H12O6. Misturas São materiais formados por duas ou mais substâncias chamadas de componentes. Exemplo: água + sal (2 componentes). Misturas Principais componentes Ar N2, O2, Ar, CO2 Água do mar H2O, NaCl e outros sais Petróleo Mistura de hidrocarbonetos Vinagre H2O + H3CCOOH (ácido acético) Aço Fe + C Latão Cu + Zn Bronze Cu + Sn Ouro 18 quilates Au + Cu Pólvora NaNO3 + C + S Amálgama Hg + metal Propriedades físicas e químicas Propriedades são as características das substâncias. Exemplo: algumas propriedades da água líquida à temperatura ambiente: inodora, incolor, insípida, derrete a 0 ºC, ferve a 100 ºC ao nível do mar, reage com sódio liberando hidrogênio. a) Propriedades físicas são propriedades referentes a determinada substância, as principais são: • Ponto de Fusão (PF) é a temperatura na qual um material sólido passa para o estado líquido. Água PF = 0 ºC; cloreto de sódio PF = 801 ºC; alumínio PF = 660 ºC; ouro PF = 1063 ºC. • Ponto de Ebulição (PE) é a temperatura na qual um material líquido passa para o estado gasoso. PE depende da pressão atmosférica. Ao nível do mar temos: 2 • Água PE = 100 ºC; álcool comum PE = 78,5 ºC; éter PE = 35 ºC; cloreto de sódio PE = 1490 ºC. Densidade (d) ou massa específica é a relação entre a massa (m) e o volume (V) do material: m d= . v Exemplo: d H 2 O = 1 g/cm3. Isso significa que 1 cm3 de água tem massa igual a 1 g. Conclusão: óleo é menos denso que a água. b) Propriedades químicas são propriedades de uma substância em contato com outra substância, isto é, está ocorrendo uma reação. Exemplos: ferro enferruja; álcool é inflamável; água com sódio libera hidrogênio. Material homogêneo e heterogêneo Fase é cada porção homogênea (contínua ou não) de um material. a) Material homogêneo: uma só fase mesmo ao ser examinado em um aparelho óptico. Pode ser: Substância: iodo, água, cloro. Mistura homogênea ou solução: água + sal; água + álcool; mistura de gases. b) Material heterogêneo: mais de uma fase a olho nu ou ao aparelho óptico. Pode ser: Substância em mudança de estado físico: água + gelo; água + vapor d’água. Mistura heterogênea: água + areia; água + óleo; sangue; leite. Resumo importante 3 Aquecimento dos materiais a) Substância PF constante, PE constante: água (PF = 0 ºC; PE = 100 ºC). 2 patamares (retas paralelas ao eixo da abscissa). b) Mistura homogênea ou solução PF variável, PE variável: água + sal. Sem patamar. c) Mistura eutética PF constante, PE variável. Exemplo: 62% Sn e 38% Pb — PF = 183 ºC. d) Mistura azeotrópica PF variável, PE constante. Exemplo: 96% álcool e 4% água — PE = 78,1%. 4 Separação das substâncias em uma mistura heterogênea a) b) c) d) Filtração: separação de um sólido em contato com um líquido. Ex.: água + areia. Decantação com funil de bromo: separação de líquidos imiscíveis. Ex.: água + óleo. Flotação: separação de sólidos com densidades bem diferentes. Ex.: serragem + areia. Dissolução Fracionada: separação com solubilidades diferentes, em determinado líquido. Ex.: sal + areia. e) Separação magnética ou imantação: um dos componentes da mistura é atraído por um ímã. Ex.: limalha de ferro + enxofre. f) Sublimação: um dos componentes da mistura sublima com facilidade. Ex.: iodo + areia. g) Cristalização fracionada: mistura de sólidos é totalmente dissolvida em um líquido; por evaporação do líquido ou resfriamento da mistura, cristaliza o componente de menor solubilidade. Ex.: NaNO3 + KIO3. h) Cromatografia em papel: as substâncias da mistura líquida são separadas usando um papel de filtro e um solvente adequado. Ex.: componentes de uma tinta. Separação das substâncias em uma mistura homogênea ou solução a) Destilação simples: separação de um sólido dissolvido em um líquido. Ex.: sal + água. b) Destilação fracionada: separação de líquidos miscíveis com pontos de ebulição diferentes. Ex.: água + acetona. c) Liquefação fracionada: separação de gases por resfriamento. Ex.: O2 + Cl2. Práticas de laboratório Filtração simples 5 • • Às vezes a filtração simples é muito lenta, como no caso da mistura água e farinha. Para acelerar esse tipo de filtração, utiliza-se a filtração a vácuo ou a pressão reduzida. A filtração também é utilizada para separar os componentes de uma mistura sólido—gás. Exemplo: aspirador de pó. Decantação com funil de bromo (funil de separação) Dissolução fracionada 6 Destilação simples • • Balão de destilação: o líquido vira vapor. Condensador: o vapor vira líquido (condensação). Destilação fracionada • Recolhimento de um gás insolúvel na água. 7 Exercícios de fixação 1. I. II. III. (UFES) Considere os seguintes sistemas: nitrogênio e oxigênio; etanol hidratado; água e mercúrio. a) b) c) d) e) Assinale a alternativa correta. Os três sistemas são homogêneos. O sistema I é homogêneo e formado por substâncias simples. O sistema II é homogêneo e formado por substâncias simples e compostas. O sistema III é heterogêneo e formado por substâncias compostas. O sistema III é uma solução formada por água e mercúrio. 2. a) b) c) d) e) 3. a) b) c) d) e) 4. a) b) c) d) e) (UFV) A gasolina comum consumida no Brasil contém, em volume, aproximadamente 25% de etanol. Este sistema é um exemplo de: substância pura simples. substância pura composta. mistura homogênea. mistura heterogênea. mistura alotrópica. (UFRS) Um sistema heterogêneo bifásico é formado por três líquidos diferentes A, B e C. Sabe-se que: A e B são miscíveis entre si; C é imiscível com A e com B; A é mais volátil que B. Com base nessas informações, os métodos mais adequados para separar os três líquidos são centrifugação e decantação. decantação e fusão fracionada. filtração e centrifugação. filtração e destilação fracionada. decantação e destilação fracionada. (Unifesp) Para isolar a cafeína (sólido, em condições ambientais) de uma bebida que a contenha (exemplos: café, chá, refrigerante, etc.) pode-se usar o procedimento simplificado seguinte. “Agita-se certo volume da bebida com dicloroetano e deixa-se em repouso algum tempo. Separa-se, então, a parte orgânica, contendo a cafeína, da aquosa. Em seguida, destila-se o solvente e submete-se o resíduo da destilação a um aquecimento, recebendo-se os seus vapores em uma superfície fria, onde a cafeína deve cristalizar.” Além da destilação e da decantação, quais operações são utilizadas no isolamento da cafeína? Flotação e ebulição. Flotação e sublimação. Extração e ebulição. Extração e sublimação. Levigação e condensação. 8 5. (UERJ) A aguardente é uma bebida alcoólica obtida da cana-de-açúcar. A charge abaixo poderia transmitir a ideia de que se trata de uma substância pura. Na realidade, ela não é uma substância pura, mas, sim, uma mistura homogênea. Isso pode ser comprovado pelo seguinte processo físico de separação: a) b) c) d) filtração destilação decantação centrifugação 6. ( ( ( (UFPE) Associe as atividades do cotidiano abaixo com as técnicas de laboratório apresentadas a seguir: ) Preparação de cafezinho de café solúvel. ) Preparação de chá de saquinho. ) Coar um suco de laranja. (1) (2) (3) (4) Filtração Solubilização Extração Destilação a) b) c) d) e) A sequência correta é: 2, 3 e 1 4, 2 e 3 3, 4 e 1 1, 3 e 2 2, 2 e 4 7. a) b) c) d) (PUC-MG) Nas salinas o processo de separação do cloreto de sódio (NaCl) é: dissolução cristalização destilação fusão 9 8. a) b) c) d) 9. a) b) c) d) (UERJ) Para a remoção do óleo derramado na Baía de Guanabara, um dos processos utilizados consistiu na adição de um produto semelhante à serragem que, após a aplicação, é facilmente recolhido, podendo ser despejado em aterros sanitários. A função desse produto, em relação ao óleo derramado, é de favorecer a: solubilização evaporação dispersão absorção (UERJ) São preparadas 3 misturas binárias em um laboratório, descritas da seguinte maneira: 1ª mistura → heterogênea, formada por um sólido e um líquido 2ª mistura → heterogênea, formada por dois líquidos 3ª mistura → homogênea, formada por um sólido e um líquido Os processos de separação que melhor permitem recuperar as substâncias originais são, respectivamente: filtração, decantação, destilação simples decantação, filtração, destilação simples destilação simples, filtração, decantação decantação, destilação simples, filtração 10. (U. E. Londrina-PR) Em uma destilação simples, para resfriar os vapores formados por um líquido em ebulição, utiliza-se a) proveta. b) balão volumétrico. c) cilindro graduado. d) frasco kitassato. e) condensador de vidro. 11. (UFRJ) Com a adição de uma solução aquosa de açúcar a uma mistura contendo querosene e areia, são vistas claramente três fases. Para separar cada componente da mistura final, a melhor sequência é: a) destilação, filtração e decantação. b) cristalização, decantação e destilação. c) filtração, cristalização e destilação. d) filtração, decantação e destilação. e) centrifugação, filtração e decantação. 12. (PUC-RJ) Dentro de um frasco, estão bem misturados pó de ferro, areia e sal de cozinha, todos finamente divididos. Baseado nas operações de I. Filtração II. Centrifugação III. Solubilização em água IV. Separação magnética V. Decantação a) b) c) d) e) Indique a ordem de procedimentos que separará os três componentes desta mistura: I, II, III. I, III, II. IV, III, I. IV, III, II. III, I, V. 10 13. (Puccamp) As proposições a seguir foram formuladas por um estudante, após o estudo de substâncias puras e misturas. I. O leite puro não pode ser representado por fórmula molecular porque é uma mistura de várias substâncias. II. Como se trata de substância pura, o álcool anidro apresenta ponto de ebulição e densidade característicos. III. A água mineral é substância pura de composição definida. IV. O ar empoeirado é mistura heterogênea sólido + gás. V. Por ser substância pura, o café coado não pode ser submetido a processos de fracionamento de misturas. Quantas proposições estão corretas? a) 1 b) 2 c) 3 d) 4 e) 5 14. (Fatec) O esquema a seguir representa a técnica, usada comumente em navios, para dessalinizar a água do mar. Trata-se da a) evaporação. b) condensação. c) destilação. d) sifonação. e) filtração. 11 15. (Fei) Associar os métodos (indicados na coluna A) que devem ser utilizados para separar as misturas (indicadas na coluna B): a) 1 - IV; 2 - III; 3 - V; 4 - II; 5 - I. b) 1 - III; 2 - IV; 3 - V; 4 - I; 5 - II. c) 1 - I; 2 - V; 3 - III; 4 - II; 5 - IV. d) 1 - II; 2 - IV; 3 - III; 4 - V; 5 - I. e) 1 - III; 2 - IV; 3 - V; 4 - II; 5 – I. 16. (PUCMG) O aparelho a seguir é usado na: a) destilação fracionada. b) separação por evaporação. c) separação de líquidos imiscíveis. d) destilação simples. e) liquefação seguida de destilação. 17. (Uece) Dadas as afirmativas: I. II. III. IV. IV. Num sistema constituído de NaCl dissolvido na água, areia, vapor d'água e oxigênio gasoso, nós temos um sistema heterogêneo, com três fases e quatro componentes. A ebulição da água é um fenômeno físico. Na estocagem de gasolina, é comum injetar gás hidrogênio para que, ocupando o lugar do ar, impeça a formação da mistura (gasolina + oxigênio). Dentro do tanque, temos um sistema bifásico. O fracionamento do petróleo é uma transformação química. Balão com saída lateral, termômetro, mangueira de látex e condensador são materiais usados para a montagem de um sistema de destilação fracionada em laboratório. São verdadeiras: a) I, II, III e IV b) II, III, IV e V c) I, II, III e V d) I, II, IV e V 12 18. (Uel) Um aspirador de pó residencial, quando em funcionamento, separa uma fase a) líquida de outra líquida. b) líquida de uma fase gasosa. c) sólida de uma fase gasosa. d) sólida de outra sólida. e) gasosa de outra gasosa. 19. (UFMG) Um sistema heterogêneo, constituído por uma solução colorida e um sólido esbranquiçado, foi submetido ao seguinte processo de separação. Com relação a esse processo, a afirmativa FALSA é a) a operação X é uma filtração. b) o líquido B é uma solução. c) o líquido D é o solvente da solução contida no sistema original. d) o sólido A contém grande quantidade de impurezas. e) uma destilação produz o efeito da operação Y. 20. (Unitau) Uma maneira rápida e correta de separar uma mistura com ferro, sal de cozinha e arroz é, na sequência: a) filtrar, aproximar um ímã, adicionar água e destilar. b) adicionar água e destilar. c) aproximar um ímã, adicionar água, filtrar e destilar. d) destilar, adicionar água, aproximar um ímã. e) impossível de separá-la. 21. (Puccamp) Determinada indústria trata, preliminarmente, seus efluentes com sulfato de alumínio e cal. A formação do hidróxido de alumínio permite que haja a eliminação de materiais. a) em solução, por meio de destilação simples. b) em suspensão, por meio de decantação e filtração. c) sólidos, utilizando cristalização fracionada. d) sólidos, por meio de fusão e filtração. e) líquidos, utilizando a sifonação e a evaporação. 13 Gabarito 1. b 2. c 3. e 4. d 5. b 6. a 7. b 8. d 9. a 10. e 11. d 12. c 13. c 14. c 15. b 16. a 17. c 18. c 19. d 20. c 21. b G:\Editoração\Ped2009\Química\Atividade 01- Revisão site-1C.doc 14
Download