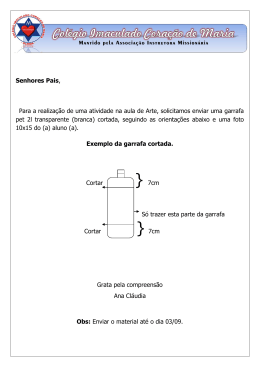
O problema do volume Ciência em Casa Material Compostos Garrafa de plástico transparente. Papel. Caneta. Frasco de medida. Água. Álcool etílico. Procedimento 1. Corta uma tira de papel e cola-a na parede da garrafa. 2. Com a ajuda de um frasco de medida, mede 200 ml de água. (podes medir outra quantidade, mas depois deves seguir sempre esta até ao fim da experiência) 3. Deita a água do frasco de medida na garrafa. 4. Marca o nível de água na fita com um (1). 5. Adiciona mais 200 ml de água à garrafa. 6. Marca o segundo nível de água com um (2). 7. Despeja e deixa secar a garrafa. Fotos: 8. Verte 200 ml de água, previamente medidos, à garrafa. 9. Mede 200 ml de álcool etílico no frasco de medida. 10. Adiciona os 200 ml de álcool à água da garrafa. (adiciona de maneira a que os dois líquidos se misturem bem) 11. Podes verificar que o nível da mistura é inferior ao nível (2) que marcaste anteriormente. Está provado que 200 ml, de água, mais 200 ml, de álcool, não são 400 ml. (1+1 é diferente de 2) O porquê? Como é possível 200 ml de água mais 200 ml de álcool etílico não serem 400 ml? Achas que aconteceu uma reacção. A resposta é: remataste para a bancada. As interacções entre as moléculas de água dão-se por pontes de hidrogénio. Estas interacções formam vazios entre as moléculas da água, devido ao facto de se estabelecerem entre o oxigénio e dois hidrogénios. Entre as moléculas de álcool etílico vão existir também interacções por pontes de hidrogénio, mas com intensidade menor. Quando se adiciona água ao álcool, estes vão formar uma mistura não ideal, porque o volume final não corresponde ao total adicionado. Isso é devido à possibilidade das moléculas de água interagirem com as moléculas de álcool, porque possuem ligações inter-moleculares semelhantes. Os espaços vazios, entre as moléculas de água, vão ser ocupados pelo álcool, diminuindo assim o volume total.
Baixar