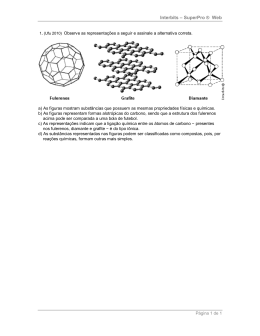
A QUÍMICA DA BOLA por prof. antonio carlos pavão A QUÍMICA DA BOLA A descoberta de uma bola, formada pela ligação de 60 átomos de carbono, garantiu o prêmio Nobel de Química de 1996 para Harold Kroto, Robert Curl e Richard Smalley. Esta bola foi considerada “a mais bela molécula”, uma “perfeita simetria” e inaugurou uma nova química das formas elementares do carbono, os fulerenos, onde os átomos estão dispostos formando uma rede esférica fechada. O interessante é que, nesse aglomerado de 60 átomos de carbono [C60], as ligações dos átomos formam um arranjo idêntico ao da bola de futebol utilizada nos diversos estádios pelo mundo. Mesmo os craques às vezes não percebem, mas nessa bola existem 12 superfícies pentagonais (cinco ângulos) costuradas a 20 superfícies hexagonais (seis ângulos). Colocando átomos de carbono nos vértices dos pentágonos, forma-se exatamente um aglomerado de 60 átomos (12 vezes 5). Então a bola de futebol, assim como a cúpula geodésica da exposição mundial de Montreal em 1967, desenhada pelo arquiteto Richard Bucky Fuller (daí veio o nome fulereno), serviram de modelo para a identificação dessa nova forma elementar do carbono capaz de gerar supercondutores, catalisadores, sensores e outros materiais de grande utilidade. Os fulerenos podem ser encontrados em atmosferas de estrelas ricas em carbono, no gás interestelar, na vaporização do carbono e, em pequeníssimas concentrações, até mesmo na fumaça de cigarro. Entretanto, a preparação de fulerenos pode ser feita pela irradiação de uma superfície de grafite com um laser potente. Os fragmentos de grafite ejetados da superfície, devidamente recolhidos por uma corrente de gás hélio, irão conter quantidades significativas de fulerenos. E por que a bola é redonda? Costurando apenas os hexágonos, ela jamais seria redonda. Ao contrário, ligando hexágonos forma-se uma rede plana, algo parecido com as redes usadas no gol. É necessário incluir os pentágonos para arredondar a superfície. 2 BRASIL um país um mundo Molécula de fulereno, formada pela ligação de 60 átomos de carbono. Recorte pentágonos e hexágonos (use papelão, plástico, madeira etc.). Agora tente “ladrilhar um piso” com os hexágonos. Depois tente com os pentágonos. Por que a superfície fica fechada com os hexágonos mas com os pentágonos ficam buracos? O que acontece se unirmos os pentágonos pelas suas arestas? Um dos três pesquisadores laureados com o Nobel, Sir Harold Kroto, da Universidade de Sussex, Inglaterra, agora procura pentágonos em todas as superfícies curvas que vê. Numa palestra na UFPE, quando visitou o Brasil, em julho de 1993, ele mostrou uma foto da Catedral de Brasília onde se destacavam aquelas figuras. A busca de pentágonos é um bom campo para descobertas. Eles existem no casco de tartarugas, em fragmentos arqueológicos de carapaça de tatus gigantes e em diversas outras superfícies arredondadas. Descubra você também onde ocorrem outros pentágonos e registre no site da exposição. Pesquise em toda superfície arredondada que aparecer. Comparando as diversas formas de carbono elementar, verificamos que a estrutura microscópica determina o comportamento macroscópico. Dependendo do arranjo dos átomos, formam-se materiais com diferentes propriedades. É a relação entre essência e aparência. Não ocorrem pentágonos na estrutura do grafite ou do diamante, as outras duas formas mais conhecidas de carbono elementar. No grafite, os átomos estão ligados em arranjos hexagonais e sua estrutura é formada apenas por inúmeros planos paralelos. Por isso o grafite pode ser usado como lubrificante, já que esses planos podem deslizar uns sobre os outros. No diamante o arranjo é tetraédrico e as ligações ocorrem em todas as direções, tornando-o um cristal duro e ótimo isolante. Todos os aglomerados de carbono que formam os fulerenos (C60,C70,C120 etc.) têm estruturas fechadas, parecendo gaiolas. Na verdade, isso segue a Lei de Euler, uma proposição matemática que afirma que é possível construir um poliedro com 12 pentágonos e nenhum (o dodecaedro), ou mais de um, hexágono. A QUÍMICA DA BOLA 3 Use o teorema de Euler: V + F = A + 2 e prove esta afirmativa. Coloque sua resposta no site da Exposição. A estrutura de gaiola dos fulerenos sugere que se possa aprisionar outros átomos dentro dela, uma nova e promissora possibilidade de manipulação para a Química. Assim foram preparados diversos fulerenos dopados com metais. O C60 dopado com potássio, por exemplo, é um supercondutor a temperaturas abaixo de 18 graus na escala Kelvin (-255 ºC). Visite o site da Sociedade Brasileira de Química – http://quid.sbq.org. br/palavras/carbono_e_fulereno_a.html – e aprenda mais sobre fulerenos e a química do carbono. Portanto, em tempos de Copa do Mundo, é bom lembrar que o futebol, “ganha-pão da imprensa”* e às vezes utilizado como instrumento de alienação e patriotismo, também pode ser fonte de profundos conhecimentos científicos. * Curta a música “Caixinha, obrigado” de Juca Chaves: http://www.ouvirmusica.com.br/juca-chaves/319509/#maisacessadas/319509 Aprenda mais: http://qnesc.sbq.org.br/online/qnesc05/elemento.pdf http://quid.sbq.org.br/palavras/carbono_e_fulereno_a.html http://www.somatematica.com.br/biograf/euler.php h t t p : / / t ve s co l a . m e c . g ov. b r/ i n d e x . p h p ? o p t i o n = co m _ zoo&view=item&item_id=2349 h t t p : / / t v e s c o l a . m e c . g o v. b r/ i n d e x . p h p ? & o p t i o n = c o m _ zoo&view=item&item_id=5209 http://www.brasilescola.com/matematica/relacao-euler.htm 4 BRASIL um país um mundo
Download