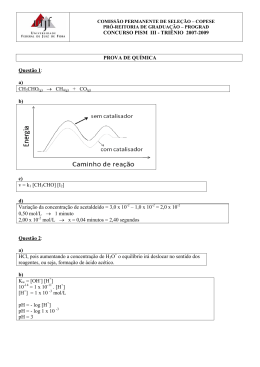
1. Num forno de microondas, a radiação é absorvida pela água da comida que se quer aquecer. Qual é a energia necessária que deve ser fornecida pelas microondas para elevar a temperatura de 350g de água de 25 °C para 100 °C? Dado: Cs(H2O) = 4,184 J/K.g E = q + w, no microondas, a única forma de transferência de energia é através do calor. O calor necessário para aumentar a temperatura de uma quantidade de água é dado por: m = 350g o T = 100 – 25 = 75 C, neste caso, também é 75 K. ou ~110 kJ. 2. Dois estágios sucessivos da preparação industrial de ácido sulfúrico são a combustão do enxofre e a oxidação do dióxido de enxofre a trióxido de enxofre. A partir das entalpias padrão de reação: o S(s) + O2(g) -> SO2(g) H = -296,83 kJ o 2 S(s) + 3 O2(g) -> 2 SO3(g) H = -791,44 kJ calcule a entalpia da reação de oxidação do dióxido de enxofre a trióxido de enxofre na reação: 2 SO2(g) + O2(g) -> 2 SO3(g) Utilização da Lei de Hess: 2 SO2(g) -> 2 S(s) + 2 O2(g) H = -2(-296,83 kJ) = +593,66 kJ 2 S(s) + 3 O2(g) -> 2 SO3(g) H = -791,44 kJ ___________________________________________________________________ 2 SO2(g) + O2(g) -> 2 SO3(g) H = (+593,66 kJ) + (-791,44 kJ) = -197,78 kJ 3. A entropia de vaporização da acetona é aproximadamente 85 J/K.mol. o a) Estime a entalpia de vaporização da acetona na temperatura de ebulição (56,2 C). a pressão constante: S = 85 J/K.mol o T = 56,2 C = 329,2 K ou ~28 kJ/mol o b) Qual é a variação de entropia quando 10 g de acetona (MM = 58g/mol) condensam a 56,2 C Para 1 mol, ou 58 g: S = - 85 J/K.mol (Svap = -Scond) Para 10g, : 4. Calcule a Variação de Energia Livre Molar (∆Gm) para o processo de fusão da água em (a) 0 0 10 C, e (b) 0 C, e verifique se a fusão é espontânea nessas temperaturas, a pressão constante. Considere que ∆Hfus e ∆Sfus são independentes da temperatura. Dados: ∆Hfus = 6,01 kJ/mol e ∆Sfus = 22,0 J/K.mol o Para 10 C (283 K): - Processo espontâneo o Para 0 C (273 K): ~ 0 (equilíbrio)
Baixar