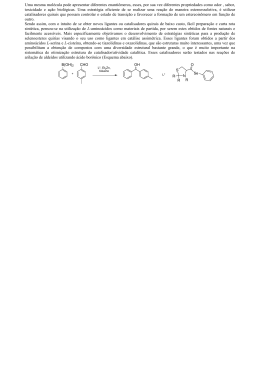
Ciências exatas e da terra/ Físico-Química/ Catálise ESTUDO CINÉTICO DA DECOMPOSIÇÃO TÉRMICA DO CATALISADOR EMPREGADO NA REAÇÃO DE HIDROGENÓLISE DO GLICEROL Lília Figueiredo Bonfim Matos [email protected] Graduanda em Engenharia Química - Universidade Salvador - UNIFACS Viviana Oliveira Mateus Profa. Msc./Orientadora Introdução Este trabalho propõe o estudo da decomposição térmica dos catalisadores relevantes na reação de hidrogenólise catalítica do glicerol. A determinação da decomposição irá permitir determinar a equação que melhor representa o comportamento cinético do catalisador. O estudo cinético é realizado a partir de dados experimentais aplicados em vários modelos de equações já descritas pela literatura, em função do tempo ou da temperatura, mantendo-se o controle da massa. Estas medidas podem ser obtidas através da termogravimétrica. A relevância desse estudo se dá pela sua utilidade na descoberta do mecanismo envolvido no processo da decomposição térmica. Com posse destes resultados é possível mensurar os motivos que levam a diminuição da área que os catalisadores dispõem, por exemplo. E, por conseguinte, seu controle. Isto pode garantir a obtenção de catalisadores mais ativos a serem empregados na produção de propeno, a partir do glicerol. Os catalisadores escolhidos para esse estudo foram aquelas que apresentaram maior conversão de glicerol a propeno de acordo com MOTA et al. (2010). Métodos Os catalisadores de ferro e óxido de molibdênio suportados em carvão ativado foram preparados pelo método de impregnação em lama com variação do pH do metal de transição, de acordo com a patente brasileira MOTA et al. (2010). As amostras foram submetidas a uma análise termogravimétrica, com um detector TGA-50H SHIMATZU sob uma atmosfera de nitrogênio com uma vazão de 50 ml/min em duas diferentes taxas de aquecimento de 5ºC/min e 10ºC/min. Com o auxílio do programa OriginPro® foram feitas as curvas da perda de massa Vs tempo de aquecimento. Para a realização do cálculo de ativação das amostras foi utilizado o método de Vyazovkin com o auxílio do software Excel. Os parâmetros cinéticos, k, A, e Ea, que referem-se a constante de velocidade específica de reação, ao fator de frequência ou fator pré-exponencial e a energia de ativação, respectivamente. Os demais termos são: a constante universal dos gases (R), a temperatura (T) dada em Kelvin e a função g(a) que refere-se aos modelos cinéticos das reações de decomposição térmica em sólidos, tais modelos refletem os fatores que influenciam na velocidade da reação como nucleação, geometria, difusão e ordem. Resultados e Discussão Os catalisadores de molibdênio suportado em carvão ativado (CM) e de molibdênio e ferro suportado em carvão ativado apresentaram perda de massa entre as temperaturas de 24,51ºC a 105,114ºC, 105ºC a 400ºC. O decaimento de massa, presente em todas as amostras, compreendido até a temperatura aproximada de 105ºC está associado a evaporação da água. As amostras de CMF apresentaram um evento de decaimento de massa presente entra a temperatura de 105ºC200ºC, esse decaimento pode estar associado a perda de amônia relacionada ao molibdênio. A partir de 790ºC o decaimento de massa provavelmente está associado ao ponto de fusão do MoO 3. A decomposição do CM com taxa de aquecimento de 10ºC/min, que ocorreu em apenas uma etapa significativa, tem a nucleação (P4) como modelo cinético que melhor a representa. Os demais catalisadores obtiveram duas etapas significativas no processo. O CM com taxa de aquecimento de 5ºC/min têm a ordem como modelo cinético, F1 e F2 respectivamente para suas etapas. O CMF com taxa de aquecimento de 5ºC/min possui na primeira etapa a um modelo de segunda ordem (F2) enquanto que na segunda etapa é (P4), o mesmo catalisado com a taxa de aquecimento de 10ºC/min apresenta na primeira etapa (A3) e na segunda (P4). Conclusões Os catalisadores multimetálicos, em questão, de ferro e molibdênio suportados em carvão ativado são decompostos, geralmente, em duas etapas importantes onde a primeira etapa acontece a liberação de água e amônia e maior perda de massa quando não há presença do ferro. Menores taxas de aquecimento são mais apropriadas para o estudo da decomposição térmica desses catalisadores, pois apresentam etapas que em taxas de aquecimento maiores passam despercebidas. A velocidade da decomposição desses catalisadores acontecesse por meio de nucleação ou ordem, ou seja, a geometria e difusão não interferem na cinética da decomposição. A baixa energia de ativação das etapas finais indicam que não há formação de novos compostos em temperaturas muito elevadas. Instituição de fomento: Fundação de Amparo à Pesquisa do Estado da Bahia - FAPESB Trabalho de Iniciação Científica Palavras- chave: Cinética Química / Hidrogenólise / Catálise
Baixar