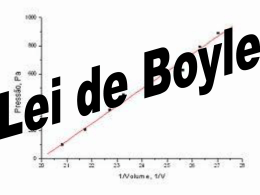
Tópicos da História da Física Clássica Lei dos Gases Victor O. Rivelles Instituto de Física da Universidade de São Paulo Edifício Principal, Ala Central, sala 314 e-mail: [email protected] http://www.fma.if.usp.br/~rivelles O Vácuo Aristóteles: a natureza abomina o vácuo. O Vácuo Aristóteles: a natureza abomina o vácuo. Otto von Guericke inventa a bomba de vácuo em 1650 e investiga as propriedades do vácuo. O Vácuo Aristóteles: a natureza abomina o vácuo. Otto von Guericke inventa a bomba de vácuo em 1650 e investiga as propriedades do vácuo. Constroi os hemisférios de Magdburg para demonstrar a força da pressão do ar. O Vácuo Aristóteles: a natureza abomina o vácuo. Otto von Guericke inventa a bomba de vácuo em 1650 e investiga as propriedades do vácuo. Constroi os hemisférios de Magdburg para demonstrar a força da pressão do ar. http://http://www.youtube.com/watch?v=YjfWTo75THs A Pressão da Atmosfera Evangelista Torricelli era um admirador de Galileu. A Pressão da Atmosfera Evangelista Torricelli era um admirador de Galileu. Tentava resolver o problema de fazer uma bomba de água elevar a água por mais de 10 m de altura. A Pressão da Atmosfera Evangelista Torricelli era um admirador de Galileu. Tentava resolver o problema de fazer uma bomba de água elevar a água por mais de 10 m de altura. Colocou mercúrio num tubo de 1 m e o colocou de cabeça para baixo. A coluna de mercúrio desceu e estacionou à cerca de 735 mm: barômetro! A Pressão da Atmosfera Evangelista Torricelli era um admirador de Galileu. Tentava resolver o problema de fazer uma bomba de água elevar a água por mais de 10 m de altura. Colocou mercúrio num tubo de 1 m e o colocou de cabeça para baixo. A coluna de mercúrio desceu e estacionou à cerca de 735 mm: barômetro! Havia feito vácuo na parte superior. A Lei dos Gases Robert Boyle Rejeitava a alquimia e a teoria dos 4 elementos de Aristóteles. A Lei dos Gases Robert Boyle Rejeitava a alquimia e a teoria dos 4 elementos de Aristóteles. Publicou “The Sceptical Chymist” em 1661 onde define elemento químico. Estas idéias só foram retomadas um século depois por Antoine Lavoisier. A Lei dos Gases Robert Boyle Rejeitava a alquimia e a teoria dos 4 elementos de Aristóteles. Publicou “The Sceptical Chymist” em 1661 onde define elemento químico. Estas idéias só foram retomadas um século depois por Antoine Lavoisier. Construiu uma bomba de vácuo para estudar as propriedades do ar: elasticidade, peso, som, respiração, combustão, ... A Lei dos Gases Robert Boyle Rejeitava a alquimia e a teoria dos 4 elementos de Aristóteles. Publicou “The Sceptical Chymist” em 1661 onde define elemento químico. Estas idéias só foram retomadas um século depois por Antoine Lavoisier. Construiu uma bomba de vácuo para estudar as propriedades do ar: elasticidade, peso, som, respiração, combustão, ... Publicou “New Experiments Physico-Mechanical Touching the Spring of the Air and its Effects” em 1660, que contém a Lei de Boyle: PV = constante. As leis do gás ideal Lei de Boyle, 1660: P1 V1 = P2 V2 , à T constante. As leis do gás ideal Lei de Boyle, 1660: P1 V1 = P2 V2 , à T constante. Lei de Charles, 1678: V1 T1 = V2 T2 , à P constante. As leis do gás ideal Lei de Boyle, 1660: P1 V1 = P2 V2 , à T constante. Lei de Charles, 1678: V1 T1 = Ley de Gay-Lussac, 1809: V2 T2 , à P constante. P1 P2 T1 = T2 , à V constante. As leis do gás ideal Lei de Boyle, 1660: P1 V1 = P2 V2 , à T constante. Lei de Charles, 1678: V1 T1 Ley de Gay-Lussac, 1809: Lei de Avogadro, 1811: de moles do gás. V2 T2 , à P constante. P1 P2 T1 = T2 , à V constante. = Vn22 , à P e T constantes; = V1 n1 n =número As leis do gás ideal Lei de Boyle, 1660: P1 V1 = P2 V2 , à T constante. Lei de Charles, 1678: V1 T1 Ley de Gay-Lussac, 1809: Lei de Avogadro, 1811: de moles do gás. Lei do gás ideal: P1 V1 T1 = V2 T2 , à P constante. P1 P2 T1 = T2 , à V constante. = Vn22 , à P e T constantes; = V1 n1 P2 V2 T2 ou PV = nRT , R=constante universal dos gases. n =número As leis do gás ideal Lei de Boyle, 1660: P1 V1 = P2 V2 , à T constante. Lei de Charles, 1678: V1 T1 Ley de Gay-Lussac, 1809: Lei de Avogadro, 1811: de moles do gás. Lei do gás ideal: P1 V1 T1 = V2 T2 , à P constante. P1 P2 T1 = T2 , à V constante. = Vn22 , à P e T constantes; = V1 n1 P2 V2 T2 n =número ou PV = nRT , R=constante universal dos gases. Lei de Charles: http://http://www.youtube.com/watch?v=GcCmalmLTiU Teoria Cinética dos Gases Daniel Bernouilli Publicou Hidrodynamica em 1738 onde delineou as bases da teoria cinética dos gases. Teoria Cinética dos Gases Daniel Bernouilli Publicou Hidrodynamica em 1738 onde delineou as bases da teoria cinética dos gases. Um gás consiste de um grande número de moléculas movendo-se em todas as direções. O impacto das moléculas nas paredes do recipiente que contém o gás causa a pressão do gás. O calor do gás é devido à energia cinética das moléculas. Teoria Cinética dos Gases A teoria não foi aceita imediatamente porque a conservação da energia não estava ainda estabelecida. Também não era claro que a colisão de moléculas poderia ser perfeitamente elástica. Teoria Cinética dos Gases A teoria não foi aceita imediatamente porque a conservação da energia não estava ainda estabelecida. Também não era claro que a colisão de moléculas poderia ser perfeitamente elástica. Rudolf Clausis em 1857 incluiu o movimento rotacional e vibracional das moléculas. Teoria Cinética dos Gases A teoria não foi aceita imediatamente porque a conservação da energia não estava ainda estabelecida. Também não era claro que a colisão de moléculas poderia ser perfeitamente elástica. Rudolf Clausis em 1857 incluiu o movimento rotacional e vibracional das moléculas. James Clerk Maxwell em 1859 introduziu a distribuição de Maxwell para a velocidade das moléculas: proporção de moléculas com velocidades dentro de um certo limite. Teoria Cinética dos Gases A teoria não foi aceita imediatamente porque a conservação da energia não estava ainda estabelecida. Também não era claro que a colisão de moléculas poderia ser perfeitamente elástica. Rudolf Clausis em 1857 incluiu o movimento rotacional e vibracional das moléculas. James Clerk Maxwell em 1859 introduziu a distribuição de Maxwell para a velocidade das moléculas: proporção de moléculas com velocidades dentro de um certo limite. Ludwig Boltzmann em 1875 apresentou uma conexão precisa entre a entropia S e o movimento molecular, S = k log W , onde k é a constante de Boltzmann e W é o número de estados possíveis que o gás pode apresentar. Termodinâmica Lei Zero: Se dois sistemas estão em equilíbrio térmico com um terceiro então eles estão em equilíbrio térmico entre si. Primeira Lei: A mudança na energia interna de um sistema termodinâmico fechado é igual a diferença entre o calor fornecido ao sistema e a quantidade de trabalho feito pelo sistema sobre sua vizinhança. Segunda Lei: O calor não pode fluir de forma espontânea de um local mais frio para um local mais quente. Terceira Lei: Quando um sistema se aproxima do zero absoluto todos os processos cessam e a entropia do sistema aproxima-se de seu valor mínimo. A termodinâmica pode então ser descrita em termos do movimento das partículas e suas leis podem ser derivadas da mecânica estatística aplicada a um grande número de partículas.!!!
Download