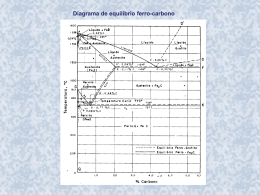
Diagramas de Fases Diagramas de Fases Vamos tentar responder... Quando nós combinamos dois elementos... que estado de equilíbrio teremos? • Em particular, se nós especificamos... -- uma composição (por ex., %peso Cu - %peso Ni), e -- uma temperatura (T ) então... Quantas fases teremos? Qual a composição de cada fase? Quanto de cada fase teremos? Fase A Fase B Ni Cu Limite de Solubilidade Introdução – Soluções –soluções sólidas , fase única – Misturas – mais do que uma fase Sucrose/Water Phase Diagram • Limite de Solubilidade: Questão: Qual o limite de solubilidade a 20°C? Temperature (°C) Máxima concentração na qual uma fase única ocorre. 100 Solubility Limit 80 L (liquid) 60 L 40 (liquid solution i.e., syrup) 20 + S (solid sugar) Resposta: 65 %peso açucar. 20 40 60 65 80 100 Co =Composition (wt.% sugar) Pure Sugar 0 Pure Water se Co < 65 %p açúcar: xarope se Co > 65 %p açúcar: xarope + açúcar Componentes e Fases • Componentes: Elementos ou compostos que estão presentes em uma mistura (por ex., Al e Cu) • Fases: Distinção física e química de regiões de um material (por ex., α e β). β ( fase clara) Liga Al-Cu α (fase escura) Efeitos da Temperatura e da Composição (Co) • Mudando Temp pode mudar # de fases: de A para B. • Mudando Co pode mudar # de fases: de B para D. B (100°C,70%p) D (100°C,90%p) Sistema Água - Açúcar 1 fase Temperatura (°C) 100 2 fases L 80 (liquido) 60 L (Solução liquida 40 i.e., xarope) + S (açúcar solido) A (20°C,70%p) 20 2 fases 0 0 20 40 60 70 80 100 Co =Composição (%peso açúcar) Equilíbrio de Fase Sistema de solução Completa (por ex., Ni-Cu) EletroEstrutura negatividade r (nm) Ni FCC 1.9 0.1246 Cu FCC 1.8 0.1278 • (Regra de W. Hume –Rothery) sugere alta solubilidade mutua. • Ni e Cu são totalmente miscíveis em todas as proporções 5.2.1. SOLUÇÕES SÓLIDAS EM METAIS SOLUÇÕES SÓLIDAS SUBSTITUCIONAIS • As soluções sólidas formam-se mais facilmente quando os átomos do solvente e do soluto têm dimensões e estruturas eletrônicas comparáveis. • No caso do latão, o cobre e o zinco têm raios atômicos de 0,1278 e 0,1332 nm, respectivamente. Ambos têm, excetuando-se o nível de valência, 28 elétrons e apresentam, quando isolados, número de coordenação NC = 12. Portanto, o zinco substitui facilmente até um máximo de cerca de 40% dos átomos de cobre no reticulado CFC. Este é um exemplo de solução sólida substitucional, bastante comum em vários sistemas metálicos. • Outro exemplo é a solução de cobre e níquel formando o monel. Estas soluções vão desde praticamente a ausência de níquel até quase 100% de átomos de níquel. Todas as ligas cobre-níquel são CFC. Os raios atômicos do cobre e do níquel são 0,1278 e 0,1246 nm, respectivamente, e eles têm a mesma estrutura CFC. • Por outro lado, há um limite muito bem definido na quantidade de estanho que pode substituir cobre para formar bronze e ainda manter a estrutura CFC do cobre. O estanho em excesso, além da quantidade correspondente à solubilidade sólida, forma uma outra fase. Isto é definido pelo limite de solubilidade. • Conforme aumenta a diferença de dimensões entre os átomos, ocorre cada vez menos substituição. Apenas 20% dos átomos de Cu podem ser substituídos por alumínio. • Para ocorrer a completa miscibilidade em soluções sólidas metálicas, os metais devem ser bastante similares, como definido pela Regras de Hume-Rothery (metalurgista inglês, 1899-1968): 1) Menos que cerca de 15% de diferença nos raios atômicos 2) A mesma estrutura cristalina 3) Eletronegatividades similares (atração de elétrons) 4) A mesma valência. • A Tabela 4-1 e a Figura 4-3 mostram a solubilidade sólida máxima, no cobre, de vários metais com a mesma estrutura CFC do cobre. Diagrama de fases do sistema Cu-Sn rCu = 0,1278 nm rSn = 0,1509 nm Diagrama de fases do sistema Cu-Al rCu = 0,1278 nm rAl = 0,1431 nm Diagrama de fases do sistema Cu-Ni rCu = 0,1278 nm rNi = 0,1246 nm Diagramas de Fases • Indica as fases como função da Temperatura, Co, e P. Neste curso: - Sistemas binários: apenas 2 componentes. - Variáveis independentes : Temperatura e Co (P = 1 atm). 1600 •Diagrama de Fases para o sistema Cu-Ni Temperatura (°C) 1500 L (liquido) • 2 Fases: 1400 L (liquido) α (solução sólida CFC) 1300 α 1200 (solução sólida CFC) 1100 1000 0 Cu 20 40 60 %peso Ni 80 100 Ni • 3 Campos de Fases: L L+α α Diagramas de Fases : # e tipos de fases • Regra 1: se conhecemos a Temp e a Co, então conhecemos: -- o # e os tipos de fases presentes. • Exemplos: A(1100°C, 60%p): α 1 fase: 1500 1400 oT(°C) B(1250°C, 35%p): 2 fases: L + α B (1250°C,35%p) 1600 1300 L (liquido) α 1200 (ss CFC) 1100 1000 0 A (1100°C,60%p) 20 40 60 %peso Ni 80 100 Diagramas de Fases : composição e fases • Regra 2: se conhecemos a Temp e a Co, então conhecemos: -- a composição de cada fase. Sistema Cu-Ni • Exemplos: T D = 1190°C: apenas Sólido ( α ) Cα = Co ( = 35 %peso Ni) A TA 1300 T(°C) Co = 35 %peso Ni TA = 1320°C: apenas Líquido (L) CL = Co ( = 35 %peso Ni) L B TB 1200 D TD 20 TB = 1250°C: ambos α and L CL = C liquidus ( = 32 %peso Ni ) Cα = C solidus ( = 43 %peso Ni ) α 30 32 35 CL Co 40 43 Cα %peso Ni 50 Diagramas de Fases: frações de fases • Regra 3: se conhecemos a Temp e a Co, então conhecemos: -- a quantidade de cada fase (%peso ou %mol). • Exemplos: Co = 35 %peso Ni T(°C) TA : apenas Líquido (L) W L = 100 %peso, Wα = 0 TD: apenas Sólido ( α ) W L = 0, Wα = 100 %peso T B : ambos α e L 43 − 35 = 73 % 43 − 32 WL = S R +S Wα = R = 27 % R +S = A TA 1300 TB 1200 TD 20 L B R S α D 3032 35 CLCo 40 43 50 Cα %peso Ni Regra da Alavanca • Linha de interligação – conecta as fases em equilíbrio – essencialmente numa isoterma T(°C) Quanto de cada fase? Pense nisso como uma alavanca (gangorra) L 1300 B TB Mα ML α 1200 R 20 S 30C C 40 C α L o R 50 S M α ⋅S = M L ⋅R %peso Ni WL = C − C0 ML S = = α M L + M α R + S C α − CL Wα = C − CL R = 0 R + S C α − CL Resfriamento em um sistema binários: Cu-Ni • Sistema é: -- binário i.e., 2 componentes: Cu e Ni. T(°C) L (liquid) 1300 L: 35 %p Ni α: 46 %p Ni --isomórfico A 35 32 i.e., solubilidade 24 completa de um componente no outro; 1200 o campo da fase α estende-se de 0 to 100% Ni. • Considerar Co = 35 %pesoNi. L: 35%pNi 110 0 20 B C 46 43 D L: 32 %p Ni 36 α: 43 %p Ni E L: 24 %p Ni α: 36 %p Ni α (solid) 30 35 Co 40 50 %peso Ni Sistemas em equilíbrio • Cα no resfriamento. • Cu-Ni : Primeira fase α a solidificar possui Cα = 46 %peso Ni. Última fase α a solidificar possui Cα = 35 %peso Ni. • Altas taxas de resfriamento: estrutura em partes • baixas taxas de resfriamento: estrutura em equilíbrio primeiro α 46 %peso Ni último α < 35 %peso Ni Uniforme Cα: 35 %peso Ni Propriedades Mecânicas: Sistema Cu-Ni • Efeito da solução sólida na resistência: 400 300 200 0 20 40 60 80 100 Cu Ni %peso Ni -- Máximo em função de Co --Ductilidade (%EL) Elongamento (%EL) Limite de Resistência (MPa) -- Limite de Resistência (TS) 60 50 40 30 20 0 20 Cu 40 60 80 100 Ni %peso Ni -- Mínimo em função de Co Sistemas Binários-Eutéticos 2 componentes Possui uma composição com Temp de fusão inferior aos componentes puros T(°C) Sistema Cu-Ag 1200 • 3 regiões com uma fase L (liquid) (L, α, β) 1000 • solubilidade Limitada : α L + α 779°C α: rico em Cu L+β β 800 TE 8.0 71.9 91.2 β: rico em Ag 600 • TE : mínima Temp de fusão α+β • CE : Composição em TE 400 • Transição Eutética L(CE) α(CαE) + β(CβE) 200 0 20 40 60 CE 80 100 Co , %peso Ag Diagrama de fases do sistema Ag-Cu rCu = 0,1278 nm rAg = 0,1444 nm Diagrama de fases do sistema Cu-Pb rCu = 0,1278 nm rPb = 0,1750 nm EX: Sistema Eutético Pb-Sn • Para uma liga com 40 %p Sn – 60 %p Pb a 150°C, temos... -- fases presentes: α + β T(°C) --composição das fases: CO = 40 %peso Sn Cα = 11 %peso Sn Cβ = 99 %peso Sn -- Qtde de cada fase: Wα = C - CO S = β R+S Cβ - Cα 59 99 - 40 = = 67 % 88 99 - 11 C - Cα Wβ = R = O Cβ - Cα R+S 40 - 11 29 = = 33 % = 99 - 11 88 300 200 L (liquid) α L+ α 18.3 150 100 L+β β 183°C 61.9 R 97.8 S α+β = 0 11 20 Cα 40 Co 60 80 99100 Cβ C, %peso Sn EX: Sistema Eutético Pb-Sn • Para uma liga com 40 %p Sn – 60 %p Pb a 220°C, temos... -- fases presentes : α + L T(°C) -- composição das fases : CO = 40 %peso Sn Cα = 17 %peso Sn CL = 46 %peso Sn -- Qtde de cada fase : CL - CO 46 - 40 = Wα = CL - Cα 46 - 17 6 = = 21 % 29 CO - Cα 23 = WL = = 79 % 29 CL - Cα 300 α 220 200 L+α R L (liquido) L+β β S 183°C 100 α+β 0 17 20 Cα 40 46 60 Co CL 80 C, wt% Sn 100 Microestruturas em Sistemas Eutéticos: • Co < 2 %peso Sn • Resultados: -L -L + α -policristais de grãos α i.e., apenas uma fase sólida. T(°C) L: Co %peso Sn 400 L α L 300 200 α L+ α TE α: Co %peso Sn 100 α+ β 0 Co 10 20 30 Co, %peso Sn 2 (limite de solubilidade a Temp ambiente) Microestruturas em Sistemas Eutéticos: • 2 %p Sn < Co < 18,3 %p Sn • Resultados: L L+α apenas α finalmente duas fases ¾ α policristalino ¾ inclusões finas de fase β L: Co %p Sn T(°C) 400 L L α 300 L+α α: Co %p Sn α 200 TE α β 100 α+ β 0 10 2 20 Co 30 C , %p Sn o 18,3 (limite solub. a TE) Microstruturas em Sistemas Eutéticos: • Co = CE • Resultados: microestrutura Eutética (estrutura lamelar) -- camadas alternadas (lamelares) de cristais de α e β. T(°C) L: Co %peso Sn 300 Micrografia de microestrutura eutética Pb-Sn L α 200 L+α L+β β 183°C TE 100 α+β 0 20 18,3 40 β: 97,8 %peso Sn α: 18,3 %pesoSn 60 CE 61,9 80 100 97,8 C, %peso Sn 160 μm Estrutura Eutética Lamelar Microstruturas em Sistemas Eutéticos: • 18,3 %peso Sn < Co < 61,9 %peso Sn (hipoeutético) • Resultados: cristais α e uma microestrutura eutética • logo acima TE : L: Co %peso Sn T(°C) 300 L α L α 200 α L L+α R TE L+ β S β α+β 100 α primário α eutético β eutético 0 20 18,3 40 60 61,9 CL = 61,9 %p Sn Wα = S = 50 % R+S WL = (1- Wα) = 50 % • logo abaixo TE : S R Cα = 18,3 %p Sn 80 100 97,8 Co, %peso Sn Cα = 18,3 %peso Sn Cβ = 97,8 %peso Sn Wα = S = 73 % R+S Wβ = 27 % Hipoeutético & Hipereutético 300 L T(°C) α 200 L+ α L+β β TE (Sistema Pb-Sn) α+β 100 0 hipoeutético: Co = 50 %p Sn α α α 20 40 60 80 Co, %peso Sn eutético 61,9 hipereutético: (apenas ilustração) eutético: Co = 61,9 %p Sn β α α β α 175 μm 100 160 μm eutético micro-constituinte β β β β Compostos Intermetálicos Mg2Pb Composto intermetálico forma uma linha – não uma área – composição estequiométrica exata Eutetóide & Peritético • Eutético L cool heat α+β • Eutetóide S2 intermetallic compound - cementite S1+S3 γ • Peritético S1 + L cool heat α + Fe3C (727ºC) S2 δ+L cool heat γ (1493ºC) Eutetóide & Peritético Diagrama Fase Cu-Zn Transição Eutetóide δ γ+ε Transição Peritética γ + L δ Diagrama de fases do sistema Cu-Zn rCu = 0,1278 nm rZn = 0,1332 nm Diagrama de Fase Ferro-Carbono (Fe-C) • 2 pontos importantes T(°C) 1600 -Eutetóide (B): γ ⇒ α + Fe3C L 1400 1200 γ +L γ (austenita) γ γ γ γ 1000 α 800 600 120 μm Resultado: Perlita = Camadas alternadas de α de Fe3C S γ +Fe3C 727°C = Teutetóide R S 1 0.76 L+Fe3C R B 400 0 (Fe) A 1148°C 2 3 α+Fe3C 4 5 6 Fe3C (cementita) L ⇒ γ + Fe3C δ Ceutetóide -Eutético (A): 6.7 4.30 Co, %peso C Fe3C (cementita-dura) α (ferrita - macia) Aço Hipoeutetóide T(°C) 1600 δ L 1400 α γ γ α γ αγ (Sistema Fe-C) 1000 800 γ + Fe3C r s 727°C αRS w α =s/(r +s) 600 w γ =(1- wα ) 400 0 α (Fe) perlita L+Fe3C 1148°C α + Fe3C 1 C0 w perlita = w γ w α =S/(R+S) w Fe3C =(1-w α ) perlita 2 3 4 5 6 Fe3C (cementita) γ γ γ γ γ +L γ 1200 (austenita) 0.76 γ γ γ γ 6.7 Co , %peso C 100 μm Aço Hipoeutetóide Ferrita pre-eutetóide Aço Hipereutetóide T(°C) 1600 δ L Fe3C γ γ γ +L γ 1200 (austenita) γ γ 1000 γ γ γ γ r 800 w Fe3C =r/(r +s) w γ =(1-w Fe3C ) s α R 600 400 0 perlita(Fe) L+Fe3C 1148°C γ +Fe3C 0.76 γ γ γ γ (Sistema Fe-C) S 1 Co w perlita = w γ w α =S/(R+S) w Fe3C =(1-w α ) α +Fe3C 2 3 4 5 6 6.7 Co , %pesoC 60 μm perlita Fe3C (cementita) 1400 Aço Hipereutetóide preeutetóide Fe3C Aços ligados com mais elementos Ti Mo Si W Cr Mn Ni %peso de elementos de liga • mudanças na Ceutetóide : Ceutetóide (%pesoC) T eutetóide (°C) • Mudanças na Teutetóide Ni Cr Si Ti Mo W Mn %peso de elementos de liga Composição da escória em aços • • • • A escória adicionada no Refino tem a função tanto de proteção térmica (evitar perda de temperatura) quanto proteção atmosférica (evitar reoxidação), mas também pode ter a função de captação de inclusões. Os principais insumos de escórias são: cal (CaO), a fluorita (CaF2), a alumina (Al2O3), o óxido de magnésio (MgO), ou mais recentemente escórias pré-fundidas, escórias sintéticas em que, além da mistura mecânica dos componentes, é realizada também uma pré-fusão. A utilização única ou combinada destes compostos fica a cargo dos engenheiros de processos, que são os responsáveis por desenhar o roteiro a ser seguido. Normalmente, seguem os diagramas quaternários CaO-Al2O3-SiO2-MgO, mas na prática são utilizados os ternários da combinação destes elementos. A composição da escória está diretamente ligada à formação de inclusões. Deseja-se evitar escórias de alto ponto de fusão, sólidas, com interação ruim com o aço, e pouca ou nenhuma captação de inclusões. Busca-se portanto escórias líquidas nas temperaturas de processamento (1550°C a 1650°C), com boa interação com o aço e que preferencialmente captem inclusões. Composição da escória em aços Diagrama ternário em corte isotérmico e em vista tridimensional do sistema CaO-Al2O3SiO2, evidenciando a região de menor ponto de fusão (Dave Finkelnburg. How Glazes Melt: In Search of the Elusive Eutectic. Ceramic Starts Daily. [Online] Dezembro 09, 2009. http://ceramicartsdaily.org/wp-content/uploads/2009/11/ternary-diagram-large.jpg).
Baixar