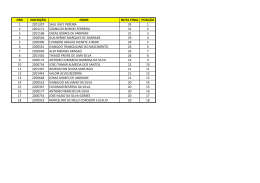
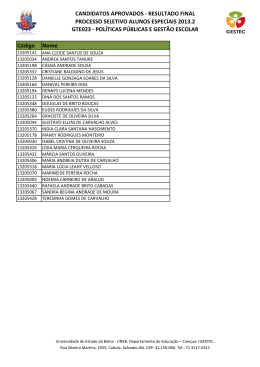
Es t u d o d a v e l o c i d a d e d a s r e a ç õ e s q u ím i c a s e d o s f a t o r e s que nela influem . Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA CL A SSI FI CA ÇÃ O DA S REA ÇÕES CI N ÉT I CA S I - Qu a n t o à v e l o c i d a d e Rá p i d a s : n e u t r a l i za ç õ e s e m m e i o a q u o s o , c o m b u s t õ e s ,... Lent as: ferm ent aç ões, form aç ão d e f e r r u g e m ,... Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA CL A SSI FI CA ÇÃ O DA S REA ÇÕES CI N ÉT I CA S I I - Qu a n t o a o m e c a n i s m o El e m e n t a r e s : o c o r r e m n u m a s ó e t a p a . H2 + I2 2 HI Co m p l e x a s : o c o r r e m e m d u a s o u m ais et apas. 2 NO(g) + O2(g) 2 NO2(g) 1a etapa (rápida) : 2 NO(g) N2O2(g) 2a etapa (lenta) : N2O2(g) + O2(g) 2 NO2(g) reação global : 2 NO(g) + O2(g) 2 NO2(g) Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA V EL OCI DA DE DA S REA ÇÕES I - V e l o c i d a d e m é d i a (v m ) Re p r e s e n t a a v a r i a ç ã o n a quant idade de um reagent e ou produt o num int ervalo de t em po. Dm Dn DV DC ou ou ou vm = Dt Dt Dt Dt m = m assa, n = no m ols, V = volum e, C = c onc ent raç ão m olar Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA Re p r e s e n t a ç ã o g r á f i c a O gráfic o ac im a m ost ra c om o variam as c onc ent raç ões de reagent e (N 2 O 5 ) e p r o d u t o s (N O 2 e O 2 ) , c o m o p a s s a r d o t e m p o . Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA V EL OCI DA DE DA S REA ÇÕES I I - V e l o c i d a d e i n s t a n t â n e a (v i o u v ) Re p r e s e n t a a v a r i a ç ã o n a quant idade de um reagent e ou inst ant e (m e n o r produt o num int ervalo de t em po que se possa i m a g i n a r ). Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA A veloc idade inst ant ânea de um a reaç ão é obt ida at ravés de um a ex pressão m at em át ic a c onhec ida c om o L EI DA A ÇÃ O DA S M A SSA S o u L EI CI N ÉT I CA , propost a por Gu l b e r g e Wa a g e , em 1876. Ca t o Gu l b e r g Pe t e r Wa a g e Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA Pa r a u m a r e a ç ã o g e n é r i c a h o m o g ê n e a a A (g ) + b B (g ) x X (g ) + y Y (g ) a veloc idade inst ant ânea é c alc ulada pela ex pressão v = k [ A ] a[ B ] b onde k = c onst ant e de veloc idade [A] e [B] = c onc ent raç ões m olares a e b = ordens ou graus Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA Nas reaç ões elem ent ares as ordens são iguais aos próprios c o e f i c i e n t e s (a = a e b = b ); Nas reaç ões c om plex as as ordens são iguais aos c oefic ient es da et apa m ais lent a da reaç ão, c onhec ida at ravés do m ec anism o da m esm a. Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA Ex e m p l o I - Re a ç ã o e l e m e n t a r H2 + I2 2 HI Lei de veloc idade (i n s t a n t â n e a ) v = k [ H 2] 1[ I 2] 1 Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA Ex e m p l o I I - Re a ç ã o c o m p l e x a 2 N O + O2 2 N O2 * Mec anism o 2 N O N 2 O2 (e t a p a l e n t a ) N 2O2 + O2 2 N O2 2 N O + O2 2 N O2 (e t a p a r á p i d a ) (r e a ç ã o g l o b a l ) L e i d e v e l o c i d a d e (i n s t a n t â n e a ) v = k [ N O] 2 CI N ÉT I CA QU Í M I CA PORQU E OCORREM A S REA ÇÕES QU Í M I CA S ? I - Co l i s õ e s i n t e r m o l e c u l a r e s a ) N ã o -e f i c a ze s o u n ã o e f e t i v a s (n ã o f o r m a m -s e p r o d u t o s ) * sem energia de c olisão sufic ient e ou geom et ria de c olisão inadequada. b ) Ef i c a ze s o u e f e t i v a s (f o r m a m -s e o s p r o d u t o s ) * c om energia de c olisão sufic ient e e geom et ria de c olisão adequada. Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA Ex e m p l o d e c o l i s ã o e f i c a z ( g e o m e t r i a Re a ç ã o : H B r + O 2 ¾ H B r O 2 Prof . Mat eus Andrade favorável) CI N ÉT I CA QU Í M I CA Co l i s õ e s e m g e o m e t r i a d e s f a v o r á v e l CI N ÉT I CA QU Í M I CA PORQU E OCORREM A S REA ÇÕES QU Í M I CA S ? I I - En e r g i a m ín i m a p a r a r e a g i r (En e r g i a d e A t i v a ç ã o - E a ) Além de c olisões c om orient aç ão espac ial adequada, as m oléc ulas devem apresent ar um a energia c inét ic a m ín i m a q u e p r o p i c i e a r u p t u r a d a s ligaç ões ent re os reagent es e form aç ão de novas ligaç ões, nos produt os. Qu a n t o m a i o r a E a , m a i s l e n t a a reaç ão ! Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA Re p r e s e n t a ç õ e s g r á f i c a s Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA Fa t o r e s q u e i n f l u e m n a veloc idade das reaç ões a ) Área de c ont at o ent re os reagent es; b ) Co n c e n t r a ç ã o d o s r e a g e n t e s ; c ) T e m p e r a t u r a e En e r g i a d e A t i v a ç ã o ; d ) Ra d i a ç õ e s e d e s c a r g a s e l é t r i c a s ; e) Aç ão de c at alisadores. Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA a) Área de c ont at o ent re os reagent es um Es s e f a t o r t e m s e n t i d o q u a n d o dos reagent es for sólido. Ex e m p l o : Fe (p r e g o ) + H 2 SO 4 (a q ) Fe SO 4 (a q ) + H 2 (g ) Fe (l i m a l h a ) + H 2 SO 4 (a q ) Fe SO 4 (a q ) + H 2 (g ) (v 1 ) (v 2 ) * na segunda reaç ão a área de c ont at o é m aior ! Po r t a n t o : v 2 > v 1 Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA b ) Co n c e n t r a ç ã o d o s r e a g e n t e s A veloc idade é proporc ional à c o n c e n t r a ç ã o d o s r e a g e n t e s . Es s e f a t o r é e x p r e s s o p e l a L EI DA A ÇÃ O DA S M A SSA S o u L EI CI N ÉT I CA (Gu l b e r g e Wa a g e ) v = k [ A ] a[ B ] b k = c onst ant e c inét ic a [A] e [B] = c onc ent raç ões m olares a e b = o r d e n s c i n é t i c a s (d a d a s n o p r o b l e m a ) Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA c ) T e m p e r a t u r a e En e r g i a d e A t i v a ç ã o As variaç ões de t em perat ura m odific am o v a l o r d a c o n s t a n t e d e v e l o c i d a d e (k ). Um aum ent o na T, aum ent a a freqüênc ia das c olisões int erm olec ulares e aum ent a a e n e r g i a c i n é t i c a d a s m o l é c u l a s f a ze n d o c om que um m aior núm ero alc anc e a e n e r g i a m ín i m a p a r a r e a g i r (E a t i v a ç ã o ). U m a u m e n t o n a e n e r g i a c i n é t i c a (a g i t a ç ã o m olec ular) favorec e a rupt ura das ligaç ões. Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA d) Aç ão de c at alisadores Ca t a l i s a d o r e s s ã o s u b s t â n c i a s q u e , q u a n d o present es, aum ent am a veloc idade das r e a ç õ e s q u ím i c a s , s e m s e r e m c o n s u m i d o s . A o f i n a l e n c o n t r a m -s e q u a l i t a t i v a e quant it at ivam ent e inalt erados. Os c a t a l i s a d o r e s e n c o n t r a m “ c a m i n h o s alt ernat ivos” para a reaç ão, envolvendo m e n o r e n e r g i a (d i m i n u e m a En e r g i a d e A t i v a ç ã o ), t o r n a n d o -a m a i s r á p i d a . Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA Ex e m p l o SO 2 (g ) + ½ O 2 (g ) ¾ SO 3 (g ) E a = 2 4 0 k J /m o l sem c at alisador U t i l i za n d o N O 2 (g ) c o m o c a t a l i s a d o r a E a s e r e d u z p a r a 1 1 0 k J /m o l , t o r n a n d o a r e a ç ã o ex t rem am ent e m ais rápida ! Mec anism o da reaç ão SO2 + NO2 SO3 + NO NO + ½ O2 NO2 E1 (consumo do catalisador) E2 (regeneração do catalisador) Reação global: SO2 + ½ O2 SO3 E = 110 KJ/mol Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA Ca r a c t e r ís t i c a s d o s c a t a l i s a d o r e s a ) So m e n t e a u m e n t a m a v e l o c i d a d e ; b) Não são c onsum idos; c ) Não inic iam reaç ões, m as int erferem nas que já oc orrem sem a sua presenç a; d ) Po d e m s e r u t i l i za d o s e m p e q u e n a s quant ias, vist o que não são c onsum idos; e ) Se u s e f e i t o s p o d e m s e r d i m i n u íd o s pela presenç a de “ venenos de c at álise” . Prof . Mat eus Andrade CI N ÉT I CA QU Í M I CA Co m o f u n c i o n a o c a t a l i s a d o r a u t o m o t i v o ? Prof . Mat eus Andrade
Download