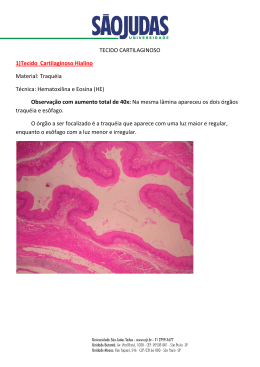
Estudo da viabilidade da cultura de condrócitos humanos 84 ARTIGO ORIGINAL Estudo da viabilidade da cultura de condrócitos humanos visando aplicação clínica para o transplante autólogo* Study on human chondrocyte culture viability for autologous transplantation in clinical application Christiane Lombello 1 , Geraldo Marins dos Reis Jr 2 , Moisés Cohen 3 ABSTRACT Objective: The limited regenerative capacity of the cartilage tissue makes the treatment of chondral lesions difficult. The techniques currently available to treat cartilage lesions may relieve symptoms, but do not regenerate the injured tissue. Autologous chondrocyte transplantation uses cell biology and cell culture techniques to regenerate the hyaline cartilage. Methods: In this study, we analyze chondrocyte biopsy collection and culture for autologous transplantation. Ultrastructural analyses of hyaline cartilage biopsies were performed 0, 6, 24 and 48 hours after collection. The tissue even after 48 hours. Eleven cell culture assays were performed to evaluate isolation, viability, morphology, proliferation and absence of contaminants. Results: The cell culture techniques used allowed chondrocyte proliferation. Rates on cell viability were maintained above the acceptable patterns (above 90). Control of cell culture laboratory conditions showed absence of contaminants, assuring safety of the process. The chondrocytes obtained presented the morphology typical of cultured cell monolayers. Conclusion: The results indicate viability of chondrocyte culture technique for clinical application in autologous transplantation. Keywords: Cell culture; Chondrocytes/transplantation; Transplantation, autologous/methods; Cartilage RESUMO Objetivo: A baixa capacidade regenerativa do tecido cartilaginoso dificulta o tratamento das lesões condrais. As técnicas disponíveis atualmente para o tratamento de lesões de cartilagem articular podem resultar em alívio dos sintomas, mas não na regeneração do tecido lesado. O transplante autólogo de condrócitos utiliza técnicas de biologia celular e cultura de células para a regeneração da cartilagem hialina. Neste trabalho procuramos analisar a cultura de condrócitos visando o transplante autólogo. Métodos: Foram realizados 11 experimentos de cultura celular para avaliar os dados de isolamento, viabilidade, morfologia, proliferação e ausência de contaminantes. As condições de cultura celular utilizadas permitiram a proliferação dos condrócitos. As taxas de viabilidade celular se mantiveram acima de 90%. Resultados: O controle das condições do laboratório de cultura celular demonstrou a ausência de contaminantes, garantindo a segurança do processamento. As células obtidas apresentaram morfologia típica de condrócitos cultivados em monocamada. Conclusão: Os resultados obtidos indicam a viabilidade da técnica de cultura de condrócitos para a aplicação clínica na técnica de transplante autólogo. Descritores: Cultura de células; Condrócitos; Transplante autólogo/ métodos; Cartilagem INTRODUÇÃO A nutrição do tecido cartilaginoso das superfícies articulares é realizada por meio da difusão de substâncias encontradas no líquido sinovial. Os condrócitos presentes no tecido são altamente especializados e sua principal função é conferir as propriedades biomecânicas, pela síntese dos componentes da matriz extracelular. Na cartilagem articular estão presentes proteoglicanos, principalmente o agregan, e colágeno tipo II preferencialmente. O estado diferenciado dos condrócitos e mesmo a ausência de vascularização do tecido dificultam o reparo de lesões condrais. O reparo tecidual das lesões condrais se baseia em técnicas cirúrgicas cujo princípio é o preenchimento da lesão com células mesenquimais provenientes da medula óssea subcondral, como abrasão, perfurações e microfraturas. No entanto, as lesões são preenchidas por tecido fibroso, ou fibrocartilagem, com carac- *Trabalho realizado no Hospital Israelita Albert Einstein, São Paulo/SP, em parceria com o Laboratório Biológica, Campinas /SP, e Departamento de Ortopedia e Traumatologia da Unifesp/EPM (SP). 1 Doutora em Biologia Celular e Estrutural pela Universidade Estadual de Campinas (SP). 2 Mestre em Engenharia Biomédica pela Universidade Estadual de Campinas (SP). 3 Professor Livre-docente, Chefe do Centro de Traumatologia do Esporte da Disciplina de Traumatologia do Departamento de Ortopedia e Traumatologia da Universidade Federal de São Paulo - Unifesp/EPM (SP). Endereço de correspondência: Christiane Lombello - R. Perez Y Marin, 81 - Guanabara - CEP 13020-250 - Campinas (SP) - e-mail- [email protected] Recebido em 1 de julho de 2003 – Aceito em 22 de outubro de 2003 einstein 2003; 1:84-8 einstein 2003; 1:84-8 Estudo da viabilidade da cultura de condrócitos humanos terísticas distintas da cartilagem hialina originalmente presente. Nesse tecido de reparação, há a predominância na matriz extracelular de colágeno tipo I. O transplante autólogo de condrócitos tem sido utilizado como alternativa biotecnológica para o tratamento de lesões condrais resultantes de trauma agudo ou repetitivo e que não responderam a tratamentos anteriores, cirúrgicos ou não (1-4). O transplante autólogo de condrócitos é uma técnica que visa a regeneração da cartilagem hialina, restaurando a função da superfície articular. Esta técnica vem sendo estudada desde o final da década de 1980 (5-6). Em 1994, um grupo da Universidade de Gotemburgo e do Hospital Universitário apresentou um estudo piloto com 23 pacientes submetidos a esta técnica para o tratamento de lesões cartilaginosas (7) . Destes, 16 pacientes apresentavam lesões no côndilo femoral e sete lesões patelares. Acompanharam-se os casos por até dois anos, tendo sido constatada recuperação boa ou excelente em 14 dos 16 com lesão no côndilo femoral. Realizaram-se biópsias em 15 pacientes, tendo-se constatado a presença de cartilagem hialina semelhante ao tecido original em 11 destes casos. Outros relatos científicos foram publicados a partir de então (8-11). O aprimoramento da técnica envolve a suplementação das culturas celulares com fatores de crescimento (12), o uso de biomateriais(13-14) e a aplicação de sistemas de biorreatores para a produção de tecido cartilaginoso in vitro (15) . A técnica de transplante autólogo de condrócitos para regeneração de cartilagem articular (Figura 1) consta da retirada de uma amostra de cartilagem normal em uma região de pouca carga da articulação. Esta biópsia é devidamente acondicionada e enviada para o laboratório de cultura celular, onde será realizada a digestão enzimática do tecido para o isolamento e cultivo celulares(16-17). Após um período de 30 a 40 dias é preparada uma suspensão dos condrócitos cultivados. A injeção da suspensão celular envolve o desbridamento da lesão condral, a cobertura da lesão com uma camada de periósteo, normalmente retirado da tíbia, e a injeção da suspensão celular entre a cobertura de periósteo e o osso subcondral(8). Os condrócitos transplantados têm a capacidade de se reorganizar para a produção de matriz hialina, regenerando o tecido com as mesmas características da cartilagem hialina original. Observa-se uma completa integração do tecido recém-formado, preenchendo todo o sítio da lesão alinhado às áreas adjacentes (7) . Nas primeiras oito semanas após o transplante este já está preenchido, em média, em 71%, sendo a natureza do tecido basicamente hialina, 85 com a formação de grupamentos celulares e predominância de colágeno tipo II (8). No presente trabalho, procuramos o aprimoramento da técnica de cultura celular visando o transplante autólogo de condrócitos, avaliando os aspectos de preservação, proliferação e morfologia celulares. MÉTODOS Coleta das Biópsias Obtiveram-se amostras de cartilagem articular de nove pacientes, seis homens e três mulheres, com idades entre 23 e 66 anos (média de 48 anos). Duas amostras foram submetidas à digestão enzimática em dias diferentes, contabilizando um total de 11 culturas celulares. Os pacientes foram submetidos a artroscopia por diversas causas. As amostras de cartilagem foram coletadas, com prévia autorização dos pacientes, em meio de cultura segundo o protocolo descrito anteriormente(7). Para o transporte das amostras de cartilagem foram utilizados recipientes térmicos permitindo a manutenção da temperatura entre 4ºC e 8ºC. Isolamento dos Condrócitos Onze amostras de cartilagem articular foram transportadas até o laboratório de cultura, onde foram submetidas ao processo de digestão enzimática para o isolamento das células, segundo o protocolo de Archer e colaboradores (16). Cultura dos Condrócitos As células provenientes das digestões enzimáticas foram então cultivadas em frascos de cultura na presença de meio HAMF12 contendo 1% de penicilina/ estreptomicina e 10% de soro fetal bovino, por períodos de até 40 dias, com duas ou três trocas semanais de meio. O repique das células foi realizado sempre que necessário. Contagem e Viabilidade Celulares Realizaram-se contagens para o número total de células e a porcentagem de células viáveis, logo após o isolamento das células e ao término das culturas, utilizando o corante vital Azul de Tripan, em câmara hemocitométrica. Análises Morfológicas Análises morfológicas das células foram realizadas rotineiramente utilizando microscopia de fase em einstein 2003; 1:84-8 86 Lombello C, Reis Jr GM, Cohen M microscópio invertido (Olympus IX-50). As culturas foram fotografadas periodicamente para os registros de morfologia celular. Análises Microbiológicas Algumas das culturas celulares foram amostradas para os testes de contaminação microbiológica. Testes para a presença de bactérias, fungos e micoplasmas foram realizados segundo as normas ISO 11737-1, 5TH Ed. 1995 e USP XXIII/NF XVIII, 1995. RESULTADOS Isolamento dos Condrócitos Obtiveram-se condrócitos isolados das amostras de cartilagem articular pesando entre 102 mg e 417 mg (média de 255 mg), resultando em uma média de 140.560 condrócitos em 100 mg de tecido (Tabela 1). Tabela 1. Acompanhamento das culturas celulares a partir da biópsia do tecido cartilaginoso. São demonstrados os valores de peso das biópsias, contagens celulares e viabilidades inicial e final, bem como o tempo transcorrido até a fase final da cultura. Peso da Número Inicial Viabilidade Dias de Biópsia (mg) de Células Inicial (%) Cultura Número Final de Células Viabilidade Final (%) 154 100,000 100 28 6,000,000 — 294 11,000 50 33 1,000,000 — 514 53,000 — 31 11,000,000 — 310 84,000 — 13 18,000,000 95 292 93,000 100 27 3,000,000 94 184 41,000 90 56 9,500,000 93 224 245,000 96 25 10,000,000 — 417 135,000 96 24 3,300,000 — 102 153,000 93 36 1,200,000 94 400 85,000 96 42 18,800,000 96 300 73,000 98 — — — Os condrócitos recém-isolados apresentavam morfologia arredondada, característica destas células. Realizaram-se contagens para viabilidade celular nas 11 amostras, apresentando valores sempre superiores a 90% (Tabela 1). Cultura dos Condrócitos Os condrócitos foram mantidos em cultura por períodos entre 13 e 56 dias para a obtenção de pelo menos um milhão de células, resultando em uma média einstein 2003; 1:84-8 de 31,5 dias de cultura. Para o encerramento das culturas procedeu-se à contagem do número total de células e sua viabilidade. Os valores obtidos para a viabilidade celular foram superiores a 90%. Os valores obtidos para o número final de células, variando entre 1.200.000 e 18.800.000 células, resultando em uma média de 8.500.000 células, ou seja, um aumento de 23,7 vezes o número celular inicial (Tabela 1). Análises Morfológicas Os processos de adesão e espalhamento celulares sobre a superfície de polipropileno durante a cultura celular resultaram na alteração da forma arredondada característica dos condrócitos. Decorridos três a cinco dias em cultura foi possível observar condrócitos achatados e espalhados, com morfologia típica de fibroblastos (Figura 2). A presença de figuras de divisão celular nas culturas foi observada com freqüência (Figura 2D). Apesar da morfologia alongada não foram observados sinais evidentes de degeneração ou apoptose celulares, dados comprovados pela contagem final da viabilidade celular. Análises Microbiológicas Toda as análises microbiológicas realizadas nas culturas celulares apresentaram resultados negativos, traduzindo a ausência de bactérias, fungos ou micoplasmas nestas culturas. DISCUSSÃO Técnicas cirúrgicas que procuram obter o reparo tecidual se baseiam no princípio de preencher a lesão com células mesenquimais provenientes da medula óssea, como as técnicas de abrasão, perfurações e microfraturas. Todavia, as células que preenchem a lesão condral sintetizam tecido fibroso, ou fibrocartilagem, com constituição e propriedades distintas do tecido hialino originalmente presente. Nesse caso, há o predomínio de colágeno tipo I na matriz extracelular. Para o paciente, a presença de tecido fibroso pode resultar em dores e limitação de movimento a longo prazo. Para a formação de cartilagem articular hialina semelhante à original, o transplante autólogo de condrócitos constitui uma alternativa para o tratamento de lesões condrais resultantes de trauma agudo ou repetitivo e que não responderam a tratamentos anteriores, cirúrgicos ou não(5-11). Testamos em nosso laboratório as condições de processamento das biópsias cartilaginosas e as fases da cultura dos condrócitos, visando a proliferação celular. Obtivemos fragmentos de cartilagem do côndilo femoral de diferentes proporções e regiões, Estudo da viabilidade da cultura de condrócitos humanos A. Retirada de biópsia de cartilagem articular. C. Desbridamenteo da lesão condral. 87 B. Fase laboratorial para o isolamento, cultura e proliferação dos condrócitos. D. Retirada de periósteo para cobertura da lesão condral. E. Injeção da suspensão celular sob a cobertura de periósteo. Figura 1. Transplante autólogo de condrócitos para a regeneração da cartilagem articular. Primeiramente é retirada uma biópsia de cartilagem de uma região não submetida a carga da articulação (A), em seguida a biópsia é transportada para o laboratório de cultura celular, onde é realizado o isolamento e cultivo dos condrócitos (B). A suspensão celular resultante deste processo é enviada para o transplante. A área da lesão deve ser desbridada (C), e recoberta com periósteo (D) para a injeção da suspensão celular (E). A B C D Figura 2. Microscopia de fase. (A). Podem ser observados condrócitos recém-isolados apresentando morfologia arredondada característica. (B) Cultura em monocamada semiconfluente, 8 dias de cultivo. (C) Cultura em monocamada confluente, 33 dias de cultivo. (D). Divisão celular com 35 dias de cultivo. Barra: 100υ m. einstein 2003; 1:84-8 88 Lombello C, Reis Jr GM, Cohen M sendo que nossas observações expressam a realidade clínica, não sendo possível padronizar a coleta de material. Mesmo assim limitamos nossas coletas ao côndilo femoral, preservando sempre o osso subcondral. O processo de isolamento das células mostrou-se eficiente, permitindo a obtenção de um grande número de células por 100 mg de tecido. É importante a obtenção de um número mínimo de células para o início das culturas, uma vez que, visando o transplante autólogo, contamos com uma grande proporção de aumento celular em poucas passagens de cultura, visando preservar as características celulares e evitando apoptose. Sabemos que após algumas passagens sem cultura as células podem entrar no processo de morte celular e todo o processo de cultivo foi realizado respeitando este limite. As condições de cultivo celular, como a suplementação com soro fetal bovino, garantiram alta taxa de proliferação celular, permitindo a obtenção do número mínimo de 1.000.000 de células, sempre com viabilidade celular superior ao limite de 85%, descrito na literatura(7). A morfologia dos condrócitos em cultura traduz o estado diferenciado das células, condizente com a função proliferativa das culturas (18-20) . Condrócitos cultivados em monocamadas por algumas passagens adquirem morfologia achatada e apresentam alta taxa proliferativa. A morfologia celular está diretamente ligada à síntese protéica. Neste estado diferenciado as células passam a produzir colágeno tipo I preferencialmente, substituindo a síntese de colágeno tipo II, característico da cartilagem hialina. Após algumas passagens é possível restabelecer o fenótipo normal dos condrócitos desde que haja condições ideais para que ocorra a rediferenciação celular (21-23). No caso do transplante autólogo de condrócitos, o fato das células serem implantadas em substrato hialino, com a presença de matriz extracelular característica, atua como sinal de diferenciação celular. Uma vez implantados, os condrócitos têm a capacidade de expressar seu fenótipo normal, sintetizando matriz extracelular. Não observamos intensa síntese de matriz extracelular em nossas culturas, pois a finalidade era obter alta taxa proliferativa das células. A ausência de contaminantes em todas as culturas testadas (de acordo com as exigências do controle de qualidade dos órgãos competentes) permitiu comprovar a segurança das condições de trabalho. Os resultados obtidos neste estudo permitiram avaliar as condições de processamento das biópsias para a obtenção dos condrócitos e as condições de cultura visando a proliferação celular. Pudemos concluir que o cultivo de condrócitos para o transplante autólogo em nosso meio é uma técnica possível, viável e segura para aplicação clínica, como técnica cirúrgica de regeneração da cartilagem articular. einstein 2003; 1:84-8 REFERÊNCIAS 1. Mandelbaum BR, Browne JE, Fu F, Micheli L, Mosely JB Jr, Erggelet C et al. Articular cartilage lesions of the knee. Am J Sports Med 1998; 26: 853-61. 2. Cohen M, Carvalho RT. Ciências básicas nas lesões da cartilagem articular. Rev Joelho 2002; 2: 25-28. 3. Cohen M, Carvalho RT. Tratamento não cirúrgico das lesões condrais do joelho. Rev Joelho 2002; 2: 33-6. 4. Cohen M, Abdalla RJ, Silva RT, Souza CF. Tratamento cirúrgico das lesões condrais do joelho. Rev Joelho 2002; 2: 37-42. 5. Grande DA, Singh IJ, Pugh J. Healing of experimentally produced lesions in articular cartilage following chondrocyte transplantation. Anat Rec 1987; 218: 142-8. 6. Grande DA, Pitman MI, Peterson L, Menche D, Klein M. The repair of experimentally produced defects in rabbit articular cartilage by autologous chondrocyte transplantation. J Orthop Res 1989; 7: 208-18. 7. Brittberg M, Lindahal A, Nilsson A, Ohlsson C, Isaksson O, Peterson L. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. New Engl J Med 1994; 331: 889-95. 8. Brittberg M, Nilsson A, Lindahal A, Ohlsson C, Peterson L. Rabbit articular cartilage defects treated with autologous cultured chondrocytes. Clin Orthop 1996; (326):270-83. 9. Brittberg M, Tallhenden T, Sjogren-Jansson B, Lindahal A, Peterson L. Autologous chondrocytes used for articular cartilage repair: an update. Clin Orthop 2001; (391Suppl): S337-48. 10. Minas T. Autologous chondrocyte implantation for focal chondral defects of the knee. Clin Orthop 2001; (391 Suppl): S349-61. 11. Peterson L, Minas T, Brittberg M, Nilsson A, Sjogren-Jansson E, Lindahal A. Two- to 9-year outcome after autologous chondrocyte transplantation of the knee. Clin Orthop 2000; (374): 212-34. 12. Martin I, Suetterlin R, Baschong W, Heberer M, Vunjak-Novakovic G, Freed LE. Enhanced cartilage tissue engineering by sequential exposure of chondrocytes to FGF-2 during 2D expansion and BMP-2 during 3D cultivation. J Cell Biochem 2001; 83: 121-8. 13. Ameer GA, Mahmood TA, Langer R. A biodegradable composite scaffold for cell transplantation. J Orthop Res 2002; 20: 16-9. 14. Lombello CB, Malmonge, SM, Wada, MLF. PolyHEMA and polyHEMApoly(MMA-co-AA) as substrates for culturing Vero cells. J Mater Sci: Mater Med, 11:541-6. 2000. 15. Freed LE, Hollander AP, Martin I, Barry JR, Langer R, Vunjak-Novakic G. Chondrogenesis in a cell-polymer-bioreactor system. Exp Cell Res 1998; 240: 58-65. 16. Archer CW, McDowell J, Bayliss MT, Stephens MD, Bentley G. Phenotypic modulation in sub-populations of human articular chondrocytes in vitro. J Cell Sci 1990; 97 (Pt 2) : 361-71. 17. Bujia J, Sittinger M, Pitzke P, Wilmes E, Hammer C. Synthesis of human cartilage using organotypic cell culture. ORL J Otorhinolaryngol Relat Spec 1993; 55: 347-51. 18. Shapiro F, Koide S, Glimcher MJ. Cell origin and differentiation in the repair of full-thickness defects of articular cartilage. J Bone Joint Surg 1993; 75: 532-53. 19. Folkman J, Moscona A. Role of cell shape in growth control. Nature 1978; 273: 345-9. 20. Benya PD, Shaffer JD. Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels. Cells 1982; 30: 215-24. 21. Glowacki J, Trepman E, Folkman J. Cell shape and phenotypic expression in chondrocytes. Proc Soc Exp Biol Med 1983; 172: 93-8. 22. Lombello CB, Malmonge SM, Wada ML. Morphology of fibroblastic cells cultured on poly(HEMA-co-AA) substractes. Cytobios 2000;101: 115-22. 23. Lombello CB, Santos Jr AR, Malmonge SM, Barbanti SH, Wada MLF, Duek, EAR. Adhesion and morphology of fibroblastic cells cultured on different polymeric biomaterials. J Mat Sci Mat Med 2002; 13: 867-74.
Download