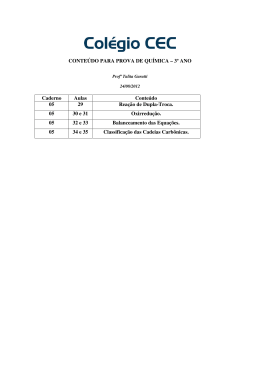
Modulo 23 Reação de síntese ou adição: são aquelas que duas ou mais substâncias originam um único produto. A+B→C Exemplo dessa reação: quando o magnésio reage com o oxigênio do ar: 2Mg(s) + 1 O2(g) → 2MgO(s) Reação de análise ou decomposição: nessa reação uma única substância gera dois ou mais produtos. A→B+C Algumas reações recebem nomes especiais: Eletrólise: as substâncias se decompõem pela passagem de corrente elétrica. Fotólise: decomposição da substância química pela luz. Pirólise: decomposição pela ação do calor e do fogo. Reação de simples troca ou deslocamento: ocorre quando uma substância simples reage com uma composta originando novas substâncias: uma simples e outra composta. A + XY → AY + X Exemplo: Quando uma lâmina de zinco é introduzida em uma solução aquosa de ácido clorídrico, vai ocorrer a formação de cloreto de zinco e o gás hidrogênio vai ser liberado. Zn (s) + 2 HCl (aq) → ZnCl2(aq) + H2 (g) Reação de dupla troca: dois reagentes reagem formando dois produtos, ou seja, se duas substâncias compostas reagirem dando origem a novas substâncias compostas recebem essa denominação. AB + XY → AY + XB Exemplo: a reação entre o ácido sulfúrico com hidróxido de bário produz água e sulfato de bário. H2SO4 (aq) + Ba(OH)2(aq) → 2 H2O(l) + BaSO4(s) Combustão ● ● Na reação de combustão dos hidrocarbonetos ocorre a formação de gás carbônico (CO2) e água, a energia é liberada sob a forma de calor. Veja a equação de combustão: H + O2 → CO2 + H2O Exercícios (Pucpr 2005) Uma das etapas da formação da chuva ácida pode ser representada pela equação a seguir: SO3 + H2O H2SO4 A respeito desse processo, podemos afirmar: a) óxido reagente é um óxido básico. b) referido fenômeno pode ser classificado como reação de síntese. c) ácido resultante é um ácido fraco. d) ácido resultante pode ser considerado uma base de Lewis. e) SO3é uma base deArrhenius. (Mackenzie 2009) I. 2 NO2 N2O4 II. (NH4)2Cr2O7 Cr2O3 + N2 + 4 H2O III. Zn + CuSO4 ZnSO4 + Cu IV. Na2CO3 + 2 HCℓ 2 NaCℓ + H2O + CO2 As reações I, II, III e IV, acima representadas, são classificadas, respectivamente, como: a) síntese, análise, dupla-troca e simples-troca. b) ánalise, adição, dupla-troca e simples-troca. c) síntese, análise, dupla-troca e decomposição. d) adição, decomposição, deslocamento e dupla-troca. e) ánalise, decomposição, deslocamento e dupla-troca. A hidrazina é um composto utilizado na remoção de íons metálicos em águas poluídas. Sabe-se que ela é constituída de 87,42 % em massa de nitrogênio e de 12,58 % em massa de hidrogênio. Com base nessas informações, é correto afirmar que a sua FÓRMULA MÍNIMA é: a) (NH)n. b) (NH2)n. c) (NH3)n. d) (N2)n. e) (N3)n. Pucrj 2004) A fórmula mínima de um composto orgânico é (CH2O)n. Sabendo-se que o peso molecular desse composto é 180, qual o valor de n?
Baixar