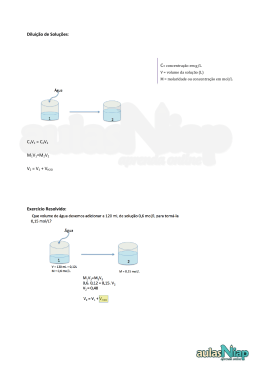
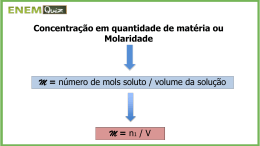
3/9/2012 Química Analítica Teoria e Prática Primeiro semestre/2012 Curso: Farmácia Prof. Wendell Coltro [email protected] http://www.quimica.ufg.br/docentes/wendellcoltro/ 1 Bloco IQ 1 – Sala 220 Telefone: 3521-1097 Ramal 220 INTRODUÇÃO À QUÍMICA ANALÍTICA QUALITATIVA E QUANTITATIVA 2 Aula 01 Instituto de Química – UFG – Prof. Wendell Coltro A Química Analítica é uma das áreas das Ciências Químicas com a maior abrangência em termos de APLICAÇÕES E CONCEITOS BÁSICOS. É a parte da Química que estuda 3 a composição da matéria. matéria 1 3/9/2012 Pode-se classificar a química analítica em qualitativa e quantitativa. Em ambos os casos, uma série de técnicas, métodos e instrumentação são requeridos para resposta a uma questão básica: O QUE e QUANTO se tem de uma 4 determinada espécie em uma amostra. PSICOLOGIA NEUROLOGIA ASTRONOMIA ELETRÔNICA MEDICINA METALURGIA E GEOLOGIA FISIOLOGIA E NEUROLOGIA QUÍMICA BIOLOGIA FÍSICA ANÁLISE QUÍMICA FARMACOLOGIA E TOXICOLOGIA 5 AGRICULTURA ARQUEOLOGIA E HISTÓRIA ENGENHARIA CIÊNCIAS CIÊNCIA DO DE ECONOMIA AMBIENTE ALIMENTOS Q. ANALÍTICA X FARMÁCIA 6 2 3/9/2012 7 8 ANÁLISE QUALITATIVA -COR -PRECIPITADO Reações características de -pH cada elemento, ou de cada grupo de -GÁS 9 -ODOR elementos. 9 3 3/9/2012 Análise Quantitativa 10 Análise Quantitativa 11 Dados Analíticos × Estatística -ALGARISMOS SIGNIFICATIVOS -MÉDIA -ERRO DE UMA MEDIDA -EXATIDÃO E PRECISÃO 12 -TIPOS DE ERROS -DESVIO PADRÃO 4 3/9/2012 -Algarismos Significativos Precisão de 0,1 mL na medida de volume. 13 -Algarismos Significativos Precisão de 0,1 mL na medida de volume. Precisão de 0,01 mL na medida de volume. 14 -Algarismos Significativos Algumas considerações: 15,1321 g 15132,1 mg Seis algarismos significativos. 15 5 3/9/2012 -Algarismos Significativos Algumas considerações: 15,1321 g 15132,1 mg 1516 151,6 15,16 1,516 0,1516 16 Seis algarismos significativos. Quatro algarismos significativos. -Algarismos Significativos Os zeros são significativos quando fazem parte do número. Não são significativos quando são usados somente para indicar ondem de grandeza. Exemplos: 11 mg e 0,011 g 17 -Algarismos Significativos Os zeros são significativos quando fazem parte do número. Não são significativos quando são usados somente para indicar ondem de grandeza. Exemplos: 11 mg e 0,011 g 0,1516 0,01516 0,001516 0,0001516 1,516 × 10-1 1,516 × 10-2 1,516 × 10-3 1,516 × 10-4 18 6 3/9/2012 -Algarismos Significativos OS ZEROS… colocados à direita de outros dígitos somente são significativos se forem resultado de uma medida. Exemplo: (balança com precisão de ± 0,1 g) 2,0 g – dois algarismos significativos. 2.000 mg 19 2.000.000 µg dois algarismos significativos. Notação exponencial é sempre recomendada -Algarismos Significativos ARREDONDAMENTOS !? Regras para arredondamentos! 4,90 4,92 4,94 4,95 4,96 4,97 4,98 4,99 20 Exercícios: Quantos algarismos significativos têm em cada valor numérico abaixo: (a)0,2054; (b) 0,005550; (c) 0,007; (d) 0,01000 Faça o arredondamento dos seguintes números para que contenham três algarismos significativos: 21 (a) 12,9994; (b) 3,00828; (c) 38,655; (d) 4,9555 7 3/9/2012 -Algarismos Significativos 2,2 xxx + 0,1145 2,3145 Adição e subtração: Um corpo pesou 2,2 g em uma balança com sensibilidade de ± 0,1 g. Um outro pesou 0,1145 g ao ser pesado em uma balança analítica. A soma dos dois corpos será: A resposta correta da soma é igual a 2,3 g. 22 O valor de 2,2 é o que apresenta a maior incerteza, a qual está na primeira casa decimal. -Algarismos Significativos - Adição e subtração: 6,8 xxx 2,6367 4,1633 A resposta correta da soma é igual a 4,2 g. 23 O valor de 6,8 é o que apresenta a maior incerteza, a qual está na primeira casa decimal. -Algarismos Significativos Multiplicação e Divisão: Calcular o número de mols existente nos seguintes volumes de solução de HCl 0,1000 mol/L. (a) 25 mL nHCl = 25 × 0,1000 × 10-3 = 2,5 × 10-3 mol (b) 25,0 mL nHCl = 25,0 × 0,1000 × 10-3 = 2,50 × 10-3 mol 24 (c) 25,00 mL nHCl = 25,00 × 0,1000 × 10-3 = 2,500 × 10-3 mol 8 3/9/2012 Na titulação de 24,98 mL de uma solução de HCl foram gastos 25,11 mL de solução de NaOH 0,1041 mol/L. Calcular a concentração da solução de HCl. CHCl × VHCl= CNaOH × VNaOH CHCl = (0,1041 × 25,11) / (24,98) 25 CHCl = 0,104642…. CHCl = 0,1046 mol L-1 -MÉDIA Se X1, X2, X3, X4, X5, …, XN forem os valores encontrados para uma série de N medidas de uma mesma grandeza, a média desta série será calculara por: 26 -DESVIO PADRÃO ...é a medida mais comum da dispersão estatística. 27 9 3/9/2012 -DESVIO PADRÃO RELATIVO ...é o desvio dos valores experimentais em torno do valor médio, expresso em porcentagem. RSD = S × 100 28 - Em uma prática de Q. Analítica, -um estudante encontrou os seguintes valores na determinação de Fe2+ em uma amostra de sangue: 31,44; 31,42; 31,36; 31,38 e 31,55. 31,55 CALCULE O VALOR MÉDIO, O DESVIO PADRÃO E O DESVIO PADRÃO RELATIVO 29 DAS ANÁLISES DESTE ESTUDANTE. -Exatidão e Precisão – Atenção!!!! PRECISÃO – concordância entre vários resultados obtidos da mesma forma (repetibilidade). EXATIDÃO – indica a proximidade da medida do valor verdadeiro, ou aceito, e é expressa pelo erro. 30 Skoog, D. A. e colaboradores. Fundamentos de Química Analítica, Editora Cengage Learning, São Paulo, 2008. p.83-97. 10 3/9/2012 31 -Tipos de Erros Erros Sistemáticos: possuem um valor definido – podem medidos e descontados no resultado final. -Erros de metodologia; -Erros operacionais; -Erros pessoais; 32 -Outras fontes (Instrumentos e Reagentes). -Tipos de Erros Erros Aleatórios: efeitos de variáveis não controladas. -Leitura de escala; -Falta de Atenção; - Flutuações nos experimentos; 33 -Presença de algum fenômeno inesperado. 11 3/9/2012 -Erro absoluto de uma medida (E) -É a diferença do valor medido (Xi) e o valor verdadeiro (Xr) . E = Xi - Xr -Erro Relativo (Er) Er = 34 E Xr Er = E × 100 Xr -Erro de uma medida Exercício! - -O valor verdadeiro da concentração de NaCl em uma amostra de soro fisiológico é 0,1005 mol L-1 e o valor encontrado por um estudante foi de 0,1010 mol L-1. -Calcular o erro absoluto (E) e o erro relativo 35 (Er) do resultado. Cálculos Essenciais em Q. Analítica - Unidades de Concentração - Conversão de Unidades - Diluições - Introdução à análise quantitativa - Exercícios Aula 02 12 3/9/2012 Soluções ⇒ Podem apresentar composições continuamente variáveis e ser homogêneas numa escala que está além do tamanho das moléculas individuais. ⇒ Soluto + solvente. 37 Soluções 38 Unidades de Concentração Qualitativo × Quantitativo 1. Molaridade 2. Porcentagem (m/m; v/v; m/v) 3. Unidades de Fração Molar 4. Molalidade 5. Normalidade 39 13 3/9/2012 Molaridade (M) ⇒ Concentração Molar: é a razão entre o número de mols de soluto e o volume total da solução, em litros. É a unidade mais utilizada! C= nsoluto Vsolução C= nsoluto = msoluto MMSoluto mols = mol L-1 = M Litros (L) 40 Molaridade (M) ⇒ Uma amostra de 2,00 g de cristais de NaOH, encontrada em um recipiente de Diabo Verde foi dissolvida em água para produzir um volume total de 200 mL. Qual a molaridade desta solução? 41 Porcentagem ⇒ É imaginada como sendo uma quantidade (partes) em cem amostras (ou cem partes). ⇒ Uma solução contém 25% de água e 75% de etanol, em massa. Isso significa que, a cada 100 g de solução, há 25 g de água e 75 g de etanol. Teor (%) = Valor encontrado (m ou X 100 v) Valor total (m ou v) 42 14 3/9/2012 Porcentagem A ASPIRINA é um fármaco que contém ácido acetil salicílico (AAS) como princípio ativo e é, normalmente, comercializado nas formulações adulto e infantil infantil. AAS adulto: 500 mg/comprimido AAS infantil: 100 mg/comprimido Qual o teor (m/m) de AAS nas formulações adulto e infantil? Dados adicionais: mcomp adulto = 0,6200 g; m comp infantil = 0,1400 g Conversão de Unidades O soro fisiológico contém 0,9% de NaCl em sua formulação. 1 – Qual a massa de NaCl presente em uma alíquota de 10 mL? 2 – Qual a quantidade em mols presentes no item 1? 3 – Qual a concentração molar do NaCl no soro fisiológico? Massa MolarNaCl = 58,44 g/mol Conversão de Unidades 1 - mg para g 2 – mL para L 3 - mol/L para g/L 4 – ppm (partes por milhão) 1 ppm = 1 mg/L C (ppm) = Massa do X 106 soluto Massa da solução ppm 15 3/9/2012 Conversão de Unidades Qual é a molaridade do K+ em uma solução aquosa que contém 63,3 ppm de K3Fe(CN)6 (329,3 g/mol)? Diluições 10,0 mL 5,0 mL 10,0 mL 1 2 3 4 NaCl 0,010 mol/L NaCl x mol/L NaCl y mol/L NaCl z mol/L C 1 V1 = C 2 V2 Volume de cada balão: 25,0 mL Exercícios Uma alíquota de 25,00 mL de vinagre foi diluída para 250,00 mL em um balão volumétrico. A titulação de várias alíquotas de 50,00 mL da solução diluída requereu a média de 34,88 mL de solução de NaOH 0,09600 mol/L. Expresse o teor de acidez do vinagre em função da porcentagem (m/v) de ácido acético (CH3COOH, 60,08 g/mol) presente. 16 3/9/2012 Exercícios Uma amostra de 25,00 mL de uma solução de limpeza doméstica foi diluída a 250,0 mL em um balão volumétrico. Uma alíquota de 50,00 mL dessa solução requereu 40,38 mL de HCl 0,2506 mol/L para alcançar o ponto final, usando o verde de bromocresol como indicador. Calcule a porcentagem (m/v) de NH3 na amostra. 17
Download