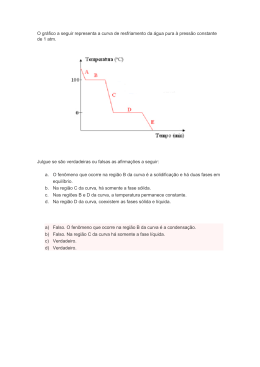
Texto: QUÍMICA NO COTIDIANO Outras disciplinas que são citadas com frequência são a química molecular, a eletroquímica, a química nuclear, a radioquímica e a estereoquímica. É de costume incluir a química industrial ao conjunto de processos de produção de substâncias químicas que sejam de interesse econômico. A química orgânica e a inorgânica são subdivisões baseadas na natureza dos compostos que constituem seu objeto de estudo, em geral define-se a química orgânica como a química dos compostos de carbono, ou seja, do carbono combinado com outros elementos, principalmente hidrogênio, oxigênio, enxofre, nitrogênio, fosforo e cloro. Os compostos estudados pela química orgânica incluem os componentes dos tecidos vegetais e animais, o petróleo e seus derivados, a hulha, os açucares, o amido, a celulose, os plásticos e a borracha. Por exclusão, a química inorgânica concentra-se no estudo dos demais compostos químicos, inclusive aqueles em que o carbono não se encontra coordenado em cadeias, como os óxidos carbonos, carbonetos metálicos e alguns outros. A físico-química representa um método de abordagem de qualquer sistema químico, seja uma substancia simples ou uma mistura de substancias, sem estabelecer considerações sobre sua natureza orgânica ou inorgânica. A disciplina inclui o estudo de propriedades mensuráveis, o desenvolvimento de métodos experimentais e instrumentos para realizar medições, além da formulação de teorias, de preferência expressas em linguagem matemática, a previsão dos valores das propriedades com o objetivo de comparalos aos resultados experimentais. Nesse campo, em que não há limite entre o fato químico e o fato físico, se incluem as pesquisas das chamadas física atômica, física nuclear, mecânica quântica atômica e molecular. INTRODUÇÃO AO ESTUDO DE QUÍMICA / SISTEMAS MATERIAIS O QUE É QUÍMICA Química é a ciência que estuda a matéria e suas transformações. Estuda também a energia que está envolvida nessas transformações. A química está muito ligada ao nosso dia a dia. Nos alimentos, medicamentos, construções, nas plantas, no vestuário, nos combustíveis. Tudo o que existe no universo é formado por química. No nosso organismo também há diversas transformações químicas. MATÉRIA E SUBSTÂNCIA Matéria é tudo o que tem massa e ocupa espaço. Qualquer coisa que tenha existência física ou real é matéria. Tudo o que existe no universo conhecido manifesta-se como matéria ou energia. A matéria pode ser líquida, sólida ou gasosa. São exemplos de matéria: papel, madeira, ar, água, pedra. Analisando a matéria qualitativamente (qualidade) chamamos a matéria de substância. Substância – possui uma composição característica, determinada e um conjunto definido de propriedades. Pode ser simples (formada por só um elemento químico) ou composta (formada por vários elementos químicos). Exemplos de substância simples: ouro, mercúrio, ferro, zinco. Exemplos de substância composta: água, açúcar (sacarose), sal de cozinha (cloreto de sódio). As substâncias químicas podem ser classificadas de duas formas: quanto ao tipo de ligação que as forma e quanto ao número de elementos químicos que participam na ligação. Classificação - Quanto ao tipo de ligação Quanto ao tipo de ligação as substâncias são classificadas em Iônicas, Metálicas. As substâncias iônicas têm pelo menos uma ligação iônica. Exemplo: NaCl (cloreto de sódio) NaNO2 (nitrito de sódio) Moleculares ou As substâncias iônicas têm elevados pontos de ebulição e fusão; muitas delas, ao serem dissolvidas na água, têm os seus íons separados por ação da água num processo chamado dissociação iônica; conduzem corrente elétrica em solução aquosa. Tabela com outros exemplos de substâncias iônicas: SUBSTÂNCIA IÔNICA DESCRIÇÃO SULFATO DE BÁRIO USADO EM ESTUDOS DE RAIOS X NO TRATO GASTRINTESTINAL ÓXIDO DE CÁLCIO CAL CARBONATO DE CÁLCIO MÁRMORE ÓXIDO FÉRRICO FERRUGEM HIDRÓXIDO DE MAGNÉSIO ANTIÁCIDO HIDRÓXIDO DE SÓDIO SODA CÁUSTICA As substâncias moleculares são formadas exclusivamente por ligações covalentes. Em geral, tem baixa temperatura de ebulição e de fusão. A maioria delas não conduz eletricidade em solução aquosa. Formam moléculas. Exemplos: água (H2O) amoníaco (NH3) Tabela com outros exemplos de substâncias moleculares: SUBSTÂNCIA MOLECULAR DESCRIÇÃO MONÓXIDO DE CARBONO GÁS VENENOSO RESULTADO DA COMBUSTÃO INCOMPLETA DA GASOLINA E DO ÁLCOOL DIÓXIDO DE CARBONO PRODUTO DA REAÇÃO DE COMBUSTÃO. ABSORVIDO PELAS PLANTAS PARA UTILIZAR NA FOTOSSÍNTESE ETANOL INGREDIENTE DE BEBIDAS ALCOÓLICAS E COMBUSTÍVEL SACAROSE AÇÚCAR COMUM As substâncias metálicas são formadas exclusivamente por ligações metálicas. Exemplos: Ferro (Fe), Prata (Ag), Ouro (Au), Alumínio (Al). - Quanto ao número de elementos químicos Quanto ao número de elementos químicos, as substâncias podem ser classificadas como simples ou compostas. Substância Simples é aquela formada por um único elemento químico. Ex. Ferro (Fe), Alumínio (Al), gás hidrogênio (H2). SUBSTÂNCIA SIMPLES – FERRO Substância Composta é aquela formada por mais de um tipo de elemento químico. Ex. Cloreto de sódio (NaCl), Monóxido de Carbono (CO), Água (H2O). SUBSTÂNCIA COMPOSTA – NaCl ATIVIDADE 1) Abaixo temos quatro sistemas formados por três tipos diferentes de átomos, representados por bolinhas de cores diferentes. Responda às perguntas abaixo referentes à classificação de cada um dos sistemas: a) Quais são substâncias simples? _________________________________________ b) Quais são substâncias compostas? _______________________________________ c) Quais são misturas? ____________________________________________________ d) Quantos componentes apresenta cada sistema? _________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________ e) No caso de sistemas com mais de um componente, quantos componentes são substâncias simples e quantos são substâncias compostas? _________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________ 2) Qual das alternativas abaixo apresenta somente substâncias compostas: a) N2, P4, S8. b) CO, He, NH3. c) CO2, H2O, C6H12O6. d) N2, O3, H2O. e) H2O, I2, Cl2. 3) (UFMG) Com relação ao número de fases, os sistemas podem ser classificados como homogêneos ou heterogêneos. As alternativas correlacionam adequadamente o sistema e sua classificação, exceto em: a) Água de coco/heterogêneo b) Laranjada/ heterogêneo c) Leite/homogêneo d) Poeira no ar/ heterogêneo e) Água do mar filtrada/homogêneo 4) As afirmações abaixo são referentes à classificação dos materiais em misturas ou substâncias. Indique quais estão corretas com a letra “C” e quais estão erradas com a letra “E”: ( ) É possível determinar a densidade de uma mistura conhecendo a proporção em que cada substância está presente. ( ) Como o álcool etílico é menos denso que a água, a densidade de uma mistura de água e álcool etílico aumenta à medida que a proporção de álcool etílico aumenta. ( ) A água potável é uma mistura, pois recebeu a adição de uma série de substâncias (como o cloro) na estação de tratamento de água, mas a água mineral obtida diretamente da fonte é uma substância. ( ) O petróleo é uma mistura de várias substâncias, como gasolina, óleo diesel e asfalto. ( ) A gasolina, mesmo pura, é uma mistura de várias substâncias. ( ) Na natureza é muito raro encontrar uma substância isolada. ( ) O sal de cozinha que utilizamos em casa é o cloreto de sódio puro, ou seja, é uma substância. TRANSFORMAÇÕES FÍSICAS Uma substancia sofre transformação física quando não existe alguma alteração na sua constituição, ou sua natureza atômica. As mudanças de estado são transformações físicas, a dissolução do sal ou do açúcar na água, bem como a recuperação de ambos por evaporação da água, a mudança da cor do ferro durante seu aquecimento ou a fragmentação do giz quando entra em átrio com quaro negro, são exemplos de que realmente existem fenômenos físicos. Uma substancia sofre transformação química, quando existe alteração na sua natureza atômica, ou que impede a recuperação da substancia por métodos elementares, exemplos são disso são as combustões, decomposições, digestões e cozimentos, claro que existem outros exemplos, mas esses são suficientes. Todos os fenômenos recebem o nome de reações químicas, assim quando colocamos fogo no álcool, existe reação química entre o álcool e o oxigênio do ar. Segue abaixo alguns exemplos de fenômenos químicos: - Até a digestão dos alimentos é um fenômeno químico que acontece em nosso corpo; - Combustão do gás, da gasolina, do querosene, do óleo diesel, do acetileno, do hidrogênio, etc.; - As explosões, como a do gás GNV, do gás GLP e de outros gases explosivos; - O fenômeno da fotossíntese, no qual o gás carbônico e a água da chuva são transformados em alimentos; - A formação de ferrugem é a reação entre o ferro e o oxigênio; - A fabricação do sabão, que consiste em aquecer gordura com soda-cáustica. ESTADOS FÍSICOS E ESTADO DE AGREGAÇÃO DAS MOLÉCULAS Uma substância pode ser encontrada no estado físico líquido, sólido ou gasoso. Estes diferentes aspectos são chamados de fases de agregação e dependem da temperatura e pressão. Para cada substância existe uma faixa de temperatura e pressão na qual ela mantém suas características como espécie, mudando apenas de fase de agregação. Exemplo: a substância água, à temperatura inferior ou igual à 0°C, submetida à pressão de 1atm, se encontra na fase sólida; entre 0°C e 100°C, submetida à mesma pressão, se encontra na fase líquida e a 100°C, também submetida à mesma pressão, passará para a forma de vapor de água, ou seja, fase gasosa. Fase gasosa Nesta fase as partículas da substância estão com maior energia cinética. Elas ficam muito distantes umas das outras. Movem-se com muita velocidade e colidem entre si. Um gás qualquer colocado dentro de uma garrafa de 1litro adquire a forma da garrafa e seu volume será de 1litro. Podemos dizer que uma substância na fase gasosa possui forma e volume variáveis. Por que os gases são compressíveis? Sabendo que os gases (ao contrário dos líquidos e sólidos) não têm volume fixo, com um aumento de pressão podemos comprimi-los, ou reduzir o seu volume. Os gases são compressíveis porque há muito espaço entre as partículas que os compõem. Fase Líquida Na fase líquida as partículas estão um pouco mais unidas em relação às partículas da fase gasosa, mas não totalmente unidas. Não há nenhum arranjo definido. A energia cinética é intermediária entre a fase gasosa e a fase sólida. As partículas nos líquidos “deslizam” umas sobre as outras e se movem. Isto é o que proporciona a fluidez no líquido. Todos os líquidos podem fluir, e alguns mais que os outros. A água, por exemplo, flui com mais facilidade que o mel. Então dizemos que a água tem baixa viscosidade e que o mel tem alta viscosidade. Os líquidos com baixa viscosidade oferecem menor resistência para fluir. Fase Sólida Na fase sólida, as partículas que formam a substância possuem a menor energia cinética; elas permanecem praticamente imóveis, unidas por forças de atração mútuas e dispostas, em geral, de acordo com um arranjo geométrico definido. No caso das moléculas de água, esse arranjo é em forma de anéis, no qual sempre há um átomo de hidrogênio entre dois de oxigênio. O arranjo das moléculas de água, na fase sólida, é o responsável pelo aumento do seu volume. Então, ao se congelar, a água se expande, formando o gelo que é menos denso que a água na fase líquida. Um bloco de mármore, sobre uma mesa, muda de forma e volume com o passar do tempo? Podemos concluir que uma substância sólida possui forma e volume próprios. MUDANÇA DE FASES E GRÁFICOS No nosso dia a dia observamos que o gelo se derrete sob a ação do calor transformando-se em água. A água ferve sob calor mais intenso transformando-se em vapor de água. A água, neste caso, apresenta três estados: sólido, líquido e gasoso. São também chamado de estados físicos ou estado de agregação da matéria. Quando se transformam de um estado para o outro chamamos de Mudança de Estados Físicos. Cada transformação recebe um nome. sólida líquida Fusão – mudança do estado sólido para o líquido. Vaporização – mudança do estado líquido para o gasoso. Liquefação ou Condensação – mudança do estado gasoso para o líquido. Solidificação – mudança do estado líquido para o sólido. Sublimação – mudança do estado sólido para o gasoso e vice-versa. Fonte: cienciaparavida.blogspot.com vapor A fusão obedece a algumas leis: - uma determinada substância funde-se sempre na mesma temperatura, em determinada pressão. Essa temperatura é o ponto de fusão (PF). A água se funde a 0ºC e o ferro a 1500°C. - durante a fusão, a temperatura permanece constante, ou seja, não é alterada. - durante a fusão, as substâncias aumentam de volume, exceto a água, ferro e a prata. A temperatura em que uma substância começa a se solidificar é a mesma que ela começa a se fundir. O ponto de solidificação é o mesmo que o ponto de fusão. A mudança da fase líquida para gasosa é dada de três maneiras. A evaporação é um processo mais lento que ocorre sem temperatura e pressão determinada. A ebulição é um processo rápido e depende de cada substância que possui a sua temperatura e pressão já determinada. É caracterizada pelo aparecimento de grande quantidade de bolhas. A ebulição obedece à algumas leis: - as substância entram em ebulição sempre na mesma temperatura. - durante a ebulição, a temperatura segue inalterada. Usamos o termo liquefação para indicar o aumento de pressão, transformando o sólido em gás. A sublimação é um processo desencadeado a partir de uma temperatura e pressão determinadas e não passa pela fase líquida. Gráfico das Mudanças de Estados Físicos: ALOTROPIA Alotropia é a propriedade que alguns elementos químicos têm de formar uma ou mais substâncias simples diferentes. São alótropos: carbono, oxigênio, fósforo e enxofre. O carbono possui dois alótropos: o diamante e o grafite.Essas duas substâncias parecem não ter nada em comum. O grafite é um sólido macio e cinzento, com fraco brilho metálico, conduz bem a eletricidade e calor e tem densidade 2,25g/mL. O diamante é sólido duro (o mais duro de todos), tem brilho adamantino, não conduz eletricidade nem calor e tem densidade 3,51g/mL. Mas as duas têm em comum a mesma composição química expressa pela fórmula Cn, sendo n um número muito grande e indeterminado. A principal diferença está no arranjo cristalino dos átomos de carbono. No grafite formam-se hexágonos. Cada átomo de carbono é ligado a apenas três outros átomos de carbono, em lâminas planas, fracamente atraídas umas pelas outras. No diamante, cada átomo de carbono está ligado a quatro outros átomos também de carbono. O oxigênio tem dois alótropos, formando duas substâncias simples: o gás oxigênio (O 2) e o gás ozônio (O3). O gás oxigênio é incolor e inodoro. Faz parte da atmosfera e é indispensável à vida dos seres aeróbicos. As plantas o devolvem para a atmosfera ao realizar a fotossíntese. O gás ozônio é um gás azulado de cheiro forte e desagradável. Como agente bactericida, ele é usado na purificação da água nos chamados ozonizadores. O ozônio está presente na estratosfera, a mais ou menos 20Km a 30Km da superfície da terrestre. Ele forma uma camada que absorve parte dos raios ultravioletas (UV) do Sol, impedindo que eles se tornem prejudiciais aos organismos vivos. GÁS OXIGÊNIO GÁS OZÔNIO O fósforo tem duas formas alotrópicas principais: o fósforo branco e o fósforo vermelho. O fósforo branco (P4) é um sólido branco com aspecto igual ao da cera. É muito reativo, tem densidade igual a 1,82g/mL e se funde a uma temperatura de 44°C e ferve a 280°C. Se aquecermos a 300°C na ausência de ar ele se transforma em fósforo vermelho, que é mais estável (menos reativo). O fósforo vermelho é um pó vermelho-escuro, amorfo (que não tem estrutura cristalina). Tem densidade igual a 2,38g/mL, ponto de fusão 590°C. Cada grão de pó desta substância é formado por milhões de moléculas P4, unidas umas às outras originando uma molécula gigante ( P∞). O enxofre possui dois alótropos principais: o enxofre ortorrômbico ou simplesmente rômbico e o enxofre monocíclico. As duas formas são formadas por moléculas em forma de anel com oito átomos de enxofre (S8). A diferença está no arranjo molecular no espaço. Produzem cristais diferentes. Os cristais rômbicos têm densidade 2,08g/mL e seu ponto de fusão é 112,8°C. Os monocíclicos têm densidade igual a 1,96g/mL e o ponto de fusão é 119,2°C. Ambos alótropos do enxofre fervem a uma temperatura de 445°C. É um pó amarelo, inodoro, insolúvel em água e muito solúvel em sulfeto de carbono (CS2). Mistura– são duas ou mais substâncias agrupadas, onde a composição é variável e suas propriedades também. Exemplo de misturas: sangue, leite, ar, madeira, granito, água com açúcar. Algumas misturas são tão importantes que têm nome próprio. São exemplos: - gasolina – mistura de hidrocarbonetos, que são substâncias formadas por hidrogênio e carbono. - ar atmosférico – mistura de 78% de nitrogênio, 21% de oxigênio, 1% de argônio e mais outros gases, como o gás carbônico. - álcool hidratado – mistura de 96% de álcool etílico mais 4% de água. Sistema – é uma parte do universo que se deseja observar, analisar. Por exemplo: um tubo de ensaio com água, um pedaço de ferro, uma mistura de água e gasolina, etc. Fases – é o aspecto visual uniforme. As misturas podem conter uma ou mais fases. Mistura Homogênea – é formada por apenas uma fase. Não se consegue diferencias a substância. Exemplos: - água + sal - água + álcool etílico - água + acetona - água + açúcar Água + sais minerais Mistura Heterogênea – é formada por duas ou mais fases. As substâncias podem ser diferenciadas a olho nu ou pelo microscópio. Exemplos: - água + óleo - granito - água + enxofre - água + areia + óleo água + óleo Os sistemas monofásicos são as misturas homogêneas. Os sistemas polifásicos são as misturas heterogêneas. Os sistemas homogêneos, quando formados por duas ou mais substâncias miscíveis (que se misturam) umas nas outras chamamos de soluções. São exemplos de soluções: água salgada, vinagre, álcool hidratado. Os sistemas heterogêneos podem ser formados por uma única substância, porém em várias fases de agregação (estados físicos). Exemplo: água - líquida - sólida (gelo) - vapor ATIVIDADE 01 (E). Dada a tabela Resolva as questões: a) Qual o estado físico de cada substância à temperatura ambiente? ______________________________________________________________________ ______________________________________________________________________ ______________________________________________________________________ b) Construa um gráfico de mudança de estado, indicando como a temperatura de uma amostra de clorofórmio sólido varia com o tempo quando submetida a aquecimento. Indique os estados físicos presentes em cada região do gráfico. 02 (E). A sequência dos quadrinhos mostra as mudanças de estado físico da água. Para cada item a seguir, identifique o nome das mudanças de estado: I—A II — B B C III — C B IV — B A 03 (P). O gráfico a seguir indica as mudanças de estado da substância pura chumbo quando submetida a um aquecimento: a) Qual o estado físico em que o chumbo se encontra após 15 minutos de aquecimento? ______________________________________________________________________ b) Durante quanto tempo o chumbo permaneceu totalmente liquefeito? ______________________________________________________________________ c) Em qual estado físico o chumbo se encontra a uma temperatura de 1760 °C? ______________________________________________________________________ d) Em quais intervalos de tempo o chumbo coexiste em dois estados físicos? ______________________________________________________________________ 04 (P). Numa bancada de laboratório temos cinco frascos fechados com rolha comum que contêm, separadamente, os líquidos seguintes: Num dia de muito calor, em determinado instante, ouve-se no laboratório um estampido, produzido pelo arremesso da rolha de um dos frascos para o teto. De qual dos frascos foi arremessada a rolha? a) 1 b) 2 c) 3 d) 4 e) 5
Download