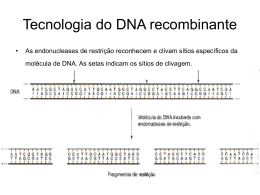
ESTSP - Escola Superior de Tecnologia da Saúde do Porto Curso: Licenciatura em Análises Clínicas e Saúde Pública Unidade Curricular: Biologia Molecular I Ano Lectivo: 2012/2013 Ano curricular: 1 Período Lectivo: 2º Semestre Frequência: Obrigatória Nº créditos (ECTS): 5.0 Horas teóricas: 30.0 h Horas práticas e laboratoriais: 30.0 h Docente Responsável: Manuela Amorim Objectivos: No final da unidade curricular o estudante tem de ser capaz de: 1. Reconhecer, definir e explicar os conceitos e mecanismos biológicos ao nível molecular. 2. Identificar, descrever e explicar as técnicas de biologia molecular mais adequadas para a resolução de problemas. 3. Analisar problemas de manipulação de material genético e reconhecer os casos estudados na aula. 4. Construir e saber como se desempenha um protocolo laboratorial adaptado às necessidades propostas. 5. Saber como se executam protocolos de manipulação de material genético 6. Argumentar em favor das técnicas adequadas para a análise de ácidos nucleicos. 7. Tomar parte, organizar e discutir os protocolos experimentais propostos. 8. Comparar diferentes técnicas de extração e amplificação. 9. Calcular concentrações de soluções necessárias e saber como se preparam as mesmas. 10. Calcular e saber escolher temperaturas de hibridação de oligonucleótidos para PCR (Reação de Polimerização em Cadeia). 11. Analisar e interpretar os resultados obtidos nos trabalhos experimentais. 12. Integrar e explicar os resultados obtidos. 13. Estar disponível para discutir e responder, participando ativamente nas catividades de aprendizagem. 14. Analisar problemas que demonstrem a integração de conhecimento teórico e práticos. 15. Demonstrar capacidade de trabalho em equipa. Programa: CONTEÚDOS TEÓRICOS Aspetos Gerais: 1. Estrutura dos Ácidos Nucleicos: DNA e RNA (2 Horas) 1.1. Perspectiva histórica 1.2. Experiências clássicas de identificação do DNA 1.3. Regras de Chargaff 1.4. Unidade básica: nucleótido e nucleósido 1.5. Bases Azotadas, açúcar e grupos fosfato 1.6. Ligações glicosídicas, fosfodiéster e pontes de hidrogénio 1.7. A dupla hélice: tipos (A, B e Z), estruturas e interações ¿Watson-Crick¿ 1.8. A estrutura da molécula de mRNA 1.9. Conceito de Desnaturação e Renaturação 1.10. Propriedades físicas 2. Replicação do DNA (4 Horas) 2.1. Possíveis modelos de replicação 2.2. Replicação semi-conservativa: experiências de Meselson e Stahl 2.3. Bolhas de replicação, 2.4. Início da replicação: fase de regulação do processo, origem de replicação 2.5. Replicação do DNA em procariotas e eucariotas 2.6. Garfos de replicação: replicação descontínua, fragmentos de Okasaki 2.7. Principais DNA polimerases em bactérias e mamíferos 2.8. DNA polimerase I: características e funções 2.9. Actividade telomérica, telomerases e transcriptase 2.10. Reação de polimerização em cadeia (PCR) 3. Transcrição do DNA (4 Horas) 3.1. Dogma central da Biologia Molecular 3.2. Transcrição versus replicação 3.3. O mecanismo de transcrição: cistrão, unidade de transcrição, regiões promotoras e terminais, 3.4. RNA polimerase 3.5. Transcrição em bactérias: etapas e características 3.6. Transcrição em eucariotas: etapas e caraterísticas 3.7. A RNA polimerase eucariota: RNA pol I, II e III 3.8. Iniciação: ativadores, mediadores e modificadores da cromatina 3.9. Extensão: fatores de extensão e tensão superhelicoidal 3.10. Terminação: cauda poli-A 4. Processamento do RNA (4 Horas) 4.1. Conceitos gerais 4.2. Formas e estruturas: mRNA, rRNA, tRNA, RNAs reguladores 4.3. RNA mensageiro: estrutura e função 4.4. Do pré- mRNA ao mRNA: transcritos I, exões e intrões 4.5. Reação de Splicing: splicing alternativo e erros de splicing 4.6. RNA ribossómico: estrutura e função 4.7. RNA transferência: estrutura e função 5. Código Genético (4 Horas) 5.1. Perpectiva histórica: hipóteses explicativas 5.2. Características gerais: universal, contínuo, redundante e degenerado 5.3. Codão de iniciação (AUG) e codões stop (UAA, UAG e UGA) 5.4. Codões de DNA e de RNA 5.5. A terceira base: oscilante 5.6. Excepções ao Código Genético: procariotas, mitocôndrias e amino-ácidos não convencionais 6. Tradução ou Síntese Proteica (2 Horas) 6.1. Perpectiva histórica 6.2. Ribossoma como local de síntese proteica 6.3. Anatomia do ribossoma e função 6.4. Processo de Síntese Proteica em procariotas e eucariotas: iniciação, extensão e terminação 6.5. Drogas e síntese proteica 7. Regulação da Expressão Génica em Procariotas (4 Horas) 7.1. Níveis de regulação genica: DNA, RNA e proteína 7.2. Regulação ao nível da Transcrição: o paradigma do operão Lac 7.3. Regulação ao nível da Tradução 7.4. Regulação ao nível da Recombinação de DNA: o operao hin de Salmonela 8. Regulação da Expressão Génica em Eucariotas (4 Horas) 8.1. Ferramentas utilizadas na análise de promotores em Eucariotas 8.2. Elementos de regulação proximal e distal: TATA box, elemento iniciador, genes house keeping 8.3. Fatores de transcrição: zinc fingers, leucine zippers, helix-loop-helix, helix-turn-helix, promotores tipo II, promotores transcripcionais 8.4. Estrutura da Cromatina e expressão génica: acetilação, metilação e fosforilação 9. Recombinação Genica (2 Horas) 9.1. Mecanismos Moleculares de recombinação homólogo e heterólogo 9.2. Sequências de inserção 9.3. Transposões e integrões CONTEÚDOS PRÁTICOS 1. Laboratório de Biologia Molecular (6 Horas) 1.1. Normas de Segurança e identificação de amostras 1.2. Sistema Internacional de Unidades 1.3. Controlo de Qualidade 1.4. Legenda de Rótulos 1.5. Preparação de Soluções para uso nas aulas práticas 2. Isolamento de Ácidos Nucleicos (2 Horas) 2.1. Manipulação de Amostras biológicas 2.2. Processo de centrifugação 2.2. Protocolo de isolamento de células nucleadas a partir de: mucosa bucal, folículos capilares, urina e buffy coat 3. Extração de Ácidos Nucleicos (4 Horas) 3.1. Extração de DNA total humano e plasmídico 3.2. Método clássico ou salting-out: conceitos e princípios básicos 3.3. Método de lise alcalina: conceitos e princípios básicos 3.4. Método de extração por fenol/clorofórmio: conceitos 3.5. Método de precipitação do DNA 4. Análise qualitativa e quantitativa de ácidos nucleicos (2 Horas) 4.1. Método da Estimativa Espectrofotométrica 4.2. Análise da concentração e pureza de amostras de DNA 5. Eletroforese (2 Horas) 5.1. Princípio da técnica e conceitos gerais: soluções tampão, voltagem utilizada, corantes e reagentes utilizados 5.2. Géis de agarose e de poliacrilamida: propriedades e aplicações 5.3. Géis nativos e géis desnaturantes de agarose e de poliacrilamida 5.4. A razão acrilamida: bisacrilamida e concentrações utilizadas 5.5. Agentes polimerizantes 5.6. Determinação da concentração e qualidade de DNA 5.7. Marcadores de pesos moleculares 5.8. Análise comparada do perfil eletroforético do DNA cromossómico e plasmídico 6. PCR- Polymerase Chain Reaction (14 Horas) 6.1. Conceitos Gerais 6.2. Constituintes e preparação da mistura de reação 6.3. Desenho de oligonucleótidos 6.4. Condições da reação de PCR: etapas de um ciclo 6.5. Determinação de temperaturas de ¿annealing¿ 6.6. Variações da técnica de PCR 6.6.1. Hot-start PCR 6.6.2. Multiplex PCR 6.6.3. Touch-down PCR 6.6.4. Nested PCR 6.6.5. RT-PCR 6.6.6. PCR Em Tempo Real 6.7. Princípio da técnica e conceitos gerais 6.8. Elaboração de protocolo e da técnica 6.9. Determinação do peso molecular de fragmentos de DNA obtidos por PCR, por eletroforese em gel de agarose Objectivos: As aulas teóricas são lecionadas em auditório recorrendo à projeção de dispositivos e/ou de transparências, utilizando-se o método expositivo e colaborativo. As aulas práticas são lecionadas no laboratório de acordo com a metodologia de ensino-aprendizagem estabelecida para aquisição de competências laboratoriais e de suporte ao lecionado nas sessões teóricas, realizando a planificação, elaboração e discussão de ensaios práticos e resolução de problemas. Métodos de Avaliação: A Classificação Final (CF) da unidade curricular é obtida através da seguinte expressão: CF = 0,6 x CT + 0,4 x CP em que: CT= classificação da componente teórica CP= classificação da componente prática A classificação final é obtida pelo somatório das classificações parcelares obtidas, arredondadas às centésimas. Para obter aprovação nesta unidade curricular é exigido: - uma classificação final não inferior a 10 valores (valor arredondado às unidades) - na componente teórica, no teste escrito sumativo, uma classificação mínima de 9,5 valores (escala 0-20) - na componente prática, nos testes escritos sumativos, uma classificação mínima de 7,5 valores (escala 0-20) e no trabalho uma classificação mínima de 9,5 valores (escala 0-20) A Classificação Final (CF) da unidade curricular pode ser obtida, em época normal, por duas modalidades de avaliação: Avaliação distribuída ou Avaliação final. O estudante deverá comunicar a modalidade de avaliação que optou até à 4ª semana do período de lecionação de aulas. a) Avaliação Distribuída CT: obtida mediante a realização de um teste escrito sumativo (100%) CP: obtida através dos seguintes elementos de avaliação: - dois testes escritos sumativos com resolução de problemas práticos(30% + 30%) - apresentação e discussão de um trabalho sobre temáticas abordadas na unidade curricular (20%) - desempenho laboratorial: discussão de trabalhos práticos (20%) b) Avaliação Final Realização de um teste escrito sumativo com resolução de problemas e execução de um procedimento laboratorial (100%), cuja classificação mínima é 9,5 valores (escala 0-20 valores) Os estudantes que não tenham obtido aprovação a uma, ou às duas componentes (CT ou CP) da UC poderão apresentar-se à época de recurso. Neste caso o aluno realizará exame somente à(s) componente(s) à(s) qual(ais) não tenha obtido aprovação. Os estudantes podem requerer provas para melhoria de classificação, desde que reúnam as condições previstas no "Regulamento de Avaliação do Aproveitamento dos Estudantes", tendo que realizar exame às duas componentes CT e CP. O sistema de avaliação desta unidade curricular segue o Despacho ESTSP/P - 13/2011 - "Regulamento de Avaliação do Aproveitamento dos Estudantes" e o Despacho ESTSP/P - 11/2012 - "Regulamento de Avaliação do Aproveitamento dos Estudantes - Alteração do Despacho ESTSP/P -13/2011". Bibliografia: BIBLIOGRAFIA DE REFERÊNCIA - Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P:. Molecular Biology of the Cell: 5ª Edição. New York: Garland Science; 2008. Disponível online em: http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=mboc4 - Videira A. Engenharia Genética: princípios e aplicações. Lisboa: Lidel, Edições Técnicas; 2006.- Azevedo C. Biologia Celular e Molecular. 4ª Edição. Lisboa-Porto-Coimbra: Lidel Edições Técnicas Lda; 2005. - Azevedo C. Biologia Celular e Molecular. 4ª Edição. Lisboa-Porto-Coimbra: Lidel Edições Técnicas Lda; 2005. - Cooper GM e Hausman RE. The Cell: A Molecular Approach. 3ª Edição. Washington DC: ASM Press; 2004. - Lewin B. Genes IX. 9ª Edição. New Jersey: Pearson Prentice Hall; 2008. - Lodish H, Baltimore D, BerK A, Zipursky SL, Matsudaira P, Darnell J. Molecular Cell Biology. 3ª Edição, New York: W.H.Freeman and Company; 1995. - Nelson DL, Cox MM. Lehninger Principles of Biochemistry. 4ª Edição. New York: W.H.Freeman and Company; 2005. - PubMed. Disponível online em: http://www.ncbi.nlm.nih.gov/. - Sambrook J. Russel D. Molecular cloning - a laboratory manual. 3ª Edição. New York: Cold Spring Harbor Laboratory Press; 2001. - Cecília M. Arraiano, Arsénio M. Fialho. O Mundo do RNA: Novos Desafios e perspectivas futuras. Lisboa: Lidel, Edições Técnicas; 2007. - Bartlett JMS. PCR Protocols (Methods in Molecular Biology). Human express. 2ªEdição; 2003. BIBLIOGRAFIA COMPLEMENTAR - Material didáctico de apoio às aulas teóricas e aulas práticas disponibilizado pelos docentes - Griffiths A, Gelbart WM, Miller JH, Lewontin RC . Modern Genetic analysis. New York: W. H. Freeman and Company; 1999. Disponível online em: http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=mga - Junqueira LC, Carneiro J. Biologia Celular e Molecular. 4ª Edição, Rio de Janeiro: Editora Guanabara Koogan; 1997. Observações: Regente: Mestre Maria Manuela Amorim Silva e Sousa - [email protected] Docente: Drª Maria de Fátima Pinto Monteiro - [email protected] Manuela Amorim Vila Nova de Gaia, 28 de Agosto de 2012
Baixar