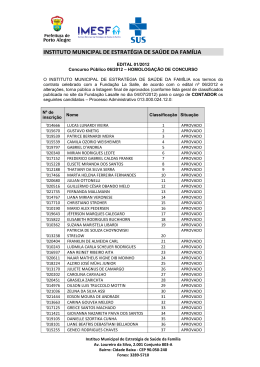
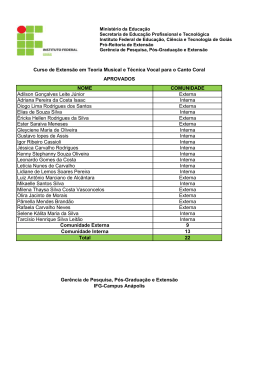
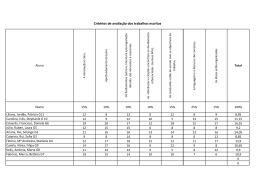
Efeitos da Suplementação Dietética com Ácidos Gordos Polinsaturados ω3 (AGω3) no Metabolismo Lipídico e Lipoproteico Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro Depto. de Bioquímica da Faculdade de Ciências Médicas da UNL Campo Mártires da Pátria, 130, 1169-056 Lisboa, Portugal À nascença o português apresenta uma esperança de vida de 85,5 anos ou de 78 anos conforme for do sexo feminino ou masculino, respectivamente. Contudo, a ideia geral que possuímos é que são poucos os que atingem estas idades com qualidade de vida e com saúde. As estatísticas disponíveis nas páginas de Actualidades do Instituto Nacional de Estatística (INE) na Internet, mostram as principais causas de morte em Portugal ao longo de mais de quatro décadas (Fig.1). Figura 1. Principais causas de morte (1960 a 1997) em Portugal. Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro Durante o ano de 1997, registaram-se em Portugal cerca de 105 mil óbitos. As doenças do Aparelho Circulatório continuam a ser a primeira causa de morte em Portugal com cerca de 40,1% do total. As Doenças Neoplásicas Malignas foram responsáveis por 19,5% dos óbitos. Estas duas causas de morte foram responsáveis por cerca de 60% dos óbitos registados em 1997, ou seja 63 mil óbitos. Figura 2. Principais causas de morte em 2000 e recursos na área da saúde em Portugal. Em 2000, verificou-se uma ligeira melhoria em relação às Doenças do Sistema Circulatório e um agravamento no que respeita a Tumores, mantendo o somatório destas duas causas de morte em cerca de 59% dos óbitos registados em 2000 (Fig.2). Ao longo das últimas 3 décadas, numerosos estudos examinaram a relação entre o consumo de gorduras consumidas na dieta e o aparecimento de doenças do foro cardiovascular. Um número significativo destes estudos, muito particularmente os de natureza epidemiológica, evidenciaram uma baixa significativa de mortalidade cardiovascular em populações com elevado -2- Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro consumo de pescado (1-3). Aparentemente, esta diminuição de doença cardiovascular é explicada pelo consumo de ácidos gordos de cadeia longa e insaturados da classe ómega 3 (AGω3) existente no pescado consumido por essas populações (4-6). Desde então, centenas de estudos clínicos têm sido realizados para analisar os efeitos de AGω3, quer obtidos de peixes e animais marinhos, quer os de origem vegetal, sobre uma vasta gama de factores e marcadores intermediários da doença cardiovascular, com o objectivo de explicar e definir os benefícios potenciais do incremento do consumo dietético dos AGω3. Recentemente, Daviglus et al. (7) apresentaram os resultados de 30 anos de follow-up do Chicago Western Electric Study, em que demonstraram claramente que homens que consumiam 35 g ou mais de pescado diariamente, em comparação a indivíduos que não consumiam qualquer quantidade de peixe, apresentavam um risco relativo de morte por Doença Coronária (DC) de 0,62 e um risco de morte não súbita por enfarte de miocárdio (IM) de 0,33. Estes resultados são confirmados por Zhan et al. (8). Neste estudo, estes autores demonstram que o consumo de pescado estava associado a uma diminuição significativa do risco de DC isquémica e Acidente Vascular Cerebral (AVC) no universo de 36 países. Mizushima et al. (9), estudando japoneses vivendo no Japão e no Brasil, demonstraram existir uma relação de dose-efeito entre a frequência de consumo semanal de peixe e a redução dos valores de factores de risco para as Doenças Cardiovasculares (obesidade, hipertensão arterial, HbA1c, alterações ST-T do ECG). Não parece existir diferenças significativas entre homens e mulheres. Hu et al. (10) ao analisarem a frequência do consumo de peixe no Nurse’s Health Study, constataram que comparando mulheres que raramente consumiam peixe (menos de uma vez/mês) com as que consumiam 1-3 vezes/mês, uma vez/semana, 2-4 vezes/semana e mais do que 5 vezes/semana, o risco de morte precoce por doença cardiovascular diminuía muito significativamente (p=0,001) nestas últimas, em 21%, 29%, 31% e 34% respectivamente. Analisando os quintis extremos para o consumo de pescado, a redução no risco de morte por doença coronária (DC) parece ser mais forte do -3- Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro que para enfartes agudos do miocárdio (EAM) não fatais, risco relativo (RR) 0,55 versus 0,73. A ligação entre o consumo deficiente de ácidos gordos ω3 (AGω3) e o risco de morte precoce por doença coronária é suficientemente forte para justificar recomendações da American Heart Association (11), da European Cardiology Society (12), da Scientifc Advisory Committee on Nutrition (Reino Unido) (13) e de muitas outras instituições e organizações profissionais ligadas à saúde, para o aumento da ingestão destes ácidos gordos ω3. Muito recentemente, uma meta-análise de 13 coortes que incluía mais de 222000 indivíduos seguidos por cerca de 12 anos para análise de incidência de morte por doença cardiovascular (14), mostrou que o consumo tão baixo como 1 refeição de peixe por semana em comparação com menos de 1 refeição por mês, estava associada a uma redução de risco em 15%. Esta diferença foi estatisticamente significativa. Quando os indivíduos incluídos nesta meta-análise foram repartidos em categorias de consumo de pescado (<1/mês, 1-3/mês, 1/semana, 2-4/semana, e ≥5/semana) os que apresentaram consumos mais elevados, usufruíram duma diminuição em 40% do risco de morte precoce por Doença Cardiovascular. Em 1999, o estudo GISSI (15) demonstrou em 11324 doentes pós-EAM, que a suplementação dietética destes doentes com 850 mg/dia de ácidos gordos ω3 (EPA+DHA) em comparação com o tratamento usual protocolado, durante 35 anos, diminuiu em 20% o risco de morte por todas as causas e o risco de morte súbita em 45% no grupo de doentes tratados com ácidos gordos ω3. Um estudo de follow-up no âmbito GISSI-Trial (16), com o objectivo de analisar o momento cronológico do efeito benéfico do tratamento com ácidos gordos ω3 sobre a taxa de mortalidade, demonstrou que as curvas de sobrevivência começavam a divergir do grupo controlo aos 3 meses de suplementação, apresentando um risco relativo (RR) de 0,59 e aos 4 meses, o risco de morte súbita tinha diminuído para um RR=0,47. No entanto, apesar de existir uma quantidade substancial de dados e evidências que suportam o efeito protector dos ácidos gordos ω3 na prevenção -4- Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro secundária da doença cardiovascular, alguns trabalhos recentemente publicados não comprovam tal efeito (17-19). Esta aparente conflituosidade poderá ser explicada na base de conceitos diferentes e factores residuais que contaminam os grupos em análise (20) como seja, por exemplo, inclusão de indivíduos no grupo controlo, com estilos de vida menos saudáveis (less healthy lifestyle). A variabilidade dos eventos de referência (end points) escolhidos, o desenho experimental utilizado, o tipo de pescados e seus conteúdos conteúdo em ácidos gordos, poderão contribuir para a não concordância dos resultados (21). Com a intenção de objectivar os efeitos benéficos dos ácidos gordos ω3 na Doença Cardiovascular muito particularmente, ao nível da lesão ateromatosa, foi realizado por Von Schacky et al. (22) um estudo randomizado, dupla ocultação e controlo por placebo em 223 doentes sujeitos a angiografia coronária. A administração de 3g/dia de ácidos gordos ω3 nos 3 meses primeiros seguido de 1,5g/dia por 21 meses demonstrou uma significativa (p=0,04) diminuição da progressão, uma maior regressão e uma menor propensão a eventos clínicos. Da mesma forma, Eritsland et al. (23) em 610 doentes sujeitos a técnicas de by-pass coronários, com suplementação dietética de 3-4 g/dia de AGω3 sob a forma de etilésteres, obteve melhor taxa de diminuição de oclusão dos enxertos vasculares em comparação aos controlos (27% vs. 33% p=0,03). Em relação à acção anti-reestenose pós-angioplastia coronária transluminal percutânea dos AGω3 parece ser ainda conflituosa. Para uns (24) observam-se efeitos benéficos, enquanto que outros (25,26) não constatam tais efeitos. Possíveis Mecanismos de Acção dos Ácidos Gordos ω3 O metabolismo lipídico e lipoproteico altera-se de forma significativa com o consumo regular de pescado e suplementação nutricional com Ácidos Gordos Polinsaturados ω3 (AGω3) (27). Os efeitos hipotrigliceridémicos dos AGω3 estão bem documentados e não são motivo de discórdia (27). A trigliceridémia pósprandial é especialmente sensível ao consumo crónico de AGω3 (28 ,29). -5- Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro Bastam doses de AGω3 inferiores a 2g/dia para produzirem tais efeitos (30). As respostas dos parâmetros lipídicos e lipoproteicos à suplementação de AGω3 não apresentam diferenças em indivíduos diabéticos e não diabéticos (31) apesar de existir uma relação muito estreita entre a glicémia e trigliceridémia. Uma recente meta-análise de 26 estudos com indivíduos com Diabetes Mellitus tipo 1 ou tipo 2 não demonstrou efeitos significativos dos AGω3 na concentração plasmática de hemoglobina A1c (32), apesar de aumentar ligeiramente a glicémia dos indivíduos com diabetes tipo 2. O efeito hipotrigliceridémico dos AGω3 é mais marcante para níveis plasmáticos dos triglicéridos superiores a 750mg/dL. Contudo os resultados preliminares por nós realizados em indivíduos assintomáticos sem diabetes ou dislipidémia e em doentes com insuficiência renal crónica em hemodiálise, sujeitos a uma suplementação dietética de AGω3 na dose semanal de 12g, apresentaram efeitos benéficos nos níveis de triglicéridos sanguíneos. Quer no Grupo Controlo quer no Grupo Doentes, os triglicéridos (TG) diminuíram de 105±34mg/dL para os 93±24mg/dL e de 161±113mg/dL para os 150±86mg/dL, nos dois grupos estudados, respectivamente. Com o decréscimo dos TG plasmáticos, era de esperar um ligeiro aumento das HDL, o que veio a suceder no Grupo Controlo, em que os níveis plasmáticos passaram de 58±21mg/dL na situação basal (pré-tratamento) para os 63±28mg/dL aos 3 meses de suplementação. Para cada 1 mg/dL de aumento das HDL plasmáticas obtém-se uma diminuição de 3% no risco cardiovascular (33). As sub-fracções das HDL, as HDL2 e as HDL3 apresentaram aumentos de 10,5% e 5% no grupo controlo, respectivamente. As HDL3 são as partículas HDL mais ricas em ApoA1 e as HDL2 resultam da transformação das HDL3 e que apresentam dimensões maiores e maior conteúdo em colesterol. A análise da porção proteica das HDL, ou seja, as apoproteínas A1 (ApoA1), a principal apoproteína das HDL3, não apresentou alterações, variando de 1,53±0,41g/dL para 1,49±0,42g/dL nos controlos e de 1,25±0,24g/dL para 1,24±0,35g/dL nos doentes, sugerindo que o rácio colesterol das HDL sobre ApoA das HDL aumentou, após suplementação com AGω3, por enriquecimento destas -6- Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro partículas lipoproteicas em colesterol. Se aceitarmos que o pequeno aumento das HDL2 (10,5%) em comparação às HDL3 (5%) e o aumento da apoproteína E (ApoE) em 27% (75±22mg/dL vs. 95±22mg/dL) aos 3 meses de suplementação, associados a uma diminuição dos TG, leva-nos a pensar que a suplementação neste Grupo Controlo estará, muito provavelmente, a favorecer o transporte inverso do colesterol tecidular periférico para o fígado (Fig.3). Figura 3. Esquema do Mecanismo do Transporte Inverso do Colesterol. HDL – lipoproteina de alta densidade; LDL – lipoproteina de baixa densidade; CETP – Cholesterol Ester Transfer Protein; Ro-LDL – Receptor das LDL; SRB1 – Scavenger Receptor B1; Ro-Holo LDL – Receptor das Holo-LDL; LCAT – Lecitina Colesterol Aciltransferase; ABCA1 – ATP-Binding Cassette A1. No Grupo Doente, a resposta dos níveis das HDL à suplementação com AGω3 foi diferente em relação ao Grupo Controlo. As HDL totais (42±13mg/dL vs. 39±14mg/dL); as HDL2 (13,5±6mg/dL vs. 13,6±8mg/dL); as HDL3 (28,9±9mg/dL vs. 26±8mg/dL) e a ApoA (1,53±0,41g/L vs. 1,49±0.42g/L) não ABCA1 modificaram ou diminuíram os valores aos 3 meses de suplementação em relação aos níveis basais. Os níveis das ApoE após suplementação subiram de 111±89mg/L para 153±84mg/L, p=0,003. A correlação entre os níveis de ApoE vs. TG revelou-se significativa: y=0,63x+6,3; r=0,72; p=0,0001. Contudo as correlações da ApoA vs. ApoE (p=0,8) e da ApoB vs. ApoE (p=0,20) não revelaram qualquer significado. Estes resultados sugerem-nos que os fenómenos de permuta apoproteica entre as Fig Figura 3. Transporte inverso do Colesterol pelas HDL e a relação com as LDL. No Grupo Doente, a resposta dos níveis das HDL à suplementação com AGω3 foi diferente em relação ao Grupo Controle. As HDL totais (42±13 mg/dl vs 39±14 mg/dL); as HDL2 (13,5±6 mg/dL vs 13,6±8 mg/dl); as HDL3 (28,9±9 mg/dL vs 26±8 mg/dl) e as ApoA (1,53±0.41 g/L vs 1,49±0,42 g/L) não modificaram ou diminuíram de valores aos 3 meses de suplementação, em -7- Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro relação aos níveis basais. Os níveis das ApoE, após suplementação, subiu de 111±89 mg/L para 153±84 mg/L, p=0,003. A correlação entre os níveis da ApoE vs TG, revelou-se significativa: y=0,63x+6,3; r=0,72; p=0,0001. Contudo as correlações da ApoA vs ApoE (p=0,8) e da ApoB vs ApoE (p=0,20) não revelaram qualquer significado. Estes resultados sugerem-nos que os fenómenos de permuta entre as diversas classes lipoproteicas, a dimensão do pool e a velocidade do turnover das lipoproteínas contendo ApoE (quilomicra remanescentes, VLDL remanescentes e HDL2) poderão ser significativamente diferentes nos doentes com insuficiência renal crónica em hemodiálise, em que o processo aterotrombogénico é mais intenso, quando comparados com controlos aparentemente saudáveis, por nós utilizados. Analisando o efeito nos níveis plasmáticos de um novo bio-marcador da Doença Atero-trombótica, referimo-nos à Lp(a), cujo nível plasmático é, em larga medida, determinado por factores genéticos (34), a diferença dos valores médios entre o Grupo Controlo e o Grupo Doente é significativa, quer antes quer depois da suplementação com AGω3. Em condições basais o Grupo Controlo e o Grupo Doente apresentavam níveis plasmáticos de Lp(a) de 0,30mg/dL e 0,55mg/dL, respectivamente. Após 12g/L de AGω3 durante 3 meses, os valores foram de 0,29mg/dL e 0,52mg/dL, respectivamente no Grupo Controlo e Grupo Doente. A não observação de diferenças significativas poderá ser devido à dispersão característica dos níveis plasmáticos de Lp(a) e ao número deveras reduzido das amostras. Contudo, uma análise mais pormenorizada das formas isomórficas da apoproteína (a), a estrutura polipeptídica presente na molécula da Lp(a) com elevada homologia estrutural com o plasminogénio, mostrou que a frequência das formas isomórficas de pequenas dimensões (F, B, S1 e S2) é maior no Grupo Doente do que no Grupo Controlo (57,7% vs 40%). Esta presença de Lp(a) com pequenas dimensões, encontra-se associada a quadros clínicos mais graves da doença coronária (35 ,36) e a lesões ateromatosas mais extensas (37,38). -8- Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro As Lp(a) portadoras de isoformas de pequenas dimensões tornam-se ainda mais susceptíveis à oxidação do que as Lp(a) de dimensões maiores. A pesquisa da susceptibilidade das LDL à oxidação foi igualmente avaliada. No Grupo Controlo a suplementação de 12g/semanal por 3 meses, baixou a presença de LDL oxidadas, medidas como LDL-TBARS, em cerca de 36% (146±54 vs 93±27mg/dL). Contudo, no Grupo Doente, os valores de LDL-TBARS subiram de 66±30mg/dL para 96±36mg/dL ao fim de 3 meses de suplementação (p=0,001), significando maior susceptibilidade das LDL à oxidação na sua porção de AG poli-insaturados que esterifica o colesterol livre e os fosfolípidos. Este fenómeno não é inédito e tem sido escrito por outros autores. Os doentes com insuficiência renal crónica em hemodiálise, apresentam um intenso stress oxidativo o que correlaciona bem com a aterogénese acelerada que se verifica nestes doentes. Por conseguinte, se a reserva de antioxidantes for deficitária, muito particularmente em vitamina E (d-α tocoferol), as consequências do ataque de radicais livres sobre as estruturas lipídicas mais susceptíveis (AG poliinsaturados) tornar-se-ão efectivas. Assim sendo, seria de todo conveniente associar à suplementação dietética de AGω3, doses adequadas de antioxidantes scavenger e da fase lipídica para controlo dos fenómenos de peroxidação lipídica que se sabe estarem envolvidos nos fenómenos de atero-trombogénese. Para além de influenciar de forma significativa o metabolismo lipídico e lipoproteico, (fig. 4) os AGω3 intervêm no mecanismo anti-aterogénico por outras vias (23). O EPA (ácido eicosapentaenoico) e o DHA (ácido docosahexaenoico) parecem perturbar o metabolismo das moléculas de adesão, tais como as VCAM-1, E-selectinas e ICAM-1 (23). Abe et al (39) relata a capacidade de suplementos de 3,4g/dia de AGω3 por 7 a 12 meses, em diminuir em 9% ICAM-1 solúvel e em 16% a E-selectina solúvel mas nenhum efeito foi exercido sobre os níveis de ICAM-1 em indivíduos hipertrigliceridémicos. Estudos realizados “in vitro” (40 ,41) tornaram evidentes a capacidade da DHA em reduzir a expressão endotelial das VCAM-1 e das E-selectinas, ICAM-1, interleuquinas-6 (IL-6) e IL-8 em células estimuladas. Os AGω3 parecem inibir o mecanismo pró-inflamatório mediado por moléculas bio-activas tais como as IL e TNF-α (Tumor Necrosis -9- Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro Factor α) (42), moléculas estas envolvidas no processo aterogénico (43). Um outro mecanismo anti-aterogénico poderá residir na competição dos AGω3 com os AGω6, originando uma larga variedade de eicosanóides (44). O EPA não só pode substituir o ácido araquidónico dos fosfolípidos das estruturas membranares, como também actuar como inibidor competitivo da ciclooxigenase e, desta forma, reduzir a produção das prostaglandinas, tromboxanos e prostaciclinas da série 2 e os leucotrienos da série 4. CD 36 MCP-1 LDL Linfócito T Moléculas de Adesão Lesão Endotelial CSF’s LDL com oxidação ligeira Íntima Monócito Monócito Citoquinas LDL muito oxidada Complexos Lipoproteína -Anticorpo Complexos LipoproteínaProteoglicanos Efluxo de Colesterol (HDL) Macrófago ASMC Linfócito T Citoquinas e Facts. Factores Cresc. Cresc. Média Célula Espumosa (Foam Cell) Migração Factores Angiogénicos ASMC Figura 4. Síntese dos eventos participantes na aterogénese. O DHA, apesar de não inibir directamente o metabolismo do ácido araquidónico, reduz a afinidade do receptor do TXA2/PGH2 para o seu ligando, e desta forma diminui a agregação plaquetária (42). Por conseguinte, os AGω3 em doses correctas reduzem a hipertrigliceridémia, podem favorecer o transporte reverso do colesterol, reduzem o processo inflamatório, a vasoconstrição e a agregação plaquetária, todos factores que se encontram envolvidos no mecanismo de formação e propagação da placa ateromatosa. - 10 - Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro Dosagem Adequada dos AGω3 Nem todos os países têm disponíveis os dados sobre o consumo de AGω3 na dieta das suas populações. Os dados disponíveis sobre os Estados Unidos, calculam que, em valores médios, a dose diária na dieta dos norte americanos seja de aproximadamente 1,6g/dia (cerca de 0,7% da ingestão energética) (46). Desta quantia, cerca de 1,4g/dia é de ácido α-linolénico e somente 0,1 a 0,2g/dia é fornecido por EPA e DHA. Embora algum ácido α-linolénico se converta em AGω3 de cadeia longa, a intensidade desta conversão é modesta e controversa (47 ,48). Todo o peixe contém EPA e DHA. Contudo as quantidades variam entre espécies e dentro da mesma espécie dependendo das variáveis ambientais e se são de captura ou criados em cativeiro. Diversos países, como o Canadá, Suécia, Reino Unido, Austrália e o Japão, e organizações mundiais como a Organização de Saúde e a Organização do Tratado do Atlântico Norte, têm apresentado recomendações dietéticas para os AGω3. A recomendação típica é de 0,3 a 0,5g/dia de EPA+DHA, e de 0,8 a 1,1g/dia de ácido α-linolénico. Recentemente, o Food and Nutrition Board, Institute of Medicine e as National Academies (USA), em colaboração com a Health Canada, publicaram as Dietary Reference Intakes for Energy and Macronutrients (49). O Acceptable Macronutrient Distribution Range (AMDR) para o ácido α-linolénico está estimado em 0,6 a 1,2% do valor calórico/dia ou seja, 1,3g a 2,7g na base de uma dieta de 2000 kCal. Estes valores são, aproximadamente, 10 vezes os valores de ingestão actual de EPA+DHA. Os objectivos das AMDR para os AGω3 são de fornecer orientações para que as pessoas possam ser saudáveis e não só, para prevenção de doenças crónicas e insuficiências nutricionais. Estas recomendações são facilmente alcançadas se consumir, pelo menos, duas refeições de peixe por semana, com - 11 - Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro especial ênfase na escolha de peixe gordo (por exemplo, carapau, arenque, sardas, salmão) e na utilização de óleo vegetal rico em ácido α-linolénico (canola, soja, flaxseed, avelãs). Peixe frito ou pré-frito disponível no comércio (restaurantes e fast-food) devem ser evitados pelo facto de conterem baixo teor em AGω3 e elevadas concentrações em trans-AG, comprovadamente aterogénicos. Portadores de doenças cardiovasculares deverão ser encorajados a consumirem, aproximadamente, 1g/dia de EPA+DHA, como preconiza o GISSIPrevention Study. Para todos aqueles que não gostam de peixe por algum motivo ou se a ingestão não for suficiente para atingir os objectivos terapêuticos, poderão recorrer ás cápsulas contendo EPA e DHA, formuladas pela indústria farmacêutica com certificação GMP (Good Manufacturing Practice). Este galardão industrial é atribuído pela associação de controlo de qualidade da indústria farmacêutica americana, em íntima colaboração com a Food and Drug Administration (FDA). Tipicamente cada cápsula de AGω3 contém 180mg de EPA e 120mg de DHA. Segurança na Utilização dos AGω3 Os AGω3 fazem parte da dieta humana há milénios. O rácio entre os AGω6/AGω3 na dieta dos nossos antepassados era de 1:1 (50). Na actualidade, este rácio é muito diferente. Nos Estados Unidos calcula-se que seja aproximadamente 10:1 (46). Desde o aparecimento do primeiro AGω3 “advisory” nos Estados Unidos (51) que a FDA certificou que consumo até 3g/dia de AGω3 obtidos de peixe, na dieta humana, era GRAS (Generally Recognized As Safe / Reconhecido Geralmente Como Seguro) (52). Em 2002 a FDA aprovou “a qualified health claim para os AGω3 (EPA+DHA)” utilizados sob a forma de suplementos dietéticos (53). Os AGω3 com GMP não apresentam qualquer contaminação de mercúrio e de contaminantes organocloretados. - 12 - Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro Contudo, dependendo da dose utilizada, alguns efeitos colaterais poderão surgir (Quadro I) (54). Quadro I. Risco de efeitos colaterais por consumo de AGω3 Problemas Gastrointestinais Hemorragias Sabor residual a Agravamento da Aumento do peixe glicemia* LDL-C † Até 1g/dia Muito baixo Muito baixo Baixo Muito baixo Muito baixo 1 a 3g/dia Moderado Muito baixo Moderado Baixo Moderado >3g/dia Moderado Baixo Provável Moderado Provável * Geralmente apenas em doentes com baixa tolerância à glicose ou diabetes. † Geralmente apenas em doentes com hipertrigliceridemia. LDL – Lipoproteina de baixa densidade. LDL-C – Colesterol das LDL. AGω3 – Ácidos gordos ómega 3. Segurança no Consumo de Pescado Algumas espécies de pescado poderão conter níveis consideráveis de metilmercúrio, bifenil policlorinados (PCB), dioxinas e outros contaminantes ambientais. Estas substâncias encontram-se, usualmente, com níveis muito baixos em peixes de água doce e salgada. Contudo, podem ser bioconcentrados ao longo da cadeia alimentar aquática. De forma que os níveis de contaminação poderão ser mais elevados nos especímenes mais velhos e maiores; nos predadores piscícolas e em animais marinhos. Nos humanos, o pescado e o marisco são a principal fonte de disposição a esses contaminantes. PCB e o metilmercúrio possuem uma semi-vida longa no organismo humano e podem sofrer maior acumulação em indivíduos que ingerem produtos contaminados numa base de maior frequência de consumo. A exposição em PCB poderá ser diminuída se se remover a pele e a gordura dos peixes antes de os cozinhar. Porque o metilmercúrio se encontra distribuído na carne magra, a remoção da pele e das gorduras visíveis não diminui a sua contaminação. Nos - 13 - Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro Estados Unidos, o Environmental Protection Agency e a U.S. Food and Drug Administration aconselham as mulheres grávidas ou que venham ficar grávidas a curto prazo e mães que estejam a amamentar que não consumam mais de uma refeição de 6 onças/semana (55). Crianças não deverão consumir mais de 2 onças de peixe de captura por semana. Deverá ser evitado o consumo de tubarão (squalius), espadarte, cavala da variedade King Mackerel, peixes da família Branchiostegidae (Golden Bass ou Golden Snapper) da dieta das grávidas, mulheres a amamentar e crianças, e limitar o consumo de outras espécies piscícolas a 12 onças por semana (3-4 doses/semanal), com o objectivo de minimizar a exposição ao metilmercúrio (56). O US FDA (57) tem evidências suficientes para poder aconselhar que qualquer adulto e mulher não grávida ou que venha a engravidar poderá consumir até 7 onças/semana com peixe contendo até 1ppm de metilmercúrio ou 14 onças/semana de pescada contendo até 0,5ppm de metilmercúrio. Em conclusão: 1. Os estudos epidemiológicos e clinical trials demonstraram que AGω3 diminuem a incidência das Doenças Cardiovasculares. 2. Os AGω3 diminuem os factores de risco das Doenças Cardiovasculares, apesar de se encontrar ainda em aberto a dose de ingestão ideal. 3. Estudos prospectivos de prevenção secundária sugerem que a suplementação de AGω3 EPA+DHA na dose de 0,5 a 1,8g/dia reduzem a taxa de mortalidade cardíaca e a taxa de morte por todas as causas. O consumo de pescado deve ser ponderado nos prós e contras no que se refere aos poluentes ambientais. O consumo de pescado deve ser variado e fornecido por origens diversas no sentido de minimizar os potenciais efeitos adversos dos contaminantes ambientais e, ao mesmo tempo, atingir as vantagens que se obtêm no que se refere às doenças cardiovasculares. - 14 - Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro Referências bibliográficas 1. Bang HO, Dyerberg J, Sinclair HM. Am. J. Clin. Nutr. 1980; 33(12): 2657. 2. Kroman N, Green, A. Acta Med. Scand. 1980; 208(5): 401. 3. Linberg S, Lundh B. J. Intern. Med. 1993; 233(3) 269. 4. Bang HO, Dyerberg J, Hjorne N. Acta. Med. Scand. 1976; 200:69. 5. Yotakis LDO. Thromb Haemostas 1980; 46:65. 6. Hirand et al. Lancet(11) 1980;1132. 7. Daviglhns ML, Stamler J., Orencia AJ et al. N. Engl. J Med 1997 ; 336:1046. 8. Zang J, Sasaki S, Amano K et al. Prev Med, 1999 ; 28 :520. 9. Mizushima S, Moriguchi EH, Ishikawa P et al. J. Cardiovasc Risk, 1997; 4:191. 10. Hu FB, Bronner L, Willet WC et al. JAMA, 2002; 287:1815. 11. Kris-Etherton PM, Harris WS, Appel LJ. Circulation, 2002; 106:2747. 12. De Backer G, Ambrosioni E, Borch-Johnson K et al. Eur. Heart J. 2003; 24:1601. 13. http://www.sacn.gov.uk/reports 14. He K, Song Y, Davighns ML et al. Circulation, 2004; 109:2705. 15. Gissi-Prevencione Trial. Lancet, 1999; 354:447. 16. Marchioli R, Banzi F, Bomba E et al. Circulation, 202; 105:1897. 17. Ascherio A, Rimm EB, Stampfer MJ et al. Health Professionals’ Follow-up Study. N. Engl. J. Med. 1995; 332:977. 18. Albert CM, Henneckens CH, O’Donnell CJ et al. US Physicians’ Health Study. JAMA, 1998; 279:23. 19. Guallan E, Aro A, Jimenez FJ et al. Euromic Study Arterioscler. Thromb. Vasc. Biol. 1999; 19:1111. 20. Kromhout D. JAMA 1998; 279:65. 21. Sheard NF. Nutr. Rev. 1998; 56:177. 22. Von Schacky C, Angerer P, Kothny W et al. Ann Intern Med. 1999; 130:554. 23. Eristsland J, Arnesen H, Gronseth K et al. Am J. Cardiol. 1996; 77:31. - 15 - Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro 24. Gapinski JP, Van Ruiswyk JV, Hendebert GR et al. Arch Intern Med 1993; 153:1595. 25. Cairns JA, Gill J, Morton B et al. The EMPAR Study Circulation 1996; 94:1553. 26. Johansen O, Brekke M, Seljeflot I et al. CART Study. J. Am. Coll. Cardiol 1999; 33:1619. 27. Harris WS. Am. J. Clin Nutr 1997; 65(5):16455. 28. Sanders TA, Oakley FR, Miller GJ et al. Arterioscler Thromb Vasc Biol 1997; 17:3449. 29. Harris WS, Connor WE, Axam N et al. J. Lipid Res, 1998; 29:1451. 30. Roche HM, Gibney MJ. Eur J. Clin Nutr. 1996; 50:617. 31. Montori VM, Farmer A, Wollan PC et al. Diabetes Care 2000 ; 23 :1407. 32. Friedberg CE, Janssen MJ, Heine RJ et al. Diabetes Care 1998; 21:494. 33. Cartelli WP, Anderson K, Wilson PW, Levy D. The Framingham Study. Ann. Epidemiol. 1992; 2(12):23. 34. 35. Rodrigues P, Andrade ML, Concelo J et al. J. Am Coll Cardiol 1998; 31(2/Supl A):1065. 36. Rodrigues P, Azevedo J, Concelo J et al. Atherosclerosis 1999; 141(1):64. 37. Rodrigues P, Azevedo J, Concelo J et al. Lipoprotein(a) Containing Small apo(a) Species and Fibrinogen in the Clinical Severity of Coronary Artery Disease Proc 5th International Symp. Multiple Risk Factors in Cardiovascular Disease: Global Assessment and Intervention. Venice, Italy, 1999. 38. . Rodrigues P, Azevedo J, Concelo J et al. Angiographic Lesion Severity in CAD patients and its relation with increased Lp(a) plasma level and detection of small isomorphic species. Proc. 5th Int. Symp. Multiple Risk Factors in Cardiovascular Disease: Global Assessment and Intervention. Venice, Italy, 1999. 39. Abe Y, El-Masri B, Kimball KT et al. Arterioscler. Thromb. Vasc. Biol. 1998; 18:723. 40. De Caterina R, Libby P. Lipids, 1996; 31:557. - 16 - Pedro O. Rodrigues, Maria da Graça Morais, Marcos Agostinho II, Rui G. Loureiro 41. De Caterina R, Liao JK, Libby P. Am J Clin Nutr 2000; 71: (1 Suppl): 2135. 42. Endres S, Von Schacky C. Curr Opin Lipidol, 1996; 7:48. 43. Lee RT, Libby P. Arterioscl Thromb Vasc. Biol 1997; 17:1859. 44. Vaug R, Mena P, Valenzuela A. Eur J Clin Nutr 1999; 53(Suppl 1): 566. 45. Bayon Y, Croset M, Daveloose D et al. J. Lipid. Res. 1995; 36:47. 46. Kris-Etherton PM, Taylor DS, Yu-Poth S et tal. Am J. Clin Nutr 2000; 71(1 Suppl):1795. 47. Emken EA, Adlof RO, Gulley RM. Biochim Biophys Acta 1994; 1213:277. 48. Pawlosky RJ, Hibbeln JR, Novotny JA et al. J. Lipid Res. 2001; 42:1257. 49. Institute of Medicine (IOM). Dietary Reference Intakes for Energy and Macronutrients. Washington, DC, National Academy Press; 2002. 50. Simapoulos AP. Prostaglandins Lenkot Essent Fatty Acids, 1999; 60:421. 51. Stone NJ. Circulation 1996; 94:2337. 52. Department of Health and Human Services, US Food and Drug Administration. Federal Register. June 5, 1997. Vol 02; nº108:30751-30757, 21 CFR Part 184. [Docket nº866-0289] 53. Office of Nutritional Products, Labeling and Dietary Supplements, Center for Food Safety and Applied Nutrition, US Food and Drug Administration. Docket nº91N-0103, February 8, 2002. 54. Harris WS, Ginsberg HN, Arunakul et al. J. Cardiovasc Risk. 1997; 4:385. 55. Office of Water, US Environmental Protection Agency. Consumption Advice Fact Sheet. January 2001. EPA-823-F-01-004. 56. Center for Food Safety and Applied Nutrition, US Food and Drug Administration. March 2001. 57. US Food and Drug Administration. FDA Consumer 1994; 28/Revised May 1995. - 17 -
Download